基于PI3K/Akt 信号轴探究补肾活血汤治疗乳腺癌骨转移的机制研究
2023-03-02陈雪珍杨满英胡金辉
陈雪珍,朱 蓉,杨满英,谢 婷,杨 争,袁 博,胡金辉*
1.张家界市中医医院,湖南 张家界 427000;2.湖南中医药大学,湖南 长沙 410208;3.湖南中医药大学第一附属医院,湖南 长沙 410007
国际癌症研究署(International Agency for Research on Cancer, IARC)发布的2020 年全球癌症数据显示,乳腺癌新发病高达226 万例,被称为全球女性第一大癌[1-3]。 虽然乳腺癌[4-7]的治疗不断更新和完善,但仍有部分患者会出现骨转移、脑转移、肺转移、肌肉转移、锁骨上淋巴结转移、肝转移等远处转移;由于癌症复发、转移的出现,使乳腺癌患者的临床结局仍不满意,特别是三阴性乳腺癌(triple negative breast cancer, TNBC)。TNBC 具有高侵袭性、高转移率、治疗手段有限等复杂问题,严重威胁患者生命健康和生活质量[4-7]。 其中,骨转移常导致病理性骨折、骨痛、高钙血症,甚至累及脊髓等,严重影响患者及家属生活质量。 由于乳腺癌骨转移机制尚未明确[8],临床上治疗方案较单一,效果欠佳且时间持久。因此,寻找能防治乳腺癌发生骨转移的辅助治疗方案具有深远意义。
补肾活血汤是一种中药复方制剂,具有补肾填精、活血化瘀的功效,临床研究证实其在治疗乳腺癌及乳腺癌骨转移患者中有明确疗效[9-11]。实验研究证实,其对于抗血管生成、抑制肿瘤细胞迁移侵袭、促进骨质修复等方面均有一定疗效[12-13],但复方成分复杂,作用机制尚未明确。 磷酸肌醇3-激酶(phosphatidylinositol-3-ki-ases, P I3 K)/蛋 白 质 激 酶B(protein kinase B, Akt)信号通路在肿瘤的发生发展中发挥着极其重要的作用,该通路中的突变在癌症中经常被发现,在乳腺癌中尤为常见,特别是与TNBC 密切相关[14-17]。 目前研究结果显示,PI3K/Akt通路涉及乳腺癌与乳腺癌骨转移的多个过程,包括增殖、迁移、侵袭、上皮间质转化、免疫逃逸、诱导破骨细胞形成等。研究表明,补肾中药淫羊藿可通过PI3K/Akt 促进成骨分化治疗骨质疏松[18];没药的成分之一槲皮素[19]能通过调节PI3K/Akt 信号通路来减少细胞增殖、诱导细胞凋亡等发挥抗癌作用。 骨微环境中成骨与破骨原是动态平衡的状态,一旦打破则可能出现骨质增生、骨质破坏等情况。 因此,本研究拟通过构建乳腺癌骨转移模型,探究补肾活血汤是否通过调控PI3K/Akt 信号轴抑制肿瘤细胞转移能力和破骨细胞活性改善骨转移,对其治疗乳腺癌骨转移机制进行研究,为补肾活血汤临床治疗乳腺癌骨转移提供新的视角。
1 材料
1.1 实验动物及细胞
雌性,SPF 级, 体质量15~20 g,5~6 周龄的BALB/c裸鼠30 只,动物由湖南中医药大学统一购买(来源于湖南斯莱克景达有限公司),许可证号:SCXK(湘)2019-0009,符合湖南中医药大学动物伦理委员会要求(LLBH-202141404)。 鼠源性TNBC 细胞系4T1(武汉普诺赛生命科技有限公司,批号:CL-0007,传代至约18 代),用含10%胎牛血清和1%双抗(青霉素-链霉素)的1640 培养,于37 ℃、5% CO2孵育。细胞密度达80%传代。
1.2 试剂与药品
p-PI3K 兔单克隆抗体(批号:PA5-38905),购自美国thermofisher 公司;磷酸化蛋白质激酶B(phosphorylated protein kinase B, p-Akt)兔单克隆抗体(批号:9271S),购自美国Thermofisher 公司;活化T 细胞胞质核因子1(nuclear factor of activated T cells c1,NFATc1)小鼠单克隆抗体(批号:66963-1-Ig)、β-肌动蛋白(β-actin)小鼠单克隆抗体(批号:66009-1-Ig)、一抗、二抗稀释液(批号:SA00001-1、SA00001-2)均购自美国Proteintech 公司;基质金属蛋白酶2(matrix metalloproteinase 2, MMP-2)兔单克隆抗体(批号:Ab92536)购自英国Abcam 公司;苏木精核染液(批号:20210809)、伊红染色液(批号:20210809)、TRAP 染色试剂盒(批号:20210918)均购自中国Abiowell 公司。 补肾活血汤全部中药均由湖南中医药大学第一附属医院药剂科统一采购,具体成分如下:杜仲15 g(批号:2112192),独活15 g(批号:NG22032103),没药6 g(批号:2021120201),红花6 g(批号:SX22032203),当归尾12 g(批号:TH22042504),熟地黄12 g(批号:21120141B),山茱萸15 g(批号:SX22032207),补骨脂15 g(批号:HY22051001),枸杞子15 g(批号:CK22053105),菟丝子15 g(批号:SX22041301),肉苁蓉15 g(批号:21121841A)。PI3K抑制剂LY294002(批号:154447-36-6-50 mg),购自中国MCE 公司。
1.3 仪器
YT-CJ-2NB 型超净工作台(北京亚泰隆公司);DH-1601 型恒温培养箱(上海三藤仪器公司);YD-315 型病理切片机(浙江金华益迪试验器材);DYY-6C 型电泳仪、DYCZ-40D 型转膜仪(中国北京六一公司);BX43 型光学显微镜(日本Olympus 公司);E7242X 型医用诊断X 线射线管组件(中国深圳威图公司)。
2 方法
2.1 动物造模[20]、分组
30 只BALB/c 裸鼠,随机选取6 只裸鼠作为空白组(蒸馏水灌胃20 mL·kg-1,每天1 次;取对数生长期4T1 乳腺癌细胞接种于其余BALB/c 裸鼠右侧胫骨,接种后标记并进行完全随机分组:模型组(蒸馏水灌胃20 mL·kg-1,每天1 次)、补肾活血汤组(中药液灌胃36.67 g·kg-1,每天1 次)、LY294002 组(LY294002 腹腔注射,50 mg·kg-1,每周2 次)、补肾活血汤联合LY294002 组(中药液灌胃,36.67 g·kg-1,每天1 次+LY294002 腹 腔 注 射,50 mg·kg-1,每周2次);每组6 只。 具体造模操作为:制备细胞悬液密度约1×106细胞,接种体积20 μL,准备27 G 胰岛素注射器,吸入人乳腺癌4T1 细胞悬液备用。 4%水合氯醛注射液(0.15 mL/10 g)腹腔注射麻醉。 麻醉成功后用左手固定后肢,屈膝呈90°暴露膝盖和胫骨之间的白色髌韧带。 用75%乙醇将裸鼠的右后肢进行消毒,右手握住针平行于胫骨,并将针通过髌韧带中心扎入胫骨近端骨髓腔内,缓慢注入大约20 μL的细胞悬液,拔出针头后用棉花按压针口。 约3 d胫骨区可见瘤体,经X 线检测发生溶骨性改变,本研究以胫骨区可见瘤体为模型成功评价标准。
2.2 药物制备与给药剂量
将中药材倒入电陶瓷煎药壶中,一煎加水1000 mL浸泡30 min,武火(500 W)煮沸,转文火(200 W)煎60 min,过滤药渣;二煎加水800 mL 煎煮45 min,过滤合并2 次煎液,混匀。 将煎液倒入圆底烧瓶中,置于旋转蒸发仪上减压浓缩(70 ℃,-0.1 MPa),至约1 g/mL 时停止。 将浓缩后的煎液倒入蒸发皿中,恒温水浴锅蒸干,转移至真空减压干燥箱,干燥后得补肾活血汤浸膏。 收集浸膏,用铝箔袋封装,保存于干燥器中。根据70 kg 人与20 g 小鼠等效剂量比例1∶9.1 折算并取2 倍浓缩剂量得到裸鼠给药剂量:补肾活血汤36.67 g·kg-1,灌胃前蒸馏水溶解浸膏成生药浓度为1.8 g·mL-1;PI3K 抑制剂(LY294002)[21],按说明书进行配制,给药剂量为50 mg·kg-1。
2.3 各组裸鼠生长情况及瘤体变化情况
从造模后第4 天开始干预,连续干预14 d,同时观察裸鼠的生存状态,实验开始后每2 天测量一次裸鼠右下肢直径(mm)。所有裸鼠在实验期间用同一电子秤、游标卡尺统一测量体质量及右下肢直径。第15 天脱颈处死后取材,对各组瘤体进行常规石蜡切片,采用HE、TRAP 染色进行观察。分多聚甲醛固定及-80 ℃冻存。
2.4 X 线评估骨转移破坏情况
X 线扫描多聚甲醛固定标本,评估骨溶解情况。设置参数为:40 kV、32 mA、6 mAs。
2.5 HE 及TRAP 染色
处死后对裸鼠右下肢骨组织制备石蜡切片,进行病理学HE 染色检测,确认为乳腺癌骨转移。TRAP 染色评估破骨细胞数量。
2.6 Western blot 检测骨组织相关蛋白表达
转移瘤标本在冷RIPA 缓冲液中溶解,并在12 000 r·min-1,4 ℃离心10 min,离心半径7 cm。将裂解物从10% SDS-PAGE 凝胶上电泳转移到NC膜上。 将膜在含有5%脱脂奶的Tris 缓冲盐(PBST)缓冲液中于室温下封闭1.5 h 后,膜与抗β-actin、抗p-PI3K、p-Akt、MMP-2、NFATc1 的抗(分别为1∶5000、1∶1000、1∶1000、1∶1000、1∶2000)室温孵育过夜,洗膜后与二抗(鼠源1∶6000,兔源1∶5000)室温下孵育1.5 h。加入ECL 显影液,放于化学凝胶成像系统显影,采用全自动化学发光图像分析系统对蛋白条带进行分析,以目标条带的灰度值与内参β-actin灰度值的比值表示蛋白的相对表达水平。
2.7 统计学分析
运用SPSS 19.0 及Graphpad Prism 5.0 软件进行统计分析,每组至少重复3 次,所有计量资料以“±s”表示,检验各组数据的正态性检验和方差齐性,组间比较采用单因素方差分析,重复测量资料进行球形分布检验,P<0.05 为差异有统计学意义。
3 结果
3.1 各组裸鼠生长曲线及瘤体变化情况
造模成功率100%。 由于移植瘤表现为局部膝关节肿胀,与普通皮下移植瘤不同,故测量下肢肿胀部分最大直径进行对比。 结果显示:与A 组相比,B组、C 组、D 组及E 组裸鼠右下肢直径增长明显,其中B 组增长速度最为迅速(P<0.01);与B 组相比,C组、D 组及E 组增长较缓,且各组增长程度呈递减趋势,以E 组最为明显(P<0.01)。 详见表1、图1。
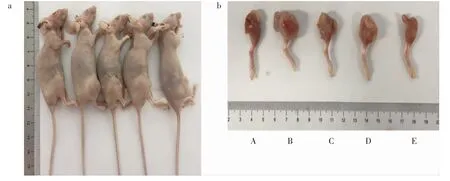
图1 乳腺癌骨转移裸鼠、瘤体图
表1 补肾活血汤对乳腺癌骨转移裸鼠右下肢直径的影响(mm,±s,n=6)
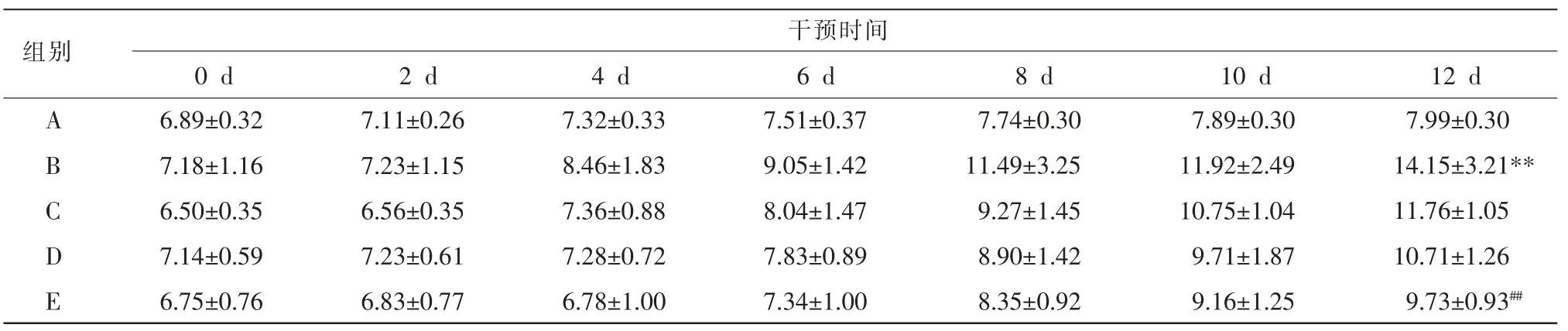
表1 补肾活血汤对乳腺癌骨转移裸鼠右下肢直径的影响(mm,±s,n=6)
注:A.空白组;B.模型组;C.补肾活血汤组;D.LY294002 组;E.补肾活血汤联合LY294002 组。 整体组别比较,P=0.034<0.05;与A 组相比,**P<0.01;与B 组相比,##P<0.01。
组别ABCDE干预时间0 d 2 d 4 d 6 d 8 d 10 d 12 d 6.89±0.32 7.18±1.16 6.50±0.35 7.14±0.59 6.75±0.76 7.11±0.26 7.23±1.15 6.56±0.35 7.23±0.61 6.83±0.77 7.32±0.33 8.46±1.83 7.36±0.88 7.28±0.72 6.78±1.00 7.51±0.37 9.05±1.42 8.04±1.47 7.83±0.89 7.34±1.00 7.74±0.30 11.49±3.25 9.27±1.45 8.90±1.42 8.35±0.92 7.89±0.30 11.92±2.49 10.75±1.04 9.71±1.87 9.16±1.25 7.99±0.30 14.15±3.21**11.76±1.05 10.71±1.26 9.73±0.93##
3.2 补肾活血汤对乳腺癌骨转移灶的影响
与A 组比较,B 组、C 组、D 组和E 组HE 染色可见肿瘤细胞浸润,核大深染,部分可见与正常组织分界,明确发生骨转移,证实造模成功(如图2)。 对下肢组织进行X 线检测,与A 组比较,B 组、C 组、D组及E 组裸鼠右侧胫骨呈现溶骨性改变,严重者骨干消失,C 组、D 组及E 组骨溶解情况均较B 组稍轻(如图3);TRAP 染色提示,与A 组比较,B、C、D、E组破骨细胞数量增多,且C 组、D 组、E 组破骨细胞数量均较B 组有不同程度减少(如图4)。
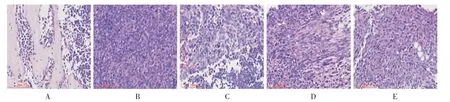
图2 补肾活血汤对裸鼠乳腺癌骨转移灶病理组织学(HE,×200)
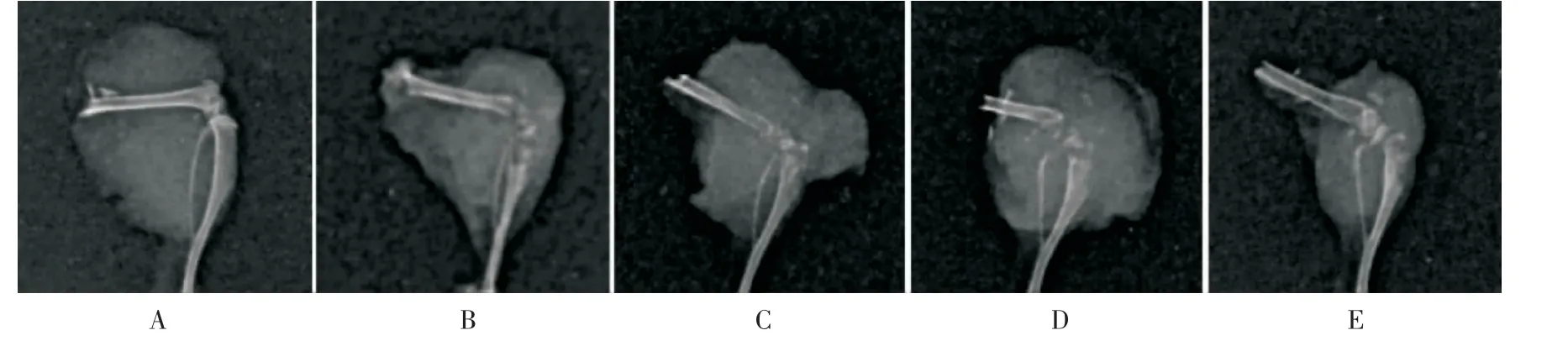
图3 补肾活血汤对裸鼠乳腺癌骨转移灶影像学影响
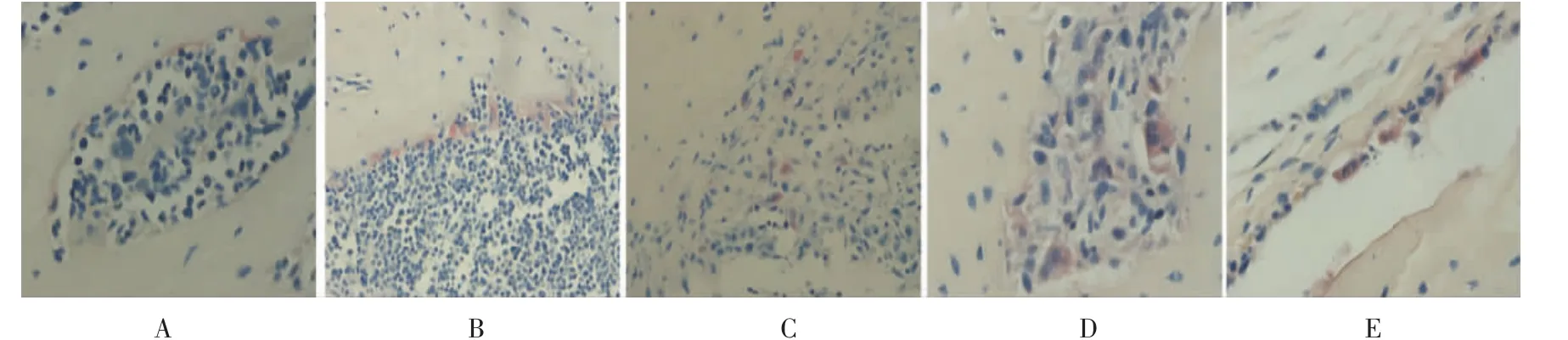
图4 补肾活血汤对裸鼠乳腺癌骨转移灶TRAP 染色的影响(TRAP,×400)
3.3 补肾活血汤对乳腺癌骨转移转移瘤组织中通路蛋白表达情况的影响
与A 组比较,B 组、C 组、D 组裸鼠瘤组织中p-PI3K、p-Akt、MMP-2 和NFATc1 蛋白的表达均升高(P<0.01 或P<0.05),E 组裸鼠瘤组织中p-PI3K、p-Akt 和MMP-2 蛋白的表达均升高(P<0.01 或P<0.05);与B 组比较,C 组、D 组及E 组裸鼠瘤组织中p-PI3K、p-Akt、MMP-2 和NFATc1 的表达均降低(P<0.01 或P<0.05);与C 组比较,E 组裸鼠瘤组织中p-PI3K、p-Akt、MMP-2 的表达均降低(P<0.01 或P<0.05),D 组及E 组裸鼠瘤组织中NFATc1 的表达呈现递减趋势(P>0.05)。 详见表2、图5。
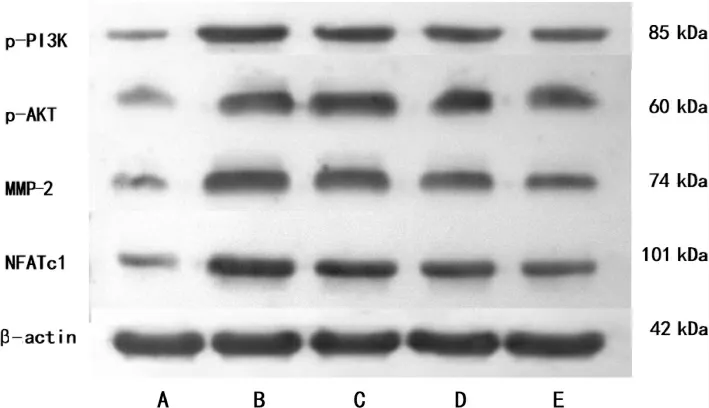
图5 各组裸鼠骨转移瘤组织p-PI3K、p-Akt、MMP-2、NFATc1 蛋白表达图
表2 补肾活血汤对乳腺癌骨转移瘤组织中p-PI3K、p-Akt、MMP-2 和NFATc1 蛋白表达的影响(±s,n=6)
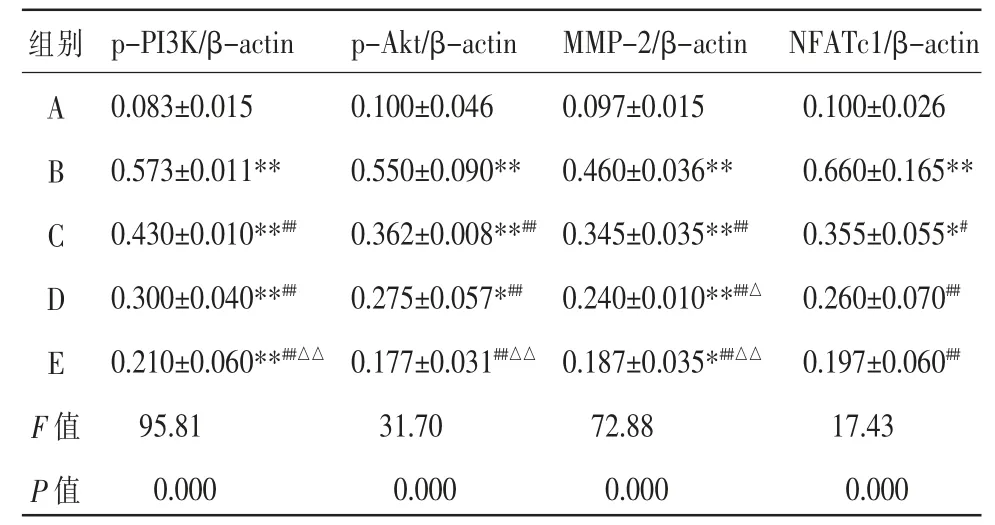
表2 补肾活血汤对乳腺癌骨转移瘤组织中p-PI3K、p-Akt、MMP-2 和NFATc1 蛋白表达的影响(±s,n=6)
注:与A 组比较,*P<0.05,**P<0.01;与B 组比较,#P<0.05,##P<0.01;与C 组比较,△P<0.05,△△P<0.01。 A.空白组;B.模型组;C.补肾活血汤组;D.LY294002 组;E.补肾活血汤联合LY294002 组。
组别A B C D E F 值P 值p-PI3K/β-actin 0.083±0.015 0.573±0.011**0.430±0.010**##0.300±0.040**##0.210±0.060**##△△95.81 0.000 p-Akt/β-actin 0.100±0.046 0.550±0.090**0.362±0.008**##0.275±0.057*##0.177±0.031##△△31.70 0.000 MMP-2/β-actin 0.097±0.015 0.460±0.036**0.345±0.035**##0.240±0.010**##△0.187±0.035*##△△72.88 0.000 NFATc1/β-actin 0.100±0.026 0.660±0.165**0.355±0.055*#0.260±0.070##0.197±0.060##17.43 0.000
4 讨论
现代医学治疗乳腺癌有手术、放化疗、靶向治疗、内分泌治疗、中医药等多种综合治疗手段,药物选择丰富多样[4]。 但是对于晚期乳腺癌,特别是转移率高达65%~75%的骨转移[22],治疗手段及疗效仍有待进一步开发研究。 PI3K/Akt 通路是细胞内的信号传导通路,其突变在TNBC 中经常被发现,高达70%[23-24]。PI3K/Akt 通路可促使M2 巨噬细胞发生极化并释放特异性降解细胞外基质的MMP-2[25-30];MMP-2 作为乳腺癌侵袭性的标志物,能促进肿瘤细胞和肿瘤基质细胞的迁移,导致肿瘤细胞更难以被免疫细胞识别、追踪与杀伤[31-32];另外,PI3K/Akt 信号通路可以通过调控破骨细胞特异性蛋白质NFATc1 的表达来影响破骨细胞形成和分化。 因此,PI3K/Akt 信号通路可能通过调控MMP-2、NFATc1 达到改善乳腺癌溶骨性骨转移的作用[33-35]。
中医学认为,乳腺癌病机为正虚邪恋,正气亏虚,邪毒凝结,病位在乳,归经属于肝、胃、肾。邪毒以痰、瘀、毒为主[7,36-37]。 加上手术、放化疗等伴随的毒副反应,导致气血精的进一步虚损,脏腑功能随之减退,全身呈现免疫低下、代谢减退及紊乱等状态。 乳腺癌骨转移以肾虚为本,血瘀为标,瘀血邪毒趁虚而入流于至虚病所,深入经筋骨骱之中,胶着不去,使经脉凝滞不通,发为病灶,出现骨痛等现象。 补肾活血汤出自《伤科大成·跌打引经用药法》,方中杜仲、熟地黄、补骨脂、独活共为君药,具有补肾壮阳、益精生髓、强筋壮骨之效;没药、当归尾、红花共为臣药,助君药以补肾填精、祛瘀通络、活血止痛;肉苁蓉、菟丝子、山茱萸、枸杞子均为佐药,性甘温平,善于补肾益精助阳。全方以补为主,标本同治,有补肾填精、活血化瘀之效。研究证实,补肾活血汤有改善局部血液循环、提高成骨细胞活性、促进骨髓间充质干细胞增殖和成骨分化、抑制破骨形成等作用[38-40]。
本研究结果显示,造模后,组织中p-PI3K、p-Akt、NFATc1 及MMP-2 蛋白的表达增高,药物干预后,C 组、D 组及E 组的转移瘤组织中p-PI3K、p-Akt、NFATc1 及MMP-2 蛋白的表达均较B 组下降;组间比较发现,E 组表达最低,呈现协同作用。 由此可见,乳腺癌骨转移发生时,机体内PI3K/Akt 通路被激活,破骨细胞活性增加,肿瘤侵袭性增强;补肾活血汤能抑制PI3K/Akt 信号通路的活化,PI3K/Akt通路的抑制下调了NFATc1 及MMP-2 蛋白的表达,减弱了破骨细胞的活性及肿瘤细胞侵袭性。 因此,补肾活血汤可能通过抑制PI3K/Akt 通路下调MMP-2 及NFATc1 的表达发挥治疗乳腺癌骨转移的作用。 本课题组选用人源性TNBC 细胞株MDAMB-231 细胞裸鼠胫骨注射造模,在预实验进行动物造模时出现造模周期长,成模率低的困境,故后期调整为鼠源性TNBC 细胞株4T1 细胞。 由于实验设备等的原因,对于X 线结果无法进行量化分析,评估存在一定局限性,无法获得统计学的验证,后续研究可结合小动物CT 进行检测,进一步评估骨小梁、骨密度等指标。
综上所述,补肾活血汤可抑制PI3K/Akt 通路以下调MMP-2 及NFATc1 的表达,削弱破骨细胞的活性和肿瘤侵袭性来治疗乳腺癌骨转移。 本研究为补肾活血汤的进一步深入研究提供了方向,为补肾活血汤的临床运用提供了数据支持。
