丹江口库区土著Pediococcus pentosaceus菌株的分离鉴定及发酵培养基的优化
2023-02-25潘中闪史红玲李中洋唐存多
潘中闪,史红玲,李 莹,李中洋,唐存多,王 娜*
(1.河南农业大学食品科学技术学院,河南郑州 450002;2.南阳师范学院南水北调中线水源区水安全河南省协同创新中心,河南南阳 473061;3.恒利康生物科技股份有限公司,河南南阳 473081)
抗生素被用作饲料添加剂以来,在全球范围内得到了广泛的应用,但同时也带来了药物残留和耐药性等一系列严峻的社会问题[1-2]。大健康时代,健康产业的概念已经不再是依赖抗生素等药物的单一救治模式,而是从这种单一救治模式转向“防-治-养”一体化模式[3],同时缓解因滥用抗生素对人类健康和生态环境造成的严重威胁[4]。在这种新型模式之下,益生菌与人体健康的关系已成为研究的热点[5]。近年来,越来越多的证据表明,人体肠道内的微生物种群变化与人体健康的关系非常密切[6],而益生菌在提升人体健康水平中扮演着举足轻重的角色。益生菌可通过维护肠道菌群的健康稳态,刺激宿主的免疫系统,增强宿主的免疫应答反应,从而帮助宿主抵抗各类疾病的发生[7]。益生菌是一类可以通过摄取适当的量、对食用者的身体健康能发挥有效作用的活菌[8],在口腔疾病、肠道疾病、过敏性疾病等的预防、治疗和修复过程中发挥着重要作用[9-11]。
戊糖片球菌(Pediococcuspentosaceus)广泛应用于食品工业领域,尤其是在益生菌剂及天然防腐剂等领域具有很广阔的应用前景[13-15]。目前戊糖片球菌多采用MRS培养基作为发酵培养基,但MRS发酵培养基成分复杂且价格昂贵。另外,菌种的自主知识产权也是制约我国益生菌产业快速发展的一个瓶颈。该研究从丹江口库区的青贮饲料中筛选一株具有知识产权、适应库区环境的土著戊糖片球菌,并在原始发酵培养基的基础上对碳源、氮源和无机盐离子分别进行成分及浓度的优化,以实现戊糖片球菌低成本、高密度的发酵生产,为丹江口库区的畜禽及水产的健康无抗养殖奠定基础。
1 材料与方法
1.1 试验材料
1.1.1主要试剂。牛肉膏、酵母粉、葡萄糖、结晶乙酸钠、柠檬酸二铵、Tween 80、K2HPO4、MgSO4·7H2O、MnSO4·H2O、CaCO3,购自北京索莱宝科技有限公司;细菌DNA基因组提取试剂盒、2×TransStart®FastPfu PCR SuperMix,购自北京全式金生物技术(TransGen Biotech) 股份有限公司;蛋白胨、琼脂、蔗糖和酵母粉,购自上海生工生物工程有限公司;淀粉、玉米粉、豆粕、麸皮,购自南阳市武侯路农贸市场;其他试剂均为国产分析纯。
1.1.2培养基。
(1)MRS液体培养基。蛋白胨10 g/L、牛肉膏10 g/L、酵母粉5 g/L、葡萄糖5 g/L、结晶乙酸钠5 g/L、柠檬酸二铵2 g/L、Tween 80 1 g/L、K2HPO42 g/L、MgSO4·7H2O 0.2 g/L、MnSO4·H2O 0.05 g/L和CaCO32 g/L,用去离子水定容至1 L,121 ℃灭菌20 min,用于菌种活化。
(2)MRS固体培养基。在液体培养基的基础上添加15 g/L 琼脂粉。
(3)基础发酵培养基。葡萄糖20 g/L、蛋白胨10 g/L、MgSO4·7H2O 0.5 g/L和MnSO4·H2O 0.2 g/L,用去离子水定容至1 L,121 ℃灭菌20 min,用于种子液发酵。
1.1.3主要仪器与设备。恒温摇床,购自上海智城分析仪器制造有限公司;UV1000紫外可见分光光度计,购自上海天美科学仪器有限公司。
1.2 试验方法
1.2.1菌种的分离及鉴定。称取1 g青贮饲料,将其置于99 mL 无菌水中,充分打散,定义稀释度为10-2,然后进行10倍梯度稀释,直到稀释度为10-6,取10-4、10-5和10-6这3个稀释度进行涂板,每个稀释度取0.1 mL涂布于MRS平板上,37 ℃厌氧培养48 h。挑取单菌落,在MRS平板上划线纯化。吸取部分液体用基因组提取试剂盒提取细菌基因组DNA。根据《伯杰细菌鉴定手册》,对目标菌株进行形态和生理生化特征鉴定。
利用细菌16S rRNA通用引物27F和1492R,以目的菌种基因组DNA为模板进行PCR扩增,1%的琼脂糖凝胶电泳。扩增后的PCR产物纯化后由上海生工生物工程有限公司测序,将测序结果提交到NCBI数据库并进行BLAST比对,下载相关序列,采用ClustalX 2.0软件进行同源性分析, Mega 6.0软件构建系统发育树。
1.2.2种子液的培养。挑取单菌落于5 mL MRS液体培养基中,37 ℃、200 r/min,振荡培养24 h。
1.2.3生长曲线的测定。以原始发酵培养基发酵种子液,37 ℃、200 r/min,振荡培养,每隔2 h取样,测定发酵液在600 nm 处的吸光度,绘制生长曲线。
1.2.4种子液的发酵培养。将活化后的种子液按体积分数5%转接至50 mL基础发酵培养基中,37 ℃、180 r/min,振荡培养18 h。
1.2.5发酵液中活菌数的测定。发酵液菌落形成单位(CFU)的测定采用稀释涂布法[16]。将稀释完的发酵液各吸取100 μL涂布于MRS固体平板,37 ℃恒温培养24 h。计数平板上形成的菌落,计算发酵液菌落形成单位数值(CFU/mL),该研究中以涂板时形成一个菌落定义为有一个活菌。
1.2.6不同碳源及其添加量对戊糖片球菌发酵活菌数的影响。配制初始发酵培养基:葡萄糖2 g、蛋白胨1 g、MgSO4·7H2O 0.05 g、MnSO4·H2O 0.02 g,用去离子水定容至100 mL,取50 mL分装至250 mL锥形瓶中,121 ℃高温灭菌20 min。初始发酵培养基的基础碳源为葡萄糖,在测定不同碳源对戊糖片球菌的发酵影响试验中,分别用蔗糖、可溶性淀粉、玉米粉替代葡萄糖作为碳源配制发酵培养基,根据发酵活菌数确定最佳的碳源。
添加不同质量浓度的最佳碳源,分别设置浓度梯度为10、20、40、60、80和100 g/L。挑取单菌落经37 ℃、200 r/min活化24 h,按5%的接种量接种至上述不同浓度碳源的培养基中,37 ℃、180 r/min培养18 h,然后分别按“1.2.5”的稀释涂布法测定不同浓度碳源下的发酵活菌数,确定最佳的碳源浓度。
1.2.7不同氮源及其添加量对戊糖片球菌发酵活菌数的影响。根据“1.2.6”中确定的发酵培养基中最佳碳源及其添加量,在该条件下配制初始发酵培养基(葡萄糖4 g、蛋白胨1 g、MgSO4·7H2O 0.05 g、MnSO4·H2O 0.02 g,用去离子水定容至100 mL,取50 mL分装至250 mL锥形瓶中,121 ℃高温灭菌20 min)。初始发酵培养基的氮源为蛋白胨,在测定不同氮源对戊糖片球菌的发酵影响试验中,分别用酵母粉、豆粕、麸皮替代蛋白胨作为氮源配制发酵培养基,根据发酵活菌数确定最佳的氮源。
添加不同质量浓度的最佳氮源,设置浓度梯度为10、20、30、40和50 g/L。挑取单菌落经37 ℃、200 r/min活化24 h,按5%的接种量接种至上述不同浓度氮源的培养基中,37 ℃、180 r/min培养18 h,然后分别按“1.2.5”的稀释涂布法测定不同浓度氮源下的发酵活菌数,确定最佳的氮源浓度。
1.2.8不同无机盐离子及其添加量对戊糖片球菌发酵活菌数的影响。根据“1.2.6”和“1.2.7”确定的发酵培养基中最佳碳源、氮源及其浓度,对无机盐离子的种类和浓度继续进行优化。在无机盐离子成分优化中,选择单一离子进行试验,即培养基中只含Mg2+或Mn2+,在此条件配制发酵培养基[葡萄糖4 g、酵母粉4 g、MgSO4·7H2O 0.05 g(或MnSO4·H2O 0.02 g),用去离子水定容至100 mL,取50 mL分装至250 mL锥形瓶中,121 ℃高温灭菌20 min],根据发酵活菌数确定最佳的无机盐离子。
在无机盐离子浓度梯度优化中,分别设置梯度为0.1、0.3、0.5、1.0、1.5、2.0和2.5 g/L。挑取单菌落经37 ℃、200 r/min 活化24 h,按5%的接种量接种至上述不同浓度无机盐离子的培养基中,37 ℃、180 r/min培养18 h,然后分别按“1.2.5”的稀释涂布法测定不同浓度无机盐离子下的发酵活菌数,确定最佳的无机盐离子浓度。
2 结果与分析
2.1 菌种的鉴定
2.1.1形态和生理生化鉴定。该研究筛选到潜在的Pediococcuspentosaceus菌株为革兰氏阳性菌,球形,在MRS固体培养基上的菌落形态呈圆形,乳白色,中央凸起、边缘齐整,光滑湿润不透明,与汪祥燕等[17]报道的高抗氧化活性戊糖片球菌菌落形态较为一致。
将该菌株根据《伯杰氏细菌鉴定手册》的方法进行生理生化鉴定。结果显示,该菌株发酵葡萄糖、果糖、乳糖产酸不产气,不发酵山梨醇、甘露醇、木糖及糊精,不还原硝酸盐,接触酶阴性,无运动性,在25和50 ℃下生长较好,这些生理生化指标均与戊糖片球菌的指标一致。
2.1.216S rRNA测序鉴定。随着分子生物学技术的发展,16S rRNA、18S rRNA及ITS测序技术已经成为微生物鉴定最可靠、最常用的分子鉴定手段。将分离出的目标菌株,利用27F和1492R通用引物克隆出了部分16S rRNA片段,并进行了测序分析,将序列在NCBI中进行BLAST分析,用ClustalX 2.0和Mega 6.0软件绘制该菌株的系统发育树,如图1所示。结果表明,该菌株的16S rRNA与PediococcuspentosaceusLE1-1菌株的相似度达到99.9%,结合形态学和生理生化特征,可以初步鉴定该菌株为Pediococcuspentosaceus,因此将其命名为PediococcuspentosaceusNY001,也获得具有自主知识产权的戊糖片球菌原始土著菌种。同时,由于它来源于本地的青贮饲料,可能具有更大地适应豫西南地区天然环境的潜能。

图1 Pediococcus pentosaceus NY001菌株的系统发育树Fig.1 The phylogenetic tree of Pediococcus pentosaceus NY001 strain
2.2 生长曲线的测定根据“1.2.3”方法测定戊糖片球菌的生长曲线,结果如图2所示,依此确定PediococcuspentosaceusNY001菌株的发酵稳定期。由图2可知,由于在一定营养物质的密闭空间内发酵,营养物质含量逐渐降低、溶液酸碱度变化等均是影响发酵后期吸光度的因素[18],当培养到18 h时,菌体的浓度基本趋于稳定,此时戊糖片球菌的生长处在稳定期;超过18 h后,菌体的浓度不会再随时间的延长而增加,相反地,活菌数目可能还有一定的降低。因此,在该研究中对PediococcuspentosaceusNY001菌株的发酵培养初步选定18 h为所考察的培养时间。
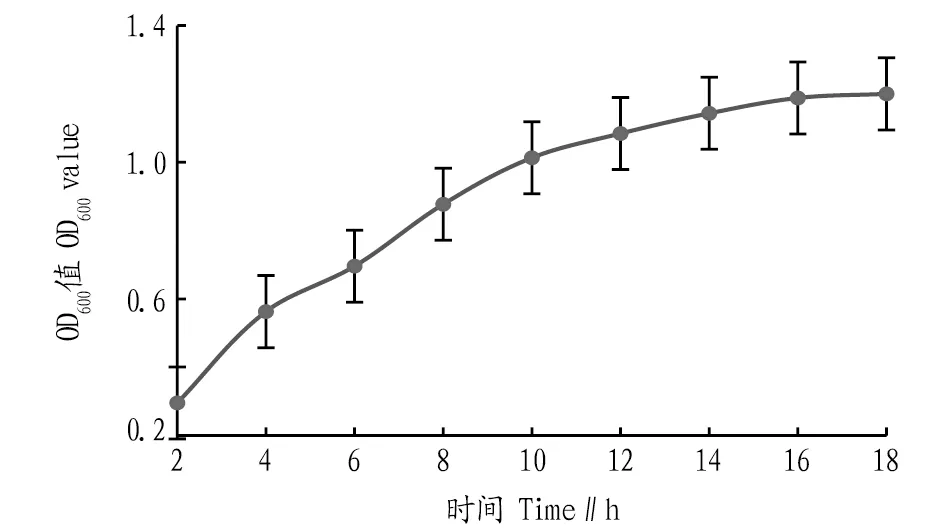
图2 戊糖片球菌生长曲线Fig.2 Growth curve of Pediococcus pentosaceus
2.3 发酵条件的优化
2.3.1不同碳源对戊糖片球菌发酵活菌数的影响。按照“1.2.6”方法,考察不同碳源对PediococcuspentosaceusNY001菌株生长的影响,利用稀释涂布法测定发酵液中的活菌数,结果如图3所示。由图3可知,在所考察的4类碳源中,最适的碳源为葡萄糖。以葡萄糖为碳源时,PediococcuspentosaceusNY001菌株发酵18 h后发酵液中的活菌数达2.5×107CFU/mL,显著高于其他3类碳源。这也表明该菌株利用二糖和多糖的能力较弱,可能归因于它体内相关的水解酶活性较低,难以将其他复合糖水解成葡萄糖进行利用。
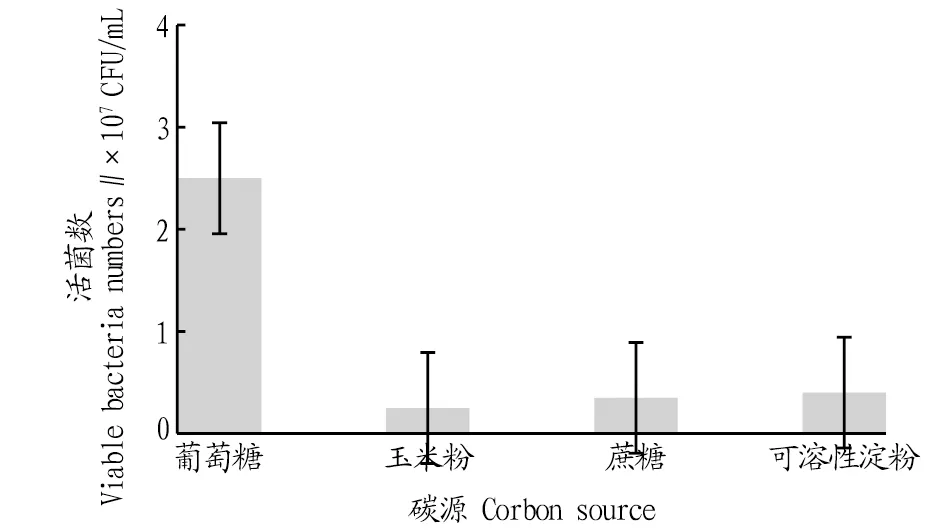
图3 不同碳源培养的活菌数比较Fig.3 Comparison of viable bacteria numbers cultured from different carbon sources
2.3.2不同碳源浓度对戊糖片球菌发酵活菌数的影响。根据图3,该研究选定葡萄糖为PediococcuspentosaceusNY001菌株发酵的最佳碳源。然后,参照“1.2.6”方法继续考察不同葡萄糖浓度对菌株发酵的影响,结果如图4所示。由图4可知,过低的葡萄糖浓度不能满足菌体生长的基本需求,过高的葡萄糖浓度对菌体生长也表现出了明显的抑制作用,虽然20 g/L的葡萄糖浓度培养的活菌数稍低于40 g/L的葡萄糖浓度培养的活菌数,但考虑到后续试验优化条件中其他因素的相互作用,因此该研究选定40 g/L为PediococcuspentosaceusNY001菌株发酵最适的葡萄糖浓度。
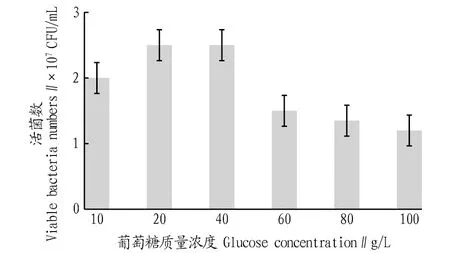
图4 不同葡萄糖浓度培养的活菌数比较Fig.4 Comparison of viable bacteria numbers cultured at different glucose concentrations
2.3.3不同氮源对戊糖片球菌发酵活菌数的影响。根据碳源优化的结果,该研究选定最佳的碳源为40 g/L葡萄糖,在此基础上再按照“1.2.7”方法继续考察不同氮源对PediococcuspentosaceusNY001菌株生长的影响,利用稀释涂布法测定发酵液中的活菌数,结果如图5所示。由图5可知,在所考察的4类氮源中,最适的氮源为酵母粉。以酵母粉为氮源时,PediococcuspentosaceusNY001菌株发酵18 h后发酵液中的活菌数达5.5×107CFU/mL,显著高于其他3类氮源。这可能归因于酵母粉的氮源组分与戊糖片球菌的组分更接近,因此戊糖片球菌对它的利用速率和效率均显著高于其他氮源。
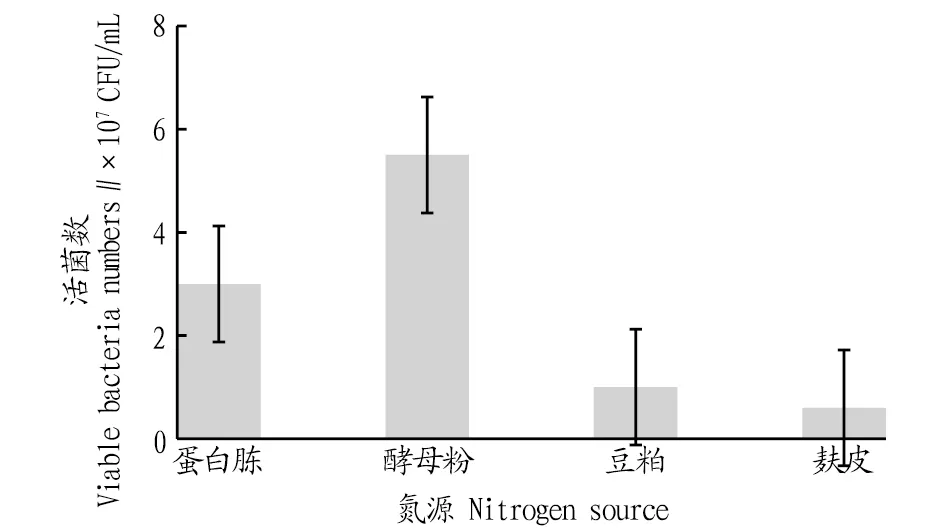
图5 不同氮源培养的活菌数比较Fig.5 Comparison of viable bacteria numbers cultured from different nitrogen sources
2.3.4不同氮源浓度对戊糖片球菌发酵活菌数的影响。根据图5,该研究选定酵母粉为PediococcuspentosaceusNY001菌株发酵的最佳氮源。然后,参照“1.2.7”方法继续考察不同酵母粉浓度对菌株发酵的影响,结果如图6所示。由图6可知,过低的酵母粉浓度不能满足菌体生长的基本需求,过高的酵母粉浓度对菌体生长也表现出了一定的抑制作用,因此该研究选定40 g/L为PediococcuspentosaceusNY001菌株发酵最适的酵母粉浓度。
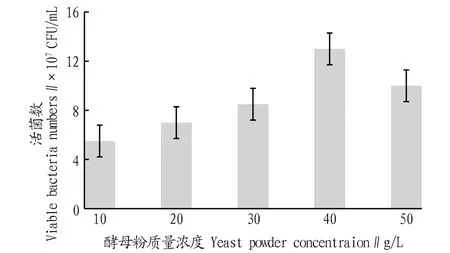
图6 不同酵母粉浓度培养的活菌数比较Fig.6 Comparison of viable bacteria numbers cultured at different yeast powder concentrations
2.3.5不同无机盐离子对戊糖片球菌发酵活菌数的影响。根据碳源和氮源优化的结果,该研究选定最佳的碳源为40 g/L 葡萄糖,最佳的氮源为40 g/L酵母粉,在此基础上再按照“1.2.8”方法继续考察不同无机盐离子类型对PediococcuspentosaceusNY001菌株生长的影响,利用稀释涂布法测定发酵液中的活菌数,结果发现,添加Mg2+的效果显著高于添加Mn2+的效果,在此条件下,PediococcuspentosaceusNY001菌株发酵18 h后发酵液中的活菌数达1.8×109CFU/mL,约为添加Mn2+的3倍。
2.3.6不同Mg2+浓度对戊糖片球菌发酵活菌数的影响。根据“2.3.5”可知,当发酵培养基中添加Mg2+时更有益于戊糖片球菌生长。为了进一步提高发酵液中的活菌数,参照“1.2.8”方法继续考察不同Mg2+浓度对菌株发酵的影响,结果如图7所示。由图7可知,过低和过高的Mg2+浓度均不利于戊糖片球菌的生长,在所考察的浓度范围内,1.0 g/L为最适的Mg2+浓度,在此条件下,PediococcuspentosaceusNY001菌株发酵18 h后发酵液中的活菌数达2.2×109CFU/mL,约为初始发酵水平(2.5×107CFU/mL)的88倍。同时,与前人的研究相比[19],该研究在没有使用牛肉膏、蛋白胨等昂贵氮源的前提下,经过18 h的发酵,发酵液中的活菌数也能达到109CFU/mL,因此该研究在一定程度上节约了生产成本和发酵时间,具有较强的产业化生产优势和应用前景。
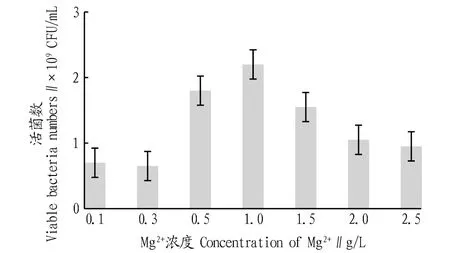
图7 不同Mg2+浓度培养的活菌数比较Fig.7 Comparison of viable bacteria numbers at different Mg2+ concentrations
3 结论
(1)该研究从南阳地区的青贮饲料中筛选到了一株野生型乳酸菌株,经过形态学、生理生化及16S rRNA测序鉴定,该菌株为戊糖片球菌,并将其命名为PediococcuspentosaceusNY001菌株。该菌株为南阳地区原始的土著菌种,长期适应了南阳地区的气候、温度、湿度等环境因素,在后续的生产应用中可能会具有更强的环境适应性。
(2)对PediococcuspentosaceusNY001菌株发酵培养基的成分进行了优化,获得了PediococcuspentosaceusNY001菌株较优的发酵培养基为葡萄糖40 g/L、酵母粉40 g/L、MgSO4·7H2O 1.0 g/L。在此条件下,PediococcuspentosaceusNY001菌株的最大发酵活菌数可达到2.2×109CFU/mL,约为初始发酵水平的88倍。
(3)该研究为开发丹江口库区环境适应性强、能用于兽用益生菌的土著戊糖片球菌制剂奠定了坚实的基础,对推动南水北调中线工程后期高质量发展有重要的意义。
