清香型白酒大曲中产酶酵母的筛选与发酵特性研究
2023-02-16牟飞燕肖钧文董孝元陈茂彬方尚玲
牟飞燕,凌 荔,肖钧文,李 良,董孝元,陈茂彬,张 玉,方尚玲
(1.湖北工业大学生物工程与食品学院,湖北武汉 430068;2.湖北省黄鹤楼酒业有限公司,湖北武汉 430068)
清香型白酒以“汾酒、黄鹤楼酒”为代表,酒曲主要原料是大麦与豌豆,中国传统白酒以“曲”为发酵剂(启动物),酿造过程直接受大曲中微生物和酶系的影响。主要起作用的微生物类型是酵母菌、霉菌、细菌以及放线菌[1]。白酒发酵过程中酵母菌主要作用是产酒和生香,可以将原料中的一部分糖转化为乙醇,同时生成酯类、醇类、醛酮类、芳香族化合物等物质,直接影响酒的外观、香味以及口感。
淀粉酶是水解淀粉和糖原酶类的总称,是一类可以催化α-D-吡喃葡糖基之间1-4 糖苷键水解的酶类,能使淀粉绝大部分转化为可发酵性糖从而提高淀粉利用率,是衡量大曲质量的重要指标[2]。蛋白酶分为中性蛋白酶、碱性蛋白酶和酸性蛋白酶,蛋白酶可以提高产酒率,产物氨基酸可参与香气物质的合成和促进酵母生长[3]。微生物代谢是蛋白酶的主要来源。微生物产蛋白酶活的高低会直接影响到微生物的作用以及大曲的质量[4]。
微生物代谢调节产生的具有特征风味的化合物是中国白酒风味特征形成的主要影响因素[5]。酵母菌的发酵特性因其菌株的不同存在明显差异,菌株的不同会导致利用的底物不同,生成的风味化学物质不同,因此固态发酵出的产物的特征香味成分会存在显著区别。本研究以湖北某酒厂的清香型大曲为原料,筛选出产淀粉酶和蛋白酶的酵母菌,对其固态发酵产物进行挥发性风味物质检测,以研究酵母菌的产酶特性和发酵特性。
1 材料与方法
1.1 材料、试剂及仪器
原料:清香型大曲,湖北某酒厂。
分离纯化培养基(YPD培养基):酵母浸粉10 g、蛋白胨20 g、葡萄糖20 g、琼脂20 g、水1000 mL。
筛淀粉酶产生菌培养基:牛肉膏5 g、NaCl 5 g、蛋白胨10 g、可溶性淀粉2 g、琼脂20 g、蒸馏水1000 mL,121 ℃灭菌15 min。
种子液培养基:牛肉膏5 g、蛋白胨10 g、NaCl 5 g、琼脂20 g、可溶性淀粉2 g、蒸馏水1000 mL,121 ℃灭菌15 min。
发酵培养基(高粱固态培养基):在一定量的高粱中加入60%的沸水润粮20 h 后在121 ℃下蒸粮50 min,用开水复水20 min,127 ℃下再次蒸粮20 min 后取出,加入15 μ g 的淀粉酶并在95 ℃保温反应1 h,再加入250 μ g 的糖化酶并在55 ℃下保温反应2 h得到固态发酵培养基。
试剂及耗材:标准葡萄糖溶液(1 g/L)、DNS 溶液、酪氨酸溶液、福林酚溶液、三氯乙酸溶液、稀碘液等。
仪器设备:高速台式冷冻离心机,德国Eppendorf 公司;超微量分光光度计,美国Thermo Fisher Scientific 公司;粉碎研磨仪,上海万柏生物科技有限公司;气质联用仪,安捷伦科技。
1.2 实验方法
1.2.1 酵母菌的分离与纯化
采用稀释涂布平板分离法[6]从大曲中分离菌种:称取10 g 粉碎后的清香型大曲加入到灭菌后的0.9%生理盐水中,摇床摇20 min后过滤得到10-1的样品,用0.9%生理盐水对10-1的样品进行稀释,得到10-2、10-3、10-4、10-5样品液,选择合适的梯度,取150 μ L 的样品液涂布在固体YPD 培养基上,30 ℃培养24~48 h。选择生长状况良好,菌落形态显著的菌种,采用划线平板分离法对其进行纯化。
1.2.2 种子液的配制与固态发酵
取纯化后的单菌落,接种于灭菌后的液体YPD培养基中,30 ℃摇床培养3 d,得到种子液;采用三角瓶培养法进行固态模拟发酵,将种子液以5%的比例接种于装于固态发酵培养基中(50 g 高粱),30 ℃培养7 d。
1.2.3 产淀粉酶功能菌筛选
经分离纯化的菌种通过透明圈法进行初筛,将活化的酵母点种于筛淀粉酶产生菌培养基上,30 ℃培养箱中培养24~48 h 后将稀碘液滴在菌落周围,菌落周围产生透明圈证明该菌产淀粉酶。
采用DNS 法[7]对菌种的产淀粉酶活力进行检测,稍作修改。(1)标准曲线的制作:由标准葡萄糖溶液(1 g/L)稀释得到0.2 g/L、0.4 g/L、0.6 g/L、0.8 g/L、1 g/L 标准糖组,分别取标准糖组中不同浓度的糖液0.5 mL,加入1.5 mL DNS 溶液后在沸水中煮沸15 min,冷却后加入10.5 mL 蒸馏水,在550 nm 处测定其OD 值,每个浓度做三个平行,以葡萄糖浓度为横坐标,以OD 值为纵坐标制作标准曲线;(2)样品粗酶液淀粉酶活力的测定:取模拟固态发酵物2.5 g,加水50 mL,静置1 h 后,8000 r/min 离心5 min 得到粗酶液,取粗酶液1 mL、加入9 mL 的淀粉缓冲液,于50 ℃下恒温水浴反应20 min,吸取反应液0.5 mL,加入DNS 试剂1.5 mL,沸水浴15 min,冷却后加入3.5 mL 蒸馏水,摇匀在550 nm 处测吸光度。对照组处理方法除了将粗酶液1 mL 换成蒸馏水1 mL外,其余步骤与样品处理相同。
1.2.4 产中性蛋白酶菌株筛选
采用福林酚法[8]对菌种产中性蛋白酶活力进行检测,稍作修改。(1)标准曲线的制作:将100 mg/L的酪氨酸溶液稀释成0 μg/mL、20 μg/mL、40 μg/mL、60 μ g/mL、80 μ g/mL、100 μ g/mL 标准酪氨酸组,分别取标准酪氨酸组的不同浓度酪氨酸1 mL,加入5 mL的Na2CO3溶液和1 mL福林酚,40 ℃水浴20 min 后,在680 nm 处测定其OD 值,每个浓度做三个平行,以酪氨酸浓度为横坐标,OD值为纵坐标绘制标准曲线;(2)含水量的测定:取一定量的培养物称重并记录,105 ℃烘干至恒重,然后称重,计算其含水量;(3)粗酶液中性蛋白酶活力的测定:取5 g 固态培养物,加pH7.2 磷酸缓冲液100 mL,静置浸提1 h 后,8000 r/min 离心5 min,得到待测样品的粗酶提取液,取粗酶液1 mL,40 ℃预热5 min,加入同样40 ℃预热5 min 的20 g/L 中性酪蛋白溶液1 mL,精准保温10 min 后加入2 mL 的0.4 mol/L 三氯乙酸后保温20 min,8000 r/min 离心5 min,取上清液1 mL,加入Na2CO35 mL 和稀释的福林酚1 mL,40 ℃水浴保温20 min 后,在680 nm 处测定OD 值。对照组处理方法除将酪蛋白溶液和三氯乙酸溶液加入的顺序调换,其余与样本处理相同。
1.2.5 分子生物学鉴定
通过16S rDNA 分子生物学鉴定对两株酵母进行测序[2]。
1.2.6 香气成分检测
HS-SPME 步骤:准确称取3 g 模拟固态发酵物质于顶空瓶中,在磁力搅拌器上(60 ℃)平衡15 min,将萃取头插入顶空瓶距离样品1 cm 处萃取40 min,插入进样口解析5 min 取出,经GC-MS 进行分析。GC-MS条件同参考文献[9]。
2 结果与分析
2.1 筛菌结果
通过稀释涂布平板法从大曲中筛选出两株菌落形态为白色、圆形、干燥、菌丝紧密、难挑起的酵母,通过镜检发现两株酵母不仅都含有酵母状的芽殖细胞,还含有分支状的隔假菌丝(图1)。将两株酵母命名为JM1-1和JM1-2。

图1 两株酵母的镜检图(10×40倍)
2.2 产淀粉酶菌株的筛选
淀粉培养基上接种筛选出的两株酵母菌,在30 ℃下培养24 h 后,将碘液滴在菌落周围,观察其透明圈,结果如图2所示。
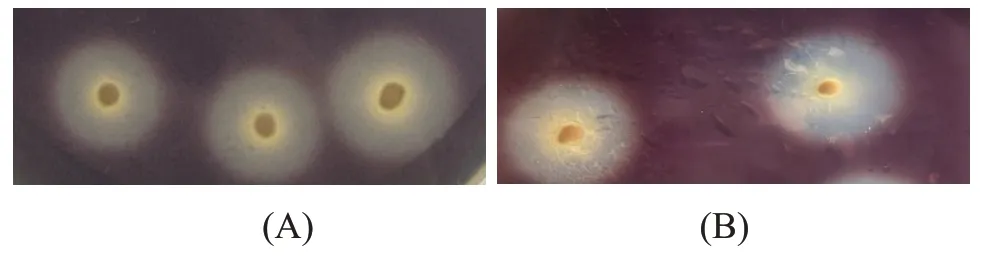
图2 两株酵母的初筛透明圈图
JM1-1 和JM1-2均产生透明圈,JM1-1 和JM1-2 的透明圈直径和菌落直径比值(D/d值)大小分别为5.55和7,即两株酵母菌均产淀粉酶。
不同菌株的生长速度、产酶速度和淀粉酶酶系的不同以及培养基的厚度和固体液体培养基的不同,会使菌种在平板上的菌种大小与堆积情况有所差异,造成透明圈大小上的区别,透明圈的D/d 值虽然可以反映菌株具有产酶能力,却不能完全代表菌株产酶能力的大小,因此模拟固态发酵进行复筛是必不可少的[10]。
进一步对初筛的两株产淀粉酶酵母菌做模拟固态发酵培养试验,采用DNS 法对待测样品的粗酶液淀粉酶酶活进行精确测定。将测定的标准曲线数据绘制成图得出的回归方程为:y=0.5759x-0.0148(R2=0.9976),两株酵母的淀粉酶活力见表1,U代表每分钟水解淀粉产生1 mg葡萄糖,定义为一个淀粉酶活力单位。

表1 两株酵母菌的淀粉酶活力
由表1 可看出,JM1-1 产淀粉酶活力为68.640 U/mL,JM1-2产淀粉酶活力为30.352 U/mL,两株酵母都产淀粉酶,JM1-1 的产淀粉酶能力强于JM1-2。
2.3 产中性蛋白酶菌株的筛选
通过福林酚法测定的数据绘制标准曲线得出的回归方程为y=0.0084x+0.0103(R2=0.9982)。两株酵母的蛋白酶活力如表2 所示,U 代表在40 ℃下每分钟水解酪蛋白产生1 mg 酪氨酸,定义为一个蛋白酶活力单位。
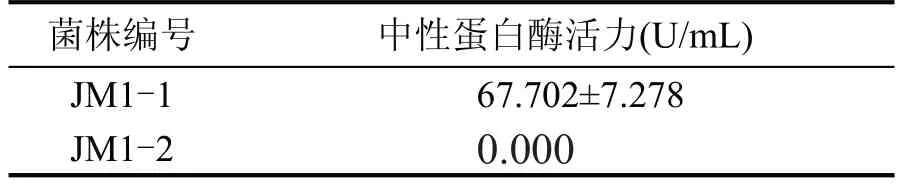
表2 两株酵母菌中性蛋白酶活力
由表2 可以看出,JM1-1 产中性蛋白酶活力为67.702 U/mL,JM1-2 不产中性蛋白酶。JM1-1 中含有的中性蛋白酶可以使蛋白质包裹的淀粉暴露,经过淀粉酶的作用,使淀粉糖化,促进发酵,同时蛋白酶使蛋白质水解获得碳源,有利于酿酒微生物的生长[11]。蛋白酶在发酵过程中可将粮谷原料中部分风味物质的前体物质即蛋白质类(氨基酸、小分子肽)等降解,降解产物可再经过多种微生物的代谢,生成醇类、酯类、酸类和醛酮类等多种风味物质,对白酒香味有一定的贡献。
2.4 鉴定结果
根据检测结果:JM1-1 为Saccharomycopsis fibuligera(扣囊复膜酵母)、JM1-2 为Wickerhamomyces anomalus(异常威克汉姆酵母)。
2.5 香气成分检测结果
由表3 可知,运用顶空固相微萃取气相色谱质谱法检测出JM1-1 和JM1-2 均有42 种香气挥发性成分。JM1-1 有19 种酯类,12 种醇类,4 种酸类,5种醛酮类,2 种其他;JM1-2 包含酯类21 种,醇类14种,酸类1种,醛酮类5种,其他1种。
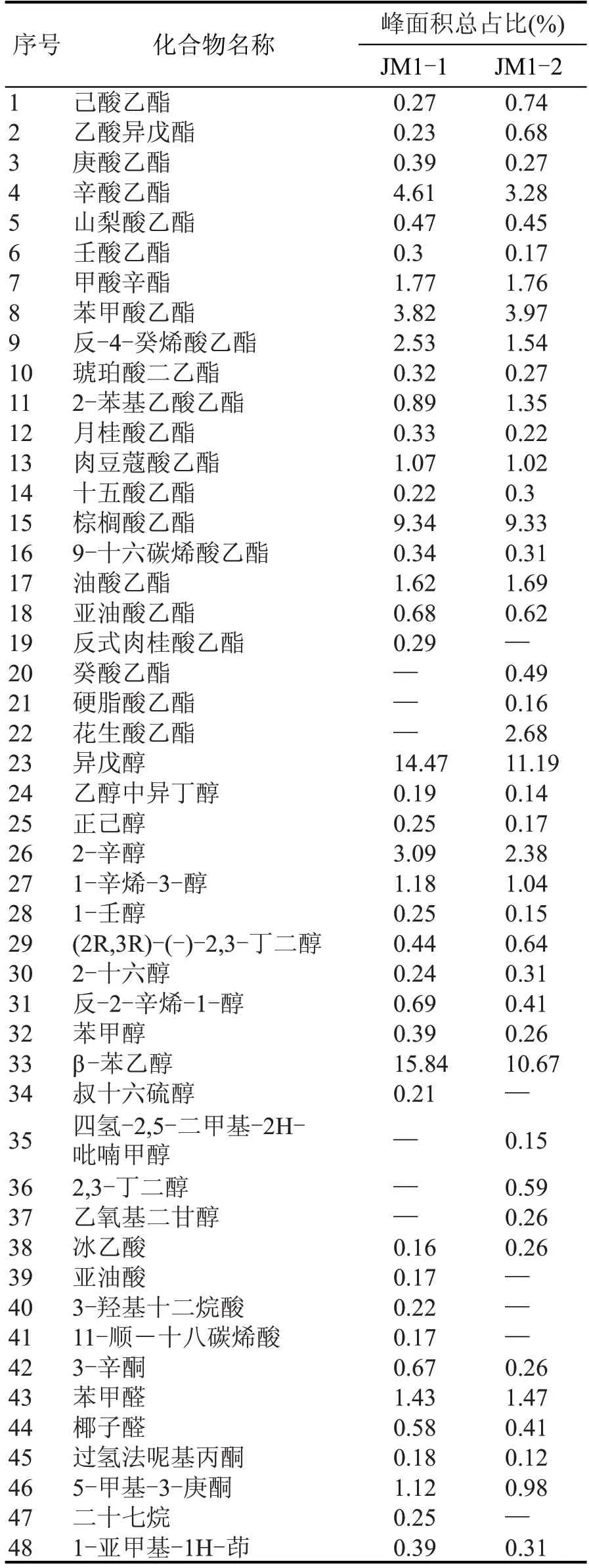
表3 两株酵母菌模拟发酵后香气成分检测结果
图3 琼脂糖凝胶电泳图
JM1-1 和JM1-2 中香气成分相对占比较大的物质有辛酸乙酯、苯甲酸乙酯、棕榈酸乙酯、甲酸辛酯、反-4-癸烯酸乙酯、油酸乙酯、异戊醇、2-辛醇和β-苯乙醇等,JM1-2中花生酸乙酯含量也较高。
固态发酵产物的挥发性成分与空白发酵产物对比,JM1-1 和JM1-2 的酯类和醇类种类大大增加,这些风味物质对香味的形成有一定贡献[12]。醇类、酯类均会产生一些令人愉快的气味,酯类是白酒中占比最大的风味物质,部分醇类具有水果香味,适量的高级醇可以丰富白酒香气并可以提升酒的浓厚感与协调感。两株酵母都产具有玫瑰香味的β-苯乙醇,β-苯乙醇是白酒中的一种重要香气成分和香气前体物质,提高其浓度有利于丰富白酒的香气层次,目前来说酵母菌是合成β-苯乙醇主要菌属[13]。
大曲中酶活与香气物质的生成有着密不可分的关系,淀粉酶可将淀粉水解为葡萄糖,葡萄糖可以经过糖酵解途径(EMP)和丙酮酸的无氧酵解反应生成乙醇,从而催化酯类的生成,当淀粉酶活力高时,可增加莽草酸途径的前体供应,致使流入莽草酸途径的通量增加[14],有利于β-苯乙醇等芳香醇特征香气成分的合成。
3 结论
非酿酒酵母可以产生酯和高级醇等风味物质,以及某些参与酿酒过程反应的酶类[15]。经鉴定判断两株酵母菌分别为Saccharomycopsis fibuligera和Wickerhamomyces anomalus。两株酵母菌均属于非酿酒酵母。Saccharomycopsis fibuligera既产淀粉酶又产蛋白酶,Wickerhamomyces anomalus只产淀粉酶,并且Saccharomycopsis fibuligera的产淀粉酶能力高于Wickerhamomyces anomalus。产淀粉酶活力和产蛋白酶活力是大曲十分重要的生化指标,淀粉酶和蛋白酶不仅影响着基酒的产量,还与白酒风味物质的生成有着密切联系,酶可以催化微生物的生化反应,有利于白酒中特征香气成分的合成。
白酒中的风味物质主要来自原料、酒曲及微生物发酵过程,微生物发酵是白酒风味的主要来源[16]。通过对两株酵母的固态发酵产物进行顶空固相微萃取检测,发现两株酵母产的风味物质种类有所不同。JM1-1 具有良好的产酶能力和产香能力。本结论与前人研究出扣囊复膜酵母(S.fibuligera)广泛存在于清香型白酒中,除了具有产糖化酶和淀粉酶能力外,还产生β-苯乙醇、乙酸异戊酯、棕榈酸乙酯和苯乙酸乙酯等风味物质[16]相符合。
本研究丰富了清香型白酒大曲中既产淀粉酶又产蛋白酶的菌种资源,同时初步说明扣囊复膜酵母在酿造生香方面具有很好的应用潜质,后续研究方向可围绕该菌株的综合性能、与酿酒酵母协同发酵以及与霉菌的产淀粉酶能力对比等方面展开。
