甘蔗内生酵母菌的分离鉴定及发酵性能
2023-01-30徐易洁张红玉解修超邓大红魏嘉毅舒颗
徐易洁,张红玉,解修超*,邓大红,魏嘉毅,舒颗
(1.陕西理工大学生物科学与工程学院,陕西 汉中 723000;2.陕西省食药用菌工程技术研究中心,陕西 汉中 723000)
甘蔗(Saccharum officinarum)为禾本科甘蔗属多年生草本植物,是世界重要的糖料作物和能源作物。我国是世界第三大甘蔗生产国,拥有丰富的甘蔗资源。甘蔗中含有丰富的糖分和水分,还含有对人体新陈代谢有益的各种维生素、脂肪、蛋白质、有机酸、钙、铁等[1],汁液也可发酵做成糖酒。酵母菌在果酒发酵过程中起着十分重要的作用[2-3]。与其它真菌相比,酵母菌具有生长周期短、易培养、发酵性能优良、不易污染等特点,在农业、工业、医药、食品发酵等行业中具有极高的应用价值[4]。近年来,许多学者从植物中分离出了内生酵母菌株,并将其应用于食品发酵行业中,如从葡萄[5]、无花果[6]、桑葚[7]和枸杞[8]等果实中分离出可以用于酿酒的内生酵母菌株。
植物内生酵母菌是指在其生命周期的一部分时间内定植在健康植物组织中,而不会对寄主植物造成损害的一类酵母菌,它与植物在长期进化过程中形成了互惠共生、相互依存的关系[9]。甘蔗中内生菌资源十分丰富[10]。目前,国内外对于甘蔗的研究主要集中于内生真菌和内生细菌多样性及其相关应用[11-13],而对甘蔗中另一类特殊的内生真菌——内生酵母菌的种类及其应用的研究较少。目前,在甘蔗叶片中被分离出的内生酵母有148株,主要为子囊菌类酵母[14];甘蔗尾中被分离出的内生酵母主要为Kazachstania humilis和扁平云假丝酵母(Candida humilis)等[15]。在甘蔗内生酵母菌的应用方面,Khunnamwong等[14]从甘蔗叶片中分离出对甘蔗红腐病具有一定生防效果的异常威克汉姆酵母(Wickerhamomyces anomalus)。关于甘蔗内生酵母菌株用于发酵行业的报道鲜见。甘蔗中的内生酵母菌种类丰富,但在各行各业中的开发率和利用率相对较低。本文旨在研究甘蔗中内生酵母菌的种类、内生酵母菌株的生长性能和发酵性能,为后续应用于发酵行业提供参考。
1 材料与方法
1.1 材料
1.1.1 材料与试剂
甘蔗:市售;硫酸镁、磷酸二氢钾、硝酸钾、硫酸铵、氯化钠、无水乙醇等均为国产分析纯。
1.1.2 培养基
综合马铃薯葡萄糖琼脂(comprehensive potato dextrose agar medium,CPDA)培养基(1 L):土豆 200 g、葡萄糖20 g、磷酸二氢钾5 g、硫酸镁3 g、维生素B 0.5 g、蛋白胨5 g、琼脂15 g,pH自然。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose agar medium,YPD)培养基(1 L):酵母浸粉 10 g、蛋白胨20 g、葡萄糖20 g、琼脂20 g,纯化时加0.1 mg/mL氯霉素,pH自然。
碳源同化试验培养基:将YPD培养基中的葡萄糖等比例分别换成木糖、肌醇、麦芽糖、柠檬酸、琥珀酸、淀粉、半乳糖醇,其余组分一致,pH自然。
氮源同化试验培养基:将YPD培养基中的蛋白胨等比例分别换成硫酸铵、硝酸钾、尿素,其余组分一致,pH自然。
糖发酵试验培养基:将YPD培养基中的葡萄糖等比例分别换成海藻糖、甘露糖、果糖、淀粉、蔗糖、葡萄糖、乳糖、麦芽糖,其余组分一致,pH自然。
以上培养基配制完成后均121℃高温灭菌25 min备用。
1.2 仪器与设备
ZHWY-2102C型数显式恒温摇床:上海志成科技发展有限公司;E600型高级研究显微镜:日本Nikon公司;Mycycler型PCR扩增仪、GelDoc型凝胶成像系统:美国Bio-rad公司;Allegra6型低温高速离心机:美国Beckman公司;SW-CJ-1D型单人超净工作台:上海苏净实业有限公司;YXQ-LS-50S型高压灭菌锅:上海博讯实业有限公司医疗设备厂;UA2550型紫外分光光度计:日本岛津公司;DYCZ-22A型水平电泳仪:北京六一生物科技有限公司。
1.3 方法
1.3.1 甘蔗内生酵母菌的分离与纯化
对新鲜甘蔗样品表面进行消毒[16],切小段研磨后收集汁液。将汁液用无菌水稀释,得到 10-2、10-4、10-6、10-8梯度稀释液,分别吸取100 μL稀释液于含有0.1 mg/mL氯霉素的CPDA固体培养基中涂布,26℃培养48 h~72 h,挑取不同形态的单个菌落,接种于加入0.1 mg/mL氯霉素的YPD固体培养基中继续培养48 h~72 h。菌落重复划线,观察菌落形态并记录特征,直至纯化出单一形态菌株。将菌株保藏在40%甘油中,冻存于-20℃冰箱备用。
1.3.2 酵母菌株的生理生化鉴定
参照《酵母菌的特征与鉴定手册》[17]进行碳氮源同化以及糖发酵的生理生化试验。
1.3.3 酵母菌株的分子生物学鉴定
1.3.3.1 酵母菌基因组总DNA的提取及片段扩增
采用十六烷基三乙基溴化铵(cetyltriethylammoni um bromide,CTAB)法[18]提取菌株基因组 DNA,于-20 ℃下保存。
26S rDNA D1/D2区序列的扩增引物为NL1(5'-GCATATCAATAAGCGGAGGAAAAG-3')和 NL4(5'-GGTCCGTGTTTCAAGACGG-3');聚合酶链式反应(polymerase chain reaction,PCR)条件:94℃、5 min预变性,94 ℃、1 min,58℃、1 min,72℃、1 min,36个循环,72℃最后延伸10 min。
1.3.3.2 测序及系统发育树的构建
PCR产物经琼脂糖凝胶电泳条带检测后送往上海生工(生物)工程有限公司测序。测序结果与GenBank序列进行同源性比较,选取GenBank中相似度最高的已知序列,通过Clustalx比对后,用MEGA 7.0软件采用邻接(neighbour-joining,NJ)法构建系统发育树。
1.3.4 酵母菌株产气性能测定
将63株酵母菌从甘油管中挑出,活化后接种到YPD液体培养基,26℃培养24 h,分别以2%接种量接种于装有YPD液体培养基的杜氏小管中,26℃培养72 h,观察并记录杜氏管[19]中菌株的产气情况、凝聚性以及发酵液的气味,初步筛选出产气性能良好的菌株。
1.3.5 酵母菌株生长性能的测定
1.3.5.1 最适生长温度和pH值的确定
将1.3.4中筛选出的产气性能良好的菌株活化后接种到YPD液体培养基内,26℃培养24 h,分别以2%的接种量接种到YPD液体培养基中,在不同温度(24、26、28、34、37、40 ℃)和其对应最适温度条件下的不同pH 值(4.5、5.0、6.0、6.5、7.5)中培养 24 h,取试验生长菌液于比色皿中,以未接种的YPD液体培养基为空白对照,用分光光度计测定波长600 nm条件下的OD值,以确定菌株的最适生长温度和pH值。
1.3.5.2 生长曲线绘制
方法同1.3.5.1中所述,将1.3.4中筛选的产气性能良好的菌株放置于其最适生长温度和最适pH值中培养72 h,每隔4 h取试验菌液于比色皿中,以未接种的YPD液体培养基为空白对照,用分光光度计测定波长600 nm条件下的OD值。
1.3.6 酵母菌株发酵性能的测定
乙醇、氯化钠以及葡萄糖的耐受性测定:将1.3.5中筛选的生长性能优良的菌株活化后接种到YPD液体培养基,26℃培养24 h,分别以2%的接种量接种于含不同乙醇体积分数(8%、10%、12%、14%、16%、18%、20%)、不同氯化钠浓度(60、80、100、120、140 g/L)和不同葡萄糖浓度(100、150、200、250、300 g/L)的 YPD 液体培养基中,26℃培养24 h,在600 nm波长下分别测OD值。
1.3.7 数据处理与分析
每个试验条件下获得3组平行试验数据,使用SPSS 22.0对不同试验条件下所获取的数据进行均值计算,使用GraphPad Prism 8.0.2进行图表制作。
2 结果与分析
2.1 甘蔗内生酵母菌的分离与鉴定
2.1.1 菌株的形态学鉴定结果
通过富集培养和划线分离,共分离得到酵母菌63株。对菌株进行菌落形态和个体形态对比,最终得到8株生长状况良好且形态不同的酵母,将其编号为J-1~J-8,菌落形态和个体形态如图1所示。
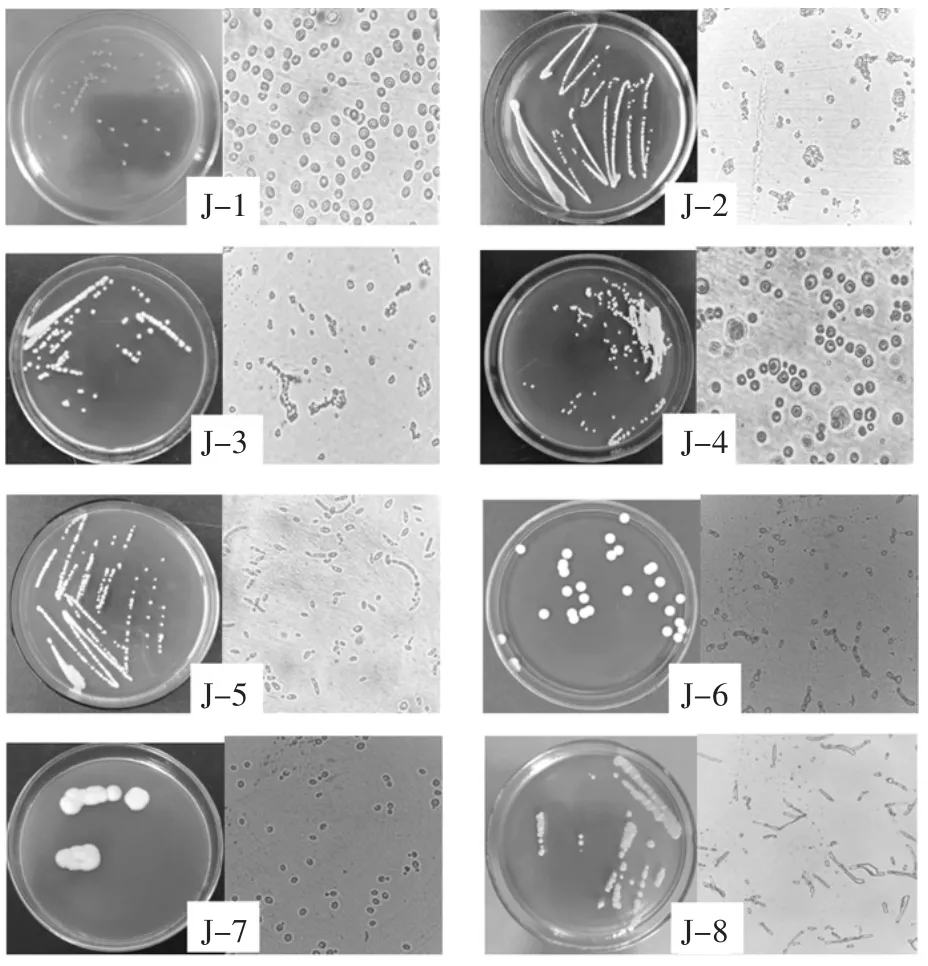
图1 酵母菌株的菌落形态及个体形态Fig.1 Colony morphology and cell morphology of yeasts
菌株J-1~J-8的菌落形态和个体形态描述如表1所示。
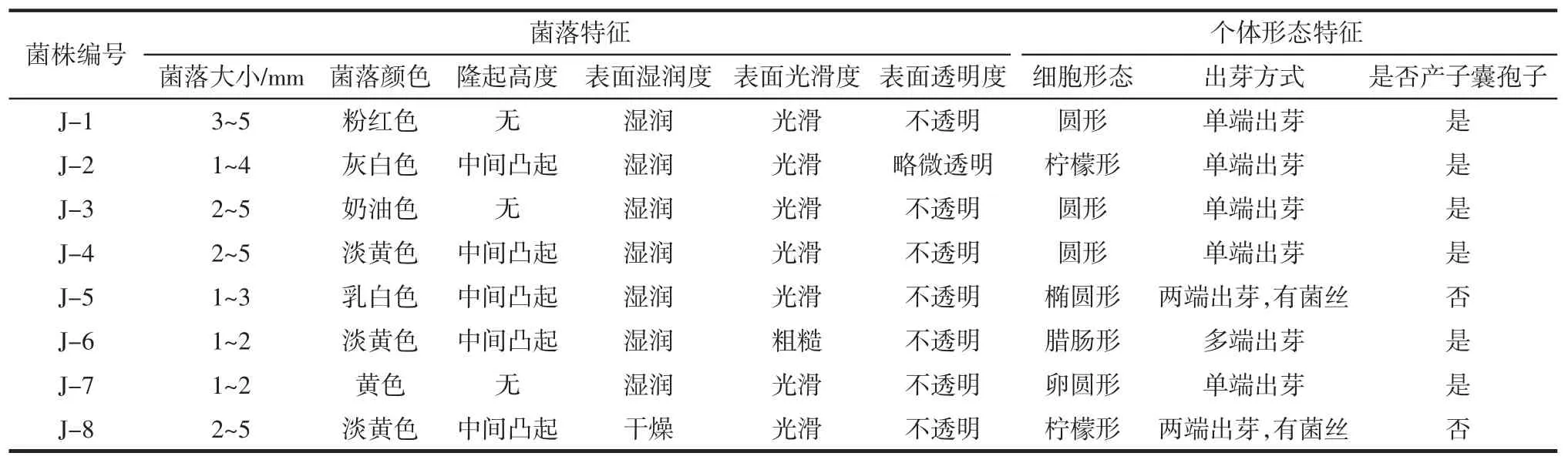
表1 甘蔗内生酵母菌菌落和形态特征Table 1 Morphological characters of endophytic yeast colony
2.1.2 菌株生理生化鉴定结果
2.1.2.1 菌株碳氮源同化试验结果
参照《酵母菌的特征与鉴定手册》,共使用7种碳源和3种氮源对8株菌进行碳氮源同化试验,结果如表2所示。
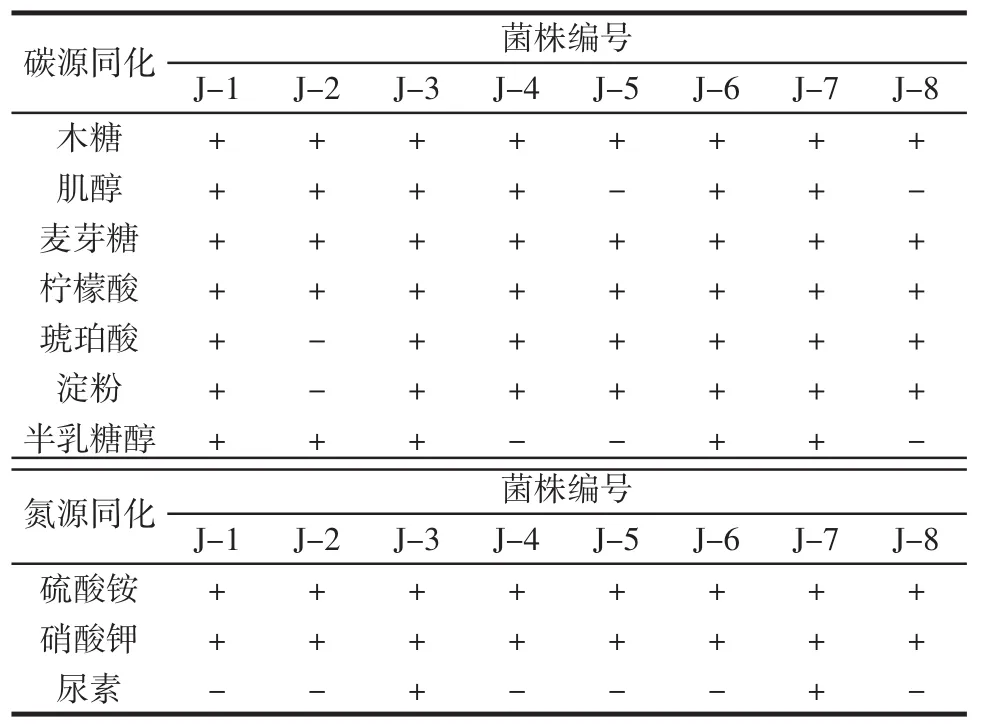
表2 碳氮源同化试验Table 2 Carbon and nitrogen source assimilation
2.1.2.2 菌株的糖发酵试验结果
参照《酵母菌的特性与鉴定手册》共使用8种糖对8株菌进行糖发酵试验,结果如表3所示。
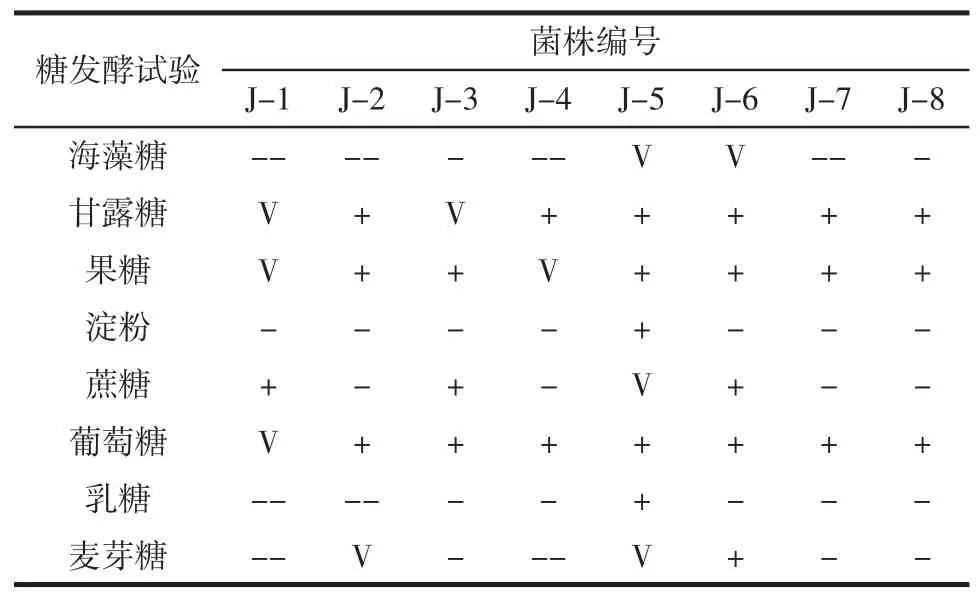
表3 糖发酵试验Table 3 Sugar fermentation test
由表1、表2、表3可知,菌株J-1~J-8符合酵母菌的基本特征。菌株J-5和J-8菌落中间凸起,细胞呈椭圆形、柠檬形,两端出芽,无子囊孢子,有菌丝,初步推测为假丝酵母属(Candida sp.)。剩余菌株暂无鉴定结果,需通过分子生物学进一步确认。
2.1.3 酵母菌的分子遗传学鉴定结果
采用30 μL体系扩增26S rDNA D1/D2区后,对扩增产物进行琼脂糖凝胶电泳检测,结果发现,所有菌株的扩增条带出现在500 bp~700 bp,且十分明亮。将PCR扩增获得的8株酵母菌的26S rDNA D1/D2区域基因序列提交到NCBI上进行BLAST比对,结果如图2所示。
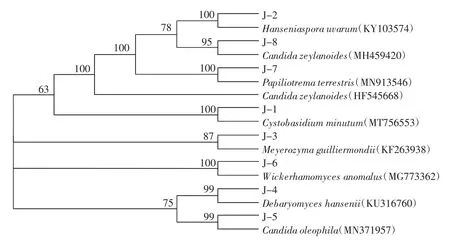
图2 酵母菌26S rDNA序列系统发育树Fig.2 Phylogenetic tree of yeasts based on 26S rDNA gene sequences
如图2所示,菌株J-1~J-8分别和Cystobasidiumminutum(MT756553)、Hanseniaspora uvarum(KY103574)、Meyerozyma guilliermondii(KF263938)、Debaryomyces hansenii(KU316760)、Candida oleophila(MN371957)、Wickerhamomyces anomalus(MG773362)、Papiliotrema terrestris(MN913546)、Candida zeylanoides(MH459420)聚集在同一分支,亲缘关系近。在GenBank数据库中进行对比,其序列相似性均达到99%。结合形态学与生理生化鉴定,可将菌株J-1~J-8分别鉴定为Cystobasidium minutum、葡萄有孢汉逊酵母(Hanseniaspora uvarum)、季也蒙毕赤酵母(Meyerozyma guiliermondii)、汉逊德巴利酵母(Debaryomyces hansenii)、嗜油假丝酵母(Candida oleophila)、异常威克汉姆酵母(Wickerhamomyces anomalus)、Papiliotrema terrestris以及类筒假丝酵母(Candida zeylanoides)。
2.2 酵母菌株产气性能的测定结果
采用杜氏管发酵法观察63株酵母菌的产气情况,从中筛选出8株具有产气性能且沉淀良好、发酵液气味适宜的酵母菌株,结果见表4。

表4 酵母菌株发酵力测定Table 4 Fermentability determination of yeast strains
由表4可知,26℃培养3 d后,菌株J-1和菌株J-8产气量少,但沉淀良好,有一定的芳香味。菌株J-3产气量一般,沉淀良好,有果香味。其余菌株产气量大、沉淀良好、酒香味浓郁。由此,初步筛选出产气性能良好的菌株为 J-2、J-4、J-5、J-6 和 J-7。
2.3 酵母菌株生长性能的测定结果
2.3.1 最适生长温度和pH值的确定
将筛选出的产气性能良好的酵母菌株分别在不同温度和pH值下培养24 h。结果如表5所示。
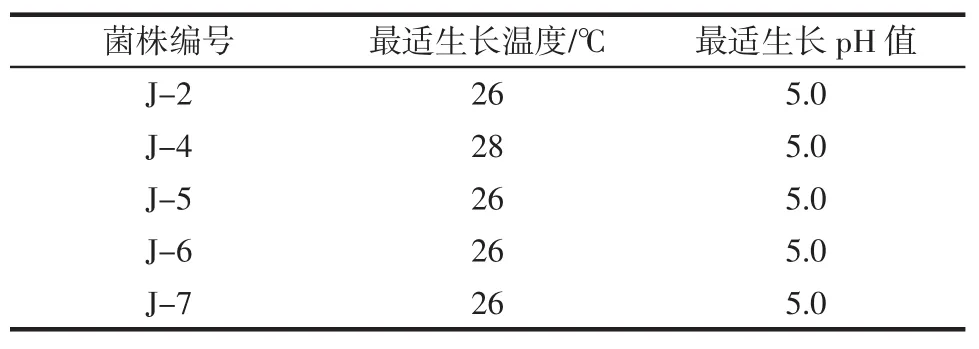
表5 菌株的最适生长温度和最适pH值Table 5 Optimal growth temperature and pH for yeast strains
由表5可知,将产气性能良好的酵母菌株分别在不同温度和pH值下培养24 h后,除菌株J-4的最适生长温度为28℃、最适生长pH值为5.0外,菌株J-2、J-5、J-6和J-7的最适生长温度和最适pH值均为26℃和5.0。
2.3.2 生长曲线的绘制
5株酵母菌株的生长曲线如图3所示。

图3 酵母菌株的生长曲线Fig.3 Growth curve of yeast strain
由图3可知,菌株J-2和J-6的生长速率最快,在8 h时进入对数期生长阶段;24 h时,吸光度均达到最大值,其最大值分别为 1.601±0.030 和 1.993±0.081,之后进入稳定期。由此,进一步筛选出两株生长性能优良的菌株J-2和菌株J-6。
2.4 酵母菌株发酵性能测定结果
菌株在乙醇体积分数为8%~20%条件下的生长情况如图4所示。
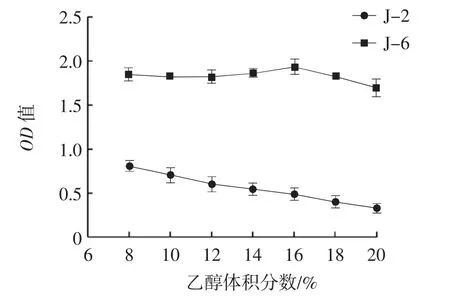
图4 酵母菌株的耐乙醇试验生长曲线Fig.4 Ethanol tolerance diagram of yeast strains
由图4可知,菌株J-6在不同体积分数的乙醇中生长状态优良,十分平稳,OD值平均为1.800±0.010。菌株J-2在乙醇体积分数为8%时,生长情况最好,OD值为0.812±0.009。随着乙醇的体积分数升高,菌株J-2的OD值逐渐减小。通过对比可知,菌株J-6的乙醇耐受能力较强。
菌株在氯化钠浓度为60 g/L~140 g/L的生长情况如图5所示。
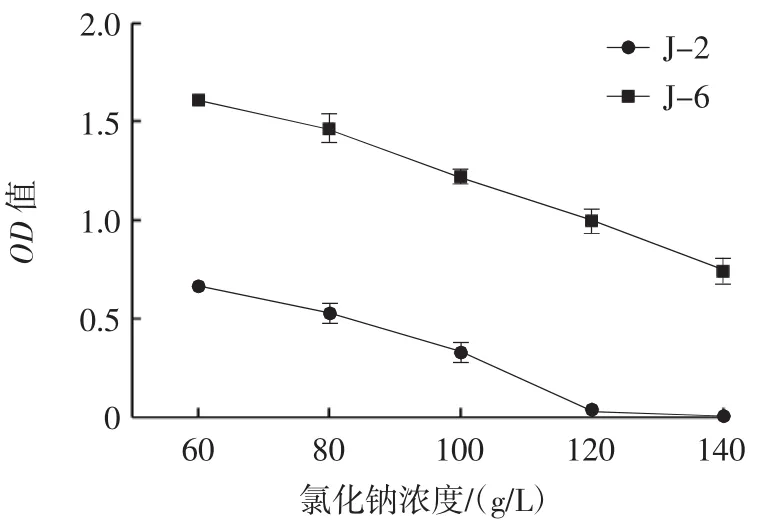
图5 酵母菌株的耐盐试验生长曲线Fig.5 Salt tolerance diagram of yeast strains
由图5可知,随着氯化钠浓度的增加,菌株J-2和菌株J-6的生长能力逐渐下降。当氯化钠浓度为140 g/L时,菌株J-6的OD值为0.752±0.011,而菌株J-2在氯化钠浓度为120 g/L时,几乎已无生长迹象。通过对比可知,菌株J-6的耐盐能力较强。
菌株在葡萄糖浓度为100 g/L~300 g/L的生长情况如图6所示。
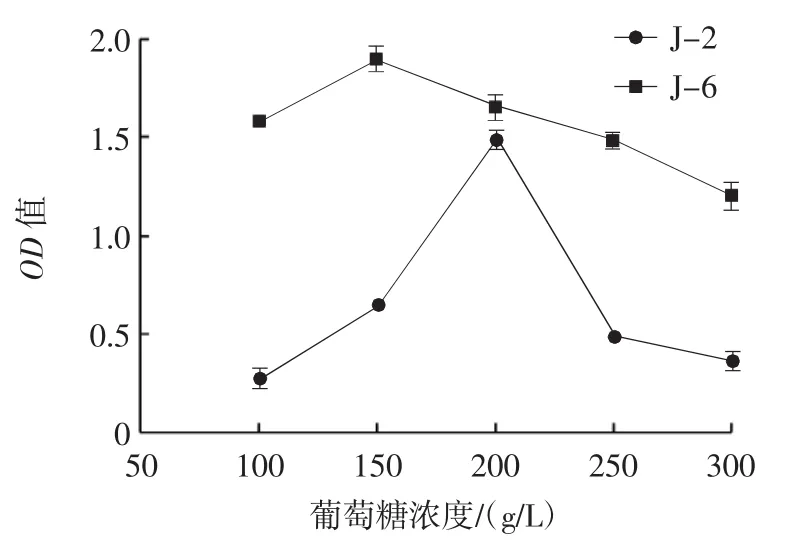
图6 酵母菌株的耐糖试验生长曲线Fig.6 Suger tolerance diagram of yeast strains
由图6可知,菌株J-2随着培养基中葡萄糖浓度的不断增加,其生长能力呈现出先增加后下降的趋势,在葡萄糖浓度为200 g/L时生长能力最强,OD值达到1.490±0.007;在其余葡萄糖浓度下的生长情况差,且OD值均未超过0.8。菌株J-6在葡萄糖浓度为150 g/L时生长能力最强,OD值达到1.901±0.010;在葡萄糖浓度为300 g/L时生长情况差,OD值为1.211±0.011。通过对比可知,菌株J-6的耐糖能力较强。
3 讨论与结论
甘蔗汁中含有十分丰富的适合酵母生长和发酵的养分[20-21],其汁液本身也可发酵为酒。由此,根据内共生理论推断[22],从甘蔗中分离出的内生酵母菌菌株生长性能和发酵性能也较为优良。
本试验从甘蔗分离的内生酵母菌株中,筛选出一株发酵性能良好的非酿酒酵母,该菌株可耐受体积分数20%乙醇、140 g/L氯化钠和300 g/L葡萄糖,经鉴定为异常威克汉姆酵母。
据相关报道,除甘蔗外,异常威克汉姆酵母也从莴苣[23]、柑橘[24]和葡萄[25]等植物中被分离出来。该菌耐低温[26]、可产香[27]、产酯[28]、产尿素[29],且产风味物质能力强[30],在发酵行业应用广泛,如发酵面团[31]、酒曲和酱油的酿造[32-33]、制备低温大曲[34]、冻干菌剂[35]等。毛祥等[36]从四川麸醋曲药中分离出的异常威克汉姆酵母菌亚种的最适生长pH值为5.0~5.5,与本试验结果一致,在酒精度为10%vol的情况下几乎不生长。Meng等[37]从酱曲中分离出在含140 g/L NaCl培养基中生长良好的异常威克汉姆酵母。范光森等[38]从贡酒曲中分离出两株异常威克汉姆酵母,一株具有较好的NaCl耐受性,另一株能耐受体积分数14%乙醇。由此可推测,本试验筛选出的异常威克汉姆酵母菌株可用于酒曲发酵和酱曲发酵等食品发酵行业。
甘蔗是制造蔗糖的原料,可直接生产酒精[39]。内生菌株是植物生长发育和代谢过程中的重要组成部分,可通过“生物转化”作用,影响宿主的生物活性和其代谢物的积累[40]。该菌株乙醇和糖耐受性强,可推测,二者之间有着密切的联系。据报道,熊建春[41]利用安琪酵母为出发菌株,筛选出适合转化甘蔗汁发酵生产乙醇的优良酿酒酵母。李翠[42]在提高甘蔗汁酒精发酵酒度的研究中使用了酿酒酵母Saccharomyces cerevisiae GJ2008和酿酒酵母Saccharomyces cerevisiae GGFS16。Limtong等[43]用马克思克鲁维酵母(Kluyveromyces marxianus)发酵甘蔗汁生产燃料乙醇,获得效果较好。由此可推测,利用从甘蔗中分离出乙醇耐受性强的内生酵母菌株来转化甘蔗汁发酵生产乙醇,能达到更加良好的酒精发酵效果。
