EGCG 与大豆7S/11S 蛋白互作对乳液稳定性的影响
2023-01-12黄国张江江田泽鹏罗小雪孙书境隋晓楠
黄国,张江江,田泽鹏,罗小雪,孙书境,隋晓楠*
(1 东北农业大学食品学院 哈尔滨150030 2 东北农业大学生命科学学院 哈尔滨 150030)
大豆蛋白是一种优质的食源性植物蛋白,因完整的氨基酸组成、优良的功能特性和较高的营养价值而被广泛地应用于食品工业中[1]。根据沉降系数大豆蛋白被细分为2S、7S、11S 和15S 蛋白,其中7S 和11S 蛋白作为大豆蛋白的主要储藏蛋白,其含量占大豆蛋白的70%~80%[2]。7S 蛋白(约180 ku)是一种三聚体糖蛋白,由3 个糖基化亚基α(67 ku),α'(71 ku)和β(50 ku)通过疏水及静电相互作用连接[3-4];而11S(约360 ku)蛋白是一种六聚体非糖蛋白,由亚基酸性多肽A(35 ku)和碱性多肽B(20 ku)通过二硫键连接而成的三聚体进一步聚合形成的六聚体[5-6]。近年来,以食源性蛋白为乳化剂的乳液体系被广泛研究。大豆蛋白因良好的表面活性及安全性而被用作乳化剂。7S/11S蛋白作为大豆蛋白的主要蛋白,其蛋白结构、组分的变化会引起乳化特性差异。7S 蛋白较小的分子量,较高的柔韧性,可以很快移动到油-水界面形成乳液[7];而11S 蛋白中高分子量和亚基中较多的二硫键限制了其在油滴表面的吸附能力,不能在界面处快速重排并迅速暴露与油相相互作用的疏水区域,使得11S 蛋白的乳化效果不如7S 蛋白[8]。11S 蛋白较高的聚集度和较多的二硫键的特性使其在凝胶功能上优于7S 蛋白。这些表明大豆蛋白的不同组分因具有不同的功能而在食品加工中发挥不同的作用。7S/11S 蛋白之间结构和功能的差异性可能会影响乳液特性[9]。Puppo 等[10]研究表明7S 蛋白对整体大豆蛋白乳液起关键作用,在600 MPa下,7S 蛋白乳液液滴絮凝形成结构化乳液,因而具有非常高的表观黏度;而11S 蛋白乳液微观结构的未发生变化。Keerati-U-Rai 等[11]发现11S 蛋白在大豆蛋白稳定的乳液中的剪切稀化行为发挥了主要作用,与7S 蛋白稳定的乳液相比,较大的液滴尺寸、较高的絮凝程度和较高的蛋白质含量都有助于11S 蛋白乳液稠度指数的提高。此外,由于乳液是一种热力学失稳的混合胶体体系,特别是在长期储存中,乳液往往会出现严重的絮凝失稳现象,降低了乳液的稳定性,进而影响食品的感官特性及营养价值。
有研究表明在乳液中添加多酚类化合物可以改善乳液的稳定性,以多酚与蛋白的复合体系构建的新型乳化剂的研究近年来引起业界极大的兴趣[12]。EGCG 是绿茶中含量最高、活性最强的儿茶素,其特殊的立体化学结构,表现出优异的生物学活性,如抗氧化、抗炎、抗病毒等,同时也被广泛地添加于食品之中[13]。EGCG 通过氢键与疏水相互作用与蛋白发生相互作用,进而影响蛋白的结构、功能及其乳液的稳定性。赵思明等[14]研究表明EGCG与大豆分离蛋白(Soy protein isolates,SPI)之间依靠疏水作用结合,并降低了SPI 的β-折叠含量。β-乳球蛋白-EGCG 复合物能够在油-水界面发生结构变化并趋于展开,形成薄而带电的界面膜,从而稳定乳液[15]。祝钢等[16]研究发现EGCG 与SPI 之间的相互作用增强了蛋白质的抗氧化性;以SPIEGCG 复合物制备的Pickering 乳液具有较好的乳化活性和乳化稳定性,乳液液滴分布均匀,不易聚集。虽然大量研究表明EGCG 的加入能够改善大豆蛋白乳液的稳定性[17-19],并明晰了EGCG 与7S/11S 蛋白的相互作用[20-21],但是相关研究未涉及EGCG 与7S/11S 蛋白的相互作用对蛋白乳液稳定性的影响。明确EGCG 与7S/11S 蛋白的相互作用,不仅可以了解7S/11S 蛋白稳定的乳液的特性差异,还可能通过开发蛋白-多酚复合乳化剂来提高蛋白乳液稳定性。
基于此,本文在前期试验的基础上,在中性条件下构建大豆蛋白-EGCG 复合体系,通过测定复合体系三维荧光光谱、热稳定性等探究其相互作用。以其为乳化剂,制备O/W 型乳液。通过测定乳液的粒径分布、色差、液滴形态,观察储藏期分层情况及界面蛋白分布等,研究EGCG 对7S/11S 蛋白乳液稳定性差异的影响,为EGCG 调控大豆蛋白乳液稳定性提供理论依据,也为大豆蛋白-多酚稳定乳液食品的开发与应用提供参考。
1 材料与方法
1.1 材料与试剂
大豆(绥农53 号),国家大豆工程技术研究中心;福临门玉米油,中粮佳悦(天津)有限公司。
EGCG(纯度≥98%),西安通泽生物科技有限公司;SDS-PAGE 凝胶制备试剂盒,北京索莱宝科技有限公司;十二烷基磺酸钠(分析纯),广州化学试剂厂;所用试剂均为分析纯级;试验用水均为去离子水。
1.2 仪器与设备
RF-6000 型荧光分光光度计,日本Shimadzu公司;DSC Q2000 差示扫描量热仪,美国TA 公司;NANO ZS90 粒度及电位分析仪,英国马尔文仪器有限公司;BX53 正置显微镜,奥林巴斯(中国)有限公司;Mastersize 2000 粒度分布仪,英国马尔文仪器有限公司;ZE-600 色差计,日本色电工业株式会社;SPCH-EP-IC-10-60 高压微通道射流均质机,英国Homogenising Systems Ltd 公司;T25 高速均质机,德国IKA 公司。
1.3 方法
1.3.1 伴大豆球蛋白与大豆球蛋白的制备 参考Nagano 等[22]的方法并稍作修改。大豆经万能粉碎机粉碎,过60 目筛,按料液比1 ∶3(g/mL)将大豆粉用正己烷脱脂。室温下搅拌2 h,重复脱脂5 次,干燥得到脱脂大豆粉。将脱脂大豆粉按料液比1∶10(g/mL)加入去离子水中,用2 mol/L NaOH 调节pH 值至7.5,室温搅拌1 h 后离心(4 ℃,10 000×g,30 min),向上清液中添加0.98 g/L 干燥后的亚硫酸氢钠,搅拌使其充分溶解。用2 mol/L HCl 调节pH 值至6.4,置4 ℃冰箱保持过夜,经离心(4 ℃,6 500×g,20 min)得到11S 沉淀物。为获得7S 蛋白,在离心后的上清液中加入固体NaCl 使其浓度为0.25 mol/L,并用2 mol/L HCl 调节pH值至5.0,搅拌1 h 使其充分溶解,然后离心(4 ℃,10 000×g,30 min)除去沉淀物。向上清液添加等体积的冰冷水,用2 mol/L HCl 调节pH 值至4.8,静置1 h 后离心(4 ℃,6500×g,20 min)得到7S 沉淀物。
将5 次水洗后的7S/11S 沉淀物重新分散于10 倍的去离子水中溶解并调节pH 值至7.5,将蛋白溶液透析48 h(3 500 u),冻干,备用。经杜马斯法(N×6.25)测定获得的(91.01±0.05)%和(95.90±0.12)%的7S/11S 蛋白。经SDS-PAGE 凝胶电泳分析,制备的7S/11S 蛋白纯度分别为(80.07 ±0.13)%,(93.43±0.06)%。
1.3.2 伴大豆球蛋白/大豆球蛋白-EGCG 复合物的制备 将EGCG、7S/11S 蛋白分别溶解于磷酸盐缓冲溶液(PBS,0.01 mol/L,pH 7.0)中搅拌2 h,而后将避光的EGCG 溶液超声脱气,与7S/11S 蛋白溶液在4 ℃冰箱中放置过夜12 h,以确保充分水化。将EGCG、7S/11S 蛋白溶液按比例混合,最终配成质量分数为1%的7S/11S 蛋白,蛋白与EGCG 质量比为1∶0 和2∶1 的混合溶液。避光搅拌2 h,确保充分反应。将混合溶液透析48 h(3 500 u),除去游离的EGCG,然后,冷冻干燥获得7S/11S 蛋白-EGCG 复合物。
1.3.3 三维荧光光谱测定 为了描述蛋白-多酚的相互作用,使用三维荧光光谱技术来测量峰位置和峰强度值的相应变化。将7S/11S 蛋白及其EGCG 复合物溶于PBS(0.01 mol/L,pH 7.0)中,最终质量浓度为0.05 mg/mL。室温下匀速搅拌2 h后4 ℃放置过夜12 h,以确保充分水化。取出,恢复室温后进行三维荧光光谱测量。激发波长(Ex)设置为200~350 nm,发射波长(Em)为200~500 nm,激发/发射狭缝宽带均为5 nm,扫描速度2 000 nm/min。
1.3.4 热稳定性的测定 参考Ren 等[23]的方法并稍作修改。取5 mg 的EGCG、7S/11S 蛋白及其EGCG 复合物放入空白坩埚中,加入20 μL PBS(0.01 mol/L,pH 7.0),压片放置过夜平衡。用Q2000 差示扫描量热仪测定蛋白质的热稳定性,以空白坩埚为对照,测定温度20~100 ℃,加热速度10 ℃/min。采用机身自带软件记录数据及处理DSC 曲线。
1.3.5 蛋白颗粒粒径分布及ζ-电位的测定 参考Sui 等[24]的方法,使用NANO ZS90 粒度及电位分析仪对大豆蛋白及其EGCG 复合物进行粒径分布及电位测定。用PBS(0.01 mol/L,pH 7.0)将样品稀释至0.1 mg/mL,过0.45 μm 水系膜,避免颗粒聚集。其中粒径分布设置参数:折射率分别为1.46和1.33,吸收参数为0.001。ζ-电位采用激光多普勒电泳光散射技术测量,将稀释后蛋白溶液注入两端加有电压的电泳池中,使用Helmholtz-Smoluchowski 方程从试验确定的电泳迁移率直接积分计算ζ-电位,温度设置为25 ℃。
1.3.6 乳液的制备 将EGCG、7S/11S 蛋白分别溶解于PBS(0.01 mol/L,pH 7.0)中搅拌2 h,而后将避光的EGCG 溶液超声脱气,与7S/11S 蛋白溶液在4 ℃冰箱中放置过夜12 h,以确保充分水化。将EGCG、7S/11S 蛋白溶液按比例混合,使其混合溶液包含最终质量分数为1%的7S/11S 蛋白及0.00%,0.01%,0.02%和0.03%的EGCG。室温下避光搅拌2 h,确保充分反应。将玉米油按照油水体积比1∶4 添加至混合溶液中,经T 25 高速均质机预乳化(10 000 r/min,2 min),高压均质(150 MPa,4 次)处理后得到新鲜乳液。使用0.1 mol/L HCl/NaOH 将乳液pH 值调节至7.0,而后加入0.02%叠氮化钠抑制微生物生长。
1.3.7 乳液色差的测定 使用ZE-600 色差计测定7S/11S 蛋白乳液的色差。测定前使用白板以及光源器件对仪器进行标准化。测定参数包括亮度值(L*)、红度值(a*)、黄度值(b*)和总色差(ΔE)。总色差(ΔE)计算公式:
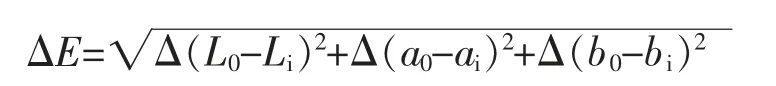
式中:L0、a0、b0——分别是不添加EGCG 对照样品的亮度值、红度值和黄度值;Li、ai、bi——分别是添加EGCG 样品的亮度值、红度值和黄度值。
1.3.8 乳液液滴尺寸及其粒径分布的测定 采用Mastersize 2000 粒度分布仪测定乳液液滴尺寸。仪器参数设置:颗粒折射率1.473,颗粒吸收率0.001,分散剂为水,分散剂折射率1.330。采用d4,3、d3,2表示乳液液滴尺寸。
1.3.9 乳液显微镜及储藏稳定性观察 将制备好的新鲜乳液用PBS(0.01 mol/L,pH 7.0)适当稀释,用高速漩涡振荡器混匀,移取10 μL 稀释乳液滴在载玻片上,在显微镜下观察。将新鲜乳液置于2.5 cm×2.4 cm×10 cm 的样品瓶中观察,室温避光储藏60 d,期间记录样品分层情况。
1.3.10 乳液界面蛋白组成的测定 参考Maneephan 等[25]的方法测定吸附在界面上的蛋白质组成。将新鲜乳液离心(25°C,20 000×g,30 min),小心地从离心管顶部刮除乳霜并在滤纸上干燥,然后,重新分散在PBS(0.01 mol/L,pH 7.0)中至初始体积。重复离心步骤3 次,确保除去未吸附蛋白。将最后一次的乳液分散液做SDS-PAGE 凝胶电泳分析。取80 μL 分散液加到20 μL 不含还原剂的5×上样缓冲液中,沸水浴3 min 变性处理并离心(25°C,10 000×g,10 min),备用。取10 μL 上清液等分试样装入含有12%分离胶与5%浓缩胶中,用于蛋白质分离。对浓缩胶、分离胶分别调节电压为60,120 V。用含R-250 考马斯亮蓝染色液进行浸染,用含冰乙酸及甲醇的脱色液洗脱。
1.4 数据结果与分析
9.5 软件绘制图像。
2 结果与分析
2.1 三维荧光光谱结果分析
采用三维荧光光谱技术深入了解多酚与蛋白质结合的微环境和构象变化。通过比较添加和不添加EGCG 的7S/11S 蛋白的光谱变化,可以获得有关7S/11S 蛋白构象和微环境变化的有用信息。如图1 所示,Peak I 的“指纹型”峰是典型的色氨酸、酪氨酸残基的荧光峰,而Peak II 的“指纹型”峰主要揭示了蛋白质多肽链的骨架结构的荧光行为[26]。11S 蛋白具有较高含量的色氨酸与酪氨酸,与7S 蛋白相比,显示出更高的荧光强度[3]。添加EGCG,导致7S/11S 蛋白的两种峰形变得稀疏,颜色变浅,说明EGCG 的加入使氨基酸特征荧光峰与多肽链骨架峰均有不同程度的降低,表明色氨酸、酪氨酸残基附近的微环境发生变化,多肽链发生解折叠,蛋白三级结构变得伸展[27]。11S 蛋白的稀疏程度要高于7S 蛋白,表明EGCG 与11S 蛋白的互作强度要强于7S 蛋白,使11S 蛋白荧光强度下降更多。以上变化表明EGCG 与7S/11S 蛋白之间存在相互作用,两者形成复合物,并改变7S/11S蛋白的微环境和三级构象,这与Ren 等[23]的研究结果一致,表明7S/11S 蛋白的Peak I 和II 荧光在很大程度上被花青素-3-葡萄糖苷猝灭,进而引起蛋白质骨架结构的解折叠,诱导氨基酸微环境由疏水向亲水转变。
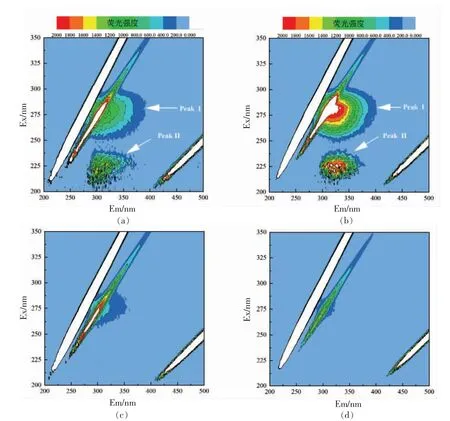
图1 7S(a)/11S(b)蛋白及其EGCG 复合物的三维荧光等高线图Fig.1 Three-dimensional fluorescence contour map of 7S(a)/11S(b)protein and its EGCG complex
2.2 热稳定性
热稳定性是了解EGCG 与7S/11S 蛋白相互作用的另一方式。如图2 所示,与7S 蛋白相比,11S 蛋白表现出更高的热转变温度,这是由于11S蛋白含有较高含量的含硫氨基酸,能够形成较多的二硫键以稳定蛋白质的空间结构所致[28]。在图2a 中,出现微小的11S 蛋白的变性峰,这是因为在7S 蛋白提取时,残留着少量的11S 蛋白,这与Añón 等[29]的报道一致。当添加EGCG 时,7S/11S蛋白的变性转变温度Td和变性焓ΔH 发生不同程度的改变,EGCG 与7S/11S 蛋白的相互作用可能使蛋白质部分结构展开,从而降低了蛋白质的热稳定性。在苹果幼果多酚-猪胰腺α-淀粉酶[30]、桑树多酚-肌原纤维蛋白[31]等多酚-蛋白相互作用中也报道了类似的发现。此外,11S 蛋白的Td、ΔH 比7S 蛋白下降的多,表明EGCG 与11S 蛋白具有更强的相互作用,这与三维荧光的结果是一致的。
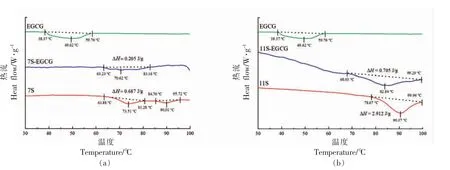
图2 7S(a)/11S(b)蛋白及其EGCG 复合物的热稳定性Fig.2 Thermal stability of 7S(a)/11S(b)protein and its EGCG complex
2.3 蛋白颗粒粒径分布及ζ-电位
粒径分布如图3a 所示,所有样品均呈单峰分布状态。当添加EGCG 后,7S/11S 蛋白的粒径分布均向粒径大的方向移动。大粒径方向的移动暗示蛋白之间可能发生解折叠和聚集。有研究表明,茶多酚与大豆蛋白间的相互作用可能会形成高分子量的大颗粒,进一步导致聚集体的形成[32]。这可能是由于EGCG 具有多个酚羟基,可与蛋白发生交联作用;其中,EGCG 充当交联剂,使蛋白质发生一定的聚集现象[33]。在Ren 等[34]的研究中同样发现,黑豆皮提取物多酚的加入使SPI 颗粒的粒径增大,并且随着多酚浓度的增加,多酚作为蛋白质分子的架桥剂,形成粒径更大的复合物。由于11S蛋白具有较高的聚集度,在EGCG 的作用下,可能形成更大的聚集体,与7S 蛋白相比,11S 蛋白粒径变化更为明显,这与OCHNIO 等[35]的结果一致:当叶酸作用于7S/11S 蛋白时,蛋白平均粒径增加;11S 蛋白似乎更易于自组装,被叶酸诱导形成更广泛的聚集体。ζ-电位是决定胶体粒子带电基团之间相互作用强度的重要因素,结果如图3b 所示。大豆蛋白的ζ-电位的绝对值因添加EGCG 而增加,这归因于在pH 7.0 时添加带负电荷的EGCG,中和了部分带正电荷的蛋白质基团。该结果表明EGCG 可能包围大豆蛋白质分子的表面,进而改变其表面电荷分布,进一步增强了粒子间的静电斥力,相对提高了分散体的稳定性。这与Zhou 等[36]的研究结果相似,添加EGCG 提高了SPI 的ζ-电位,EGCG-SPI 的交联可形成稳定的网络结构。其中,静电排斥力对网络结构的影响小于交联引起的影响。随着ζ-电位的增加,蛋白质颗粒的粒径也增加。在Peng 等[37]对EGCG 与7S 蛋白的相互作用研究中也观察到类似的现象。
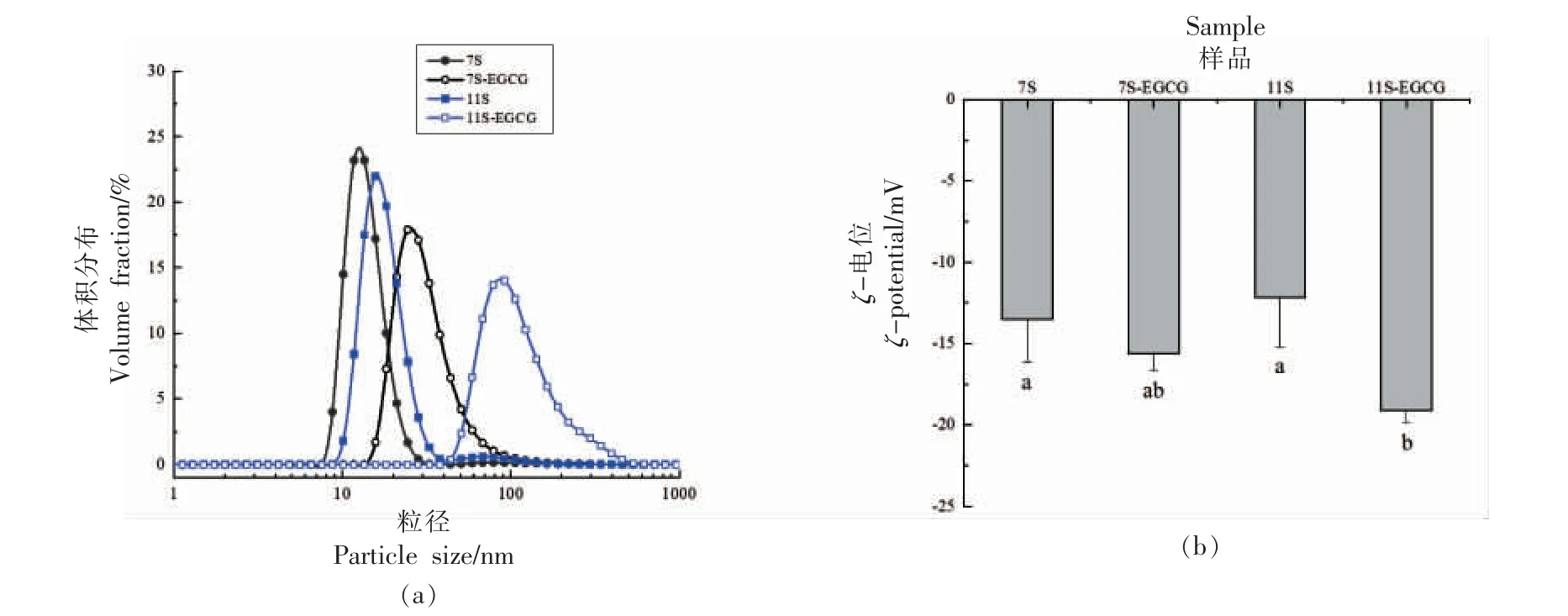
图3 7S/11S 蛋白及其EGCG 复合物的粒径分布(a)及ζ-电位(b)Fig.3 Particle size distribution(a)and ζ-potential(b)of 7S/11S protein and its EGCG complex
2.4 乳液色差
大豆蛋白乳液食品的可接受性高度取决于乳液食品的颜色特性。如表1 所示,与不添加EGCG的7S/11S 蛋白乳液相比,添加EGCG 的7S/11S 蛋白乳液显示出较低的亮度值L*,更高的红度值a*和黄度值b*。EGCG 因自身的颜色效应,故作为食品添加剂添至7S/11S 蛋白乳液,使7S/11S 蛋白乳液中呈现一定的红色[38]。当EGCG 为最大添加量时,7S/11S 蛋白乳液的L*没有显着差异,而7S 蛋白乳液的a*高于11S 蛋白乳液,7S 蛋白乳液的b*和ΔE 低于11S 蛋白乳液。这种乳液产品颜色的差异可能影响消费者对大豆蛋白乳液食品的选择。
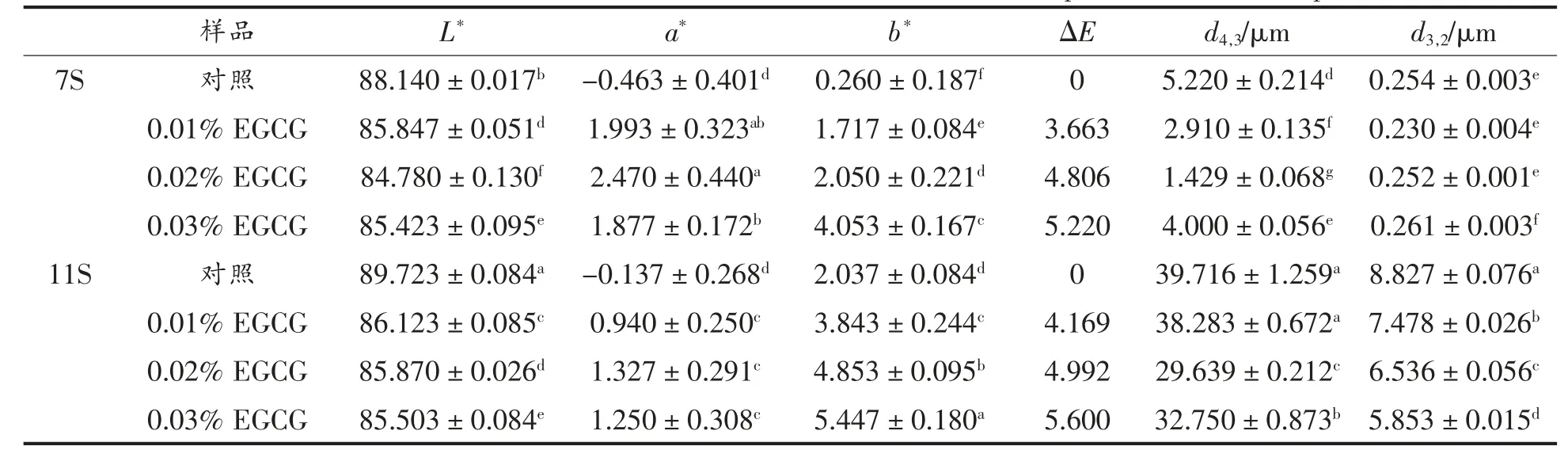
表1 不同浓度的EGCG 对7S/11S 蛋白乳液的颜色及其液滴尺寸的影响Table 1 Effect of different EGCG concentrations on the color and emulsion droplet size of 7S/11S protein emulsion
2.5 乳液粒径及其分布
颗粒的体积加权平均直径(d4,3)及表面积加权平均直径(d3,2)对乳液液滴的聚集状态高度敏感。d3,2值可以提供大多数颗粒的尺寸信息;而d4,3值可以提供大聚集体的尺寸信息,因为它对大颗粒或聚集体的存在高度敏感[39]。两者常被用于乳液稳定性的评价。较小的液滴可能有利于乳液稳定性的提高。由表1 及图4 可知,对于7S 蛋白乳液,添加EGCG 导致乳液液滴粒径分布向左移动,d4,3值逐渐降低,d3,2值变化不明显。当EGCG 添加量为0.02%,d4,3值为1.429 μm 时,达到最小值。同样的,对于11S 蛋白乳液,乳液液滴粒径分布变化 与7S 蛋白类似,其d4,3、d3,2值逐渐降低。当EGCG 添加量为0.02%,d4,3值为29.639 μm 时,达到最小值,d3,2值为6.536 μm。相比于7S 蛋白,11S蛋白乳液液滴粒径较大,这与Keerati-U-RAI 等[11]的研究一致,表明7S/11S 蛋白具有不同的界面特性,其粒径和分子结构的差异影响乳液液滴的尺寸和稳定性。7S 蛋白由于自身分子量小,聚集度低,能够快速吸附到油-水界面形成稳定的乳液,因此乳化能力强,粒径较小。而11S 蛋白分子量高,聚集度高,导致其吸附到油-水界面的速率相对较慢,并且,11S 蛋白刚性的球状结构在油-水界面处难以展开,极大地保持了完整的球形结构,导致乳液液滴高度絮凝,出现较多的乳液液滴聚集状态。另一方面,11S 蛋白的不良的溶解度,当作为以凝胶能力主导的大豆蛋白时,其乳液液滴粒径>10 μm,乳液样品黏稠、不易流动,在高压均质作用下可能发生部分凝胶作用,形成凝胶型乳液[40]。Puppo 等[10]也报道了类似的发现,凝胶型乳液的形成可能有利于乳液稳定性的提高。添加EGCG 后,在EGCG 的作用下,7S/11S 蛋白分子部分结构展开,在油-水界面发生结构重排,亲水、疏水基团重新排布使乳液液滴界面结构变得紧凑,从而降低蛋白乳液液滴的尺寸,并改善了絮凝的程度,这与Tian 等[41]的研究结论较一致。Li 等[42]研究表明,与单独的米糠蛋白相比,儿茶素-米糠蛋白复合物展开的结构,在均质化过程中更能有效减小乳液液滴尺寸,阻止液滴聚合。
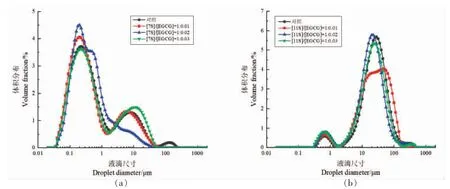
图4 不同浓度的EGCG 对7S(a)/11S(b)蛋白乳液液滴粒径分布的影响Fig.4 Effect of different EGCG concentrations on the particle size distribution of 7S(a)/11S(b)protein emulsion droplets
2.6 乳液显微镜观察结果及储藏稳定性
乳液样品经高速漩涡稀释后,通过光学显微镜标尺测算的乳液液滴大小可能与激光粒度仪测定的数据不一致。如图5 光学显微镜图像所示,7S/11S 蛋白单独稳定的乳液中出现液滴的絮凝,这与图4 的结果较一致。随着EGCG 浓度的增加,乳液液滴尺寸减小,特别是当EGCG 含量为0.02%时,7S/11S 蛋白乳液液滴较小,分布较为均匀,液滴絮凝状态得到改善。图6 为7S/11S 蛋白及其EGCG 复合乳液在60 d 储藏期的分层情况,7S 蛋白单独稳定的乳液液滴絮凝程度较低,1 周后出现乳析现象,而随着储存时间的延长,分层情况逐渐加剧。添加EGCG 后,7S 蛋白乳液的乳析程度减弱,乳液储藏稳定性得到改善。这表明EGCG 能够提高7S 蛋白乳液储藏稳定性,这是由于EGCG使7S 蛋白结构部分展开,7S 蛋白牢牢吸附于油-水界面处并形成稳定的界面膜,从而削弱了液滴的絮凝作用。据报道,花青素的加入使SPI 乳液界面膜牢固,提高了SPI 的乳化性及乳化稳定性,并在储存过程中表现出更高的稳定性[12,43]。与7S 蛋白相比,11S 蛋白及其EGCG 复合乳液由于较大的液滴尺寸,在制备1d 后观察到乳析现象。此后,这些样品的分层位置在60d 的储藏期间没有移动,表明这些乳液中没有发生进一步的乳化。11S蛋白由于在溶液中不良的聚集状态,因此很少作为稳定乳液的乳化剂,然而,在储存期间,能够为乳液提供良好的储藏稳定性[44]。虽然添加EGCG能使11S 蛋白乳液乳滴减小,但是对11S 蛋白乳液的储藏稳定性无明显影响。这可能是由于添加EGCG 浓度较低,11S 蛋白乳液液滴主要以大尺寸存在。较大的乳液液滴在储存期间容易发生絮凝耗竭,导致乳析现象。Zhu 等[45]同样发现类似的现象:低浓度的大豆皂苷(0.05%至0.2%)添加至11S蛋白乳液中,液滴d4,3略有下降,并观察到显著的相分离;而添加高浓度(0.25%)的大豆皂苷时,蛋白乳液液滴d4,3最小,乳液未出现相分离现象。

图5 不同浓度EGCG 下7S(a)/11S(b)蛋白乳液的光学显微镜图片Fig.5 Optical microscopy of 7S(a)/11S(b)protein emulsion droplets with different EGCG concentrations

图6 不同浓度的EGCG 下7S(a)/11S(b)蛋白乳液60 d 储藏期观察Fig.6 Observation of 60 days storage period of 7S(a)/11S(b)protein emulsion with different EGCG concentrations
2.7 乳液界面蛋白SDS-PAGE 的结果
SDS-PAGE 凝胶电泳用于研究EGCG 对7S/11S 蛋白乳液界面蛋白组成的影响。如图7 所示,7S 蛋白乳液界面蛋白主要由7S 蛋白固有3 个亚基:α',α 和β 组成,而11S 蛋白乳液界面蛋白主要由酸性A 和碱性B 亚基组成。随着EGCG 浓度的增加,7S/11S 蛋白乳液的界面蛋白亚基保持完整,7S/11S 蛋白的固有亚基能够吸附于乳液界面并保持乳液稳定[46]。这些结果表明:添加EGCG后,7S/11S 蛋白乳液的稳定性不受界面蛋白组成的影响。这与Hu 等[47]的研究结果一致:高压均质后,SPI 亚基均存在于油相中且保持完整,SPI 乳液界面蛋白亚基不影响乳液的稳定性。除此之外,凝胶顶部显示出一定的蛋白聚集体,这是由于蛋白乳液界面处的一些界面蛋白具有致密的界面层,这使得它们无法通过浓缩和分离凝胶[48]。致密的界面层可能会改善的乳液稳定性。对于所研究的EGCG-7S/11S 蛋白复合乳化剂稳定的乳液,7S/11S 蛋白和EGCG 均在界面处吸收,可能形成有助于乳液稳定的混合物致密层。
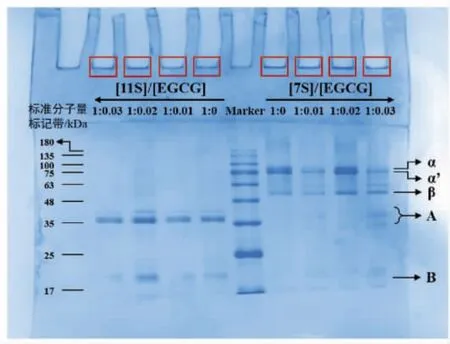
图7 不同浓度的EGCG 下7S/11S 蛋白乳液的界面蛋白组成Fig.7 Interfacial protein composition of 7S/11S protein emulsion with different EGCG concentrations
3 结论
本试验研究了中性条件下EGCG 与7S/11S蛋白间的相互作用形成的大豆蛋白-EGCG 复合物对乳液稳定性的影响。结果表明:1)三维荧光光谱及热稳定性显示EGCG 与7S/11S 蛋白发生相互作用,引起蛋白质多肽链解折叠,蛋白质热稳定性降低,蛋白质颗粒粒径增大,ζ-电位增高,且11S 蛋白与EGCG 比7S 蛋白互作更强,变化更加明显。2)EGCG 的加入使得蛋白乳液亮度降低,红度值、黄度值增加,在一定程度上改善了7S/11S蛋白乳液的絮凝程度,使得蛋白乳液液滴尺寸减小,分布较为均匀;11S 蛋白乳液仍以较大聚集的液滴存在。3)在储藏期间,11S 蛋白乳液稳定性优于7S 蛋白,EGCG 的添加提高了7S 蛋白乳液的稳定性,而对11S 蛋白乳液无明显影响。此外,
EGCG 没有改变7S/11S 蛋白乳液界面蛋白的亚基分布,7S/11S 蛋白乳液的稳定性不受界面蛋白组成的影响。
