氯化胆碱-尿素低共熔溶剂中电沉积镍磷合金镀层的研究
2022-12-29张春霞张雅琴耿乐乐郭天霞崔琳琳孙海静
张春霞,张雅琴,耿乐乐,郭天霞,崔琳琳,孙海静*
(沈阳理工大学,辽宁 沈阳 110000)
镍磷合金镀层具有优越的性能,如较高的硬度、良好的耐蚀性及耐摩擦性能、装饰性的外观等,使其在航空航天、汽车、电子、石油化工等领域的应用比例不断上升[1-2]。制备镍磷合金镀层的基本方法大致有3类:化学镀、电镀、电刷镀。这3种方法均采用水溶液体系制备镀层,易发生析氢反应,有些能与水发生化学反应的活泼金属及电化学窗口比较窄的金属不能发生电沉积,且还存在镀层质量对添加剂的依赖性高、电镀废液处理困难等问题[3]。
低共熔溶剂是离子液体中一类比较特殊的类型,由氢键供体和氢键受体通过氢键作用而形成的一类独特的多组分溶剂体系,具有熔点低、无毒性、溶解性能好、导电性能优良、电化学窗口宽、合成简单等特点,是一种新型的绿色溶剂,在电化学、化学反应、分离过程和功能材料等领域发挥着重要作用[4-7]。
ABBOTT[8]等在2003年首次发现尿素与氯化胆碱在近室温下通过简单的搅拌混合便可形成一种液态的低共熔混合物。付旭[9]等采用摩尔比为1∶2的氯化胆碱-尿素低共熔溶剂(ChCl-Urea DES)电沉积银,并研究银离子电沉积的电化学行为。谭勇[10]等研究了镍在低共熔溶剂体系中的电沉积、电化学行为及形核方式。詹龙胜[11]等利用苹果酸-氯化胆碱低共熔溶剂进行电沉积成功得到了具有一定耐蚀性的纯镍镀层。杜俊荣[12]等研究了ChCl-EG低共熔溶剂中电沉积Ni的电化学行为、成核生长机理,得出在ChCl-EG低共熔溶剂中电沉积Ni是不可逆的一步还原,成核机理属于三维瞬时成核,镀层平整致密。
本文采用摩尔比为1∶2的氯化胆碱-尿素低共熔溶剂,电沉积制备镍磷合金镀层,研究镍磷合金镀层的电沉积机理,并对其耐腐蚀性能进行分析。
1 实验方法
1.1 实验药品
氯化胆碱、尿素、六水合氯化镍、一水合次亚磷酸钠、一水合柠檬酸、氯化钠,分析纯,国药集团化学试剂有限公司。
1.2 镀层的制备
1)将2.5 cm×5 cm×0.2 cm的黄铜基体进行前处理备用。
2)用摩尔比1∶2氯化胆碱与尿素、六水合氯化镍、一水合次亚磷酸钠,借助85-2数显恒温磁力搅拌器加热至70℃搅拌混溶,完全溶解得到绿色透明液体,即ChCl-Urea-NiCl2-NaH2PO2镀液。
3)将试片放到镀液中,温度保持在50℃,沉积电压为-0.95 V,沉积40 min制得Ni-P合金镀层。
1.3 电导率测试
在初始温度为298 K时,使用DDSJ-308A型电导率仪测试溶液的电导率,每隔5 K记录一次数据,判断被测液导电性。
1.4 电化学测试
采用CS350型电化学工作站和三电极体系(工作电极、参比电极和辅助电极)进行电化学测试,用85-2数显恒温磁力搅拌器控制溶液的温度。
1.4.1 循环伏安测试
运用三电极体系(玻碳工作电极、银参比电极和铂辅助电极),在溶液温度50℃、初始电位1.5 V、低电位-1.5 V、初始扫描速率50 mV·s-1的条件下,开始循环伏安测试。
1.4.2 计时电流测试
计时电流法是研究金属及合金电沉积机理的常用方法之一。运用三电极体系(玻碳工作电极、银参比电极和铂辅助电极),在溶液温度50℃条件下,-0.95~0.98 V每隔0.01 V为一个间隔进行测试。
1.5 镀层性能测试
1.5.1 镀层微观形貌及成分表征
采用TESCAN MIRA3扫描电子显微镜(SEM/EDS)和X射线衍射技术(XRD)对Ni-P合金镀层进的微观形貌、元素和物相组成进行表征。
1.5.2 耐腐蚀性能测试
在3.5%NaCl溶液中利用三电极体系(镀片工作电极、甘汞参比电极和铂辅助电极)对实验制备的Ni-P合金镀层进行动电位极化曲线测试,分析其耐腐蚀性能。
2 结果与讨论
2.1 电导率
ChCl-Urea低共熔溶剂和ChCl-Urea-NiCl2-NaH2PO2镀液的电导率随温度的变化曲线如图1所示。从图1中可看出,这两种液体的电导率随着温度的升高而增大,因为低共熔溶剂的黏度随着温度的升高而降低,离子迁移速率增加,故电导率增大[13]。NiCl2和NaH2PO2的加入并不会使电导率的变化趋势发生改变。

图1 ChCl-Urea低共熔溶剂和ChCl-Urea-NiCl2-NaH 2PO2镀液的电导率曲线
2.2 循环伏安曲线
ChCl-Urea低共熔溶剂和不同镍磷比ChCl-Urea-NiCl2-NaH2PO2镀液的循环伏安曲线如图2 所示。

图2 ChCl-Urea低共熔溶剂和不同镍磷比ChCl-Urea-NiCl2-NaH 2PO2镀液的循环伏安曲线
由图2可看到,ChCl-Urea低共熔溶剂的循环伏安曲线在负扫至-1.30 V时,电流密度开始明显下降,在正向扫到1.37 V时电流密度开始明显上升。由此可得,ChCl-Urea低共熔溶剂的阴极极限电位为-1.30 V,阳极极限电位为1.37 V,该区间内没有明显的氧化还原峰,故其电化学窗口为2.67 V。ChCl-Urea-NiCl2-NaH2PO2镀液的循环伏安曲线在负向扫到Ⅰ区间出现还原峰,正向扫到Ⅱ区间出现氧化峰。ChCl-Urea-NiCl2-NaH2PO2体系电沉积Ni-P合金镀层时,在阴极上Ni2+和H2PO2-发生还原反应,图2中的曲线仅出现一个峰,说明Ni2+和H2PO2-可能为一步还原。NiCl2和NaH2PO2的加入比例并未影响Ni2+和H2PO2-沉积过程,依旧是一步还原,只是还原峰的位置稍有改变。
图3是ChCl-Urea-0.3NiCl2-0.05NaH2PO2镀液在温度50 ℃、扫描速率50~80 mV·s-1下的循环伏安曲线。由图5可见,镀液的还原峰电压Ep和还原峰电流Ip均与扫描速率v有关。随着v增大,镀液的还原峰呈负移趋势,Ep逐渐负移,Ip逐渐增大。通过查阅文献可知:对于可逆电极,还原峰电压Ep与还原半峰电压Ep/2均与扫描速率v无关;对于不可逆电极,Ip与v1/2成现正比关系,且Ep与Ep/2均与v有关;对于准可逆电极,可逆性与v有关,在低扫描速率时,电极反应表现为可逆特性,而在高扫描速率时,则转换为不可逆特性[14]。故镀液中Ni2+和H2PO2-的还原过程在此扫描速率范围内不可逆,电沉积的还原反应表现为不可逆特性。

图3 ChCl-Urea-0.3NiCl2-0.05NaH 2PO2镀液不同扫描速率下的循环伏安曲线
2.3 Ni-P合金镀层的成核机理研究
为了探究Ni-P合金镀层的成核方式,采用计时电流法测得计时电流曲线,结果如图4所示。
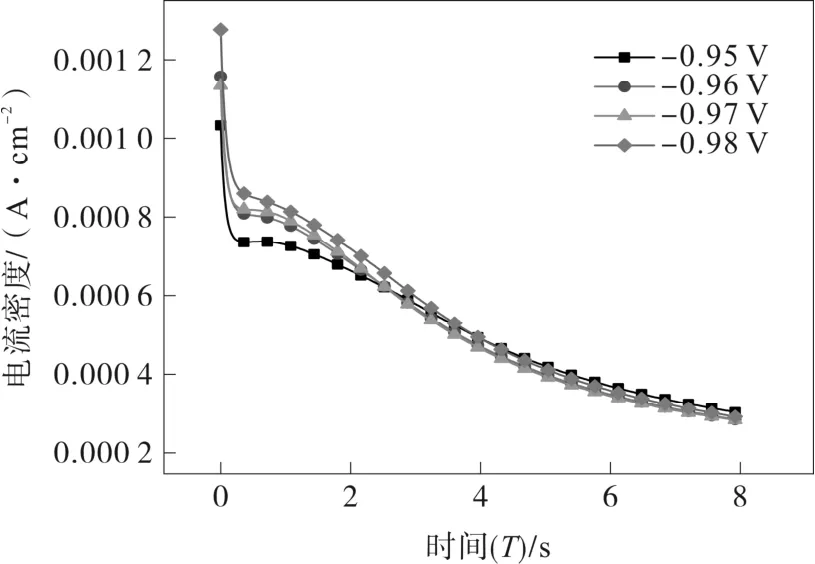
图4 ChCl-Urea-0.3NiCl2-0.05NaH2PO2镀液计时电流曲线
由图4可见,所测计时电流曲线的初始电流急剧下降,电极表面晶核初次生成;之后电流稍微增加,因为产生了双电层充电电流;接着又逐渐下降并趋于稳定,这是出现面增大并相互重叠,所形成的电流峰对应晶核的形成。此过程当晶核生长覆盖,电流达到极大值(Im,对应的时间为Tm),晶核生长扩散场向电极表面四周生长时,电流的衰减遵循cottrell 方程,阶跃电位越大,电流极大值越大[15]。因此,Ni-P 的电结晶经历成核、核交叠或核生长、扩散区相互覆盖和沉积物的结晶等阶段,是典型的扩散控制三维成核生长过程。
根据Scharifker[16]三维成核生长模型理论,三维成核机理分为三维瞬时成核和三维连续成核机理,它们的(I/Im)2-(T/Tm)关系式如下:
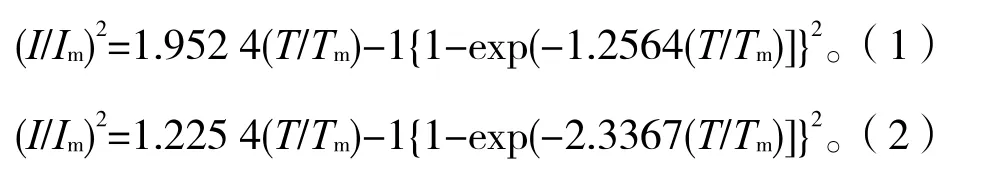
图5是对计时电流曲线进行关系拟合,图中的虚实线分别为实验结果按(I/Im)2-(T/Tm)数据处理得到的曲线与理论曲线。由图5可看出,实验得到的(I/Im)2-(T/Tm)曲线与理论曲线存在较大差别,这说明理论模型并不能很好地反映实际电沉积过程。实验得到的曲线初始电流急剧下降,这种电流趋向于非零值随时间变化,可以得出Ni2+和H2PO2-在镀液中的成核是一个扩散过程。
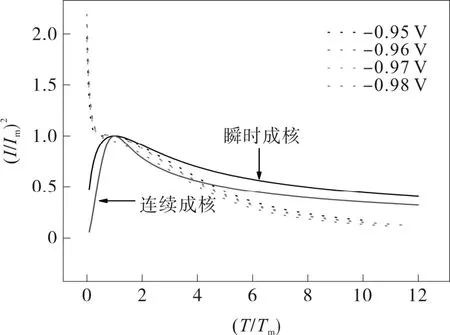
图5 ChCl-Urea-0.3NiCl2-0.05NaH2PO2镀液的计时电流拟合曲线
对于三维成核过程而言,瞬时成核和连续成核过程是两种理想情况,而实际发生的过程往往较复杂,有时两种成核并存,有时是某种成核占优势,另外一种占弱势。
2.4 Ni-P合金镀层的元素和物相组成分析
为了探究镀层的元素组成,对制备的镀层进行EDS测试,结果如图6所示。

图6 ChCl-Urea-0.3NiCl2-0.05NaH 2PO2镀液中Ni-P镀层的EDS图
由图6可见,镀层含有Cu、Zn、Ni、O、P 5种元素,可判断电沉积所得镀层为Ni-P镀层。Cu、Zn元素来自黄铜基体,O元素代表基体有轻微的氧化。
为了分析Ni-P合金镀层的物相组成,对实验制备的镀层进行XRD测试,所得结果如图7所示。

图7 ChCl-Urea-0.3NiCl2-0.05NaH2PO2镀液中Ni-P镀层的XRD图
图7 中在43.29°、50.43°、74.13°和89.93°可以看到Cu的衍射峰,分别对应晶面(111)、(200)、(220)和(311),这是由于测试时射线打到基体所致。在43.38°、48.18°和50.25°可以看到Ni的衍射峰,对应其(815)、(026)和(526)晶面,说明电沉积Ni-P合金镀层的过程中有晶态Ni生成。
2.5 Ni-P合金镀层的形貌分析
在ChCl-Urea-0.3NiCl2-0.05NaH2PO2镀液中制备的Ni-P合金镀层的宏观形貌如图8所示。为观察镀层的微观形貌,对其进行SEM检测,镀层分别放大1 000倍和5 000倍的微观形貌图如图9所示。

图8 ChCl-Urea-0.3NiCl2-0.05NaH 2PO2镀液Ni-P镀层的宏观形貌图
从图8和图9中可以看到,铜基体表面有明显的镀层,镀层平整致密,分布均匀,且具有银白色的 金 属光泽。

图9 ChCl-Urea-0.3NiCl2-0.05NaH2PO2镀液Ni-P镀层的SEM图
2.6 Ni-P合金镀层的耐腐蚀性能分析
图10 是在3.5%NaCl溶液中分别对Cu基体及在ChCl-Urea-0.3NiCl2-0.05NaH2PO2镀液中制备的Ni-P合金镀层进行动电位极化曲线测试的结果。图10中极化曲线对应的腐蚀电流密度和腐蚀电位如表1所示。
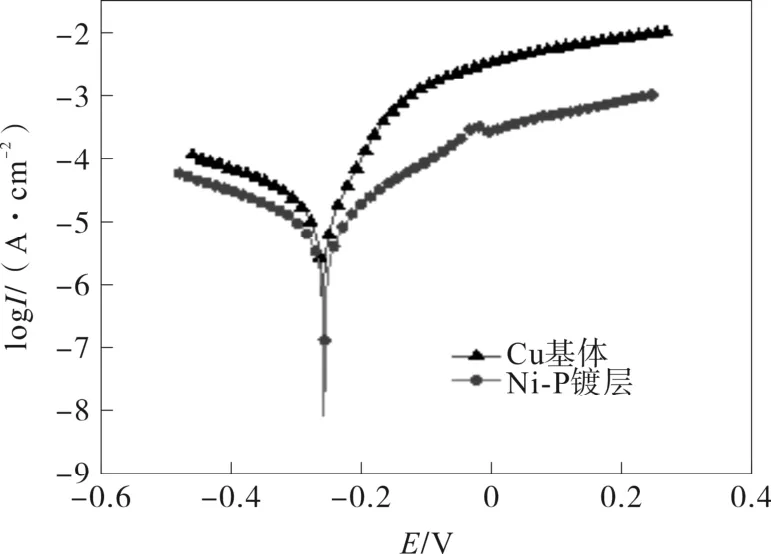
图10 Cu基体和Ni-P镀层的动电位极化曲线

表1 极化曲线对应的腐蚀电流密度和腐蚀电位
由表1可知,Ni-P合金镀层和铜基体相比,腐蚀电位稍正,腐蚀电流密度较小。因此,Ni-P合金镀层的耐腐蚀性能较铜基体强,对Cu基体具有一定的保护作用。
3 结论
1)ChCl-Urea低共熔溶剂和ChCl-Urea-NiCl2-NaH2PO2镀液的电导率随温度的升高而增大。
2)ChCl-Urea低共熔溶剂的电化学窗口为2.67 V,电化学窗口较宽,稳定性较好。
3)ChCl-Urea-NiCl2-NaH2PO2体系电沉积Ni-P合金镀层时,为不可逆的一步还原。
4)Ni-P合金镀层在ChCl-Urea-0.3NiCl2-0.05 NaH2PO2镀液中沉积的成核机理属于典型的扩散控制三维成核生长过程,得到的镀层平整致密,分布均匀,且具有银白色的金属光泽。
5)Ni-P合金镀层的耐腐蚀性能较铜基体强,对Cu基体具有一定的保护作用。
