京红桃及其晚熟芽变晚京红果实差异表达转录因子的转录组分析
2022-12-13王海静李晓颍殷亚蕊宋立琴张立彬武军凯
王海静, 李晓颍, 殷亚蕊, 宋立琴, 张立彬, 武军凯
(河北科技师范学院园艺科技学院/河北省特色园艺种质挖掘与创新利用重点实验室,河北秦皇岛 066004)
桃(Prunuspersica)是重要的核果类果树之一,对于其果实成熟期的研究也备受关注。果实的成熟是一个涉及多层次、多个代谢通路的复杂过程,是大量基因协同表达和调控的结果[1]。而转录因子作为调控因子在基因表达调控过程中发挥着重要作用,它们与靶基因上游的特定DNA元件相结合,激活或抑制靶基因的转录活性,从而调控靶基因的时空特异性表达[2-3]。多种转录因子(transcription factors,TFs)共同参与调控了果实成熟的复杂过程,包括参与植物激素合成及信号转导途径的AP2/ERF和EIN3/EILs,以及NAC、MYC、MYB、WRKY、bHLH、HSF、MADS-box、bZIP等转录因子家族成员[4-12]。在桃果实发育过程中,许多转录因子编码基因也以特定的方式调控相应靶基因的表达。比如,bZIP家族的一个转录因子基因在桃果实成熟初期有特异性高表达,在番茄中过表达该基因表现为果实成熟阶段的延长,表明该bZIP转录因子参与了桃果实的成熟进程[4]。而HD-ZIP homeobox基因(PpHB.G7)可以通过与乙烯生物合成基因PpACS1和PpACO1的启动子区域互作而影响桃果实成熟过程[5]。NAC转录因子对果实成熟同样至关重要,其主要通过结合启动子NACRS(NAC recognition sequence)或NACBS(NAC binding sequence)等元件,以实现对靶基因的转录调控进而影响多种果树果实的成熟过程。如果NAC基因外显子中有碱基片段插入则可能导致桃果实早熟[6-8]。MADS-box转录因子家族成员也参与了桃果实的成熟、软化和衰老进程[9-10]。乙烯转录因子(ethylene response factor,ERF)参与调控果树果实成熟过程也是近期研究热点之一。PpeERF2通过与启动子结合进而抑制2个脱落酸(ABA)生物合成基因(PpeNCED2和PpeNCED3)和一个细胞壁降解基因(PpePG1)的表达以调控桃果实成熟[11]。而与番茄成熟相关ERF同源的桃PpERF.E2基因在整个果实发育过程中高表达,该因子能够激活PpACS1和PpACO1,进而调控乙烯的生物合成。不同的ERFs可作为转录激活子或者转录抑制子与靶基因启动子作用,通过反馈调控乙烯合成相关基因的表达来影响乙烯生成,进而参与调控果实成熟[12]。
笔者所在课题组在前期研究中发现了京红的晚熟芽变晚京红,成熟期比京红晚19 d。本试验以京红(W)和晚京红(M)为材料研究桃果实成熟期调控的分子机制,通过分析2种果实发育及成熟阶段的差异表达转录因子及其表达模式,挖掘桃果实成熟过程中发挥重要作用的转录因子家族。该试验结果有助于提高对参与桃果实成熟调控的转录因子家族的认识,有利于更深入地理解桃果实成熟调控网络以及不同代谢通路之间的互作关系,以期为通过分子手段调控桃果实成熟期奠定理论基础。
1 材料与方法
1.1 数据来源
供试桃品种京红及其晚熟芽变晚京红采自河北科技师范学院试验基地。在京红盛花(days after full bloom,简称DAB)后40、60、70 d及其晚熟芽变晚京红盛花后60、70、80 d取果实进行转录组测序,对应样本名称分别为W1、W2、W3以及M1、M2、M3。随机采收每个阶段果实,各重复3次,取样后分别将果皮与果肉切碎混匀,-80 ℃保存备用。
1.2 差异表达转录因子基因分析
基因表达量的计算采用FPKM(fragments per kilobase per millionreads)方法。样本间差异表达基因的筛选及分析使用DESeq2软件,筛选阈值为 |log2(fold chang,FC)|≥1并且校正P<0.05。同时,与桃基因组数据库(https://www.ncbi.nlm.nih.gov/genome/)进行BLAST比对,并结合PlantTFDB数据库(plant transcription factor database 3.0,http://planttfdb.cbi.pku.edu.cn/)以筛选差异表达转录因子基因。设计以下6个比对方案W1 vs W2、W1 vs W3、W2 vs W3和M1 vs M2、M1 vs M3、M2 vs M3分别分析京红和晚京红在各自的发育及成熟过程中转录因子的表达情况,以及2个桃栽培种盛花后 60 d 比较组(W2 vs M1,60 DAB)和盛花后70 d比较组(W3 vs M2,70 DAB)用于分析京红和晚京红在相同的花后时间差异表达转录因子。
根据京红和晚京红果实转录组数据中各转录因子基因的FPKM值,分析差异表达转录因子的表达模式。log2(FC)值进行均一化后,对一些差异表达转录因子进行表达模式聚类分析。
1.3 实时荧光定量PCR验证
从RNA-seq数据中选取与果实成熟相关的9个具有不同表达模式的基因和转录因子,通过荧光定量PCR(qRT-PCR)进行验证。依据候选基因ID从数据库中检索得到对应的cDNA序列,利用Primer Premier 5.0软件进行特异性引物设计,以TEF2为内参基因,引物序列见表1,由中美泰和生物技术(北京)有限公司合成。反应在伯乐CF Connect实时荧光定量PCR仪上运行,程序为95 ℃预变性10 min;95 ℃ 10 s,60 ℃ 10 s,45个循环。相对表达水平用2-ΔΔCT法[13]计算。每个样品各3次独立的生物学重复。

表1 实时荧光定量PCR引物序列
2 结果与分析
2.1 京红及晚京红果实转录因子统计分析
从转录组测序数据中共鉴定出41个转录因子家族的302个转录因子基因,转录因子家族中基因数目较多的有B3家族(34个)、MYB-related(31个)、NAC家族(24个)、HB-other家族(19个)、C3H家族(18个)、FAR1家族(17个)、MYB家族(16个)、bHLH家族(15个)、bZIP家族(15个)和M-type MADS家族(13个),分别占鉴定转录因子基因总数的11.26%、10.26%、7.95%、6.29%、5.96%、5.63%、5.30%、4.97%、4.97%和4.30%。其中,差异表达的转录因子基因有158个,占鉴定总数的52.3%,分属于33个转录因子家族,包括B3(17个)、NAC(17个)、MYB-related(15个)、HB-other(14个)、bHLH(12个)、MYB(11个)、WRKY(10个)、bZIP(7个)和C3H(7个)等(图1)。

2.2 京红和晚京红发育及成熟过程中差异表达转录因子分析
在京红发育成熟过程中,W1 vs W2比较组中差异表达的转录因子基因62个(21个TFs家族),上调表达17个,下调表达45个,基因数量较多的转录因子家族有B3、MYB-related、NAC、WRKY、bHLH和MYB。W1 vs W3比较组中,差异表达的转录因子基因84个(24个TFs家族),上调表达32个,下调表达52个,基因数量较多的转录因子家族有NAC、B3、MYB-related、bHLH、WRKY和MYB。在W2 vs W3比较组中,差异表达的转录因子基因51个(23个TFs家族),其中上调表达26个,下调表达25个,基因数量较多的转录因子家族有HB-other、MYB-related、MYB。对京红发育及成熟过程中3个阶段比较组的差异表达转录因子进行综合分析显示,大量差异表达转录因子集中在B3、MYB-related、NAC、WRKY、bHLH、MYB家族(表2)。在晚京红发育成熟过程中,M1 vs M2比较组中差异表达的转录因子基因60个(17个TFs家族),其中上调表达25个,下调表达35个,在M1 vs M3比较组中,差异表达的转录因子基因108个(26个TFs家族),上调表达47个,下调表达61个,在M2 vs M3比较组中,差异表达的转录因子基因78个(21个TFs家族),上调表达30个,下调表达48个,对这3个发育及成熟阶段的差异表达转录因子进行综合分析发现,NAC、MYB-related、bHLH、HB-other、B3、MYB等家族的转录因子较多参与到了晚京红发育及成熟的过程中(表2)。
在京红W1 vs W2、W1 vs W3以及W2 vs W3比较组各有10、17、5个特异表达转录因子。而在晚京红中,M1 vs M2、M1 vs M3以及M2 vs M3比较组分别有6、23、9个特异表达转录因子,晚京红M1 vs M3和M2 vs M3重叠部分包含60个转录因子,远高于京红中相应的数量。分析2个栽培种各自发育成熟阶段比较组的时期特异性表达转录因子,发现参与京红发育及成熟过程的WRKY家族基因数量高过晚京红中的数量。晚京红发育及成熟过程中 HB-other家族转录因子数量较京红多(图2,表2)。
2.3 京红和晚京红60 DAB和70 DAB比较组共有和特异表达转录因子分析
为研究导致京红和晚京红果实发育成熟期差异的影响因素,对二者果实在60 DAB和70 DAB的差异表达转录因子进行分析,结果(表3)表明,60 DAB比较组中,京红和晚京红差异表达的转录因子基因35个(18个TFs家族), 27个基因上调表达,8个基因下调表达,主要包括了MYB、B3、bHLH、M-type MADS及MYB-related等转录因子家族基因,差异最大的转录因子是MYB6(LOC18770134),下调最显著的是MYB-related家族RAX2基因(LOC18772781)(表3)。70 DAB比较组中,差异表达的转录因子基因33个(20个TFs家族),包括25个上调和8个下调,分属于HB-other、B3、MYB及MYB-related等转录因子家族。上调最显著的是一个未知转录因子基因(LOC18781353),下调最显著的转录因子是ERF家族EAF-1(LOC18772983)。在京红和晚京红60 DAB和70 DAB比较组有15个共同差异表达转录因子。转录因子呈现出不同的调节模式,既表现为同一转录因子在2个比较组中均上调表达,或在一个比较组上调表达而在另一个比较组下调表达,也表现为同一转录因子家族不同成员在同一比较组内或不同比较组间呈现出不同的上调或下调表达(表3、图3)。

表2 差异表达转录因子基因家族基本信息 个

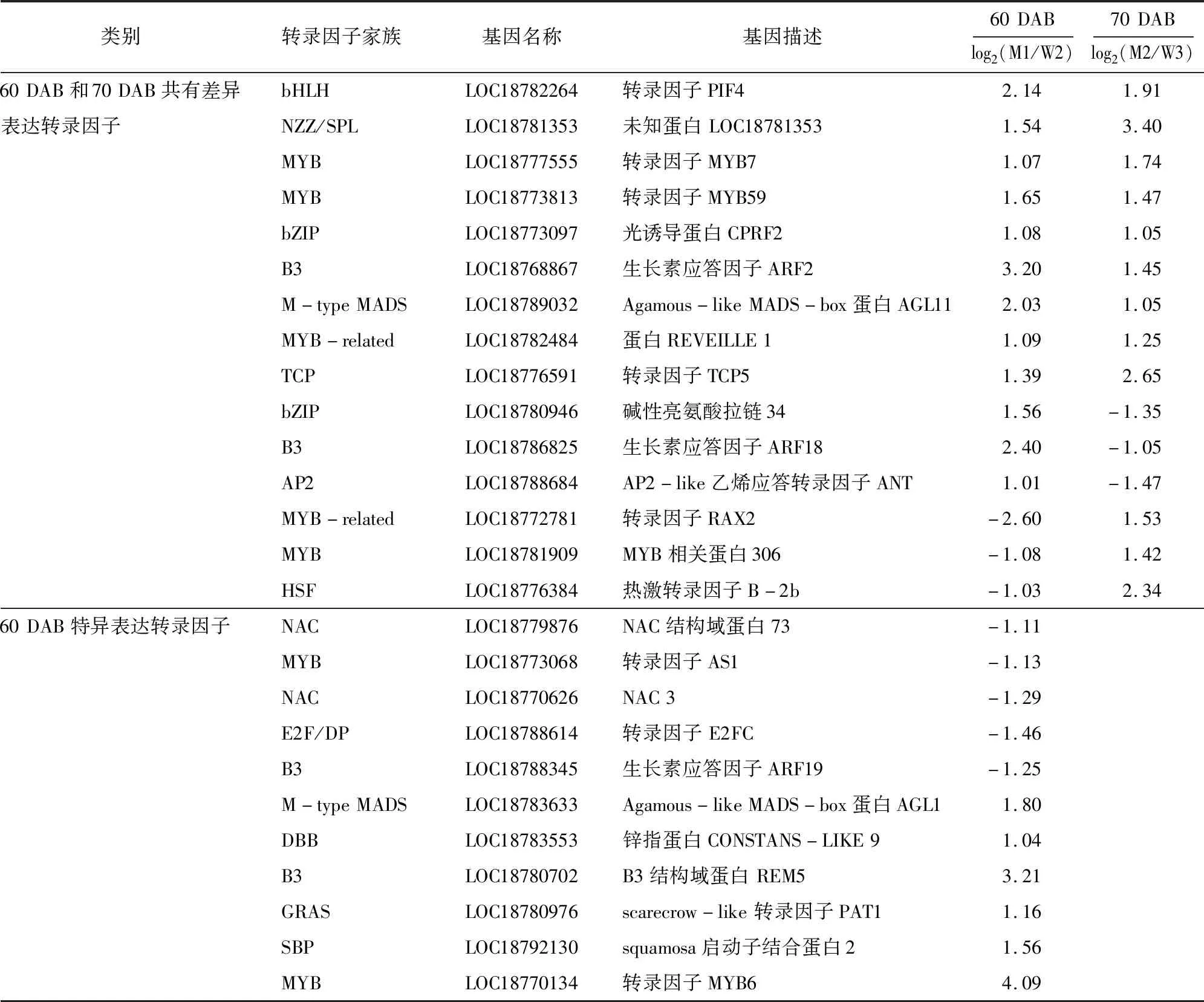
表3 京红和晚京红60 DAB和70 DAB比较组差异表达转录因子基本信息
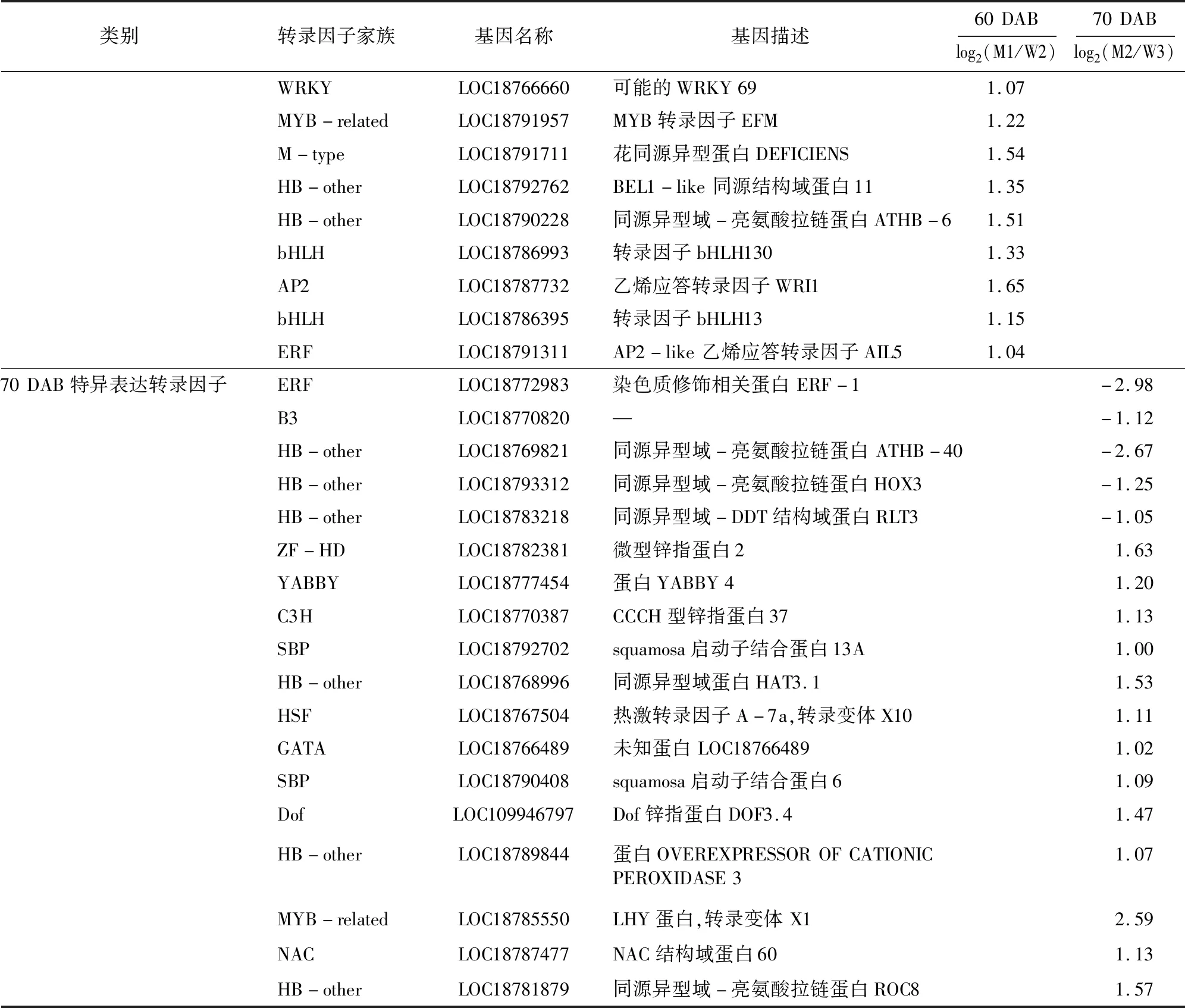
表3(续)
在京红和晚京红果实发育成熟60 DAB比较组中,20个特异表达转录因子基因中有15个上调表达,分属于M-type MADS、DBB、B3、GRAS、SBP、MYB、WRKY、MYB-related、M-type、HB-other、bHLH、AP2和ERF家族,5个下调表达转录因子家族包括NAC、MYB、E2F/DP和B3家族。MYB6(LOC18770134)上调表达差异最显著,E2F/DP家族E2FC转录因子(LOC18788614)下调表达差异最显著。而在京红和晚京红果实发育成熟70 DAB比较组中,18个特异表达转录因子基因中有5个下调表达,包括ERF、B3和HB-other家族成员,13个上调表达基因分属于ZF-HD、YABBY、C3H、SBP、HB-other、HSF、GATA、SBP、Dof、MYB-related和NAC家族。MYB-related家族LHY(LOC18785550)和ERF家族EAF-1(LOC18772983)分别为上调和下调表达差异最显著基因(表3)。

2.4 差异表达转录因子聚类分析
为分析京红和晚京红差异表达转录因子基因在整个发育成熟阶段的表达模式,对60 DAB、70 DAB比较组差异表达转录因子基因进行了聚类分析。表达模式主要分为2种类型,第1种类型转录因子基因表达水平随发育进程下调表达,而其中的LOC18777555(MYB7),LOC18782264(PIF4),LOC18770134(MYB6),LOC18776591(TCP5),LOC18777454(YABBY 4),LOC18768867(ARF2)和LOC18766660(WRKY69)等在京红果实发育成熟过程的W1期有较高水平表达,而在晚京红整个发育成熟阶段表达量均不高(图4)。第2种类型转录因子基因表达水平随发育进程上调表达,其中的LOC18779876(NAC73),LOC18791957(MYB-related EFM),LOC18769821(ATHB-40),LOC18772781(MYB-related RAX2),LOC19770626(NAC3),LOC18766489(未知转录因子),LOC18767504(HSF)以及LOC18773097(CPRF2)在京红果实发育成熟整个阶段和晚京红发育M1、M2期表达量均不高,而在晚京红果实M3期有较高水平表达。此外,LOC18793312(HOX3)和LOC18772983(EAF-1)在京红果实W3期有较高水平表达,而在晚京红果实发育成熟整个阶段和京红发育M1、M2期表达量均不高(图4)。
2.5 qRT-PCR验证
为了进一步验证转录组测序结果的准确性,从RNA-seq测序数据中随机挑取差异表达的9个基因,通过qRT-PCR对其基因表达量进行检验,如图5所示,9个基因的相对表达水平与RNA-seq分析结果一致,表明了转录组数据的可靠性。
3 结论与讨论
桃果实成熟是一个复杂而有序的生理生化过程,涉及色泽、风味、香气、质地等品质指标的变化,直接影响果品的商品价值、上市时间、货架期和市场竞争力,因此,桃果实成熟机制研究对于桃产业发展有重要的意义。基于此,本研究以京红及其晚熟芽变晚京红为试验材料,对二者各自发育成熟过程以及二者之间的差异表达转录因子进行分析,共鉴定得到41个转录因子家族的158个差异表达转录因子,分属于B3、MYB-related、NAC、HB-other、C3H、FAR1、MYB、bHLH、bZIP和M-type MADS等转录因子家族。
转录因子在同一种质不同发育成熟阶段其转录表达水平具有时期特异性。通过比较2个栽培种在不同发育成熟阶段的差异表达转录因子,发现均有其特异性和共同性表达转录因子(图2、表2),表明这些转录因子以不同的转录调控方式参与了阶段性生理过程和生化代谢途径。不论是京红还是晚京红均有大量转录因子家族及转录因子随发育成熟进程的推进而表达,有些转录因子基因表达量变化幅度较大,并且转录因子在各成熟发育阶段的转录表达水平及表达模式具有种质特异性(表3、图4),这表明不同类型的转录因子发挥特定分子功能调控了果实发育成熟过程中不同的生物过程,也可以解释2个栽培种果实成熟期的差异性,这种差异性可能是晚京红通过转录因子的差异性表达促进或抑制某些生理代谢途径相关基因的表达,重新组织和调节了生理生化代谢活动,导致了成熟期的延长[5,8]。
表达模式分析显示,多个转录因子在晚京红发育过程中有显著的变化或在某阶段有较高水平的表达,而在京红果实发育的各个阶段表达水平不高、表达水平没有变化或者与晚京红表现出相反的表达趋势。综合分析表达量和表达模式发现,NAC家族(NAC73,LOC18779876;NAC3,LOC19770626)、MYB-related家族(EFM,LOC18791957; RAX2,LOC18772781)、HB-other家族(ATHB-40,LOC18769821)、HSF(LOC18767504)以及bZIP家族(CPRF2,LOC18773097)转录因子在晚京红果实成熟启动前后变化明显,证实了这些家族的转录因子参与了芽变晚京红果实成熟的调控过程[14-17],对果实的晚熟机制起到了重要的作用。MYB家族(MYB7,LOC18777555;MYB6,LOC18770134)、bHLH家族(PIF4,LOC18782264)、TCP家族(TCP5,LOC18776591)、YABBY家族(YABBY 4,LOC18777454)、ARF家族(ARF 2,LOC18768867)和WRKY家族(WRKY69,LOC18766660)相应转录因子在京红果实发育成熟过程的W1期有较高水平表达,而HB-other家族(HOX3,LOC18793312)和ERF家族(EAF-1,LOC18772983)仅在京红果实W3期有较高水平表达(图4),与晚京红中相应表达模式存在较大差异,同样可作为成熟期延长研究的候选基因[8,11,18]。


本研究发现晚京红发育成熟过程中HB-other家族转录因子数量较京红多。HB-other家族转录因子在发育成熟过程中呈现不同的表达模式[18],如LOC18769821和LOC18793312。ERF转录因子为PETALA2 (AP2)/ERF基因超家族成员,其特征是保守的60~70个氨基酸残基组成的AP2/ERF DNA结合结构域[19-20]。ERF转录因子通过核心AGCCGCC序列直接结合到GCC-box,或者结合到下游基因的DRE基序,反馈调控乙烯合成相关基因的表达来影响乙烯生成,进而参与调控果实成熟[11-12,21]。在桃基因组中推定的ERF转录因子有116个[22],已有研究对桃ERF的表达谱进行了报道[23-25]。Zhou等也对成熟期油桃ERF转录因子表达进行分析,发现了12个ERF转录因子表达量较高[12],但不含本研究关注的ERF(LOC18772983)。ERF(LOC18772983)基因在京红果实中表达量随果实发育成熟呈升高趋势,果实成熟前的表达量显著上调至最高,表达量在60 DAB较40 DAB增幅较小(1.54倍),而在70 DAB表达量增幅达到13.3倍。在晚京红果实中,该基因表达量呈逐渐降低趋势,果实成熟前的表达量显著下调,70 DAB表达量与60 DAB相当(-1.03倍),80 DAB表达量较70 DAB降低幅度较大(-6.25倍)。
由一些转录因子基因在2个栽培种中相反的表达模式可推断其在京红和晚京红中可能分别作为转录激活子和转录抑制子调控乙烯合成基因的表达,进而影响了京红和晚京红果实成熟过程[12],这也进一步说明了转录因子参与桃成熟调控网络的复杂性。由以上分析可知,众多转录因子家族成员均参与到了桃成熟期相关的调控过程,而在果树中转录因子调控果实发育成熟是一个极其复杂的动态网络[26-27],这些转录因子如何互作调控尚待进一步深入研究。
本研究基于京红及其晚熟芽变晚京红果实发育成熟过程的转录组数据,鉴定出158个差异表达转录因子,主要包括了B3、MYB-related、NAC、WRKY、bHLH、MYB和HB-other等转录因子家族基因。对2个栽培种在相同花后时间的差异表达转录因子进行了表达量和表达模式分析,发现NAC家族(NAC73,LOC18779876;NAC3,LOC19770626)、MYB-related家族(EFM,LOC18791957;RAX2,LOC18772781)、HB-other家族(ATHB-40,LOC18769821;HOX3,LOC18793312),HSF(LOC18767504)、bZIP家族(CPRF2,LOC18773097)、MYB家族(MYB7,LOC18777555;MYB6,LOC18770134)、bHLH家族(PIF4,LOC18782264)、TCP家族(TCP5,LOC18776591)、YABBY家族(YABBY 4,LOC18777454)、ARF家族(ARF 2,LOC18768867)、WRKY家族(WRKY69,LOC18766660)以及ERF家族(EAF-1,LOC18772983)转录因子基因在晚京红成熟期延长的调控过程中发挥了作用。本研究结果可为桃特定转录因子家族基因在果实成熟过程中的功能研究提供参考。
