18F-FDG PET/CT 影像组学鉴别良、恶性高代谢孤立性肺结节
2022-12-12邱钱赛冯峰石健张益飞蒋小冬施冬辉
邱钱赛,冯峰,石健,张益飞,蒋小冬,施冬辉
南通大学附属肿瘤医院影像科,江苏 南通 226361
孤立性肺结节(solitary pulmonary nodules,SPN)是肺癌的早期影像学表现[1],可靠地鉴别诊断SPN是提高患者生存率的重要方法[2]。18F-FDG PET/CT越来越多地用于SPN的鉴别诊断,其敏感度和特异度分别为82.0%~96.8%和71.0%~77.8%[3],假阳性是18F-FDG PET/CT诊断特异度受限的主要原因[4]。通常以最大标准化摄取值(SUVmax)=2.5作为界定良、恶性病变的依据[5],SUVmax>2.5考虑为恶性肿瘤,SUVmax<2.0可以考虑为良性病变,SUVmax 2.0~2.5为临界范围。临床实践中,对高代谢的可疑SPN的诊断尤为困难,准确分类可以避免不必要的侵入性检查或手术[6]。影像组学可以高通量地提取常规影像图像中大量高维的定量特征[7],弥补视觉评估的局限性。因此,本研究拟结合18F-FDG PET图像特征与同机CT图像特征,构建鉴别高代谢SPN良恶性的多模态影像组学模型,并探究其诊断效能及临床价值。
1 资料与方法
1.1 研究对象 回顾性分析2010年10月—2017年6月于南通大学附属肿瘤医院行18F-FDG PET/CT检查发现肺部病灶患者。纳入标准:①直径≤3 cm、单一、界限清楚、影像学不透明且完全被充气肺包围的肺部结节性病变[8]。②有完整的18F-FDG PET/CT图像及临床资料。③诊断明确(病理或临床证实结节良恶性,其中手术或活检获得结节病理结果;临床随访2年及以上,病灶消失或明显缩小诊断为良性结节[9])。④18FFDG PET/CT检查前未接受治疗。排除标准:①直径≤8 mm;②SUVmax≤2.0;③18F-FDG PET或CT图像上有胸腔积液或明确的淋巴结转移。最终纳入187例SPN,其中良性44例,恶性143例。本研究获得本院机构伦理审查委员会批准(编号:2014-003),并豁免患者知情同意。
1.2 图像采集 采用Philips Gemini TF PET/CT扫描仪,校准多排螺旋CT与PET系统的轴线。所有患者行18F-FDG PET/CT检查前禁食至少6 h。注射18F-FDG前监测患者血糖水平确保在正常范围内(<140 mg/dl)。静脉注射18F-FDG 3.3 MBq/kg,平静休息60 min后采集图像。扫描范围从颅顶至股骨上段,螺旋CT扫描参数:电压120 kV,管电流150 mA,层厚3.75 mm;PET扫描参数:层厚3 mm,视野600 mm,7~8个床位/患者,3 min/床位。CT图像采用标准法重建;PET图像采用OSEM法重建,并参照CT数据进行衰减校正。PET数据行横断面、冠状面和矢状面图像重建,经多幅、多层面成像与CT图像进行融合。
1.3 图像分析 由2位经验丰富的影像科医师采用盲法对18F-FDG PET/CT 图像进行常规诊断。使用Volume viewer软件获得病灶SUVmax。CT值由2位医师分别对病灶最具代表性的层面进行测量,取平均值。
1.4 图像分割及特征提取 将纳入患者的DICOM 3.0标准格式的PET图像与同机CT图像分别导入开源软ITK-SNAP 3.6.0(http://www.itksnap.org/)。由2位影像科主治医师(分别具有6年和8年18F-FDG PET/CT诊断经验)采用盲法共同完成所有结节的全体积分割(图1)。使用A.K 3.2.0软件分别提取PET和CT图像上SPN影像组学特征,包括直方图特征、形态特征和纹理特征。
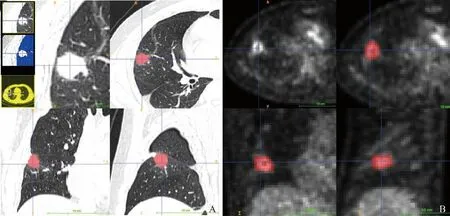
图1 ITK-SNAP软件半自动勾画CT图像上三维感兴趣区(A),参照CT图像上SPN范围分割PET图像上三维感兴趣区(B)
1.5 影像组学模型构建 将187例入组患者按照7∶3随机分为训练集和验证集。为了防止过度拟合,首先对训练集中所有PET和CT特征进行Spearman相关分析,去除相关系数>0.9的特征;然后将剩余的特征作LASSO回归分析,通过10倍交叉验证筛选LASSO回归模型给出的lambda值,在最优lambda值下,特征系数不为0 者最终用于构建SPN 影像组学模型。Radscore=所保留特征与各自对应系数乘积的和。同理,本研究分别构建基于PET图像特征、同机CT图像特征的单模态组学模型。
1.6 统计学方法 采用SPSS 24.0软件,对计量资料进行正态性检验,非正态分布的参数以中位数M(Q1,Q3)表示,采用Mann-WhitneyU检验分析良、恶性SPN、临床资料(年龄)和影像学数据(结节大小、CT值、SUVmax)的差异;计数资料以例数或百分比表示,采用χ2检验分析性别、结节部位及其形态学特征(分叶、毛刺、胸膜凹陷)的差异。采用受试者工作特征(ROC)曲线评价影像组学模型的诊断效能,并用Delong检验比较3种模型曲线下面积(AUC)的差异。通过决策曲线分析评估模型的临床应用价值。P<0.05为差异有统计学意义。
2 结果
2.1 临床及影像学数据 本研究共纳入187例SPN患者,年龄30~83岁,中位年龄62(55,70)岁。其中经手术或临床随访证实为良性结节44例,包括炎性病变28例、结核13例、良性肿瘤2例、隐球菌感染1例,经手术或穿刺活检病理确诊为恶性结节143例,包括腺癌102例、鳞癌20例、非小细胞肺癌2例、小细胞肺癌8例、大细胞癌3例、腺鳞癌2例、神经内分泌癌3例、类癌1例、黏液表皮样癌1例、乳腺癌转移1例。
良性SPN患者年龄32~83岁,中位年龄57.5(49,68)岁;恶性SPN患者30~82岁,中位年龄63(56,70)岁,差异有统计学意义(P=0.012);良、恶性SPN组CT图像上结节形态学特征(分叶、胸膜凹陷)以及PET图像上代谢参数SUVmax差异有统计学意义(P均<0.05)。两组患者性别和结节部位、大小、CT值差异无统计学意义(P>0.05),见表1。

表1 187例SPN患者的临床及影像资料比较
2.2 构建影像组学模型 在PET及CT图像上分别提取出396个影像组学特征,其中直方图特征42个、形态特征20个、纹理特征334个。经LASSO回归分析(图2)最终筛选出9个最佳特征,根据每个特征对模型的贡献(图3)给予相应的系数,并构建18F-FDG PET/CT影像组学模型:Radscore=0.359×PET_HaraVariance-0.419×PET_Compactness2-0.051×PET_LargeAreaE mphasis+0.15×CT_GLCMEntropy_AllDirection_offset 7_SD-0.086×CT_GLCMEntropy_angle90_offset4-0.1 1×CT_LongRunEmphasis_angle135_offset1+0.286×CT_ShortRunEmphasis_angle45_offset1-0.287×CT_Surfa ceVolumeRatio+0.249×CT_HighIntensitySmallAreaEm phasis+0.181。

图2 采用LASSO回归分析(A)及10倍交叉验证(B)确定18F-FDG PET/CT影像组学模型特征

图3 18F-FDG PET/CT影像组学模型中9个最佳组学特征的权重
同理可获得18F-FDG PET 影像组学模型:Radscore=0.412×HaraVariance+0.024×LongRunHighG reyLevelEmphasis_angle45_offset4-0.399×Compactnes s2+0.19;以及CT影像组学模型:Radscore=-0.083×Quantile0.025-0.182×uniformity-0.128×Correlation_Al lDirection_offset7_SD+0.084×Correlation_angle135_of fset7-0.345×LongRunHighGreyLevelEmphasis_angle0_offset1-0.03×ShortRunEmphasis_AllDirection_offset4_SD+0.316×ShortRunEmphasis_angle90_offset1+0.005。
通过约登指数确定3种模型鉴别良、恶性高代谢SPN的最佳截断值分别为0.072、0.014、0.253。图4为18F-FDG PET/CT影像组学模型在训练集和验证集中的Radscore散点图。

图4 18F-FDG PET/CT影像组学模型在训练集(A)和验证集(B)中的Radscore散点图,截断值为0.072;Label 0代表良性,Label 1代表恶性
2.3 评估影像组学模型的诊断效能 ROC曲线(图5)分析显示,训练集中,18F-FDG PET/CT影像组学模型鉴别良、恶性高代谢SPN的AUC为0.91(95%CI0.85~0.97),敏感度为85.0%,特异度为85.0%,诊断准确度为85.0%(95%CI76.0%~91.0%)。验证集中,当使用相同截断值-0.072时,该模型具有相似的诊断效能,AUC为0.88(95%CI0.80~0.97),敏感度为88.0%,特异度为80.0%,准确度为82%(95%CI71.0%~90.0%)。此外,18F-FDG PET影像组学模型与CT影像组学模型也具有良好的诊断效能(表2)。Delong检验结果显示,3 种模型的AUC 差异无统计学意义(P>0.05),训练集中CT比PET、CT比PET/CT、PET比PET/CT的P值分别为0.59、0.08、0.22;验证集中分别为0.35、0.18、0.65。3种模型的决策曲线(图6)均高于两条极端线,表明3种模型均可使患者获益,其中18F-FDG PET/CT影像组学模型的患者净获益率相对更高。SUVmax在良、恶性结节间差异有统计学意义(P<0.05),但其诊断效能不佳,AUC为0.64(95%CI0.55~0.73)。

图5 鉴别良、恶性高代谢SPN的18F-FDG PET/CT影像组学模型在训练集(A)和验证集(B)中的ROC曲线

图6 3种影像组学模型鉴别良、恶性高代谢SPN的决策曲线

表2 3种影像组学模型的诊断效能评估
3 讨论
3.1 纳入研究对象 本研究选择高代谢的SPN为研究对象,探究18F-FDG PET/CT多模态影像组学模型鉴别诊断这部分可疑恶性肺小结节良恶性的价值。随着影像学技术的发展以及临床实践中对肺结节认识的加深,SPN的检测和恶性风险评估的准确度已经较为可观,许多典型形态学的恶性征象以及代谢评估可以帮助影像科医师做出可靠诊断[10]。但仍有一部分病灶在视觉评估中缺乏典型表现,或者FDG摄取存在假阳性、假阴性可能,使得SPN定性诊断准确度变化较大[11-12]。一项大样本荟萃分析显示,可疑肺部病变的18F-FDG PET/CT假阳性率平均为25%[13]。因此,当需要鉴别的病变均表现为较高FDG摄取时,诊断难度会随之增加[14]。这可以解释本研究中SUVmax在良、恶性高代谢SPN组间的诊断效能一般(AUC=0.639)。
3.218F-FDG PET/CT的影像组学模型构建 本研究构建的18F-FDG PET/CT的影像组学模型包含3个PET特征和6个CT特征,其中3D形态特征2个(Compactness2和SurfaceVolumeRatio),均用于衡量肿瘤形态的紧凑程度,PET_Compactness2的取值范围为0~1(1表示完美球体),由ROI决定,与Radscore呈负相关,可以理解为形态越不规则的病灶越趋向于恶性;但CT_Surface VolumeRatio代表的表面积体积比在本模型中也与Radscore呈负相关,而该值越低代表更接近球状,可能的解释是对于较小病灶,良、恶性结节之间的形态学特征差别并非绝对,另一个原因是本研究用于勾画三维感兴趣区的PET和CT图像的层厚并不一致,这可能影响该比值中的分子(表面积)。灰度共生矩阵(GLCM)特征3 个(PET_HaraVariance、CT_GLCMEntropy_AllDirection_offset7_SD、CT_GLCMEntropy_angle90_offset4),三者从不同层面反映病灶的非均质程度或复杂程度,PET_HaraVariance、CT_GLCMEntropy_AllDirection_offset7_SD、Radscore呈正相关,表明病灶在PET图像上FDG摄取及CT图像上质地的异质程度越高,病灶越趋向于恶性,与既往研究一致[14]。值得注意的是,CT_GLCMEntropy_angle90_offset4代表基于某一个特定角度的熵,该值与Radscore呈负相关。灰度区域大小矩阵(GLSZM)特征2个(PET_Large AreaEmphasis、CT_HighIntensitySmall AreaEmphasis),分别反映病灶代谢图像纹理的粗糙程度和CT图像纹理的精细程度,小区域越多,纹理越精细,异质性越高,病灶更趋向于恶性。灰度程矩阵(GLRLM)特征2个(CT_LongRunEmphasis_angle 135_offset1、CT_ShortRunEmphasis_angle45_offset1),用于计算长游程和短游程的分布,同样可以反映CT图像纹理的粗糙/精细程度。总之,对于18F-FDG PET/CT影像组学模型的贡献较大的仍然是纹理特征,可以反映图像上病灶的异质程度,良、恶性结节之间的细微的异质性差异通过该模型得以区分。多项关于图像纹理特征用于肺结节良恶性诊断的研究最终筛得的特征与本研究大致相同,但多数是基于CT图像的[15-17]。
3.318F-FDG PET/CT影像组学模型的诊断效能 基于18F-FDG PET/CT的影像组学模型在鉴别诊断良、恶性高代谢SPN中具有较高的应用价值,训练集和验证集中的AUC分别为0.91和0.88,截断值为0.072,高于该值考虑为恶性。本研究使用的CT图像是18F-FDG PET/CT扫描获得的同机非对比增强CT图像,Yang等[18]的研究显示,与增强CT图像相比,非增强CT图像的影像组学特征在肺部结节分类中具有更好的性能,其原因为肿瘤本身质地的复杂程度足以表明其生物异质性,对比剂充填后反而会造成混淆。有研究尝试构建用于肺癌早期筛查的CT影像组学模型,结果发现,经模型计算得到的Radscore与患者年龄相结合可以很好地区分良性和恶性肺结节(AUC 0.836,95%CI0.793~0.879)[19],与本研究结果(AUC 0.82)相似。ROC曲线显示,18F-FDG PET/CT多模态影像组学模型的AUC均大于两种单模态影像组学模型,但无显著差异,与Zhang等[20]的研究结果一致。但多模态组学模型在理论上结合了PET组学特征对病灶代谢异质性的理解和CT组学特征对病灶质地异质性的理解,能够最大化良、恶性病变的差异,因此多模态影像组学模型仍然有很大的潜力。Kang等[21]将人工诊断结合PET/CT影像组学模型构建联合诺模图,能够显著降低肺部病变的假阳性率。本研究对象为高代谢SPN,临床指标的诊断价值受到一定限制,因此构建模型未结合临床指标。
3.4 本研究的局限性 ①本研究样本量有限,且为单中心回顾性研究。后续研究需增加样本量,利用多中心数据对本研究结果进行验证及测试。②本研究采用LASSO回归分析构建模型,尚未探究不同的统计学方法对结果的影响,因此在后续研究中可以调整统计策略,以构建最佳的SPN个性化诊断模型。
总之,本研究基于临床对SPN影像学定性的迫切性以及实际工作中18F-FDG PET/CT对于高代谢结节的诊断局限性构建了一个影像组学模型,适用于可疑恶性肺小结节(SUVmax>2.0)的分类管理。这一个性化的诊断策略有望进一步提高18F-FDG PET/CT的临床应用价值。
利益冲突 本研究过程和结果均未受到相关设备、材料、药品企业的影响,所有作者均声明不存在利益冲突
