SLC44A5对肺腺癌细胞迁移影响
2022-11-23王思,曲玥阳,肖桂山
王 思, 曲 玥 阳, 肖 桂 山
( 大连理工大学 化工学院, 辽宁 大连 116024 )
0 引 言
肿瘤的发病率和死亡率逐年升高.2020年全球癌症数据统计显示,全球大约有肺癌新发病例220万,发病率为11.6%;死亡病例180万,远超其他癌症类型,以18%的死亡率位居所有恶性肿瘤之首[1].肺癌早期症状较为隐蔽,临床上多数患者出现症状就诊时就已属晚期.随着病程的进展,10%~15%的患者会出现骨转移[2],25.4%~65.0%的患者可发生脑转移,生存时间超过2年的肺癌患者脑转移发生率高达80%[3],致使晚期肺癌5年整体生存率较低.因此,研究肺癌转移分子机制,探索新的治疗药物具有重要意义.
SLC44A5是胆碱转运蛋白,胆碱是乙酰胆碱和磷酸胆碱的前体[4],也是形成膜磷脂磷脂酰胆碱所必需的[5],胆碱还可以支持细胞膜的合成,从而促进细胞增殖[6].SLC44A5可通过降低细胞内胆碱水平诱导细胞凋亡来抑制细胞生长[7],从这个意义上说,癌症中胆碱转运体的鉴定和表征可能为抗肿瘤策略的设计提供新的靶点.因此,在癌细胞中识别胆碱转运蛋白是非常重要的.胆碱转运系统分为3类转运蛋白:高亲和力胆碱转运蛋白(CHT1/SLC5A7),中等亲和力胆碱转运蛋白样蛋白(CTL/SLC44A1-5)和低亲和力的多特异性有机阳离子转运蛋白(OCTs/SLC22A1-2)[8].已有文献报道CTL/SLC44A1-5广泛存在于不同人体组织中[9].大鼠和人类中枢神经系统中SLC44A1的存在表明,这种转运蛋白的功能失调可能对损伤后的神经系统发育和修复以及神经退行性疾病具有重要意义[10].SLC44A2在心脏、结肠、肺、肾和肝脏中表达为两种亚型,即SLC44A2-P1和SLC44A2-P2,这表明组织特异性差异可能会影响其在每个组织中的功能[11].SLC44A3在肾脏、回肠和结肠中中度表达,SLC44A4在胃和肾脏中高表达.关于SLC44A5表达的研究可用数据少得多,其在脊髓中的表达明显高于SLC44A1[12].虽然CTL/SLC44A1-5的分布已有相关文献报道,然而,对SLC44A3-5功能的相关研究较少.在已有报道中,Sugimoto等发现SLC44A5在进入肾脏途径前转运胆碱而不转运磷酸胆碱,说明SLC44A5有助于维持细胞胆碱水平[13].Peng等发现SLC44A5在肝癌中促进癌细胞凋亡抑制侵袭[14],然而其在肺腺癌发生发展过程中的功能尚待研究.因此本研究将初步探讨下调SLC44A5对肺腺癌细胞系增殖能力和迁移能力的影响.
1 材料与方法
1.1 材料与试剂
人肺腺癌细胞系H1299和H1792均购自美国ATCC公司.MTT(M8181-1g)试剂、青链霉素混合液(100×)、BCA蛋白浓度测定试剂盒(PC0020)、Tween 20均购自北京索莱宝生物科技有限公司.胎牛血清、1640培养基、Trypsin-EDTA胰酶购自Gibco公司.ECL超敏发光液(P1010)、RIPA裂解液购自北京普利莱公司.蛋白免疫印迹实验相关化学试剂购自天津大茂化学试剂厂.质粒小提中量试剂盒(DP106)、TRNzol Universal总RNA提取试剂(DP424)购自天根生化科技(北京)有限公司.SLC44A5(APREST83577)抗体购自Sigma公司.鼠二抗(A25012)和羊二抗(A25022)购自Macklin公司.
1.2 实验方法
1.2.1 细胞培养 细胞系H1299、H1792、H1299对照组及H1792对照组使用含10% FBS和1%双抗的1640培养基,H1299 shSLC44A5和H1792 shSLC44A5使用含10% FBS、1%双抗和2 μmol/L DOX的1640培养基,置于37 ℃、5% CO2的培养箱(Thermo Fisher Scientific)中培养.
1.2.2 RT-qPCR分析 采用TRNzol Universal从H1299细胞中提取总RNA,用酶标仪测定其浓度与质量,按照PrimeScriptRRT Reagent Kit试剂盒说明将其反转录成cDNA,再经过扩增后,上机检测.GAPDH前引物:5′-CTCCTCCACCTTTGACGCTG-3′,后引物:5′-TCCTCTTGTGCTCTTGCTGG-3′;SLC44A5前引物:5′-TCAAGTTTGCAGTGATTCAGGC-3′,后引物:5′-TCCTTGGATCACCAAAGTCCTC-3′.
1.2.3 转 染 在6孔板中接种细胞,待细胞融合度在60%~80%时将细胞培养基换成无血清培养基.将SiRNA干粉于12 000 r/min下离心2 min,使用depc水溶解,制备成最终浓度为20 μmol/L 的储备液.按细胞种类,每孔按5~8 pmol 的用量,使用150 μL无血清培养基稀释SiRNA储备液;每孔按5~8 μL LipofectamineTM2000用量,使用150 μL无血清培养基稀释转染试剂.室温孵育5 min.将稀释好的SiRNA工作液和转染试剂按1∶1混合.室温孵育20 min.将混合液加入6孔板中.6 h后换成完全培养基.48 h 后提取RNA用于后续测定.
1.2.4 低表达细胞模型建立 设计SLC44A5 SiRNA,将筛选后的SLC44A5 SiRNA序列转换成shRNA序列,整合到pLKO-Tet-On载体上,将构建好的shSLC44A5质粒和pLKO-Tet-On质粒包装成慢病毒,感染野生型H1299和H1792细胞,使用G418筛选至少3代得到SLC44A5低表达细胞系.
1.2.5 Western Blot检测 用胰蛋白酶消化待提取的目标细胞,按说明书比例加入RIPA裂解液、PMSF、蛋白酶抑制剂,置于冰上孵育10 min,12 000g离心15 min,上清液即为所提取细胞蛋白.使用BCA蛋白浓度检测试剂盒测定蛋白浓度,按比例加入4×上样缓冲液后置于70 ℃金属浴中煮10 min,然后保存于-20 ℃冰箱.每条泳道加入20 μg蛋白样品,设置恒压80 V跑完浓缩胶后恒压调至130 V跑分离胶,随后切取凝胶上目标蛋白条带转移至甲醇活化过的PVDF膜上,300 mA约70 min恒流转膜,用快速封闭液封闭0.5 h,用TBST清洗PVDF膜3次,每次5 min,加入一抗(体积1∶1 000稀释)置于冰箱4 ℃孵育过夜.次日用TBST洗3次膜,每次10 min;室温下二抗孵育1 h,TBST洗3次膜,每次10 min;随后将PVDF膜用ECL超敏发光液避光孵育1 min,置于凝胶成像仪(Bio-Rad,17001402,ChemiDOC MP Imaging System)中显影.
1.2.6 MTT法检测 待细胞生长到对数生长期时,使用胰蛋白酶消化细胞,按照每孔1 000个细胞铺于96孔板,每种细胞设置7组,每组设置6个复孔,置于培养箱中孵育,分别对应检测1、2、3、4、5、6、7 d的细胞增殖情况.每隔24 h孵育结束,在每孔中加入20 μL MTT溶液(5 mg/mL),放入培养箱孵育4 h后,吸去上清,在每孔加入150 μL DMSO,置于96孔板摇床振摇15 min,用酶标仪(Tecan,Infinite 200 pro)检测490 nm波长处的吸光度.
1.2.7 细胞划痕实验 将细胞接种到6孔板中,待其密度达到80%~90%时,使用200 μL黄色吸头去除单层细胞,并用磷酸盐缓冲液(PBS)洗3次以去除细胞碎片,倒置显微镜(Olympus公司,U-RFL-T)拍照记录划痕距离.培养箱中孵育24 h后拍照观察细胞迁移并测定距离.在每个孔中随机选3个区域进行分析,通过计算伤口愈合面积百分比来量化细胞迁移能力.
1.2.8 Transwell细胞迁移实验 将细胞用不含FBS的1640培养基培养24 h后,用胰蛋白酶消化,以2.5×104个/mL的密度重悬于不含有FBS的1640培养基中,从中取200 μL置于Transwell 小室(Corning Costar公司)的上隔室且在下隔室中加入含有10% FBS的1640培养基500 μL,置于培养箱中孵育24 h后,用棉签擦去膜上表面的细胞,将下表面的细胞用4%多聚甲醛固定30 min,随后用0.5%结晶紫溶液染色15 min,PBS清洗多余的结晶紫,置于倒置显微镜下拍照并计算迁移率.
1.2.9 统计学分析 使用软件GraphPad Prism 8.0及Image J对数据进行处理,结果以均值±标准差表示,两组间差异比较采用t检验,以P<0.05 为有显著性差异.
2 实验结果
2.1 SLC44A5在人体内表达情况
通过NCBI公共数据库检索SLC44A5在全身各器官中的表达情况,结果如图1所示,可以观察到,虽然SLC44A5在其他组织中表达量较低或者不表达,但在胎盘、全脑中相对高表达.
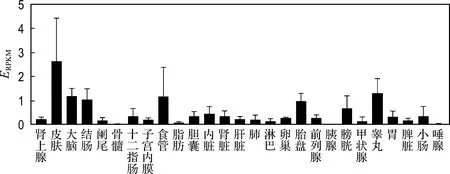
图1 SLC44A5在各器官中的表达
2.2 SLC44A5低表达细胞模型构建
为了验证SLC44A5与肺腺癌细胞生长能力和迁移能力之间的关系,本文按照载体构建的方法来构建SLC44A5低表达载体.首先设计了3组SLC44A5的SiRNA,SiRNA序列见表1.为了筛选SiRNA,将3组SiRNA序列转染到野生型肺腺癌细胞H1299中.转染48 h后,利用qPCR考察H1299细胞中SLC44A5的敲降效率R.结果如图2(a)所示,Si1序列敲降效率较高,为77%,最终选取该序列为构建shRNA敲降载体的候选序列.

表1 SLC44A5 SiRNA序列
随后分别用浓度为31.25、62.5、125、250、500、1 000、2 000、4 000、8 000 μg/mL的G418作用于H1299细胞,通过MTT法得出72 h时G418对细胞的杀伤作用,结果如图2(b)所示,浓度为2 000、4 000、8 000 μg/mL的G418细胞存活率V均为10%,组间无显著差异,因此最终选择2 000 μg/mL 为合适的G418浓度.
根据1.2.4实验方法构建SLC44A5低表达细胞模型,随后利用Western Blot检测4种细胞中SLC44A5蛋白的表达情况.结果如图2(c)所示,与对照组相比,H1299 shSLC44A5和H1792 shSLC44A5中SLC44A5蛋白表达量降低了.以上结果说明,SLC44A5低表达细胞模型构建成功.
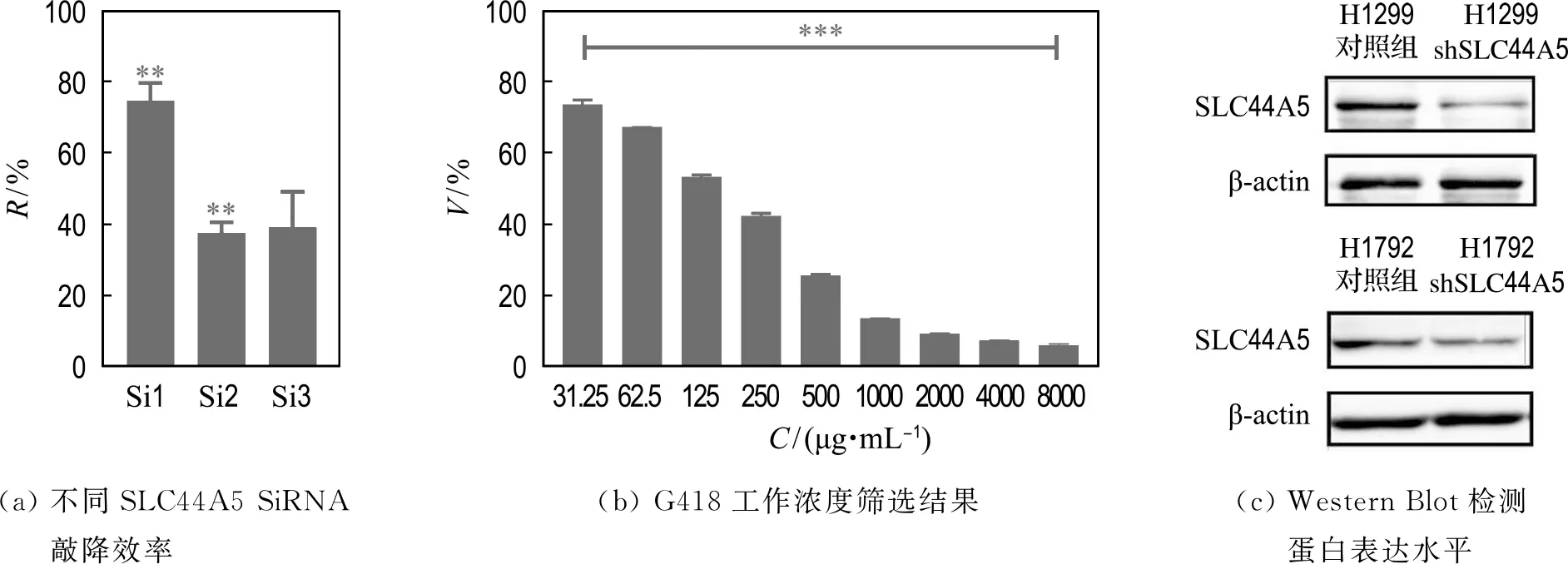
图2 SLC44A5低表达细胞模型构建
2.3 SLC44A5低表达抑制肺腺癌细胞增殖能力
为了更直观地观察敲低SLC44A5对肺腺癌细胞的影响,本研究观察了H1299对照组、H1299 shSLC44A5、H1792对照组、H1792 shSLC44A5的细胞形态变化.H1299和H1792为上皮样细胞,呈多边形形状.结果如图3(a)所示,发现SLC44A5低表达,细胞形态并未发生明显变化,但生长更为分散.
又利用MTT法检测上述4种细胞生长7 d的细胞存活率来验证SLC44A5是否对肺腺癌细胞增殖能力产生影响.结果如图3(b)所示,与对照组相比,SLC44A5低表达可以抑制肺腺癌细胞的生长.

(a) 细胞形态
2.4 SLC44A5低表达抑制肺腺癌细胞迁移能力
通过细胞划痕实验和Transwell细胞迁移实验来检测SLC44A5对肺腺癌细胞迁移能力的影响.首先将H1299对照组、H1299 shSLC44A5、H1792对照组、H1792 shSLC44A5接种于6孔板,细胞贴壁后进行细胞划痕实验,培养24 h后进行拍照,比较0 h和24 h后的伤口面积.结果如图4(a)所示,SLC44A5低表达,伤口愈合面积显著减少.
接着将上述4种细胞用无血清1640培养基培养24 h,接种于小室中(5 000/孔)进行Transwell 细胞迁移实验,24 h后进行拍照对比,比较0 h和24 h后细胞穿过小室的数量.结果如图4(b)所示,H1299和H1792在敲低SLC44A5的表达后,穿过小室的细胞数量有所减少.
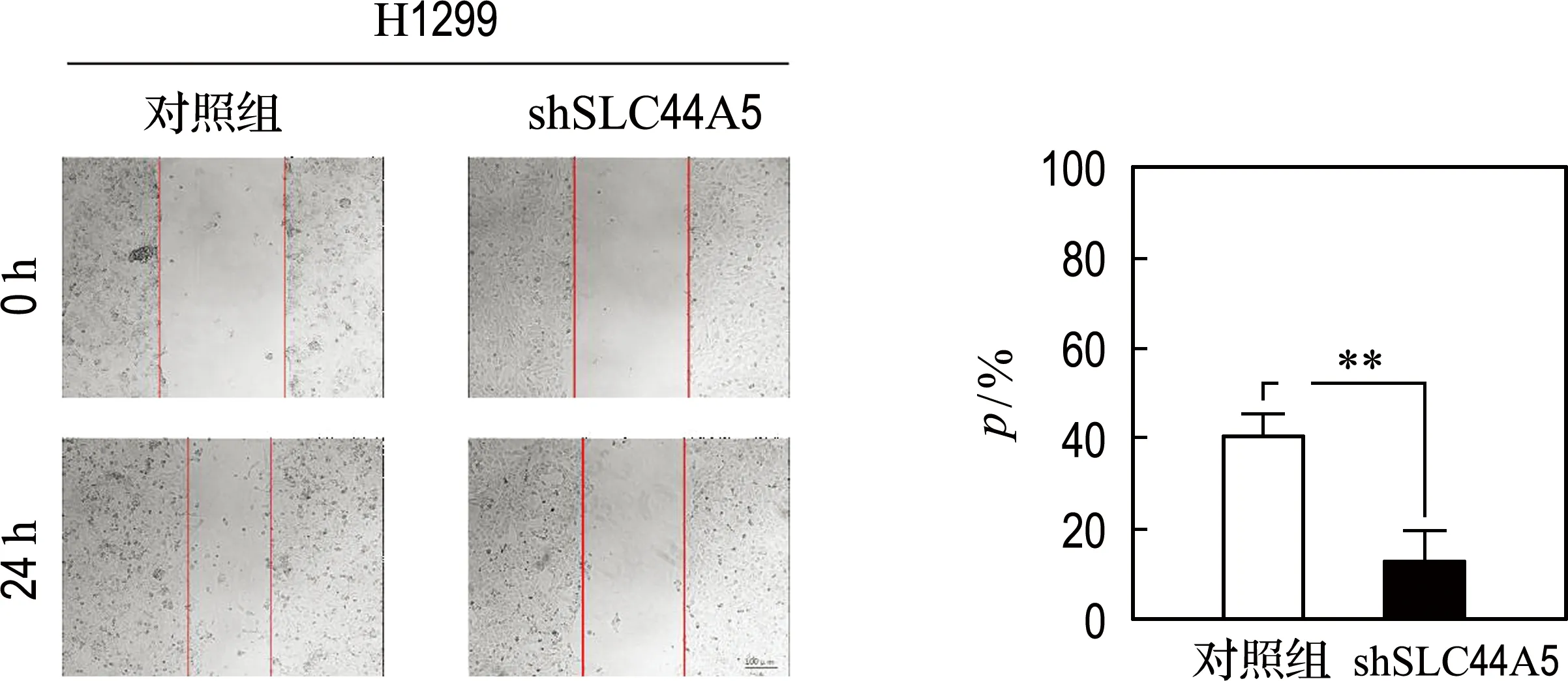
(a) 细胞划痕实验结果(p为伤口愈合面积百分比)
上述两个实验现象都说明了降低SLC44A5的表达可以抑制肺腺癌细胞的迁移.
3 结果讨论
肺癌的发生和发展是一个复杂的过程,涉及细胞生物学过程中多个重要基因的调控.已有的研究表明SLC44A1-5家族的独特胆碱转运体存在于各种人类癌细胞中[15],但胆碱转运蛋白的表达模式因癌细胞类型而异,且SLC44A5敲低的细胞可通过降低细胞中凋亡标志物caspase-3和caspase-9的表达水平而表现出细胞凋亡,并抑制了侵袭,表明SLC44A5可能是癌症治疗的分子靶点[14].基于此,通过SLC44A5低表达细胞系H1299 shSLC44A5、H1792 shSLC44A5进行一系列研究,结果发现降低SLC44A5的表达可抑制肺腺癌细胞的生长和迁移能力.因为SLC44A5在肺部表达量少,如果通过抑制SLC44A5表达的方式影响肺腺癌细胞迁移,对正常肺器官造成的影响较小.因此,针对该靶点设计药物,在保证疗效的情况下副作用较低,有较好的成药性.
4 结 语
本文实验结果初步证明,SLC44A5对肺腺癌细胞的生长和迁移发挥了重要作用,可能成为临床肺腺癌的治疗靶点.当然,SLC44A5在肺腺癌中的作用机制研究仍然处于探索阶段,要想彻底解决肺腺癌的相关临床问题,还需要继续深入探索.
