植物Na+/H+逆向转运蛋白研究进展
2022-11-17李源蔡勤安马瑞于志晶魏嘉
李源蔡勤安马瑞于志晶魏嘉
(1.吉林师范大学生命科学学院,吉林 四平 136000;2.吉林省农业科学院生物技术研究所/吉林省农业生物技术重点实验室,吉林 长春 130033)
土壤盐分是主要的非生物胁迫之一,对全球农业作物生产造成严重威胁[1]。盐驱动的细胞离子失衡和毒性被认为是阻碍植物在高盐条件下生长和发育的主要原因[2]。植物对这种离子或养分失衡的反应主要是通过调节过量离子的内流、外排、以及有毒离子的积累和分区来维持离子稳态[3],在大麦[4]、蚕豆[5]、水稻[6]和大豆[7]中已有报道。在盐碱土壤中,钠(Na+)是一个占主导地位的阳离子[8],通常是由于盐度压力产生毒害作用。Na+/H+逆向转运蛋白位于质膜和液泡上,可以将Na+从细胞质转运到胞外空间或液泡,在维持Na+稳态方面发挥关键作用,其作为Na+转运体得到了广泛关注[9]。有证据表明利用盐生植物中的Na+/H+逆向转运蛋白,通过基因工程方法可以培育耐盐作物[1]。本文对Na+/H+逆向转运蛋白的发现、结构、功能、调控机制以及作物耐盐性应用等内容进行综述。
1 植物Na+/H+逆向转运蛋白的分子生物学研究
1.1 植物Na+/H+逆向转运蛋白基因的发现
Na+/H+逆向转运蛋白根据其在细胞中的定位,通常分为两类,一类是质膜Na+/H+逆向转运蛋白(SOS1),定位于质膜;另一类是液泡膜Na+/H+逆向转运蛋白(NHX1),定位于液泡膜或内体膜。1976年,Ratner等[10]在大麦质膜上首次发现植物Na+/H+逆向转运蛋白。1985年,Blumwald和Poole[11]在甜菜(Beta vulgarisL.)根部发现了第一个植物液泡膜Na+/H+逆向转运蛋白;1999年,AtNHX1作为酵母ScNHX1的同源基因从拟南芥中克隆出来,是第一个被鉴定的植物NHX转运蛋白[12];此外,在植物中首次发现的核内体NHX蛋白是来自番茄的LeNHX2和来自拟南芥的At-NHX5和AtNHX6[13]。2000年,Shi等[14]从拟南芥中克隆得到一个与盐超敏感表型相关的基因AtSOS1,研究发现,AtSOS1与SOD2、NHA1、NhaA和NhaP等位于细菌和真菌质膜上介导Na+外排的Na+/H+逆向转运蛋白基因具有很高的同源性,证明AtSOS1是一种定位于质膜上的Na+/H+逆向转运蛋白。随后在盐生植物盐芥[15]、小花碱茅[16]、冰叶日中花[17]、滨藜[18]、盐爪爪[19]等以及甜 土 植 物 小 麦[20,21]、大 麦[22-24]、水 稻[25,26]、大豆[27,28]、辣椒[29]、菠菜[30]等中鉴定了编码这两类转运蛋白的基因(表1、表2)。

表2 已克隆的部分植物液泡膜Na+/H+逆向转运蛋白基因
1.2 植物Na+/H+逆向转运蛋白的分子特征
植物液泡膜Na+/H+逆向转运蛋白基因含有1410~1767 bp的开放阅读框,植物质膜Na+/H+逆向转运蛋白基因含有3410~3500 bp的开放阅读框。不同物种之间其分子量大小差距较大,如拟南芥中AtNHX1的分子量为47 kDa[54],At-SOS1的分子量为127 kDa,大豆中GmNHXs的分子量范围是50.05~60.79 kDa[55],菊芋HtNHX1分子量高达178.53 kDa[51]。马清等[56]对单、双子叶植物质膜Na+/H+逆向转运蛋白氨基酸序列同源性进行分析发现,单子叶植物之间同源性在80%左右,双子叶植物之间的同源性为65%左右,而单、双子叶植物之间的同源性仅为55%左右,可见不同植物之间质膜Na+/H+逆向转运蛋白存在一定的差异。
生化和动力学分析表明NHXs可能包含9~12个跨膜结构域[57]。通过酵母异源表达分析AtNHX1的拓扑结构(图1),AtNHX1蛋白由9个跨膜片段连接亲水C端区域和3个疏水区域组成,其中第5、6个疏水区域有可能参与Na+或H+结合与转运残基,没有跨膜;第3个疏水区域是一段高度保守的序列,为氨氯吡嗪脒的结合位点[58]。AtNHX1的N-末端位于胞质且高度保守,对于蛋白质的活性十分重要,如果缺失,Na+/H+的转运会降低,而Na+/K+的转运会增加;C-末端位于液泡腔中,且变化较大,可能起到调节蛋白质活性的作用,C-末端的缺失会增加Na+/H+和Na+/K+的转运活性[59]。Shi等[14]根据对AtSOS1疏水性分布的预测,绘制了其结构图(图2),At-SOS1的疏水N-末端和亲水C-末端均位于细胞质一侧,有12个跨膜结构域,与液泡膜Na+/H+逆向转运蛋白不同的是,虽然质膜Na+/H+逆向转运蛋白有一段非常保守的Na+结合区,但是并没有氨氯吡嗪脒的结合位点。C-末端的亲水尾部有多达近700个氨基酸残基,可以与多种逆转运蛋白调节因子结合;另外,在AtSOS1的C-末端亲水尾巴中有一段保守环核苷酸结合区域,环核苷酸在植物响应胁迫信号转导的过程中起着重要的作用,因此AtSOS1的C-末端也可能对蛋白的活性起到调节作用。
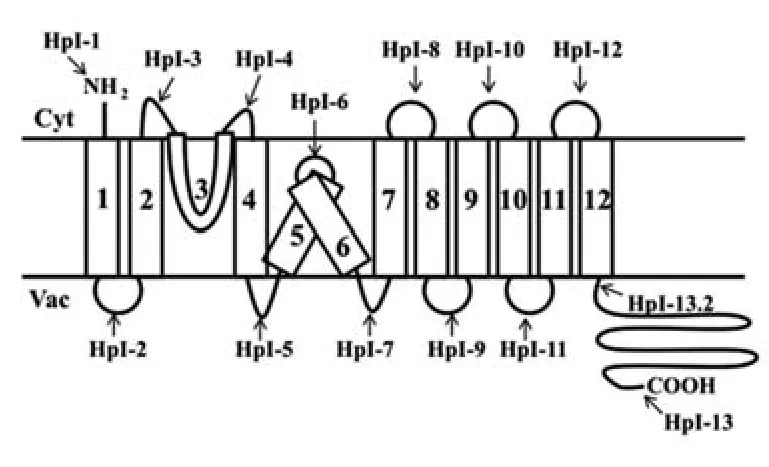
图1 AtNHX1的拓扑模型[59]
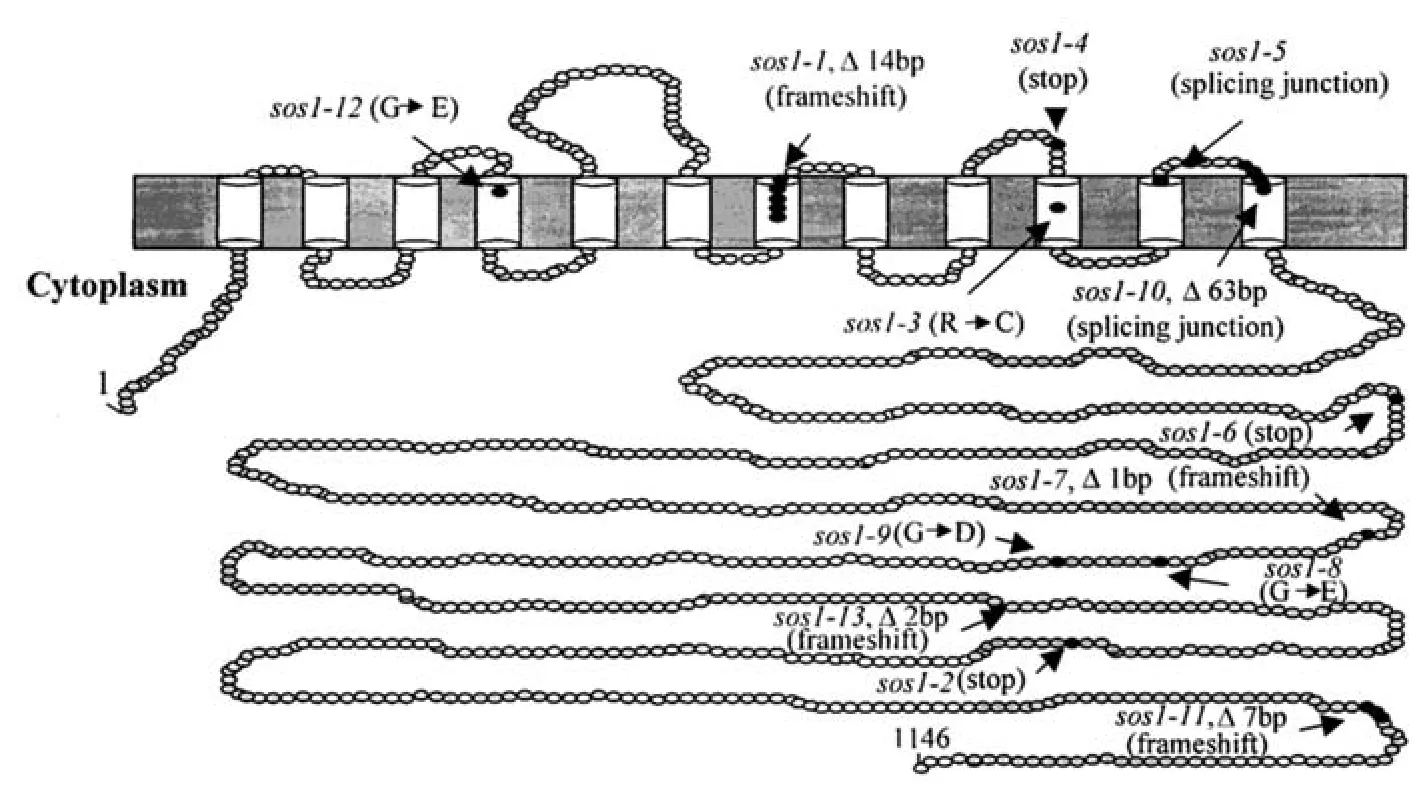
图2 SOS1结构图示[14]
2 Na+/H+逆向转运蛋白的功能
阳离子/质子反转运体(CPAs)介导单价阳离子(主要是Na+和K+)与1~2个质子穿过细胞膜,是主要的离子通道和转运体之一。这些逆向转运蛋白属于两个主要家族,CPA1和CPA2[60]。CPA1家族包括NHX和NHE(钠-质子交换器)两个分支,根据这些转运蛋白的亚细胞定位,CPA1家族主要有两大类具有与植物耐盐性相关的特征明确的逆向转运蛋白,第一组在液泡水平参与Na+和K+的分隔,第二组浆膜结合蛋白介导Na+和K+转运出细胞[61,62]。这两组代表了两种不同的逆境耐受性分子进化路径。NHX和SOS1基因家族经历了净化选择,SOS1基因家族经历了新功能化[63]。本文综述了Na+/H+逆向转运蛋白在Na+运输、K+平衡、pH稳态以及囊泡运输中的关键作用。
2.1 Na+/H+逆向转运蛋白介导Na+的运输
植物Na+/H+逆向转运蛋白依赖于H+-ATPase水解ATP产生的能量,将H+泵入细胞质中,产生跨膜的H+电化学势梯度来驱动Na+的主动运输[64],介导Na+的区隔化或排出,降低胞质中Na+的含量,维持胞质内的离子平衡,保证细胞正常的生理活动。Apse等[65]研究发现,野生型拟南芥中Na+/H+逆向转运蛋白的活性要高于nhx1突变体植株,低于过表达AtNHX1的株系,在番茄[66]、小麦[67]、棉花[68]的AtNHX过表达株系中也有同样的发现,表明液泡膜Na+/H+逆向转运蛋白具有将Na+区隔化的作用,以使植物能在较高的渗透压环境中维持离子稳态平衡,保证植物的正常发育。此外,Wang等[69]在盐地碱蓬中发现,与Na+转运相关的基因SsHKT1,在根部与SsSOS1协同作用,随着NaCl浓度的升高,具有更强的转运Na+到木质部的能力。
2.2 参与K+的稳态平衡
K+在植物细胞的生命活动中发挥着重要的作用,参与植物的氮、脂肪以及蛋白质的代谢及渗透调节,促进光合作用,增强植物的抗逆性等[70]。在对拟南芥NHX1、NHX2的双敲除中,液泡膜囊泡的K+/H+交换显著减少,说明渗透调节受损[71]。酵母中缺少NHX1基因,K+浓度则是正常酵母细胞的三分之一[72],而将番茄LeNHX2转化进NHX1缺失的酵母中后,可以显著提高K+浓度[73]。张桦等[74]将紫花苜蓿MvNHX1导入烟草后,K+含量提升了2~3倍。许杰等[75]将AtNHX1导入烟草后,相较于野生型,其K+吸收速率和ATPase的活性均显著提高,说明液泡膜Na+/H+逆向转运蛋白参与调控K+的稳态平衡。
通常认为质膜Na+/H+逆向转运蛋白是一类Na+特异的转运载体,不具备转运其他阳离子(如K+和Li+)的能力[76]。Ma等[77]发现,在面对盐胁迫时,旱生植物霸王ZxSOS1-RNAi株系与野生型相比较,叶和根中的K+浓度分别下降27%和7%,表明ZxSOS1参与了K+的转运。在甜菜中,BvAKT1、BvHAK5、BvSKOR、BvHKT1;5、BvSOS1和BvNHX1在全株水平协同控制K+和Na+稳态中发挥着重要作用[78]。有研究发现,TaHKT2;1、TaNa+/H+和TaSOS1基因的协同表达调控,提高了抗氧化酶活性、脯氨酸积累的响应和细胞积累K+的能力,增强了面包小麦突变体的耐盐性[79]。
2.3 调节pH值
Yamaguchi等[80]发现在三色牵牛花由紫色的花蕾开放为蓝色花的过程中,液泡内pH值由6.6上升为7.2,同时InNHX1的表达量也明显增加;Yoshida[81]等进一步研究发现,三色牵牛花液泡中pH值变化的同时,花瓣液泡膜的H+-ATPase、H+-PPase和Na+/H+逆向转运蛋白活性也增强,这是由于Na+在区隔化的过程中,借助质子泵将液泡中的H+转运到了胞质中,从而使液泡内的pH值升高。Zhu等[82]发现,水稻OsNHX5蛋白在烟叶表皮细胞中与高尔基体、反式高尔基网络(TGN)和前液泡隔室(PVC)共定位;体内pH值测定表明,gpa6使高尔基体、TGN和聚氯乙烯腔内酸性增强。证明OsNHX5在调节水稻内膜腔内pH值中发挥重要作用,而这对水稻种子贮藏蛋白的转运至关重要。
质膜Na+/H+逆向转运蛋白介导的Na+外排时,会使H+内流入细胞质中,降低细胞质的pH值,但是当质膜Na+/H+逆向转运蛋白的基因发生突变时,细胞质pH值则会显著升高[83],用NaCl胁迫拟南芥sos1突变体后,根部液泡中Na+含量显著增加,而细胞质pH值却显著高于液泡,细胞中与pH值调节相关的基因,如AHAA1、AHA2等的表达量均明显下降[84],说明质膜Na+/H+逆向转运蛋白具有调节细胞pH值的功能,同时也能调控根细胞中与pH值调节相关的基因表达。
2.4 影响植物组织器官的发育
Apse等[65]对拟南芥AtNHX1缺失突变体进行研究发现,其总叶面积减小,表皮细胞数量较少,Na+/H+和K+/H+交换活性降低,再将AtNHX1在该突变体重超表达,可以使植株基本恢复正常。Bassil等[13]已经证明AtNHX5和AtNHX6参与植物的生长发育。Wang等[85]在拟南芥中过表达花花柴KcNHX1不仅增强了拟南芥对盐胁迫的耐受性,在高温下还能增加拟南芥对于生长素的积累,表现出更强的生长能力。综上表明Na+/H+逆向转运蛋白参与植物发育过程。
2.5 参与囊泡的运输
在分析拟南芥nhx1突变株转录组编码基因表达差异时,发现与囊泡运输有关蛋白(如动力蛋白、网格蛋白包被蛋白、网格蛋白结合蛋白等)的编码基因表达水平下降[86];另外,对拟南芥nhx5、nhx6双突株系进行分析发现,突变体中无法顺利完成液泡膜的囊泡运输过程[87]。表明液泡膜Na+/H+逆向转运蛋白参与了囊泡的运输过程。
2.6 参与Ca2+的转运
Guo等[83]用盐胁迫拟南芥sos1突变体时,胞质内Ca2+的浓度降低,Oh等[84]发现,拟南芥sos1突变体中液泡膜上与Ca2+转运相关的基因表达量显著上调,在液泡中积累了大量的Ca2+。表明质膜Na+/H+逆向转运蛋白参与Ca2+的转运。
3 Na+/H+逆向转运蛋白调控机制
3.1 液泡膜Na+/H+逆向转运蛋白调控机制
目前,液泡膜Na+/H+逆向转运蛋白表达调控机制的主要研究对象是拟南芥AtNHX1。Shi等[88]研究发现,植物中的盐胁迫信号通过ABA依赖性和ABA非依赖性途径发生,在ABA诱导条件下,abi1-1、aba2-1和ba3-1突变体中At-NHX1的转录水平并不相同,说明AtNHX1的表达不完全是ABA依赖性调节。进一步研究发现,AtNHX1的活性是在转录水平上调节的,盐胁迫调节的ABA部分依赖性似乎由ABI1而非ABI2途径介导,AtNHX1在叶片中高水平表达,并且在NaCl胁迫下表达显著增加,尤其在有大液泡的较老叶片中,这与Na+转运到液泡的区隔化耐盐机制相一致。Kim等[89]发现水稻OsRab11突变植物有与sos11相似的敏感表型,而过表达OsRab11的植物表现出对高盐胁迫的抗性,在没有盐胁迫条件下检测Na+/H+逆向转运蛋白基因,如At-NHX1、AtNHX2和AtSOS1的表达时,野生型和Os-Rab11突变植株之间没有显著差异,表明OsRab11是液泡膜Na+/H+逆向转运蛋白和质膜Na+/H+逆向转运蛋白的一个调控因子,对于植物耐高盐胁迫起到重要作用。
3.2 质膜Na+/H+逆向转运蛋白调控机制
SOS途径是植物中建立的第一个非生物胁迫信号途径,主要过程为:盐胁迫诱导细胞中产生Ca2+信号,SOS3接收Ca2+信号感应后,激活SOS2并形成具有磷酸化功能的SOS3-SOS2蛋白激酶复合体,使SOS1的C-末端发生磷酸化,从而激活SOS1并将细胞内的Na+外排(图3),高Na+胁迫启动Ca2+信号,激活SOS3-SOS2蛋白激酶复合物,然后刺激SOS1的Na+/H+交换活性,并在转录和转录后调节一些基因的表达[90]。
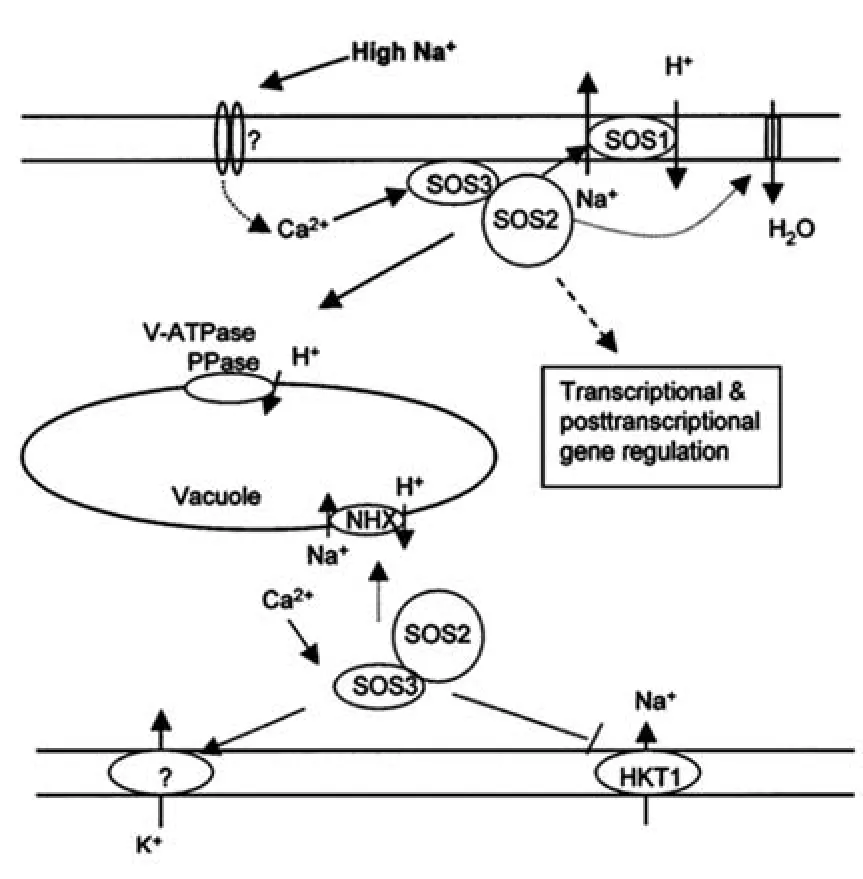
图3 SOS途径的离子稳态[90]
Shen等[91]研究发现磷脂酸特异性结合MKK7和MKK9,磷酸化MPK6,并促进MKK7/MKK9的活化,NaCl处理可以诱导MKK7/MKK9活性的显著增加,磷脂酸或NaCl处理可诱导MKK7/MKK9易位至质膜,证实磷脂酸通过促进Na+/H+逆向转运蛋白SOS1的磷酸化活化MPK6来介导盐胁迫信号传导。Yang等[27]发现,拟南芥在非胁迫条件下,磷脂酰肌醇会结合到质膜H+-ATPase的C-末端,抑制H+-ATPase的活性,发生盐胁迫时,磷脂酰肌醇-4-磷酸会与磷脂酰肌醇结合,同时结合并激活质膜Na+/H+逆向转运蛋白,导致磷脂酰肌醇水平下降,增加了质膜H+-ATPase的活性和盐的耐受性;在pi4kβ1突变体中,磷脂酰肌醇-4-磷酸水平降低,质膜Na+/H+逆向转运蛋白的活性和植株对于盐的耐受性也随之降低。
4 Na+/H+逆向转运蛋白提高植物耐盐性的应用
Na+/H+逆向转运蛋白参与了细胞扩张、pH调节、K+稳态和细胞囊泡运输以及盐胁迫反应[2,65]。由于这些重要作用,质膜(SOS)和液泡膜(NHX)Na+/H+逆向转运蛋白基因作为作物耐盐工程中的候选基因受到广泛关注。
4.1 液泡膜Na+/H+逆向转运蛋白提高植物耐盐性的应用
在拟南芥和小麦中发现的液泡膜Na+/H+逆向转运蛋白基因,是在双子叶植物和单子叶植物中耐盐性改善贡献最大的基因[57]。在棉花中过量表达小麦TaNHX2,提高了转基因棉花的抗旱和耐盐性[92],在向日葵和茄子中过表达TaNHX2基因,均提高了转基因向日葵和茄子对高含量Na+、K+的耐性和生长性能[93,94]。在多种植物如大豆[95]、中林美荷杨[96]、紫花苜蓿[97]等中过量表达TaNHX2,都在一定程度上提高了转基因植株的耐盐能力。Yang等[98]研究结果表明,与野生型相比,过表达AtNHX1和AtNHX3任一基因的转基因杨树均对盐胁迫表现出高抗性,在100 mmol/L NaCl胁迫下积累了更多的Na+和K+,并且在水分胁迫下叶片中的电解质泄漏减少。在其他植物如水稻[99]、大豆[87]、番茄[100]、绿豆[101]等中过表达拟南芥液泡膜Na+/H+逆向转运蛋白基因后,都能一定程度上增强转基因植株对高盐的耐受性,在盐胁迫下,长势显著优于野生型。此外,在玉米中过表达碱蓬SsNHX1,提高了叶片中K+/Na+比值,且种子发芽率显著提高(79%),表明转基因玉米的耐盐性增强[102]。过表达鸢尾属IlNHX的烟草,盐胁迫条件下,组织中维持了较高的K+/Na+比值,同时降低了叶绿素损失和脂质过氧化,从而提高烟草耐盐性[103]。过量表达红树林植物Avicennia的AoNHX1提高了水稻和拟南芥的耐盐性[104]。盐生植物盐爪爪液泡膜Na+/H+逆向转运蛋白KfNHX1通过调节胞间离子的跨膜转运来维持细胞内离子和pH平衡,从而提高转基因拟南芥的耐盐性,具有提高植物耐盐性的潜力[19]。
植物的耐盐性状由多个基因调控,通过共表达相关基因增强转基因植物的耐盐性也是一种理想手段。共表达AtNHX1和SOS1可以使转基因拟南芥耐受高达250 mmol/L的NaCl处理,并且可显著降低热盐复合胁迫造成的产量损失,证实了两个基因叠加过表达可显著提高对多重胁迫耐受性的假设[105]。Maach等[106]通过分析盐胁迫下LeNHX2和SlSOS2共表达对番茄果实产量和品质的影响发现,与野生型相比,转基因植株的产量、pH值和可溶性固体总量(TSS)显著提高,表明,LeNHX2和SlSOS2的共表达提高了盐胁迫下番茄的产量和果实品质。
4.2 质膜Na+/H+逆向转运蛋白提高植物耐盐性的应用
关于质膜Na+/H+逆向转运蛋白在提高植物耐盐性方面的应用报道相对较少,大多是研究其在拟南芥或烟草中的耐盐表现。过表达陆地棉(Gossypium hirsutumL.)GhSOS1降低了转基因植株的MDA含量和Na+/K+比值,从而提高了拟南芥对盐胁迫的耐受性[38]。AtSOS1在烟草中过表达后,盐胁迫条件下,转基因植株体内维持较高的K+/Na+比值,从而提高转基因烟草对盐害的抗性[107]。在烟草中过表达SbSOS1基因,促进了植物的生长,除了Na+外排到质膜外,SbSOS1蛋白还有助于维持不同器官Na+含量的变化,并间接影响其他转运蛋白的活性,进而使烟草具有高耐盐性[108]。此外,Yang等[109]的研究表明,PtSOS2基因在木本植物白杨中过表达,与野生型对比,其能在高盐条件下表现更强的生长特性,是培育耐盐树木的理想候选基因。OsSOS1基因在水稻中过表达,通过对叶绿素含量、细胞膜透性、细胞活力等指标的研究,表明过表达OsSOS1的转基因水稻植株具有较好的耐盐性[110]。
5 展望
土壤盐碱化是制约全球农业发展的一个重要因素,土壤修复虽然能快速改善土壤盐碱化程度,但这种改善并不是永久的,如果缺少对修复后的土壤进行维护与保养,很容易形成二次污染[111],因而研究和培育耐盐碱作物对于盐碱地的利用是一条较为经济、有效的途径。在盐胁迫下,Na+/H+逆向转运蛋白对于维持植物细胞内的稳态有着重要的作用。目前,尽管已经有了一些关于Na+/H+逆向转运蛋白基因研究的相关报道,并且都不同程度提高了作物对于盐胁迫的耐受性,但仍需进一步了解Na+/H+逆向转运蛋白的功能机制和不同产物的相互作用,挖掘更多优良的耐盐基因资源,利用基因工程技术培育出耐盐的转基因新品种,对于增加盐碱地的利用、提高作物整体产量具有重要意义。
