蓝莓果渣多糖提取工艺的响应面优化及其抗氧化活性
2022-11-17杜佳金桂勇陈芝飞郑峰洋罗灿选宋伟民张晓平刘鹏飞席高磊
杜佳,金桂勇,陈芝飞,郑峰洋,罗灿选,宋伟民,张晓平,刘鹏飞,席高磊
(1.河南中烟工业有限责任公司技术中心,河南 郑州 450016;2.河南农业大学烟草学院/河南省香精香料与调香工程技术研究中心,河南 郑州 450002)
植物多糖亦称植物多聚糖,是植物代谢过程中聚合而成的天然高分子聚合物,起到维持植物正常生命活动的功能[1]。大量研究表明植物多糖具有抗氧化[2]、抗肿瘤[3]、抗菌[4]和抗病毒[5]等生理和药理活性,并且无毒无害,是医药、食品和化妆品等领域[6]开发产品的重要原料。目前科研工作者已将人参多糖[7]、黄芪多糖[8]和枸杞多糖[9]等制成注射液或胶囊广泛用于临床治疗和保健品[10]。
蓝莓多糖是指从蓝莓鲜果、叶或果渣等原料中提取出来的植物多糖[11]。已有提取方法包括微波辅助法、超声辅助法、热水浸提法和酶法[12-15]。但这些方法仍存在一定局限性,比如微波辅助法和超声辅助法在提高多糖提取率的同时会改变多糖微观结构,影响多糖活性[16];酶法成本较高,对提取条件较为苛刻[17]。热水浸提法对设备需求较低,操作简单,备受关注。朱金艳等[18]采用热水浸提法对蓝莓果渣中多糖进行提取,并用单因素试验结合正交试验对提取工艺进行了优化,但提取率仍较低,且未系统研究蓝莓多糖的抗氧化活性。因此,进一步优化提取技术,提高提取率,仍是今后实现蓝莓果渣多糖高效利用的重要基础。
本研究以蓝莓果渣为原料,选用热水浸提法提取蓝莓多糖,采用单因素试验和响应面法对提取工艺进行优化,并通过抑制自由基氧化DNA反应和淬灭自由基反应系统研究蓝莓果渣粗多糖和精多糖的抗氧化活性,以期为蓝莓果渣多糖的合理利用提供理论依据。
1 材料与方法
1.1 试验材料及主要仪器与试剂
蓝莓果渣,由河南中烟工业有限责任公司提供。N-1300型旋转蒸发仪、NVP-10006A型循环水真空泵(上海爱郎有限公司),LYOVAC GT2型冷冻干燥机(德国SRK公司),FA2004型分析天平(上海上平仪器有限公司),UV-1800PC紫外-可见分光光度计(上海菁华科学仪器有限公司)。
氯仿、磷酸、无水乙醇:分析纯,天津市科密欧化学试剂有限公司;2-硫代巴比妥酸(TBA):分析纯,国药集团化学试剂有限公司;脱氧核糖核酸钠盐(DNA)、2,2’-偶氮二异丁基脒二盐酸盐(AAPH):标准品,ACROS ORGANICS公司;还原型谷胱甘肽(GSH)、四氯氢醌(TCHQ):分析纯,上海源叶生物科技有限公司;三氯乙酸(TCA)、乙二胺四乙酸二钠(EDTA)、正丁醇、二甲基亚砜(DMSO):分析纯,上海达瑞精细化学品有限公司;2,2’-偶氮-双-(3-乙基苯并噁唑啉-6-磺酸)二铵盐自由基(ABTS·+)、二苯苦味酰肼自由基(DPPH·)、2,6-二叔丁基-(3,5-二叔丁基-4-氧代-2,5-环己二烯)-对-甲苯氧自由基(Galvinoxyl·):标准品,美国Sigma-Aldrich公司。
1.2 试验方法
1.2.1 蓝莓果渣多糖的提取 参考文献[18]的方法:蓝莓果渣经无水乙醇脱脂2 h后,于55°C烘箱干燥72 h,粉碎过60目筛,得蓝莓果渣干粉。称取2.00 g蓝莓果渣干粉,加一定体积蒸馏水,在一定温度下提取一定时间,提取两次,提取液4000 r/min离心10 min,上清液即为蓝莓果渣多糖溶液。
1.2.2 标准曲线绘制及多糖得率测定 配制40 μg/mL的葡萄糖工作液。分别吸取0.2、0.4、0.6、0.8、1.0 mL工作液于10 mL试管,用蒸馏水补至1 mL,分别加1 mL 5%苯酚溶液和3 mL硫酸,摇晃均匀,冷至室温后在波长490 nm处测定吸光度。以葡萄糖质量浓度为横坐标,吸光度为纵坐标,制得标准曲线A=0.0138x+0.2452,R2=0.9990。式中:A为吸光值;x为浓度,μg/mL。取适量蓝莓果渣多糖溶液,按下述公式计算多糖得率:
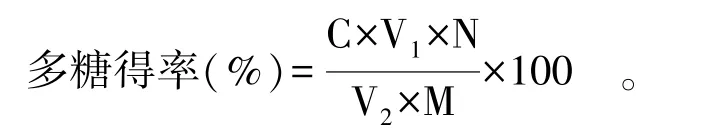
式中:C为稀释后多糖浓度,μg/mL;V1为多糖提取液体积,mL;V2为测试的样品体积,mL;N为稀释倍数;M为蓝莓果渣干粉质量,μg。
1.2.3 单因素试验 称取2.00 g蓝莓果渣干粉,固定提取2次,提取时间5 h,提取温度70℃,考察不同液料比(30、40、50、60、70 mL/g)对蓝莓果渣多糖得率的影响。
称取2.00 g蓝莓果渣干粉,固定提取2次,提取时间5 h,液料比60 mL/g,考察不同提取温度(50、60、70、80、90℃)对蓝莓果渣多糖得率的影响。
称取2.00 g蓝莓果渣干粉,固定提取2次,提取温度70℃,液料比60 mL/g,考察不同提取时间(2、3、4、5、6 h)对蓝莓果渣多糖得率的影响。
1.2.4 响应面试验 在单因素试验基础上,采用Design Expert 8.0.6软件设计响应面优化试验,以蓝莓果渣多糖得率为响应值Y,以液料比(A)、提取温度(B)和提取时间(C)为变量因子,因子编码和水平见表1。

表1 响应面试验设计因子和水平
1.2.5 蓝莓果渣粗多糖的纯化 蓝莓果渣多糖溶液浓缩至原体积1/5,加无水乙醇至乙醇体积分数为75%,4℃冰箱过夜,4000 r/min离心后取沉淀物冻干得蓝莓果渣粗多糖。采用文献[19]的方法对蓝莓果渣粗多糖进行脱蛋白、脱色和透析等操作后得蓝莓果渣精多糖。
1.2.6 抗氧化活性测试 采用文献[20]的方法对蓝莓果渣粗多糖和精多糖进行抑制AAPH、GS·和HO·引发的DNA氧化反应测试。多糖浓度为6 mg/mL。
1.2.7 淬灭自由基性能测试 分别配制1、2、3、4、5、6 mg/mL的多糖溶液,VC为阳性对照。ABTS·+清除试验根据文献[21]的方法进行,DPPH·清除试验根据文献[22]的方法进行,Galvinoxyl·清除试验参考文献[23]的方法稍加修改。
1.3 数据处理与统计分析
试验均设3次平行。用Design-Expert 8.0.6软件进行多糖提取工艺优化,用Origin 2018软件进行数据处理和绘图。显著性检验方法为Duncan’s多重比较,显著水平为5%。
2 结果与分析
2.1 单因素试验结果
2.1.1 液料比对蓝莓果渣多糖得率的影响 增加溶剂能够提高液料间的多糖浓度梯度差,导致液相传质动力变大,有利于多糖的溶出[24]。从图1可知,当液料比从30 mL/g增加到50 mL/g时,蓝莓果渣多糖得率显著增加,在液料比60 mL/g时达到最大值1.93%。但继续提升液料比,蓝莓果渣多糖得率有所降低,这可能是因为溶剂过多时溶出较多杂质,从而影响多糖的溶出[25]。另外,液料比过大会浪费溶剂且不利于回收。因此选择液料比60 mL/g为响应面试验的中心值。
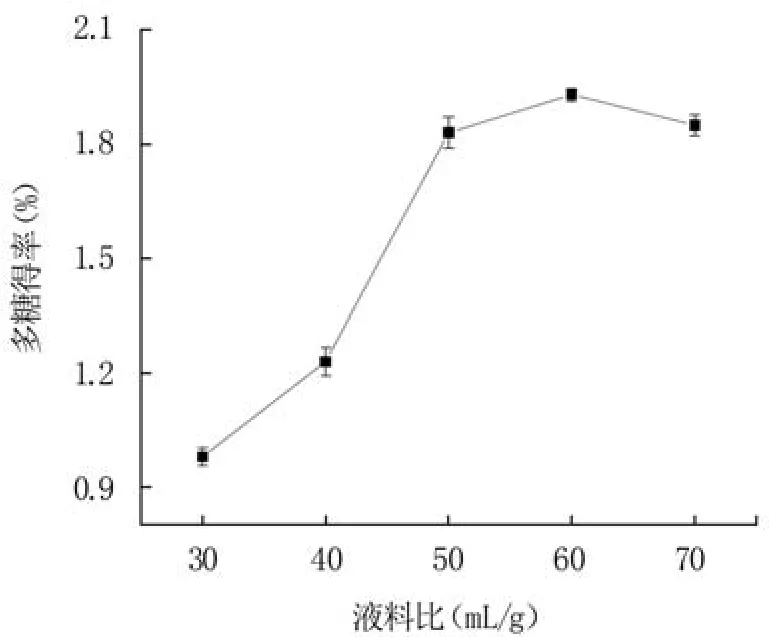
图1 液料比对蓝莓果渣多糖得率的影响
2.1.2 提取温度对蓝莓果渣多糖得率的影响 从图2可知,随提取温度的升高,蓝莓果渣多糖得率先升高后略有降低。升高温度有利于细胞破碎,促使多糖溶出[26]。当提取温度升至80℃时,蓝莓果渣多糖得率达到最大值2.23%,继续升高则有所下降。这可能是因为温度过高导致部分多糖分解,从而降低多糖得率[27]。因此选择80℃作为响应面试验的中心值。
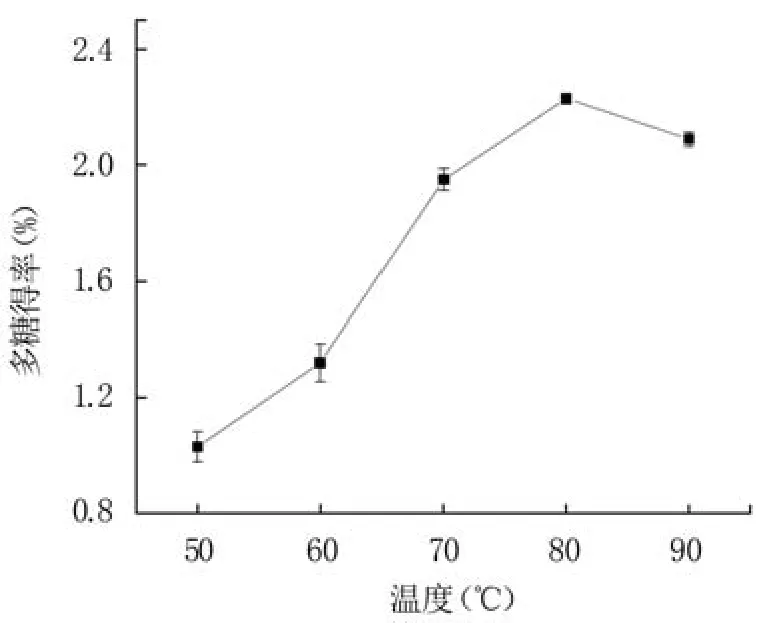
图2 提取温度对蓝莓果渣多糖得率的影响
2.1.3 提取时间对蓝莓果渣多糖得率的影响 从图3可看出,随提取时间的延长,蓝莓果渣多糖得率呈现先迅速上升而后趋于稳定的趋势。提取时间从2 h增加到4 h,蓝莓果渣多糖得率显著增加,提取时间为5 h时达到最大值2.13%,而继续延长提取时间可能导致多糖降解或杂质溶出,影响多糖得率[27]。因此,选择5 h作为响应面试验的中心值。
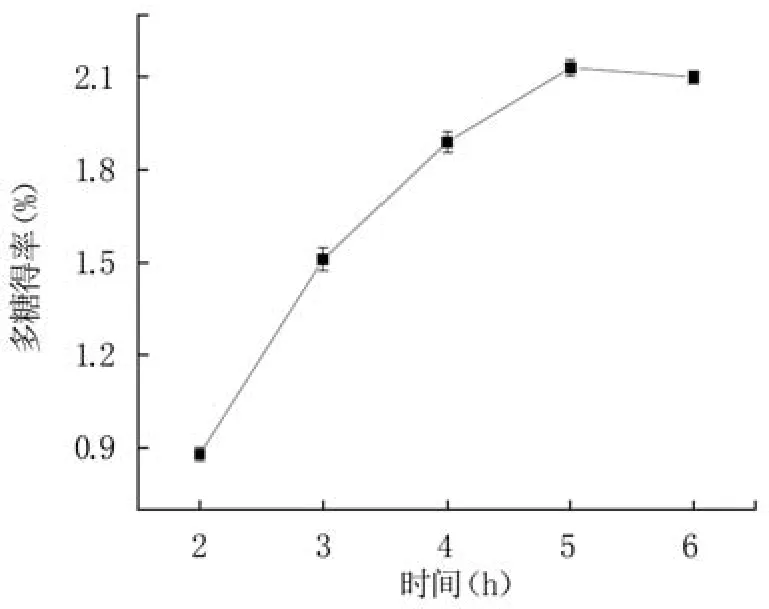
图3 提取时间对蓝莓果渣多糖得率的影响
2.2 响应面试验结果
2.2.1 Box-Behnken试验设计及结果 根据单因素试验结果进行3因素3水平的响应面试验,结果见表2。
通过软件Design-Expert 8.0.6对表2数据进行方差分析,结果见表3。经分析,3因素拟合得到的回归方程为:Y=2.326-0.0125A+0.02375B+0.08125C-0.065AB-0.07AC-0.0725BC-0.18425A2-0.21675B2-0.14175C2。模型P<0.01,表明该模型极显著,试验可靠。模型决定系数R2=0.9135,拟合度较高,表明该模型与实际试验的拟合程度较好,说明上述回归方程可用于蓝莓果渣多糖提取的分析与优化。由F值可知,各因素对蓝莓果渣多糖得率的影响大小顺序为提取时间>提取温度>液料比。
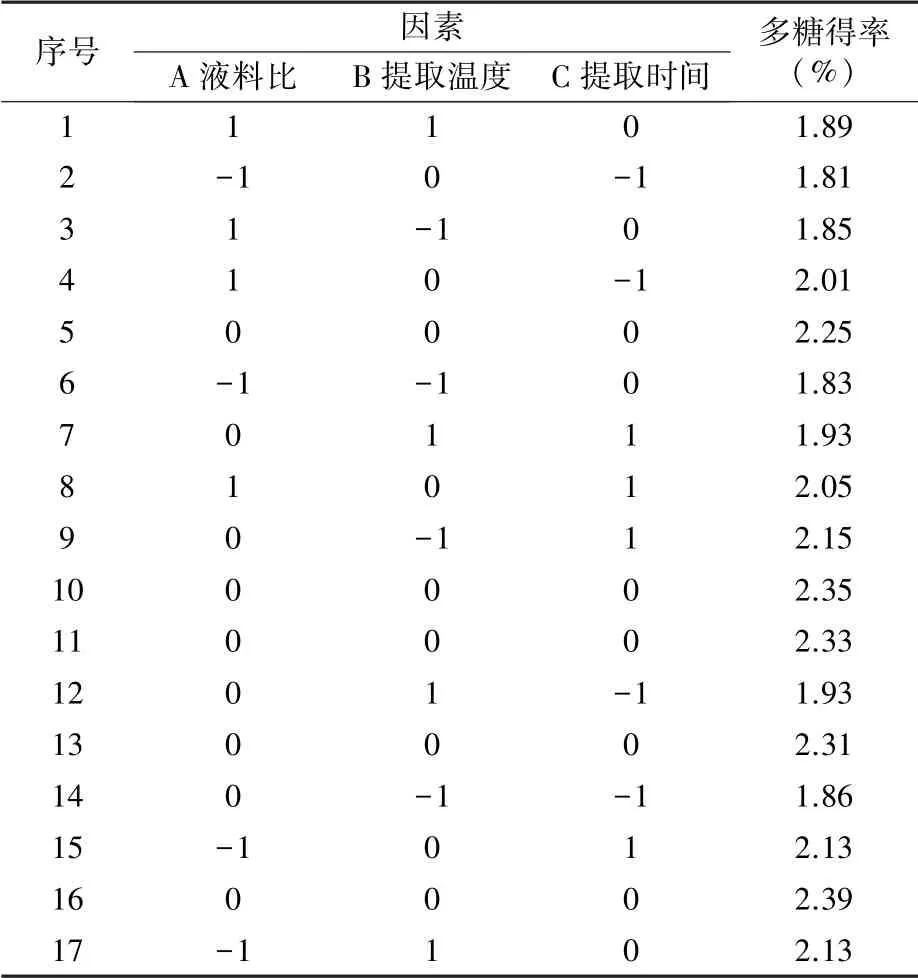
表2 响应面试验设计及结果
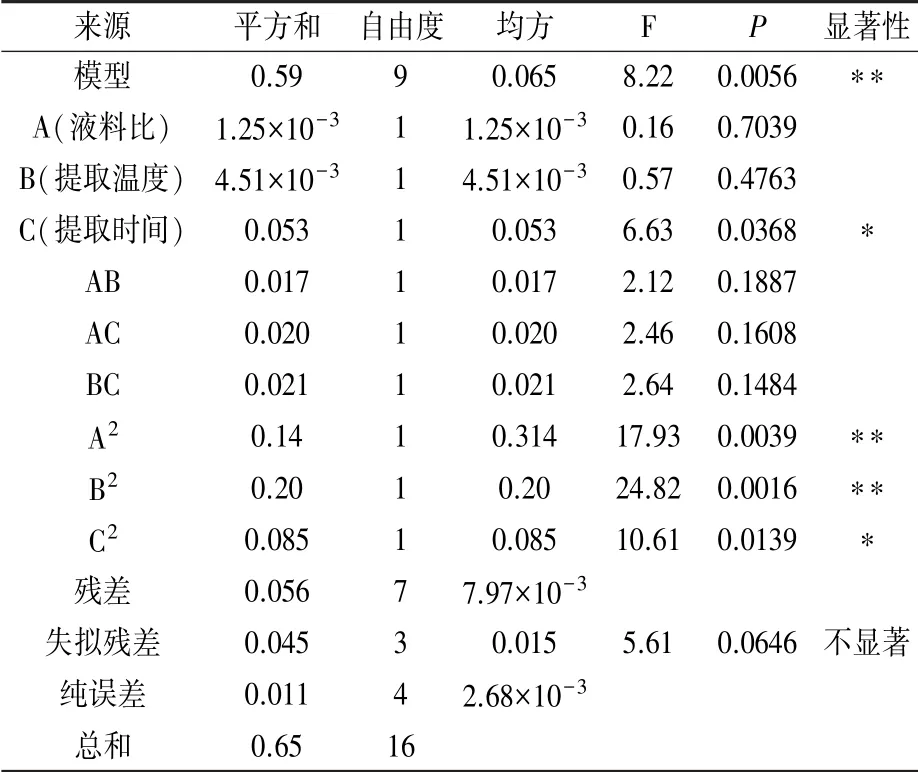
表3 回归系数的显著性分析
2.2.2 因素间交互作用结果 响应面图和等高线图反映了液料比、提取温度和提取时间两两交互作用对响应值的影响。响应面曲面越陡峭、等高线图越接近椭圆,说明两因素间交互作用越强,反之越弱。由图4(A)可知,当提取时间固定时,液料比与提取温度的交互曲面较为陡峭,而等高线近似圆形,表现为不显著;由图4(B)和图4(C)可知,提取温度与提取时间、液料比与提取时间两组交互作用的曲面均较为平缓,等高线均近似圆形,交互作用也并不显著。同时,影响多糖得率最显著的因素是提取时间,表现为其响应面的弧度最大,其次为提取温度和液料比,与表3结果一致。优化得到的最佳提取工艺为:液料比59.04 mL/g、提取温度80.18℃、提取时间5.30 h,在此条件下蓝莓果渣多糖得率为2.34%。
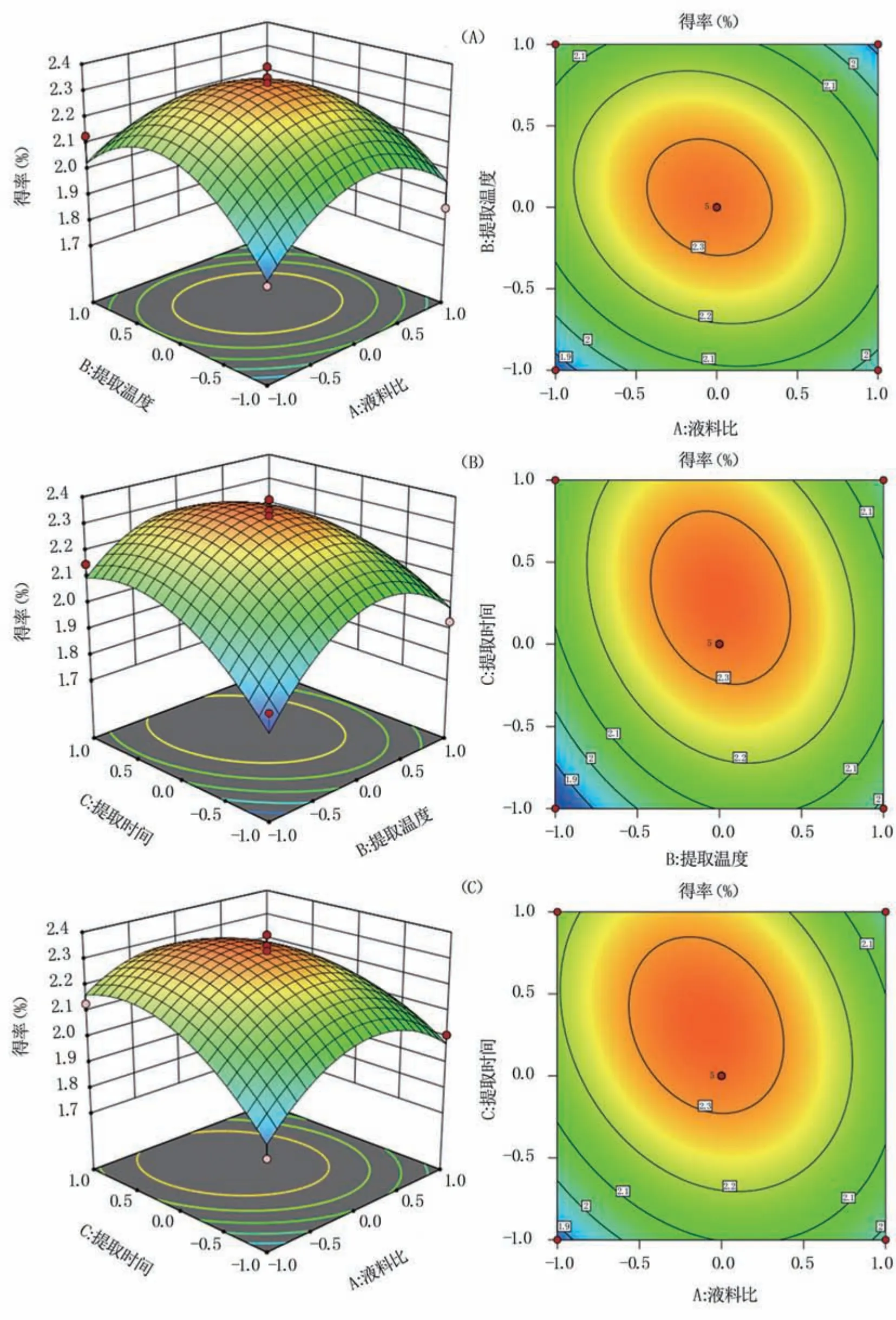
图4 各因素交互作用响应曲面和等高线图
2.2.3 验证试验 根据2.2.2所得结论,选取液料比59 mL/g、提取温度80℃、提取时间5.30 h,进行3组重复试验,所得多糖提取率平均值为2.33%,与2.2.2节所得理论值基本吻合,进一步说明该回归方程能够较真实反映各因素对多糖得率的影响。
2.3 抗氧化活性测试
2.3.1 抑制AAPH氧化DNA结果分析 在AAPH氧化DNA体系中,以加0.1 mL蒸馏水为空白组,加0.1 mL多糖溶液为测试组,测得的TBARS吸光度值分别为A空白和A多糖。空白组TBARS百分数为100%,多糖抗氧化能力可采用相对于空白组吸光度值的百分数(TBARS百分数)进行衡量[28],TBARS百分数计算公式为TBARS百分数(%)=(A多糖/A空白)×100。
如图5所示,蓝莓果渣粗多糖和精多糖的TBARS百分数均低于空白组的100%,说明粗多糖和精多糖均具有抑制AAPH引起DNA氧化的能力。其中,粗多糖的TBARS百分数为90.38%,低于精多糖的94.97%,说明粗多糖的抑制能力较精多糖强。这表明,蓝莓果渣粗多糖经纯化后其抑制AAPH引起DNA氧化的能力降低。
2.3.2 抑制GS·氧化DNA结果分析 参考2.3.1中的方法求得多糖抑制GS·氧化DNA的TBARS百分数。如图5所示,粗多糖和精多糖的TBARS百分数分别为87.48%和91.41%,均小于空白的100%,说明两者均可抑制GS·氧化DNA,且粗多糖的抑制能力更强,强于文献报道的水溶性维生素E(TBARS百分数为88.30%)[29]。这一结果与2.3.1中的结论一致,同样说明纯化过程降低了多糖的抗氧化性能。另外,粗多糖和精多糖抑制GS·氧化DNA的TBARS百分数均低于相应抑制AAPH氧化DNA的体系,说明两者抑制GS·引起DNA氧化的能力更强。
2.3.3 抑制HO·氧化DNA结果分析 参考2.3.1中的方法求得蓝莓果渣多糖TBARS百分数。如图5所示,粗多糖的TBARS百分数为94.36%,小于精多糖的TBARS百分数(97.70%),但均低于空白的100%,表明粗多糖和精多糖均能够抑制HO·氧化DNA,具有抗氧化的性能,粗多糖抗氧化能力大于精多糖。而且两者的TBARS百分数均高于相应抑制AAPH和GS·氧化DNA体系,说明其抑制HO·氧化DNA的能力弱于上述两种体系。
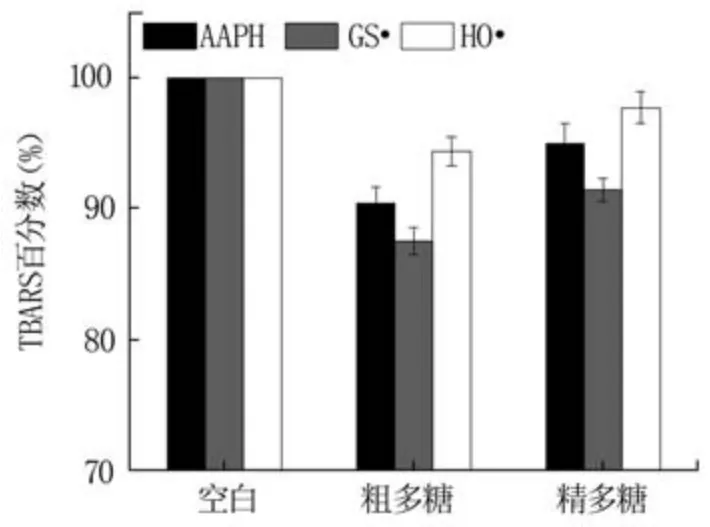
图5 蓝莓果渣多糖抑制AAPH、GS·和HO·引发DNA氧化反应的TBARS百分数
2.4 抑制清除自由基性能
2.4.1 清除ABTS·+性能分析 ABTS被氧化成ABTS·+后其颜色变为蓝绿色,当抗氧化剂与其孤对电子配对后变为无色,因此可通过颜色变化来评估清除ABTS·+能力。由图6可知,粗多糖和精多糖均具有清除ABTS·+的能力,且随着浓度的增加,其清除能力明显增强,表明两者的质量浓度与ABTS·+清除率呈量效关系。在多糖浓度为6 mg/mL时,粗多糖和精多糖的ABTS·+清除率分别为68.85%和54.42%,说明粗多糖的清除能力明显强于精多糖,但与VC相比仍有差距。
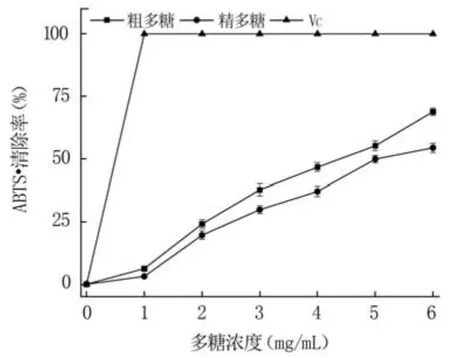
图6 多糖的ABTS·+清除率
2.4.2 清除DPPH·性能分析 由图7可知,粗多糖和精多糖均能够清除DPPH·,且随着多糖浓度的增加,DPPH·清除率逐渐增大,粗多糖的DPPH·清除率始终大于精多糖。在多糖浓度为6 mg/mL时,粗多糖和精多糖的DPPH·清除率分别为23.53%和16.87%,但均明显低于VC,说明纯化过程降低了蓝莓果渣多糖清除DPPH·的能力。
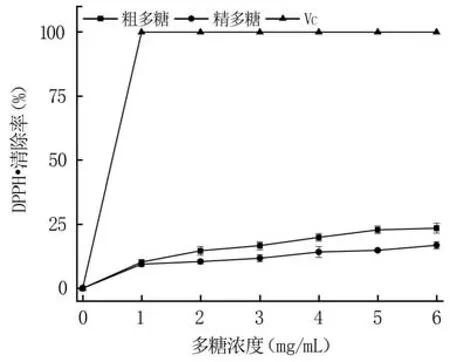
图7 多糖的DPPH·清除率
2.4.3 清除Galvinoxyl·性能分析 Galvinoxyl·是一种C-中心自由基,在乙醇溶液中显淡黄色,最大吸收波长为428 nm。如图8所示,随着多糖浓度的增加,粗多糖和精多糖的Galvinoxyl·清除率增加趋势较弱,在多糖浓度为6 mg/mL时,两者的Galvinoxyl·清除率分别为13.39%和11.58%,粗多糖清除率略高于精多糖,但明显低于VC。
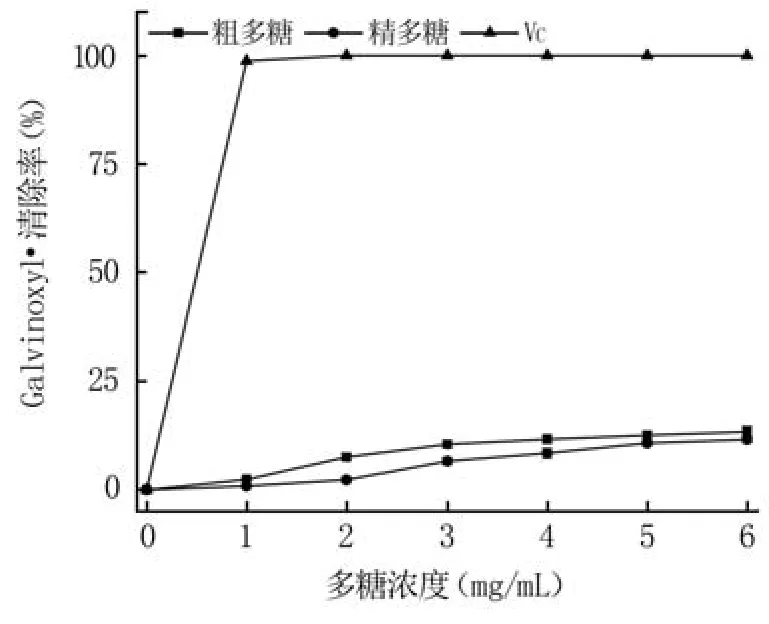
图8 多糖的Galvinoxyl·清除率
3 讨论与结论
3.1 蓝莓果渣多糖提取工艺优化
单因素试验表明提取时间和提取温度都不宜过高,超过阈值会破坏多糖结构导致得率降低,与魏增云等[27]的研究结果一致;随液料比的增大,多糖得率呈先增加后降低的趋势,在液料比为60 mL/g时多糖得率最大。这是因为液料比较小时多糖不能充分溶出,而液料比过大时杂质会逐渐溶出,不仅影响多糖的溶出速率,而且降低了多糖纯度。进一步采用响应面优化试验研究提取温度、时间和液料比对蓝莓果渣多糖得率的影响,结果表明,提取时间对多糖得率的影响最大,提取温度次之,液料比影响最小;各因素之间交互作用并不显著。综上,蓝莓果渣多糖的最佳提取工艺为液料比59 mL/g、提取温度80℃、提取时间5.30 h,在此条件下多糖得率为2.33%。朱金艳等[18]通过正交试验得出蓝莓果渣多糖提取参数为:液料比60 mL/g、温度90℃、时间4 h,蓝莓果渣多糖得率为2.108%。与之相比,本试验的提取温度更低、节省能源且易于控制,多糖得率也有所增加,具有一定的工业应用前景。
3.2 蓝莓果渣多糖抗氧化性能评价
6个抗氧化体系研究结果显示,粗多糖和精多糖均能有效抑制自由基、氧化DNA和清除自由基且粗多糖的抗氧化能力优于精多糖。这与陈琳等[30]的研究结果一致,其原因可能是粗多糖在纯化过程中,某些非糖的抗氧化物质被除去,而这类物质的抗氧化性能远高于多糖。再如,杨燕敏[31]对哈密大枣多糖提取时,发现粗多糖的多酚类物质未完全除去,导致其ABTS·+清除率高于精多糖。龚雯等[32]研究发现,金花茶多糖的结构不同也会影响多糖的抗氧化能力,β-吡喃糖构型的金花茶多糖HO·清除率与VC相似,因此,纯化前后蓝莓果渣多糖抗氧化能力的改变也可能是因为多糖的结构发生了改变。但另有研究表明,粗多糖经纯化后,抗氧化能力增强,这可能是因为粗多糖经纯化后多糖含量提升而导致自由基清除能力增强。综上,多糖的抗氧化能力与多种因素有关,如多糖的纯度、结构、单糖组成等[33,34],而有关蓝莓果渣多糖纯化前后抗氧化性能的构效关系有待进一步研究。
综上,本研究结果可为蓝莓果渣的合理利用提供理论参考,另外有关纯化前后粗多糖和精多糖的结构、单糖组成及其与抗氧化性能之间的关系有待进一步研究。
