DJ-1蛋白在程序性细胞死亡中的作用
2022-11-16王英迪付宇程润刘伟洁缪明星颜天华中国药科大学基础医学与临床药学学院生理教研室南京0009中国药科大学国家药学实验教学示范中心南京0009
王英迪,付宇,程润,刘伟洁,缪明星,颜天华*(.中国药科大学基础医学与临床药学学院生理教研室,南京 0009;.中国药科大学国家药学实验教学示范中心,南京 0009)
迄今为止,已经有至少五种主要的程序性细胞死亡(programmed cell death,PCD)被发现和深入研究,包括凋亡、自噬或自噬性细胞死亡、坏死性凋亡、焦亡和铁死亡。PCD 受基因或信号转导通路的调控,对体内平衡的维持发挥着重要作用,而当PCD 失调时,则会引起神经退行性疾病、癌症和一系列其他疾病,因此针对细胞死亡途径的治疗有着巨大的前景[1]。
1997年,Nagakubo 等[2]发现了一种新的与c-myc 相互作用的蛋白,将其命名为DJ-1 蛋白,之后越来越多的研究表明该蛋白介导多种信号转导通路,参与多种细胞死亡方式,从而影响疾病状态[3-4]。DJ-1 蛋白与自噬之间的关系在许多研究中已经得到了证明,即DJ-1 蛋白对自噬产生正负调节两种相反的作用,这种差异可能是由于DJ-1 蛋白在不同细胞类型中的作用不同所致[4]。DJ-1 蛋白已经被证明通过下游调节因子,如凋亡信号调节激酶1(apoptosis signal-regulating kinase 1,ASK1)、Akt、死亡域相关蛋白Daxx 和P53等,防止由多种凋亡刺激物触发的细胞凋亡[5]。研究发现DJ-1 蛋白还可对焦亡[6]、铁死亡[7]及坏死性凋亡[8]产生影响。总之,DJ-1 蛋白参与PCD 过程(见表1),现就DJ-1 蛋白在PCD 中的作用进行综述,以期为靶向DJ-1 蛋白的药物研发及临床应用提供借鉴。

表1 DJ-1 蛋白在PCD 中的作用Tab 1 Role of DJ-1 protein in PCD
1 DJ-1 蛋白概述
1.1 DJ-1 蛋白结构
DJ-1 蛋白由189 个氨基酸残基组成,分子量在20 kDa 左右,属于ThiJ/PfpI 超家族,主要以同型二聚体形式存在,最初被鉴定为癌基因产物,后来发现DJ-1 蛋白的基因PARK7突变时可导致常染色体隐性早发性帕金森病[3]。编码DJ-1 蛋白的基因——PARK7,在人类1 号染色体1p36.23 处,包含17 个内含子和7 个外显子,在小鼠染色体4E 上发现了基因同源物。当DJ-1 蛋白的基因发生突变时,将会影响DJ-1 蛋白的二聚化、蛋白的稳定性及其他功能,目前已经发现了DJ-1 蛋白的几种突变,包括M26I、A104T、D149A、E163K 和L166P 等[4]。DJ-1 蛋白单体蛋白具有螺旋-折叠-螺旋结构,包含11 个β链(β1~β11)和8 个α-螺旋(αA~αH)。β-折叠位于结构中心,分子的一端是α-螺旋和一个β3-4发夹,另一端是三股反平行β-折叠[3-4]。
1.2 DJ-1 蛋白功能
DJ-1 蛋白作为一种高度保守且广泛表达的蛋白质,在人体胰腺、肾脏、肝脏、睾丸和心脏等器官组织中存在[3],具有多种功能,参与多种生物学过程,如调节线粒体功能、参与氧化还原平衡、调节凋亡和自噬等。就其分子功能而言,DJ-1蛋白可介导PI3K/Akt、ASK1、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、核因子E2 相关因子2(nuclear factor E2 related factor 2,Nrf2)、P53 等信号通路,在细胞存活、抗氧化防御和细胞应激反应中起重要作用[5]。
1.2.1 氧化还原调节 在氧化应激状态下,DJ-1蛋白作为一种抗氧化剂,在对氧化最为敏感的106 位半胱氨酸(Cysteine 106,Cys106)残基处发生氧化。Cys106 可在轻度氧化应激下从还原形式(Cys106-SH)氧化为亚硫酸(Cys106-SO2H),并可在更强烈的氧化条件下进一步氧化为磺酸(Cys106-SO3H),使DJ-1 蛋白的等电点从6.2 变化至5.8[9]。既往研究认为,线粒体参与许多关键的细胞调控过程,如活性氧(reactive oxygen species,ROS)生成,因此,确保线粒体功能正常对维持氧化还原平衡至关重要。在生理条件下,DJ-1 蛋白主要存在于细胞质中,在细胞核和线粒体中仅少量存在,然而在氧化应激时,DJ-1 蛋白可易位到线粒体的不同部位,对调节线粒体稳态和功能及对细胞的存活起重要作用[3-4]。此外,DJ-1 蛋白可以抑制Nrf2(抗氧化转录调控因子)与其抑制剂Kelch 样ECH 关联蛋白1(Kelch-like ECH-associated protein 1,Keap1)的相互作用,从而抑制Nrf2 的降解,导致Ⅱ期解毒酶和抗氧化酶的上调[9]。在缺氧条件下,DJ-1 蛋白还可以稳定缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)并增加其转录活性,从而增加细胞对缺氧应激的抗性[10]。
1.2.2 MAPK 通路 MAPK 信号通路是调节细胞增殖、分化、凋亡等胞内信号传导的重要通路,通过高度保守的三级激酶级联传递信号,包括MAPK 激酶的激酶(MAPKKK)、MAPK 激酶(MAPKK)和MAPK[5]。MAPK 主要包括3 个亚族:ERK、JNK 和P38MAPK。DJ-1 蛋白可直接与c-Raf 结合激活MEK 和ERK1/2;也可作用于ERK的上游或直接与ERK 结合激活ERK1/2;还可作用于P53,抑制DUSP1(一种丝裂原活化蛋白激酶磷酸酶,介导MAPK 去磷酸化)的表达,从而激活ERK1/2[11]。ASK1 是MAPKKK,其下游是MAPKK,可以激活JNK 和P38MAPK,在应激诱导的细胞凋亡中起关键作用。DJ-1 蛋白可通过与ASK1 直接结合、增加ASK1 抑制剂Trx1 的表达或在细胞核中与Daxx 相互作用,阻止Daxx 向细胞质转运来抑制ASK1 活化并减少细胞死亡[11]。
1.2.3 PI3K/Akt DJ-1 蛋白通过与10 号染色体上缺失的磷酸酶和张力蛋白同源物(phosphatase and tensin homolog deleted on chromosome ten,PTEN)结合并抑制其磷酸酶活性来抑制PTEN的功能,使得PI3K 和Akt 磷酸化激活,有利于细胞存活[9]。DJ-1 蛋白还可在S/G2 核自身抗原(SG2NA)的作用下,与Akt 相互作用形成复合物,促进Akt 信号传导活性。P53、DJ-1 蛋白和Akt 之间可能存在复杂的相互调节。P53 能够抑制DJ-1 蛋白的表达和活化,而DJ-1 蛋白能与P53 结合或通过PI3K/Akt 途径抑制P53 活性;P53 通过增加靶基因如IGF-BP3或PTEN的转录来负调节PI3K/Akt 途径,而Akt 激活E3 泛素连接酶MDM2,诱导P53 降解[5]。此外,DJ-1 蛋白还可通过PI3K/Akt 信号通路调节其下游凋亡抑制因子survivin 的表达,从而抑制细胞凋亡,促进细胞增殖[12]。
1.2.4 P53 P53 调节细胞周期停滞,诱导细胞凋亡。DJ-1 蛋白通过与P53 的DNA 结合区结合来抑制P53 转录活性;DJ-1 蛋白还可以直接与沉默信息调节因子1(silent information regulator 1,Sirt1)结合并激活Sirt1 的去乙酰酶活性,随后,Sirt1 作用于P53 并抑制P53 的转录。此外,DJ-1蛋白还可与Topors/P53BP3 结合,从而释放P53的泛素化形式,促进P53 的转录[13]。
2 DJ-1 蛋白与PCD
2.1 DJ-1 蛋白与自噬
自噬是将细胞组分或整个细胞器送入到溶酶体中以降解的过程,是应对细胞应激时的自我保护现象。迄今为止,已经鉴定了三种不同形式的自噬——大自噬、小自噬和分子伴侣介导的自噬(chaperone-mediated autophagy,CMA)[14]。
2.1.1 DJ-1 蛋白正调节自噬 DJ-1 蛋白通过促进自噬对神经细胞产生保护作用,并因此改善疾病状态。α-syn 的沉积是帕金森病(Parkinson’s disease,PD)的典型病理学特征,且α-syn 主要通过CMA 途径降解,因此,CMA 的损伤与PD的发病机制密切相关。研究表明,使用shRNA敲除溶酶体相关膜蛋白2A(lysosomeassociated membrane protein 2A,LAMP2A) 可使DJ-1 蛋白表达下调,使神经元细胞对氧化应激的刺激敏感,影响神经元稳态;然而DJ-1 蛋白表达的下调也可加速LAMP2A 的降解,抑制CMA 途径,增加α-syn 的积累[15-16]。DJ-1 蛋白敲除还使自噬受体蛋白P62 和细胞自噬蛋白LC3 的自噬依赖性降解受损,不仅导致α-syn 积聚,还更容易对α-syn产生促炎反应,使炎症因子IL-6 和IL-1β的分泌增加,产生神经毒性,加重PD[17]。此外,DJ-1蛋白还可通过ERK 途径,增加自噬水平,保护小鼠中脑多巴胺能神经元细胞(MN9D)免受鱼藤酮的侵害,保护神经元[18]。总之,这些研究证明了DJ-1 蛋白在自噬反应中的重要性,为PD 治疗策略的发展提供了新的视角。
DJ-1 蛋白上调自噬还可在其他疾病中发挥保护作用。如Chen 等[19]研究表明,DJ-1 蛋白的过表达通过p-VHL 上调IKKβ的表达p-Tau,逆转了Aβ1-42抑制的自噬和下调了Aβ1-42诱导的P-Tau 蛋白表达,改善了阿尔茨海默病(Alzheimer disease,AD)。DJ-1 蛋白还可通过AMPK/mTOR 信号通路上调自噬,发挥糖尿病大鼠缺血后处理诱导的心脏保护作用[20]。而DJ-1 蛋白敲除导致的自噬受损,可恶化心肌肥厚[21]。
2.1.2 DJ-1 蛋白负调节自噬 自噬水平的降低与肿瘤密切相关,许多癌基因产物抑制自噬,如DJ-1 蛋白就可抑制自噬。DJ-1 蛋白过表达通过介导JNK/Bcl2/Beclin1 信号通路,抑制JNK 的磷酸化和Bcl2 的表达,抑制Beclin1 和Bcl2 的解离,从而抑制自噬过程,促进肿瘤细胞增殖,而沉默DJ-1 蛋白的效果则完全相反[22]。自噬还可以增强某些肿瘤细胞在化疗期间获得的抵抗力,从而限制抗肿瘤药物的疗效,产生化疗耐药性。Zhou 等[23]研究表明抗肿瘤药物环吡洛胺(ciclopirox olamine,CPX)可下调DJ-1 蛋白,激活AMPK 通路和抑制mTOR,诱导结直肠癌细胞(colorectal cancer,CRC)发生自噬,发挥细胞保护作用,促进细胞存活。因此,靶向DJ-1 蛋白为肿瘤发生和耐药性的研究提供了新的方向。此外,DJ-1 蛋白过表达还可通过PTEN/PI3K/Akt 促生存途径通路来抑制自噬,减少细胞死亡,降低C2-神经酰胺诱导的神经毒性[24]。也可降低DJ-1 蛋白,增强自噬,改善肝缺血再灌注损伤[25]。
2.2 DJ-1 蛋白与凋亡
细胞凋亡是一个依赖半胱氨酸蛋白酶(caspase)高度调控的细胞死亡过程,不会引起炎症反应,有内源性和外源性两种途径[1]。细胞凋亡的失衡可导致许多疾病,如凋亡过激会导致神经退行性疾病,而凋亡功能失活会导致肿瘤不受控制的增殖和耐药。因此,了解凋亡机制对于开发有效的化学治疗剂非常重要。
2.2.1 DJ-1 蛋白/PI3K/Akt DJ-1 蛋白过表达可能通过PI3K/Akt/mTOR 信号通路改善线粒体功能,降低ROS 的产生,降低促凋亡蛋白p-P53 和活化的caspase-3 的表达,保护视网膜周细胞免受高糖诱导的凋亡[26]。DJ-1 蛋白还可调节HIF-1α的表达促进CRC 细胞在缺氧条件下存活,而当DJ-1 蛋白敲除后,细胞凋亡率明显增加[10]。DJ-1蛋白的下调可降低肿瘤细胞中K-RAS、H-RAS和N-RAS 的表达,其下游通路ERK1/2 和Akt的磷酸化均下降,且用厄洛替尼处理后,Akt 和ERK1/2 的磷酸化进一步降低,细胞凋亡增加[27]。此外,miR142 还可与DJ-1 蛋白结合,抑制DJ-1蛋白的表达,使抗凋亡蛋白survivin 的表达降低,从而增加胰腺癌细胞的凋亡,降低对化疗药的耐药性[12]。表明DJ-1 蛋白可通过抑制凋亡来促进肿瘤细胞存活及增强化疗耐药,因此靶向DJ-1 蛋白可能为肿瘤的治疗提供新的思路。
2.2.2 DJ-1 蛋白/P53 DJ-1 蛋白可通过与P53直接作用来抑制P53 的转录活性,降低促凋亡蛋白Bax 的表达,抑制caspase 的活化,从而抑制细胞凋亡,发挥细胞保护作用。而DJ-1 蛋白的敲除则上调了Bax 蛋白表达并加速了紫外线照射诱导的细胞死亡[28]。DJ-1 蛋白还可维持结肠炎上皮屏障的稳态,Zhang 等[29]研究表明炎症性肠病患者和急性结肠炎小鼠模型的肠道DJ-1 蛋白表达降低,导致P53 和P21 的表达增加,肠上皮细胞凋亡增加,从而导致肠上皮屏障的破坏,加重炎症性肠病。因此,DJ-1 蛋白表达的调节可能是炎症性肠病的潜在治疗策略。此外,有研究表明白藜芦醇可通过DJ-1 蛋白/Sirt1/P53 通路,减少缺氧/复氧诱导的H9c2 细胞的凋亡,增强细胞活力,产生心脏保护作用,而DJ-1 蛋白敲除则抵消了白藜芦醇的抗凋亡和心脏保护作用[30]。
2.2.3 DJ-1 蛋白/ASK1 DJ-1 蛋白是P38 调节活化蛋白激酶(P38 regulated/activated protein kinase,PRAK)的下游相互作用靶点,在氧化应激反应中,PRAK 可能通过促进DJ-1 蛋白和细胞核Daxx相互作用,阻止Daxx 的易位,从而发挥细胞保护作用,抑制细胞死亡[31]。DJ-1 蛋白过表达转染的细胞,在H2O2诱导情况下,与未转染的细胞相比,DJ-1 蛋白的过度表达抑制了ASK1 及P38 MAPK 的激活。Gao 等[32]研究同样表明DJ-1 蛋白通过Akt 磷酸化抑制P38MAPK 的激活,对ROS诱导的细胞凋亡具有预防作用,并起到神经保护的作用。
2.2.4 其他 在人子宫内膜癌细胞中发现,DJ-1蛋白可与Cezanne 相互作用并负调节Cezanne,激活非经典NF-κB 通路,抑制细胞凋亡并促进其增殖[33]。DJ-1 蛋白与pro-caspase-8 竞争结合Fas 相关死亡域蛋白(Fas-associated protein death domain,FADD)的DED 结构域,通过阻断FADD 和pro-caspase-8 之间的相互作用来调节肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)诱导的细胞凋亡[34],对TRAIL 诱导的细胞死亡具有抗性。DJ-1 蛋白上调还可激活Nrf2 通路,抑制氧化应激,保护SH-SY5Y 细胞免受利多卡因诱导的凋亡,发挥神经保护作用[35];诱导Nrf2 依赖的P-糖蛋白(P-glycoprotein,P-gp)和Bcl-2 的表达,促进药物主动外排,增强细胞的抗凋亡能力[36]。
综上,DJ-1 蛋白可通过不同的信号通路抑制细胞凋亡发挥细胞保护作用或增加肿瘤细胞的增殖及耐药,因此,靶向DJ-1 蛋白为不同疾病治疗药物的研究提供了方向。
2.3 DJ-1 蛋白与其他PCD
2.3.1 DJ-1 蛋白与焦亡 与凋亡不同,焦亡是促炎性的PCD,且依赖的是caspase-1(经典途径)和caspase-4/5/11(非经典途径)。Ji 等[37]研究表明DJ-1 蛋白敲除显著抑制Nrf2 的表达,同时促进NLRP3 的表达,增加炎症反应,加重PD 症状。而脑内DJ-1 蛋白的过表达可降低氧化应激,降低caspase-1、IL-1β和IL-18 的水平,同时减少转基因小鼠的神经元死亡和Aβ沉积,并改善认知功能,但不影响caspase-3 的表达,表明DJ-1蛋白对AD 的保护作用可能与抑制焦亡有关[6]。
2.3.2 DJ-1 蛋白与铁死亡 铁死亡是一种铁依赖性的脂质过氧化物水平积累所致的新的细胞死亡形式。DJ-1 蛋白 C 末端最后3 个氨基酸(DJ-1 蛋白ΔC3)对其同型二聚化非常重要,当DJ-1 蛋白ΔC3 缺失时,对由erastin(一种铁死亡诱导剂)诱导的脂质ROS 的积累几乎没有影响,对铁死亡的抑制作用消除[38]。DJ-1 蛋白还被证明通过抑制S-腺苷-同型半胱氨酸水解酶(SAHH,在转硫途径中催化S-腺苷-同型半胱氨酸水解为同型半胱氨酸和腺苷酸)和S-腺苷同型半胱氨酸水样蛋白1(AHCYL1,负调节SAHH)的相互作用,恢复SAHH 的四聚体结构和SAHH 活性,维持转硫途径中合成的半胱氨酸水平来降低脂质ROS,从而抑制erastin 诱导的铁死亡[39]。值得注意的是,DJ-1 蛋白低表达显著增强了体内外肿瘤细胞对铁死亡诱导剂的敏感性,表明DJ-1 蛋白可作为肿瘤治疗的潜在靶标,且靶向DJ-1 蛋白二聚化的抑制剂可作为肿瘤治疗的新药物。此外,DJ-1 蛋白通过调节Nrf2/GPX4 信号通路抑制铁死亡,在子痫前期的发病机制中发挥保护作用[7]。
2.3.3 DJ-1 蛋白与坏死性凋亡 坏死性凋亡是一种不依赖于caspase 酶的促炎性细胞死亡。使用DJ-1 蛋白 siRNA 转染骨髓瘤细胞后,测量caspase-3 活性,作为凋亡的指标,但是未观察到caspase-3 活性的显著增加,而用50 μmol·L-1necrostatin-1(坏死性凋亡抑制剂)处理后,显著降低了DJ-1 蛋白 siRNA 转染引起的细胞死亡[8],表明DJ-1 蛋白是通过抑制坏死性凋亡来发挥抗肿瘤作用的。
3 治疗药物
DJ-1 蛋白是一种多功能蛋白,参与调节多种信号转导通路,并对不同形式的PCD 产生影响,从而影响多种疾病状态。目前,已有许多靶向DJ-1 蛋白的药物处于临床试验中,包括中药和小分子化合物(见表2)。
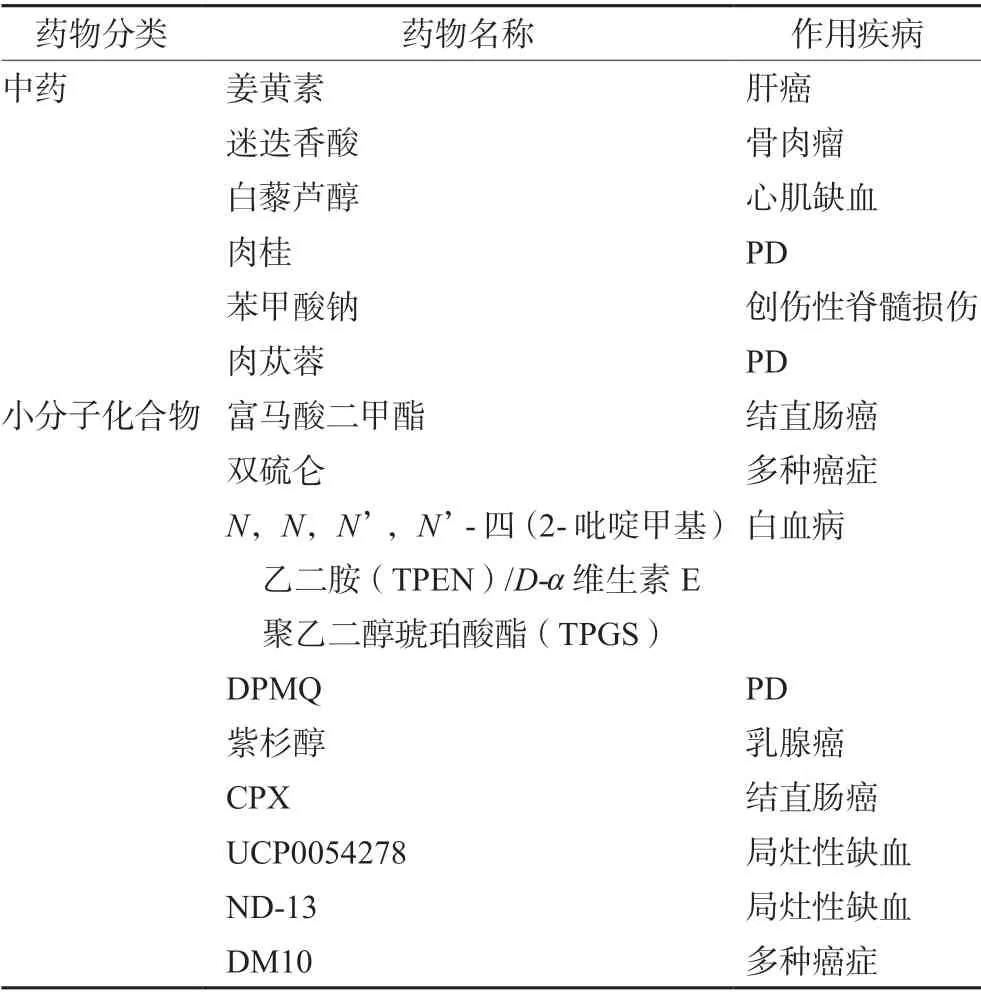
表2 靶向DJ-1 蛋白的治疗药物Tab 2 Therapeutic drugs targeting DJ-1 protein
姜黄素和迷迭香酸是酚类化合物,可靶向抑制DJ-1 蛋白的表达,通过外源性和内源性两种途径诱导细胞凋亡,还可抑制肿瘤细胞的迁移和侵袭,发挥抗肿瘤作用[40-41]。白藜芦醇可上调DJ-1蛋白的表达,并促进DJ-1 蛋白与Sirt1 的相互作用,恢复Sirt1 活性和降低P53 的乙酰化水平,抑制细胞凋亡,对心脏起到保护作用[30]。肉桂可在体内代谢成苯甲酸钠(natrium benzoate,NaB),并且能够进入中枢神经系统,通过上调DJ-1 蛋白,在MPTP 诱导的PD 小鼠模型中发挥神经保护作用,改善运动功能,并减少多巴胺能神经元的死亡,同时使PD 小鼠模型的黑质和纹状体中的多巴胺水平正常化,且研究过程中小鼠没有表现出任何药物相关的不良反应[42]。此外,NaB 还能减轻大鼠创伤性脊髓损伤中ROS 诱导的神经细胞凋亡[32]。肉苁蓉提取物可改善突变型DJ-1 蛋白转染的SH-SY5Y 细胞中过氧化氢诱导的神经毒性,为PD 的治疗提供可能[43]。
富马酸二甲酯(dimethyl fumarate,DMF,商品名Tecfidera),用于治疗复发型多发性硬化症和银屑病,最近在临床试验用于治疗淋巴瘤和白血病[44]。DJ-1 蛋白可能是DMF 的直接靶标,高浓度的DMF 降低DJ-1 蛋白的表达,引起氧化应激,发挥抗肿瘤作用[45]。FDA 批准的一种戒酒药物双硫仑(disulfiram,DSF)可以与DJ-1 蛋白-Cys 残基的巯基共价结合,显著抑制DJ-1 蛋白的功能,增强不同类型肿瘤细胞中N-(4-羟基苯基)维生素甲酰胺[N-(4-hydroxyphenyl)retinamide,4-HPR]诱导的凋亡,从而发挥抗肿瘤作用,为肿瘤的协同治疗提供选择[46]。TPEN和TPGS 的联合治疗可以显著诱导DJ-1 蛋白-Cys106 残基处的氧化,增加细胞内氧化应激,从而诱导白血病细胞的凋亡,为不同类型的白血病患者开发更有效的治疗策略[47]。DPMQ [2-(4(二甲基氨基)苯基亚氨基)甲基)喹啉-8-醇]以Cu2+依赖性方式稳定DJ-1 蛋白,增加Nrf2 的核转位和SOD1 的表达,抑制鱼藤酮或过氧化氢处理后的氧化应激并改善线粒体功能,降低神经元细胞的凋亡[48]。紫杉醇和褪黑素联合使用显著降低DJ-1 蛋白,减少乳腺癌细胞的迁移和侵袭,且优于使用单一药物[49]。环吡酮胺(ciclopirox,CPX)是一种合成的抗真菌药物,能剂量依赖性地降低DJ-1 蛋白的表达,从而诱导细胞内ROS积累,促进细胞凋亡,发挥抗肿瘤作用[23]。
通过计算机虚拟筛选技术,Yanagida 等[50]发现了一个可以和DJ-1 蛋白相互作用的小分子化合物UCP0054278,可显著地抑制ROS 的产生,抑制神经细胞的死亡并改善局灶性缺血损伤。Molcho 等[51]基于DJ-1 蛋白的结构,设计了一种命名为ND-13 的肽,并用ND-13 处理内皮素-1 诱导的局灶性缺血小鼠模型,发现参与调节线粒体功能的几种蛋白质的表达改变,使线粒体功能恢复,显著改善小鼠局灶性缺血后的运动功能。同时,有学者基于DJ-1 蛋白的同源二聚体结构,设计合成了一系列双靛红衍生物,如DM2、DM4、DM6、DM8、DM10 和DM12,其 中DM10 对DJ-1 蛋白同源二聚体抑制作用最显著,还可以显著增强4-HPR 诱导的细胞凋亡和erastin 诱导的铁死亡,为抗肿瘤药物的协同治疗提供了可能[52]。
4 小结与展望
细胞不适当的死亡可导致许多疾病的产生,目前已经研究了多种疾病状态下细胞的不同死亡方式及死亡机制。DJ-1 蛋白对自噬和凋亡的调节,可对神经退行性疾病及癌症产生重要影响,DJ-1蛋白还可调节其他死亡方式,但目前相关的研究比较少,还需要进一步研究。已经有许多靶向DJ-1 蛋白的药物被研究,尤其是中药,其不良反应少,具有很大的临床价值。此外,体外DJ-1 蛋白 siRNA 的研究为其辅助治疗选择的潜在应用奠定了基础。总之,DJ-1 蛋白可调控细胞内相关因子的表达,改变细胞的存活状态,对疾病的研究及靶向治疗药物的开发和临床应用具有重要意义。
