缺氧诱导因子-1α、Notch1和Jagged1共转染对急性心肌梗死模型大鼠心功能的改善作用
2022-11-11李雪梅南武娟
李雪梅,南武娟
(1.榆林市第一医院心血管内科,陕西 榆林 719000;2.咸阳市第一人民医院急诊医学科,陕西 咸阳 712000)
急性心肌梗死(Acute myocardial infarction,AMI)指心肌缺血导致心肌细胞凋亡和坏死,进而导致心肌缺氧,最终导致心功能受损[1-3]。AMI是所有类型心血管疾病的主要死因,因此探索心肌梗死后缺氧调节心肌细胞凋亡的机制可能为深入了解和预防心肌细胞凋亡提供重要的分子基础。心肌缺血/再灌注可激活保护心肌细胞免受缺血性损伤的各种分子和细胞途径[4-5]。在这些信号通路中,Notch信号传导是一种重要的模式识别受体,与骨髓分化、炎症和平滑肌细胞增殖密切相关,并且与动脉粥样硬化、糖尿病和其他代谢疾病等有关[6]。在典型的信号通路中,Notch受体与其配体(Delta-like或Jagged)相互作用导致跨膜Notch受体的蛋白水解切割,产生Notch细胞内结构域,迁移到细胞核中。在细胞核中,细胞内结构域与转录因子重组信号结合蛋白J结合并调节转录。Jagged1是Notch信号通路重要的配体,是一种在血管内皮细胞、平滑肌细胞中表达的特异性单次细胞跨膜蛋白,具有修复神经元、促进其再生的作用,进而提高神经元的存活率。Notch信号使巨噬细胞向M1促炎表型极化并增强炎性反应。此外,Notch信号传导可能通过发状分裂相关增强子1(Hairy and enhancer of split 1,Hes1)/信号转导及转录激活因子3通路的激活子激活缺氧诱导因子-1α(Hypoxia inducible factor-1α,HIF-1α)基因。HIF-1α在缺氧期间调节一系列基因的表达水平,并在调节细胞功能中发挥双向作用[7]。HIF-1α是心肌梗死后缺氧反应的主要调节剂,在调节氧稳态中起关键作用,通过减少氧气或增加氧化应激激活 HIF-1α,在心肌中发挥心脏保护作用[8]。本研究探讨急性心肌梗死模型大鼠外周血缺氧诱导因子-1α、Notch1和Jagged1表达水平与心功能的关系。
1 材料与方法
1.1 实验动物 雄性Wistar大鼠30只,鼠龄2~3个月,平均体重(250±30)g,购自陕西省疾病预防控制中心,许可证号:XYXK(陕)2018-009。将大鼠饲养在(22±2)°C、40%~50%湿度、12 h/12 h光/暗循环、自由获取食物和水的环境中。
1.2 主要试剂与仪器 1%戊巴比妥钠(批号:P3761,德国Sigma-Aldrich公司);4%多聚甲醛(批号:47608,德国Sigma-Aldrich公司);TRIzol试剂(批号:5017511,美国Thermo Fisher公司);PCR试剂盒(批号:4349182美国,Thermo Fisher公司);增强型化学发光试剂(批号:WP20005,美国Thermo Fisher公司);光学显微镜(型号:CH20BIMF200,日本东京奥林巴斯公司)。
1.3 实验分组 将30只大鼠分为模型组、共转染组和对照组,每组10只。①模型组:通过腹腔注射40 mg/kg 1%戊巴比妥钠对大鼠进行麻醉。气管插管后,所有大鼠使用小动物呼吸机接受正压有氧通气,并在左侧第4肋间打开胸部,切开心包后将心脏外化。使用6-0丝线缝合冠状动脉左前降支,距主动脉根部约3~5 mm。通过梗死区域的局部发绀验证AMI模型的制备成功。②共转染组:在冠状动脉左前降支结扎过程中将HIF-1α、Notch1、Jagged1共转染慢病毒注射到大鼠心脏的胸前组织中,即在梗死区域周围的4个不同点注射慢病毒,每个点注射1×106个慢病毒转导单位。③对照组:与模型组进行相同的外科手术,但不结扎冠状动脉左前降支。
1.4 心肌组织HE染色 用40 mg/kg 1%戊巴比妥钠腹膜内注射麻醉大鼠,快速解剖心脏并用0.9%氯化钠溶液冲洗,随后使用充水球囊将左心室内压维持在20 mmHg。移除主动脉弓、右心室、心房和耳廓,水平切成五个1 mm厚的部分。提取的左心室梗死区域在4%多聚甲醛中固定24 h。将固定的组织标本切成6 μm切片用于HE染色。在光学显微镜下以400倍放大率评估染色组织的形态学改变。
1.5 反转录定量PCR(RT-qPCR)分析 根据制造商的方案,用Trizol试剂从100 mg缺血心肌组织样品中提取总RNA。RNA的纯度用分光光度法测定A260/A280比值。每个样品的总RNA(2 μg)用莫洛尼鼠白血病病毒反转录酶合成cDNA。以下引物序列由上海捷瑞生物工程有限公司合成:HIF-1α正向序列为5’-CAGCGATGACACGGAAAC-3’,反向序列序列为5’-AGTGACTCTGGGCTTGAC-3’;Notch1 正向序列为5’-CTTCGTGCTCCTGTTCTTTG-3’,反向序列为5’-GCCTCTGACACTTTGAAACC-3’;Jagged1正向序列为5’-CACCCGAACTGGACAAAC-3’,反向序列为5’-AGCCTCAGACTGGGATAC-3’。这些引物对分别产生210、105、170 bp的扩增产物。将大鼠甘油醛三磷酸脱氢酶(GAPDH)作为内部对照:正向序列为5’-GTCGGTGTGAACGGATTTG-3’,反向序列为5’-TCCCATTCTCAGCCTTGAC-3’。使用SYBR实时PCR试剂盒制备qPCR反应。通过检测SYBR-Green 荧光信号强度对PCR产物进行定量,并通过Applied Biosystems Prism 7300 SDS软件进行分析。HIF-1α、Notch1和Jagged1 mRNA相对表达水平通过2-ΔΔCt法量化,归一化为GAPDH水平。
1.6 蛋白印迹分析 将20 mg冷冻组织样品粉碎并在150~250 μl RIPA裂解缓冲液中均质化。根据制造商的方案,通过进行BCA测定来确定蛋白质水平。制备的蛋白质样品通过10% SDS-PAGE分离并转移到硝酸纤维素膜上,将膜在室温下用TBS中的奶粉封闭60 min,与抗HIF-1α(1∶1000)、抗Notch1(1∶1000)、抗Jagged1(1∶500)和抗GAPDH(1∶1500)一抗在4 ℃下孵育过夜后,用含0.1% Tween-20的TBS洗涤膜3次,随后用含0.1% Tween-20的TBS中的HRP偶联二抗(1∶2000)在37 ℃下孵育30 min。根据制造商的方案,使用增强型化学发光试剂使条带可视化。将HIF-1α、Notch1和Jagged1蛋白质的相对表达水平标准化为来自同一样品的GAPDH条带的强度。所有实验重复3次,并计算平均值。
1.7 心功能指标检测 通过超声心动图和有创压力-容积血流动力学评估心脏功能。超声心动图专家以盲法进行测量,检测射血分数(EF)、左心室缩短分数(FS)、左心室舒张末期内径(LVEDD)和左心室收缩末期内径(LVESD)。
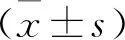
2 结 果
2.1 三组大鼠心肌组织HE染色结果 见图1。对照组大鼠心肌细胞膜完整,无炎症细胞浸润;模型组心肌细胞溶解或破坏、心肌结构紊乱、出现大量成纤维细胞或胶原纤维及少量炎症细胞浸润;共转染组上述组织病理学异常较模型组减轻。

图1 三组大鼠心肌组织HE染色结果(×400)
2.2 三组大鼠HIF-1α、Notch1、Jagged1蛋白相对表达水平比较 见图2(表1)。模型组HIF-1α、Notch1和Jagged1蛋白相对表达水平较对照组降低,共转染组HIF-1α、Notch1和Jagged1蛋白相对表达水平较模型组升高(均P<0.05)。

图2 三组大鼠HIF-1α、Notch1、Jagged1蛋白电泳结果

表1 三组大鼠HIF-1α、Notch1、Jagged1蛋白相对表达水平比较
2.3 三组大鼠HIF-1α、Notch1、Jagged1 mRNA相对表达水平比较 见表2。模型组HIF-1α、Notch1和Jagged1 mRNA相对表达水平较对照组降低,共转染组HIF-1α、Notch1和Jagged1 mRNA相对表达水平较模型组升高(均P<0.05)。

表2 三组大鼠HIF-1α、Notch1、Jagged1 mRNA相对表达水平比较
2.4 三组大鼠心功能指标比较 见表3。模型组EF和FS较对照组降低,共转染组EF和FS较模型组升高(均P<0.05)。模型组LVEDD和LVESD较对照组升高,共转染组LVEDD和LVESD较模型组降低(均P<0.05)。

表3 三组大鼠心功能指标比较
3 讨 论
AMI伴有心肌细胞凋亡、心肌重构等多种病理特征,心肌细胞凋亡是AMI后心肌损伤的主要原因。一系列病理因素可诱导心肌细胞凋亡,包括缺氧、钙超载和酸中毒,其中缺氧是导致心肌细胞凋亡的重要因素[9-11]。在本研究中,通过冠状动脉结扎建立大鼠AMI模型。HE染色观察到梗死心脏组织学变化表现为心肌细胞溶解或破坏、心肌结构紊乱和大量成纤维细胞或胶原纤维,而HIF-1α、Notch1和Jagged1共转染过表达显著减轻了这些病理异常。
HI是一种核转录调节因子,由HIF-1α和HIF-1β组成[12-13]。研究表明,HIF-1α是一种表达发生变化的转录因子,在缺氧期间发挥重要作用。HIF-1α调节与糖酵解、糖代谢、线粒体功能、细胞存活相关的一系列基因的表达,以及细胞凋亡和抗氧化应激。具体来说,低剂量和高剂量的HIF-1α对缺氧后心肌细胞凋亡的影响不同。研究[14-16]表明,HIF-1α增强了对缺氧的耐受性并保护了心肌。随着HIF-1α剂量的增加,HIF-1α介导的细胞功能调节可能导致更差的结果。AMI诱导缺血或缺氧心肌中HIF-1α的上调,这有助于心脏保护作用。在本研究中,与模型组大鼠相比,共转染组增加了HIF-1α mRNA和蛋白的表达。动物实验表明,HIF-1α过表达可减轻梗死面积并在梗死后4周改善心脏功能。因此,HIF-1α被认为是心脏保护的治疗靶点。Notch信号传导在免疫细胞中的作用也得到了广泛的研究,特别是在巨噬细胞之间的近分泌同型通讯以及在各种缺血损伤模型中[17-18]。全身和局部巨噬细胞趋化性的增加导致Notch信号和巨噬细胞(M1)的激活,并延长炎症细胞向伤口的募集。Notch信号通路对细胞增殖、分化和凋亡的调节至关重要。心肌中的低氧环境可能导致Notch信号激活,从而通过促进心肌再生、保护缺血心肌或诱导血管生成来减轻心肌损伤并改善心脏功能[19-20]。Notch1和Jagged1是在成人肌细胞中表达的主要Notch信号形式。此外,Notch1信号在增殖的胚胎和未成熟心肌细胞或梗死后心肌的边界区中被激活[21]。Notch1信号传导还抑制缺血后心肌细胞的凋亡[22]。本研究在AMI后检测到心肌中Notch1和Jagged1的表达降低,与模型组大鼠相比,Notch1和Jagged1的模拟转染物增加了Notch1和Jagged1 mRNA及蛋白的表达,表明Notch1/Jagged1信号传导的上调可能是减轻AMI后心肌损伤的潜在机制。
本研究中使用动物超声系统检测大鼠的心功能并进行比较,结果发现:模型组EF和FS较对照组降低,共转染组EF和FS较模型组升高;模型组LVEDD和LVESD较对照组升高,共转染组LVEDD和LVESD较模型组降低。这表明HIF-1α、Notch1、Jagged1共转染减轻了模型组大鼠心功能的恶化,具有改善心功能的作用。
综上所述,AMI模型大鼠外周血HIF-1α、Notch1、Jagged1表达水平降低,心功能下降。HIF-1α、Notch1、Jagged1共转染可改善AMI模型大鼠的心功能。
