万寿菊中叶黄素的皂化工艺研究
2022-11-07吴红艳杨宝茹李秀鑫仲伟健代明朗
吴红艳,杨宝茹,李秀鑫,仲伟健,代明朗
(齐齐哈尔大学 食品与生物工程学院,黑龙江 齐齐哈尔 161006)
叶黄素是存在于蔬菜、水果、植物和花卉中的一种类胡萝卜素,在万寿菊花瓣中含量极为丰富[1]。叶黄素作为一种色彩艳丽且着色能力很强的天然黄色素,还具有保护视网膜、防止紫外线损伤皮肤、调节机体免疫力、预防癌症等多种生理功能。同时,叶黄素无毒害、安全系数高,并且有良好的抗氧化活性,因此其具有较高的营养价值[2-3]。我国早在食品安全标准GB 26405-2011中规定,允许叶黄素作为食品添加剂[4]。叶黄素在食品的色泽、风味、营养价值等方面作出很大贡献,可作为一种功能性的调味品。高纯度的叶黄素在医药保健、食品、调味品、饲料添加剂、化妆品等领域具有较高的开发价值和广阔的应用前景[5-7]。
随着现阶段对叶黄素功能特性的不断研究,叶黄素类高端产品引起越来越多消费者的关注,具有良好的市场前景,因此制备高纯度的叶黄素成为研究的必然趋势[8-12]。游离态叶黄素和叶黄素酯是叶黄素存在于万寿菊中的两种形式[13],在万寿菊中大多以叶黄素酯的形式存在,游离叶黄素含量很少,若要制备高纯度的叶黄素可以对叶黄素酯进行皂化[14]。本研究选用万寿菊颗粒为原料,采用微乳液提取法,得到叶黄素酯,对叶黄素酯进行皂化,得到游离态的叶黄素粗产品,后续可采用柱层析结晶等方法进一步纯化[15]。本研究对皂化工艺条件进行优化,为制备出高纯度的食品级叶黄素奠定了基础。
1 材料与方法
1.1 材料
万寿菊颗粒:广州立达尔生物科技股份有限公司;叶黄素标准品(纯度≥90%):上海源叶生物科技有限公司。
1.2 试剂
氢氧化钾(国产分析纯):沈阳金泰尔化工有限公司;氢氧化钠(国产分析纯):伊维特(辽宁)化工有限公司;无水乙醇(国产分析纯):天津市光复精细化工有限公司;甲醇、乙酸乙酯(均为色谱纯):天津市科密欧化学试剂有限公司。
1.3 主要仪器与设备
Sartorius普及型pH计 德国赛多利斯公司;722N型可见分光光度计 冠森生物科技(上海)有限公司;BSA124S-CW型分析天平 北京海天友诚科技有限公司;SHZ-D(Ⅲ)型循环水式多用真空泵 上海力辰仪器科技有限公司;DL-360E型智能超声波清洗器 上海之信仪器有限公司;Z233 MK-2型离心机 德国HERMLE公司;RE-52AA型旋转蒸发器 上海亚荣生化仪器厂;SHA-C型恒温水浴振荡器 济南欧莱博科学仪器有限公司;HPLC-1260型高效液相色谱仪 北京京科瑞达科技有限公司。
1.4 方法
1.4.1 叶黄素酯的制备
将万寿菊颗粒粉碎并过80目筛,将万寿菊粉与葵花籽油微乳液按1∶50的比例进行均匀混合,加入1%的纤维素酶,混合均匀。将其置于45 ℃的恒温水浴振荡器中振荡2.0 h,随后用0.45 μm的滤膜抽滤处理,收集滤液,将滤液进行旋转蒸发浓缩,得到叶黄素酯。
1.4.2 皂化剂的选取
准确称取10.0 g叶黄素酯,溶解于40 mL无水乙醇中,分别加入10 mL 0.1 g/mL不同的皂化剂。在50 ℃下进行超声处理,皂化50 min,然后进行抽滤,取上清液,测量在447 nm处的吸光度值。
1.4.3 叶黄素皂化工艺的单因素试验
准确称取10.0 g叶黄素酯,溶解于40 mL无水乙醇中,量取10 mL于50 mL离心管中,以碱液浓度、皂化时间、皂化温度为考察因素,按照表1方案设计进行单因素试验,然后进行抽滤,取上清液,在447 nm处测量吸光度值。

表1 单因素试验
1.4.4 响应面优化试验
采用3个因素进行优化设计,分别为A时间(min)、B温度(℃)和C碱液浓度(g/mL),建立响应模型进行优化。响应面试验因素及水平见表2。

表2 响应面试验因素及水平表
1.4.5 叶黄素含量的测定
准确称取1 mg叶黄素,将其完全溶解在10 mL甲醇中并稀释,制成0.1 mg/mL的标准溶液。C18反相色谱柱(4.6 mm×250 mm,5 μm),柱温为30 ℃,进样量为1 μL,流速为0.5 mL/min,流动相为乙酸乙酯。
1.4.6 数据分析
每个试验重复3次,数据用Origin 8.0绘图,用IBM SPSS Statistics 19.0软件进行显著性分析,P<0.05为差异显著。
2 结果与分析
2.1 皂化剂的选择
将叶黄素酯分别与不同皂化剂进行皂化反应,固定温度为50 ℃,超声皂化50 min,然后抽滤,测量所得滤液在波长447 nm处的吸光度值,结果见图1。

图1 不同皂化剂对叶黄素酯皂化的影响
由图1可知,以氢氧化钾-乙醇溶液为皂化剂进行反应后得到的叶黄素的吸光度值最高,由于KOH比NaOH的碱性强,所以能够更顺利地进行皂化工艺,故皂化后的叶黄素溶液的吸光度值较高,另外,碱的乙醇溶液均比其水溶液的吸光度值高,是因为乙醇能够使叶黄素酯更好地溶解,使其得到了充分的分离,其与反应物之间的接触面积增加,从而导致反应速率加快,皂化效果更明显。因此,该试验使用氢氧化钾-乙醇溶液作为皂化剂。
2.2 碱液浓度对叶黄素酯皂化的影响
将叶黄素酯在温度为50 ℃、时间为50 min的条件下,以氢氧化钾-乙醇溶液为皂化剂,分别用不同浓度的碱液进行超声皂化反应,然后抽滤,测量所得滤液在波长447 nm处的吸光度值,结果见图2。
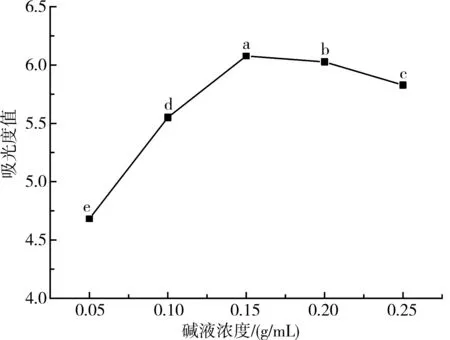
图2 碱液浓度对叶黄素酯皂化的影响
由图2可知,开始阶段吸光度值随着碱液浓度的增加而增大,碱液浓度为0.15 g/mL时吸光度值最大,为6.087,说明此时的皂化比较充分;碱液浓度高于0.15 g/mL时,叶黄素的稳定性可能会受到高碱浓度和高pH值的影响,吸光度值下降[16]。另外,过量的氢氧化钾不仅对叶黄素有不利影响,也会使溶液中的杂质增加,对吸光度和试验效果都有一定的影响。因此,本试验选取0.15 g/mL为最佳皂化碱液浓度。
2.3 皂化时间对叶黄素酯皂化的影响
在氢氧化钾-乙醇溶液浓度为0.15 g/mL、温度为50 ℃的条件下,将叶黄素酯分别按不同时间进行超声皂化处理,然后抽滤,测量所得滤液在波长447 nm处的吸光度值,结果见图3。
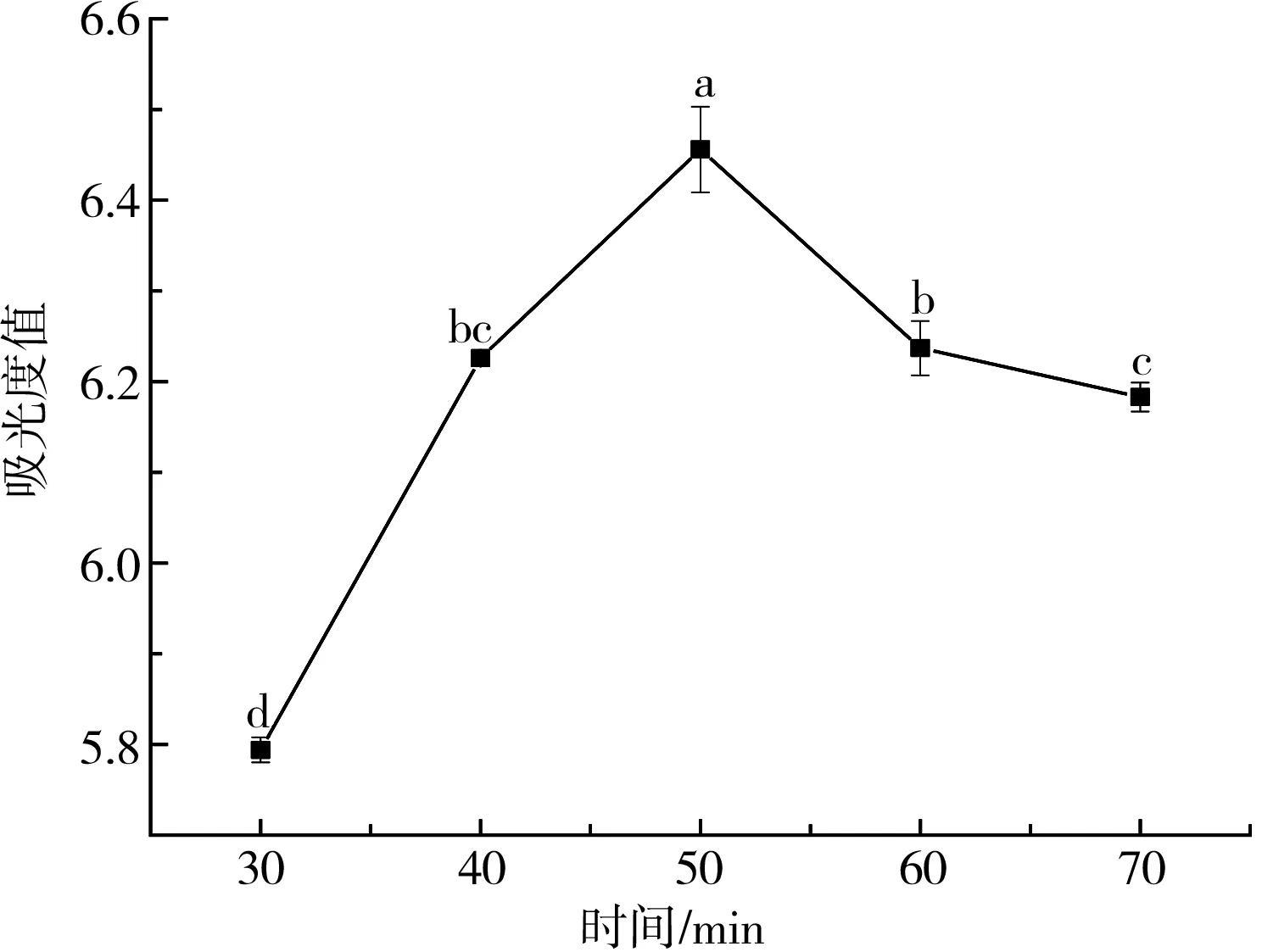
图3 时间对叶黄素酯皂化的影响
由图3可知,开始阶段溶液的吸光度值随着时间的延长而增大,皂化时间为50 min时吸光度值最大,为6.437,此时的皂化效果较好。但是皂化时间超过50 min后,可能由于叶黄素的稳定性差,时间过长而被氧化,因而吸光度值开始逐渐下降[17]。因此,本试验选取最佳皂化时间为50 min。
2.4 皂化温度对叶黄素酯皂化的影响
在氢氧化钾-乙醇溶液浓度为0.15 g/mL、时间为50 min的条件下,在不同温度条件下将叶黄素酯进行超声皂化,然后抽滤,在447 nm处测量滤液的吸光度值,结果见图4。
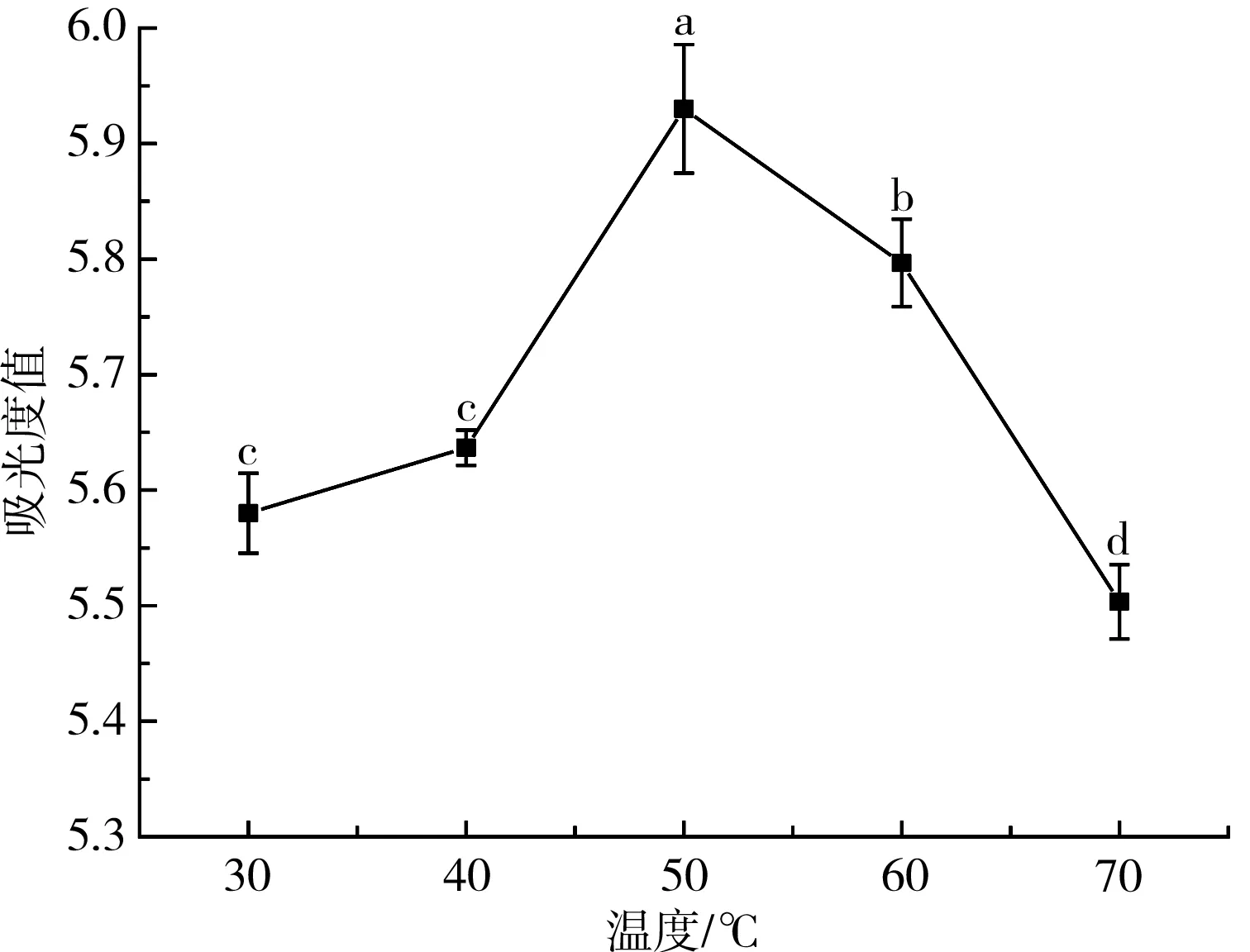
图4 温度对叶黄素酯皂化的影响
由图4可知,开始阶段溶液的吸光度值随着皂化温度的升高而增大,皂化温度为50 ℃时吸光度值最大,为5.887,此时的皂化效果较好。皂化温度高于50 ℃时,温度过高可能会对叶黄素的稳定性造成一定影响,导致吸光度值下降[18],温度过高影响皂化反应的顺利进行,从而对吸光度值也造成一定的影响。因此,本试验选取最佳皂化温度为50 ℃。
2.5 响应面分析
2.5.1 响应面优化试验结果分析
基于单因素试验3个变量因素:A时间(min)、B温度(℃)、C碱液浓度(g/mL),利用响应面分析优化皂化条件,得出最佳的皂化条件。设计了17组试验数据进行响应面分析(见表3),回归模型系数的检验结果见表4。
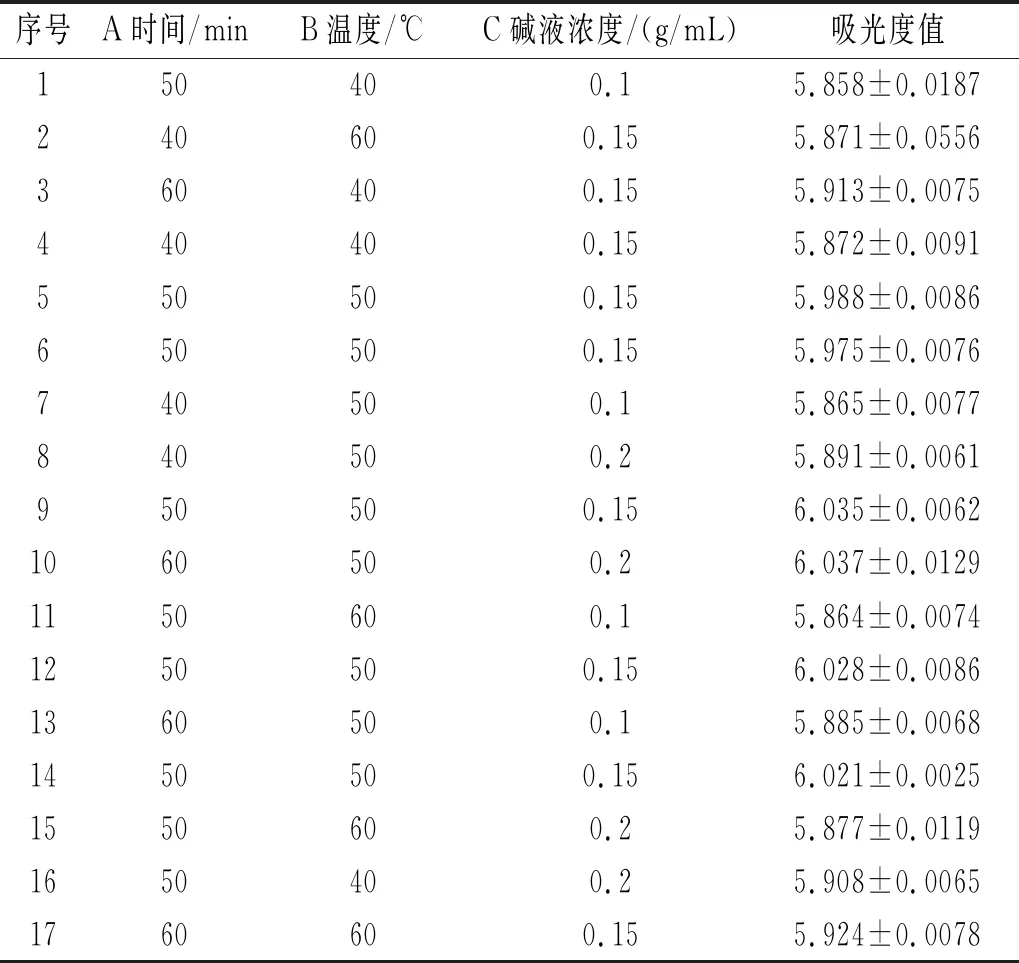
表3 响应面试验设计及结果
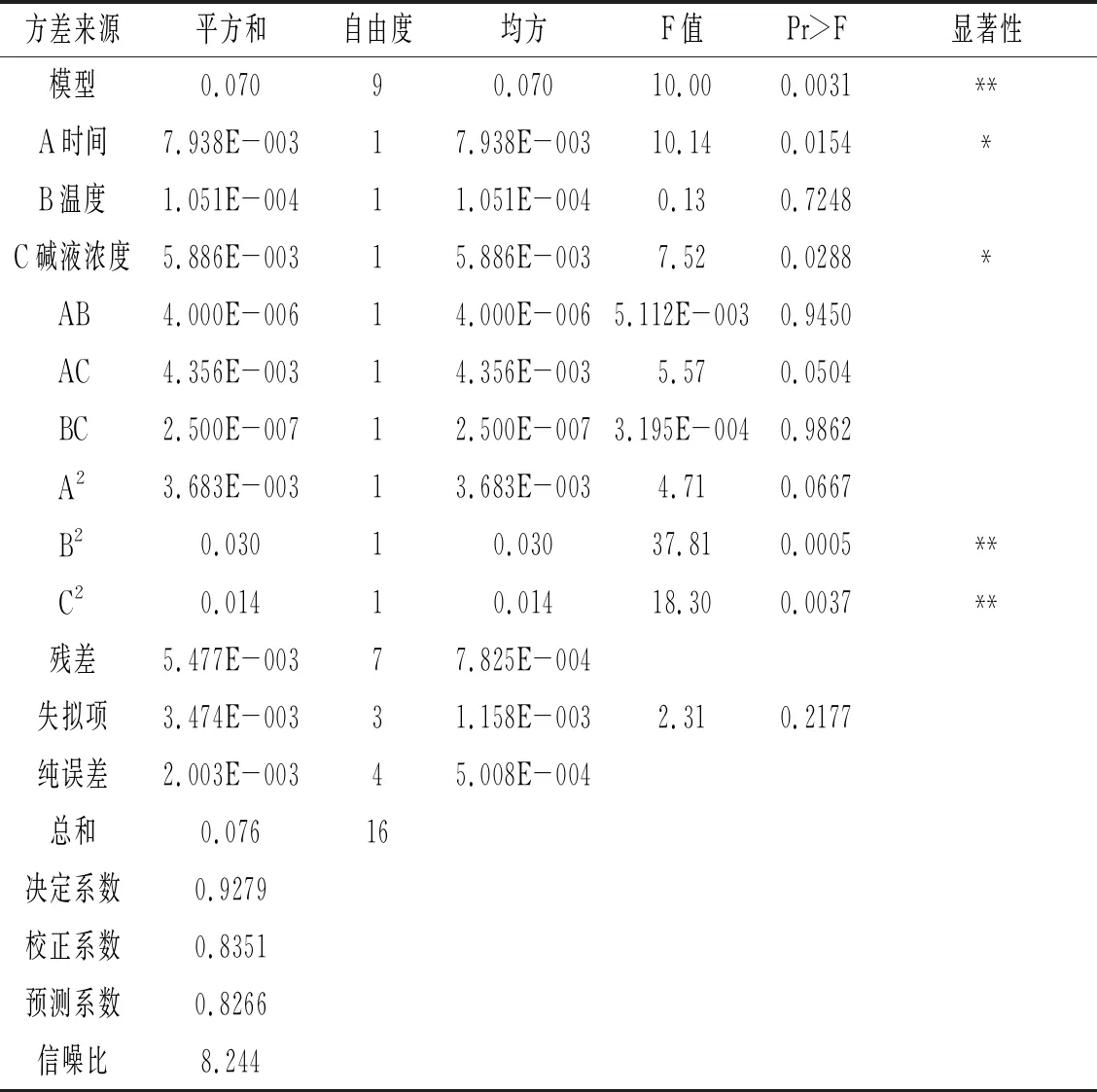
表4 回归模型系数的检验结果
2.5.2 模型建立及分析评价
对表4中的试验数据进行二项式回归拟合,吸光度值(Y)对时间(A)、温度(B)和碱液浓度(C)的二次多项式回归方程为:
Y=6.01+0.032A+3.625E-003B+0.027C+1.000E-0003AB+0.033AC-2.500E-0.004BC-0.030A2-0.0854B2-0.058C2。
F检验表示回归方程中每个变量对响应值的影响显著性。概率“Pr>F”的值越小,相应变量越显著。由表4可知,模型的“Pr>F”概率为0.0031<0.01,说明模型对响应值Y的影响极显著;该模型的单因素中,A(时间)、C(碱液浓度)对响应值Y的影响显著,B(温度)对响应值Y的影响不显著;在交互作用中,对响应值Y的影响均不显著;在模型的二次项中,B2、C2对响应值Y的影响极显著,A2对响应值Y的影响不显著。各因素对叶黄素提取率的影响大小依次为时间>碱液浓度>温度。模型失拟项的“Pr> F”为0.2177,影响不显著,可以应用于模型分析和预测叶黄素酯皂化工艺研究。
由表4可知,预测系数为0.8266,且校正系数为0.8351,预测系数的拟合度高。决定系数为0.9279,可以用于模型分析。该测试模型的信噪比为8.244>4,因此该模型可用于实际试验分析。
2.5.3 各因素的响应面图谱
在回归模型方差分析的基础上,使用响应曲面图对回归模型进行分析,以进一步检验相关因素之间的相互作用及其最大优势,见图5~图7。
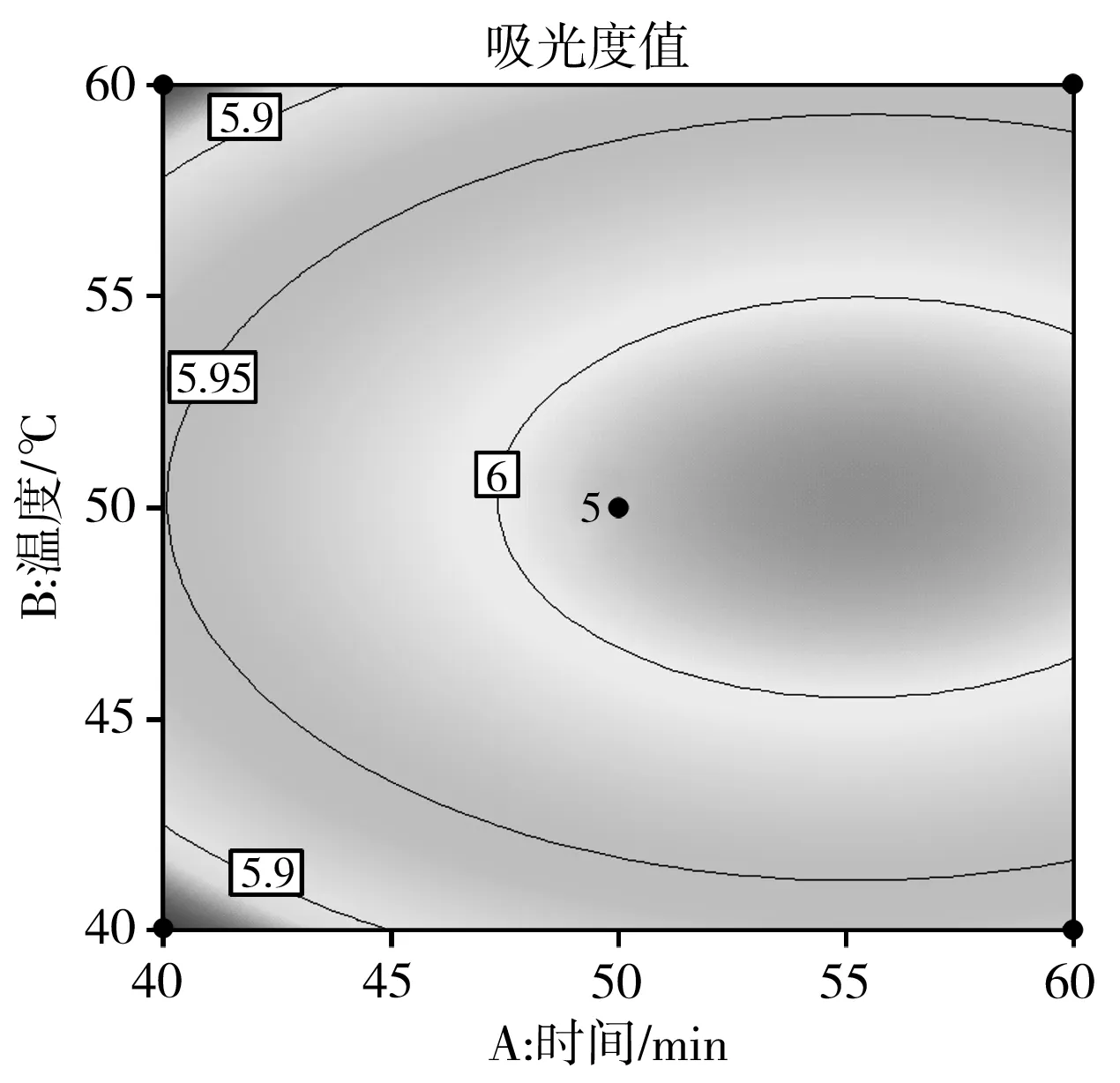
图5 因素A和因素B相互作用的等高线图和响应面图
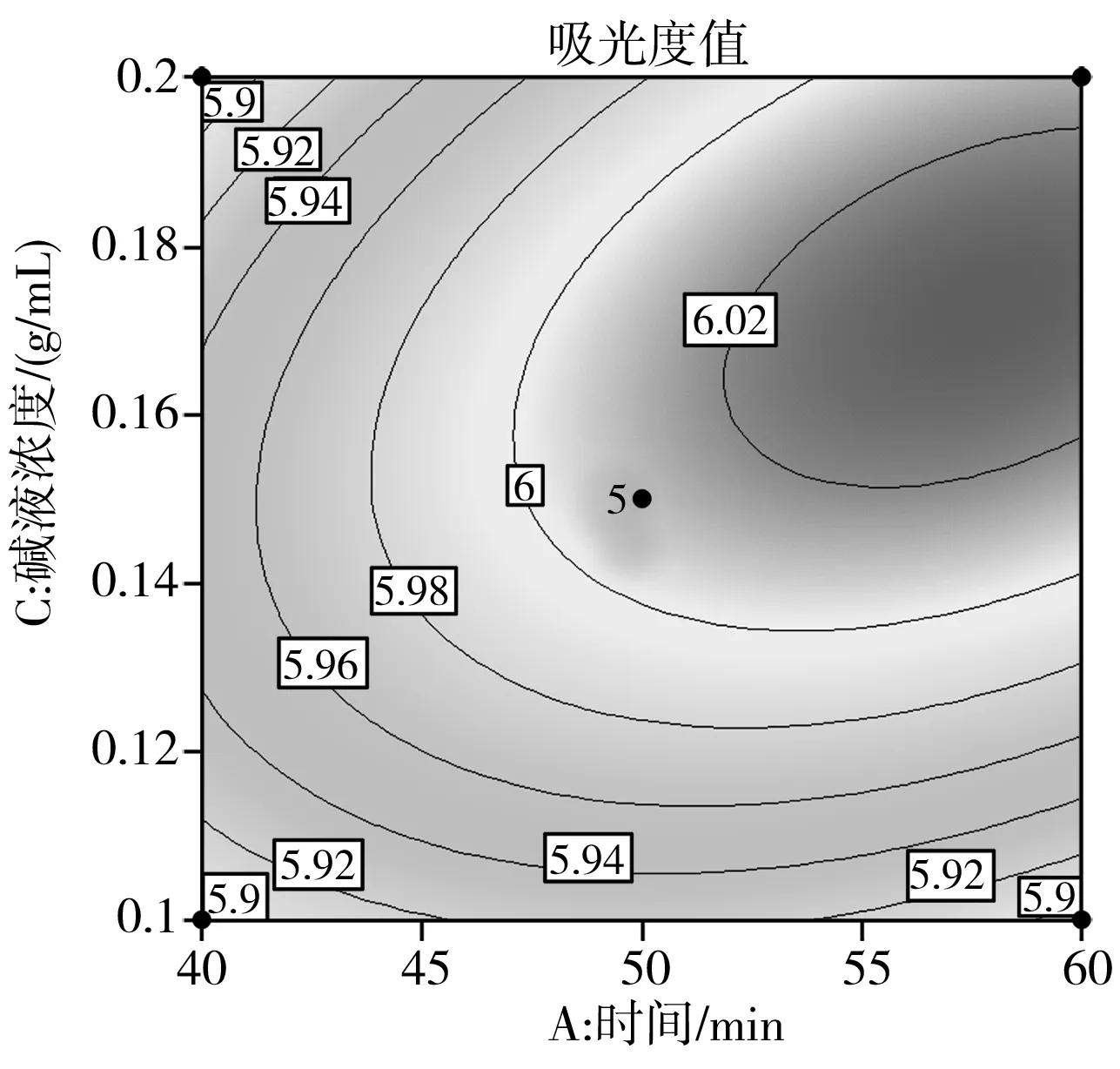
图6 因素A和因素C相互作用的等高线图和响应面图
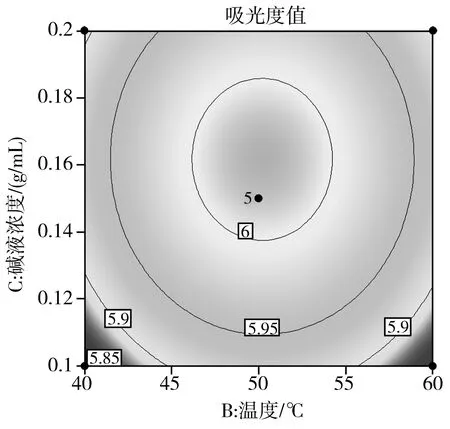
图7 因素B和因素C相互作用的等高线图和响应面图
由图5~图7可知,响应值Y与每个因素都具有抛物线关系,并且随着各因素值的变化,响应值Y也发生变化,先增大到最大值然后减小。因此,叶黄素酯皂化时,只有在一定的条件下,吸光度值才会达到最高。
根据Design Expert软件的优化得到最佳条件为时间57 min、温度50 ℃、碱液浓度0.17 g/mL。在此条件下吸光度理论值为6.029,将数据代入SAS软件进行分析来验证优化的结果。经过分析后,与获得的最佳条件结果一致。
2.6 叶黄素标准品的标准曲线
配制等梯度浓度的叶黄素乙醇标准品进行高效液相分析试验,求出峰面积。以峰面积为纵坐标,以叶黄素浓度为横坐标绘制标准曲线,见图8。

图8 叶黄素标准品-乙醇HPLC图的标准曲线
2.7 验证试验
采用Design Expert软件优化的最佳提取条件皂化叶黄素酯,即在50 ℃和碱液浓度为0.17 g/mL的条件下皂化57 min,平行3次取其平均值。结果表明,在最佳萃取条件下的实际吸光度为6.027,纯度可达到48.21%,与预测的理论值相似,表明该模型可以实际反映并筛选出最佳条件。
3 结论
本研究主要对万寿菊颗粒中的叶黄素酯进行皂化。研究结论:采用4种不同皂化剂对叶黄素酯进行皂化试验,结果表明氢氧化钾-乙醇溶液对叶黄素酯皂化的效果比较好,得出其最佳的皂化条件为时间50 min、温度50 ℃、碱液浓度0.15 g/mL。响应面数据分析表明,时间和碱液浓度对吸光度值的影响极显著,而温度不显著。优化后的最佳皂化条件:时间为57 min,温度为50 ℃,碱液浓度为0.17 g/mL。在此条件下测得吸光度理论值为6.029,叶黄素纯度可达48.21%。叶黄素可以改善食品的风味和色泽,并且具有良好的生理功效,被广泛应用于食品、医疗、饲料添加剂及保健品行业中,具有较高的商业价值。因此,本研究对万寿菊中叶黄素的皂化工艺条件进行了优化,为叶黄素的纯化试验提供了可靠的科学基础,提高了叶黄素纯化的前期制备效率,为获取高纯度的食品级叶黄素提供了简单高效的技术工艺。
