miR-760抑制人食管鳞状细胞癌细胞系的增殖、侵袭和迁移
2022-11-06袁生武
袁生武,陈 娟,刘 凯
(1.郑州大学第五附属医院 介入科, 河南 郑州 453000; 2.河南省人民医院 超声诊断科, 河南 郑州 453000)
食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)的致死率较高,占全球癌病死率的第6位[1]。由于ESCC患者的术后5年生存率较低,因此寻找有效的ESCC转移分子标志物、提高术后生存率迫在眉睫。微RNA(microRNA,miRNA)广泛存在于生物体内,不仅参与调节细胞的发育、分化、凋亡等过程,还与ESCC的发展进程密切相关。研究表明,miR-760在非小细胞肺癌[2]、肝癌[3]和结肠癌[4]中发挥抗癌作用。据报道[5],碱性亮氨酸拉链ATF样转录因子3(basic leucine zipper ATF-like transcription factor 3,BATF3)通过激活S1PR1/p-STAT3/miR-155-3p/WDR82轴行使其致癌功能,从而促进结肠癌细胞增殖、侵袭和转移。然而,BATF3在ESCC中的作用尚未见报道。因此,本研究将检测miR-760在ESCC组织和细胞中的表达情况,探讨miR-760与BATF3的靶向关系并进一步研究其对ESCC细胞的增殖、侵袭和迁移的影响。
1 材料与方法
1.1 材料
1.1.1 主要试剂:胎牛血清、RPMI-1640培养基(Hyclone公司);青、链霉素(Gibco公司);RNA提取试剂盒、反转录试剂盒、引物(上海生工生物公司);RT-qPCR检测试剂盒、BCA试剂盒(GeneCopoeia公司);Lipofectamine 2000转染试剂盒(Invitrogen公司);miR-760模拟物或抑制物(miR-760-mimics/anti-miR-760)及其阴性对照(miR-NC/anti-miR-NC)(上海碧云天生物技术有限公司);兔抗人BATF3、周期蛋白(cyclin D1)、基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)、波形蛋白(vimentin)、E-钙黏蛋白(E-cadherin)、GAPDH多克隆抗体及辣根过氧化物酶标记的二抗(SantaCruz公司);CCK-8试剂盒(Sigma-Aldrich公司);Transwell小室和基质胶(Corning公司);双荧光素酶报告基因检测试剂盒(Promega公司);ECL化学发光试剂(Millipore公司)。
1.1.2 组织和细胞:于2020年9月至2021年5月在郑州大学第五附属医院收集18例ESCC患者的癌组织及癌旁组织,液氮速冻,-80 ℃保存。本研究获得医院伦理委员会的批准(审批号:BF2020-008-01)。所有参与本研究的患者均签署知情同意书,且术前均未进行放射和化学治疗。人食管鳞状上皮细胞Het-1A及人ESCC细胞系EC9706、KYSE150、ECA109和TE-10购自中国科学院上海细胞库。
1.2 方法
1.2.1 RT-qPCR检测ESCC组织和细胞中miR-760和BATF3 mRNA表达:提取ESCC组织和细胞系总RNA,使用反转录试剂盒将其反转录为cDNA,按照PCR标准程序进行扩增反应。以U6或β-actin作为内参基因,采用2-△△Ct方法计算miR-760和BATF3 mRNA的相对表达量。引物:miR-760正向5′-AGC CGCGGCTCTGGCTCTG-3′,反向5′-GTGCAGGGTC CGAGGT-3′;U6正向5′-GCTTCGGCAGCACATATA CTAAAAT-3′,反向5′-CGCTTCACGAATTTGCGTGTC AT-3′;BATF3正向5′-ACAGGAAGGTCCGAAGGA GA-3′,反向5′-CCAGGCTCTCATATTCCTCATGG-3′;β-actin正向5′-TGGCACCCAGCACAAT GAA-3′,反向5′-CTAAGTCATAGTCCGCCTAGAAG CA-3′。
1.2.2 细胞的分组与处理:将对数增殖期的TE-10细胞,制备成细胞悬液,接种至6孔板,24 h后,使用Lipofectamine 2000转染试剂盒对TE-10细胞进行转染,并将其随机分组为:对照组(未转染细胞)、miR-760-mimics组(miR-760模拟物转染细胞)、anti-miR-760组(miR-760抑制物转染细胞)、miR-NC组(miR-NC转染细胞)、anti-miR-NC组(anti-miR-NC转染细胞)、miR-760-mimics+pcDNA组(miR-760模拟物和pcDNA空载体质粒共转染细胞)和(miR-760-mimics+pc-BATF3)组(miR-760模拟物和pc-BATF3重组质粒共转染细胞)。
1.2.3 Western blot检测TE-10细胞中蛋白质表达:将各组TE-10细胞裂解后,提取总蛋白质,BCA试剂盒对蛋白质进行定量。将蛋白质样品进行SDS-PAGE,1 h后电转至PVDF膜。室温,封闭15 min,加入BATF3、cyclin D1、p21、MMP2、GAPDH一抗,孵育洗涤后,加入相应二抗,1 h后洗涤3次,采用ECL试剂显影。
1.2.4 CCK-8法检测TE-10细胞增殖能力:将转染后的各组TE-10细胞接种到96孔板中,待细胞贴壁后,加入10 μL CCK-8试剂,37 ℃培养2 h,使用多功能酶标仪分别在24、48和72 h时间点测量490 nm波长处的A值。
1.2.5 Transwell小室法检测TE-10细胞迁移和侵袭能力:迁移实验:在Transwell上室中加入100 μL细胞悬液,下室加人500 μL RPMI-1640培养基。孵育24 h,4%多聚甲醛固定,0.1%结晶紫染色,10 min后随机选取5个视野(×200)观察并拍照计数。侵袭实验:实验前用基质胶平铺小室上室,其他步骤同迁移实验,培养时间延长至36 h。
1.2.6 双荧光素酶报告基因实验验证miR-760与BATF3的靶向关系:TargetScan软件预测BATF3和miR-760的结合位点。利用Lipofectamine 2000转染试剂将构建的载体(WT-BATF3 3′-UTR和MUT-BATF3 3′-UTR)质粒分别与miR-760-mimics和miR-NC共转染TE-10细胞。48 h后使用多功能酶标仪检测各组TE-10细胞的相对荧光素酶活性。
1.3 统计学分析
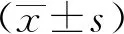
2 结果
2.1 miR-760与BATF3 mRNA在ESCC组织和细胞中的表达比较
与癌旁组织和Het-1A细胞相比,ESCC癌组织和细胞系中miR-760表达明显降低,BATF3 mRNA表达显著升高(P<0.05)(图1,2)。由于TE-10细胞中miR-760表达最低,BATF3 mRNA表达最高,故选择TE-10细胞进行后续实验。
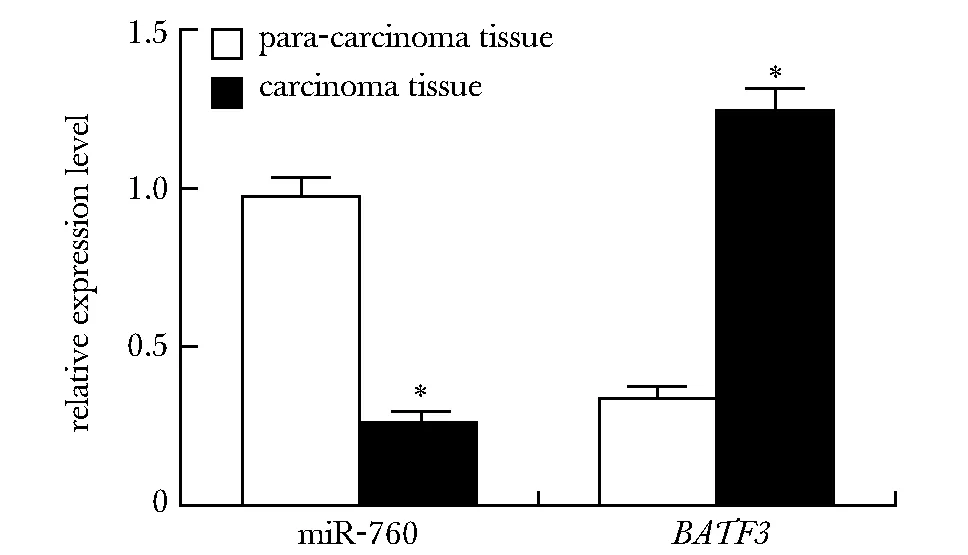
*P<0.05 compared with para-carcinoma tissue

*P<0.05 compared with Het-1A
2.2 miR-760与BATF3的靶向关系
通过TargetScan在线软件预测BATF3与miR-760有互补的核苷酸序列(图3)。(WT-BATF3 3′-UTR+miR-760-mimics)组的相对荧光素酶活性显著低于(WT-BATF3 3′-UTR+miR-NC)组(P<0.05)(图4)。miR-760-mimics组BATF3蛋白表达明显低于miR-NC组,anti-miR-760组BATF3蛋白表达明显高于anti-miR-NC组(P<0.05)(图5)。
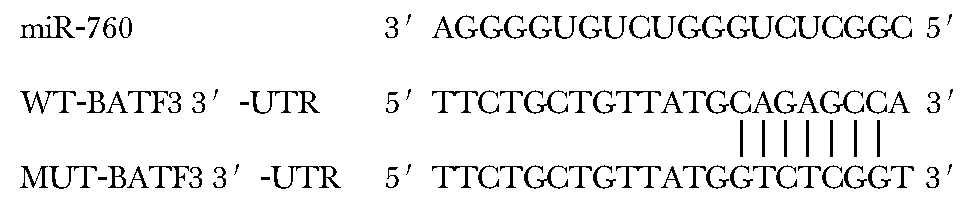
图3 miR-760与BATF3的结合位点

*P<0.05 compared with WT-BATF3 3′-UTR+miR-NC

*P<0.05 compared with control; #P<0.05 compared with miR-NC; △P<0.05 compared with anti-miR-NC
2.3 过表达miR-760或BATF3对TE-10细胞增殖的影响
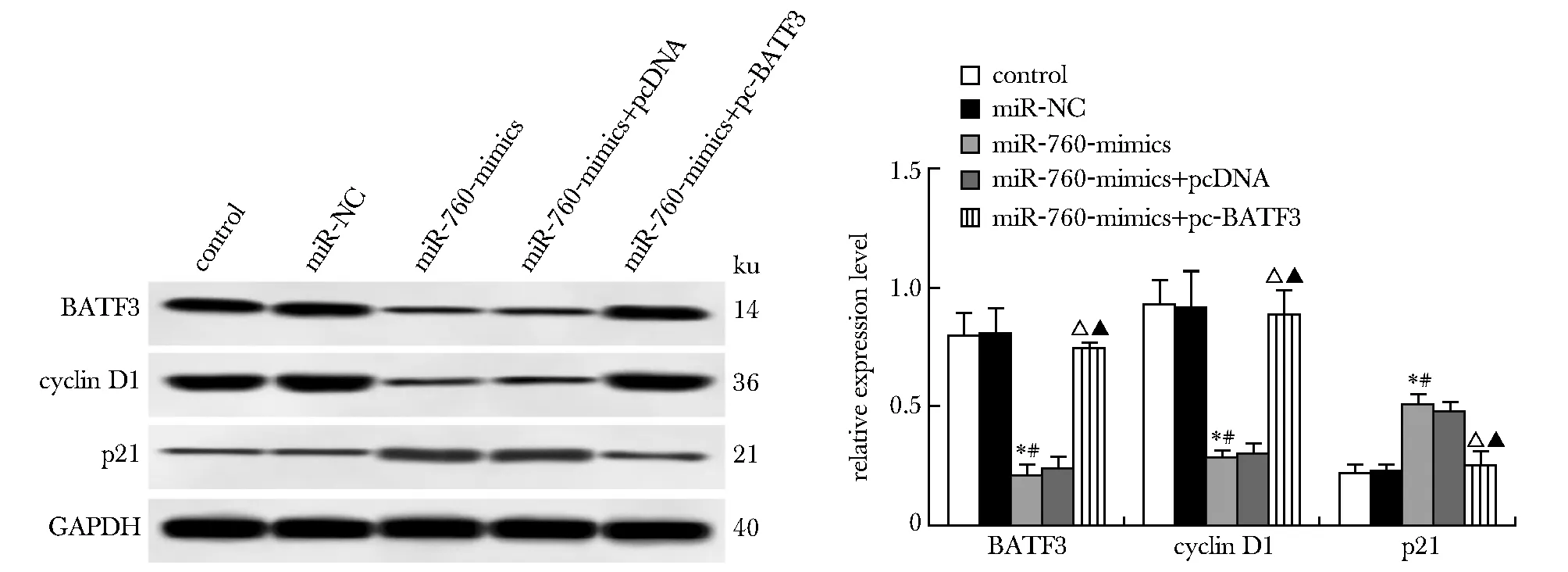
与对照组、miR-NC组相比,miR-760-mimics组miR-760表达升高,BATF3表达降低,A值(24、48和72 h)、cyclin D1蛋白表达下降,p21蛋白表达升高(P<0.05);与miR-760-mimics+pcDNA组和miR-760-mimics组比较,miR-760-mimics+pc-BATF3组miR-760和p21蛋白表达明显降低,A值(24、48和72 h)、BATF3、cyclin D1蛋白表达明显升高(P<0.05)(图6~8)。

*P<0.05 compared with control; #P<0.05 compared with miR-NC; △P<0.05 compared with miR-760-mimics+pcDNA; ▲P<0.05 compared with miR-760-mimics
2.4 过表达miR-760或BATF3对TE-10细胞侵袭、迁移的影响
与miR-NC组比较,miR-760-mimics组侵袭、迁移细胞数明显减少,MMP-2、vimentin蛋白表达降低,E-cadherin蛋白表达升高(P<0.05);与miR-760-mimics+pcDNA组和miR-760-mimics组比较,miR-760-mimics+pc-BATF3组细胞侵袭、迁移细胞数明显增多,MMP-2、vimentin蛋白表达升高,E-cadherin蛋白表达降低(P<0.05)(图9,10,表1)。

表1 过表达miR-760或BATF3对TE-10细胞侵袭、迁移的影响
3 讨论
ESCC是中国常见的食管癌类型[6]。由于其癌细胞易发生侵袭、转移,因而ESCC患者的预后差、病死率高[1]。因此,研究ESCC侵袭、转移的分子机制对其临床治疗具有重大意义。

*P<0.05 compared with control; #P<0.05 compared with miR-NC; △P<0.05 compared with miR-760-mimics+pcDNA; ▲P<0.05 compared with miR-760-mimics
*P<0.05 compared with control; #P<0.05 compared with miR-NC; △P<0.05 compared with miR-760-mimics+pcDNA; ▲P<0.05 compared with miR-760-mimics

图9 各组TE-10细胞中MMP-2、vimentin、E-cadherin蛋白表达
MiRNA可通过靶向一个或多个基因从而调控ESCC的生物学行为,并影响肿瘤的诊断及临床治疗[7]。以往研究表明,miR-760在多种肿瘤细胞中起作用,包括肺癌[2]、结直肠癌[8]、胃癌[9]等。然而,miR-760在ESCC中的功能还未有报道。本研究结果显示,miR-760在ESCC组织和细胞系中低表达,说明miR-760在ESCC中可能发挥抑癌作用。由于在TE-10细胞中miR-760表达量最高,故选择TE-10细胞进行下一步研究。有研究[10]表明,上皮-间质转化(epithelial-mesenchymal transition,EMT)途径可增强细胞的侵袭和迁移能力,其机制可能与上皮细胞失去极性相关。MMP2和vimentin是EMT过程的间质标志蛋白,其下调表达可抑制肿瘤细胞迁移[11];E-cadherin参与肿瘤细胞的侵袭过程,是重要的上皮标志蛋白[12]。本研究发现,过表达miR-760可抑制TE-10细胞增殖、侵袭和迁移,这可能与抑制EMT标志蛋白表达有关, 揭示miR-760在TE-10细胞中起抗癌作用。
为了更加深入地了解miR-760影响ESCC细胞增殖、侵袭和迁移的调控机制,本研究采用TargetScan预测了BATF3是miR-760的潜在靶基因。BATF3是AP-1家族的一员,最初被认为是转录过程的抑制剂;后来研究发现,由于BATF3具有非冗余的、独特的正转录活性,推测其具有致癌能力[13]。双荧光素酶报告基因实验表明,miR-760在TE-10细胞中负调控BATF3表达;上调BATF3表达可逆转过表达miR-760对TE-10细胞增殖、侵袭、迁移的抑制作用,提示miR-760通过抑制BATF3表达抑制TE-10细胞增殖、侵袭、迁移。
综上所述,miR-760在ESCC组织和细胞中低表达,其过表达可能通过靶向下调BATF3抑制TE-10细胞的增殖、侵袭和迁移,为ESCC的临床治疗提供新思路和新靶点。

图10 Transwell小室法检测各组TE-10细胞侵袭、迁移
