组学技术在食源性致病菌抗逆机制研究中的应用进展
2022-10-28何守魁黎丹红施春雷史贤明
何守魁,黎丹红,施春雷,史贤明
(上海交通大学农业与生物学院,中美食品安全联合研究中心,微生物代谢国家重点实验室,上海 200240)
食品安全是备受全球关注的公共卫生问题,食源性致病菌是引发食品安全问题的主要因素。据统计,我国平均每6.5 人中就有1 人因食用被食源性致病菌污染的食物而罹患疾病。沙门氏菌、金黄色葡萄球菌、副溶血弧菌、致病性大肠杆菌、蜡样芽孢杆菌、单增李斯特菌等都是我国常见的食源性致病菌。对这些食源性致病菌进行有效的控制,是保障食品安全的重要途径。
在食品工业中,常使用物理杀菌因子和化学杀菌因子来控制致病菌,从而保障食品安全。然而,这些物理和化学因子的广泛使用或不合理使用,已导致食源性致病菌形成抗性,包括低温抗性、高温抗性、干燥抗性、消毒剂抗性、有机酸抗性等。此外,有些致病菌(如沙门氏菌)甚至能够同时抵御复杂食品基质(如蛋清和花生酱)中的多种逆境因子,并引发食品安全事件。因此,探索致病菌在食品加工与贮藏环节常用理化因子胁迫下的存活机制,对于解决抗性菌导致的食品安全问题具有重要意义。
近年来,日益成熟的高通量组学技术(如基因组学、转录组学、蛋白质组学和代谢组学等)在食源性致病菌抗逆机制研究方面得到了广泛应用,为抗逆相关基因、sRNA、蛋白质和代谢物的全面发掘及其互作关系研究提供了坚实的技术支撑。例如,目前已通过转录组学和蛋白质组学技术挖掘到参与沙门氏菌酸抗性形成的多个调控蛋白质(如Fur、RpoS和OmpR)、结构基因(如、和)和sRNA(如RprA、ArcZ和GcvB),这些抗逆元件有望为新型控菌技术的开发提供候选作用靶标,最终用于食品的安全生产。
本文结合课题组前期的研究工作,综述基因组学、转录组学、蛋白质组学和代谢组学技术在食源性致病菌抗逆机制研究中的应用进展,并对未来的发展方向进行展望,以期将组学技术更好地用于相关基础研究,同时为食源性致病菌抗性菌株的防控作出重要贡献。
1 基因组学技术在食源性致病菌抗逆机制研究中的应用
基因组携带了生物体(如食源性致病菌)的绝大多数遗传信息,是微生物形成特定表型的本源。因此,全基因测序分析对于揭示食源性致病菌的抗性形成机制尤为重要。一代测序技术以Sanger双链终止法为代表,二代测序技术以Roche公司的454技术、Illumina公司的Solexa/HiSeq技术和ABI(Applied Biosystems)公司的SOLID(sequencing by oligonucleotide ligation and detection)技术为代表,三代测序技术以Pacific BioSciences(PacBio)公司的单分子实时测序技术(single-molecule real-time sequencing,SMRT)和ONT(Oxford Nanopore Technologies)公司的纳米孔测序技术(Nanopore)为代表。目前,全基因组测序主要依赖于二代和三代测序技术,这些技术在食源性致病菌应对抗生素、天然产物、高温等胁迫的抗性形成机制研究方面得到了广泛应用(表1)。

表1 基因组学技术在食源性致病菌抗逆机制研究中的应用案例Table 1 Application of genomics technology in investigations on stress response mechanisms of foodborne pathogens
1.1 二代测序技术的应用进展
二代测序技术在食源性致病菌耐药性研究方面得到了广泛的应用。例如,研究者们已借助Illumina的MiSeq/HiSeq测序平台,发现了金黄色葡萄球菌的、、、、和这6 个基因与高水平苯唑西林耐药性的形成相关,鉴定到副溶血弧菌中存在(Pro165Ser、Gly208Asp)、(Ile313Thr)、(Glu329Ala)和(Asn205Ser)等耐药基因的突变。
二代测序技术也被用于探索大肠杆菌、沙门氏菌等重要致病菌抵御天然产物、化学消毒剂和蛋清等逆境因子的机制。例如,Pereira等发现苯扎氯铵、双氯苯双胍己烷等杀菌剂的连续使用会导致大肠杆菌耐药菌株的耐药泵(、)、孔道蛋白(、)、RNA聚合酶(、)等相关基因发生突变。此外,本课题组利用Illumina HiSeq平台对肠炎沙门氏菌的1 株蛋清抗逆菌株和1 株蛋清敏感菌株进行了全基因组测序,鉴定到70 个单核苷酸多态性位点差异和6 个插入缺失位点差异,这些差异位点涉及的基因主要与细胞分裂、DNA损伤修复、氨基酸代谢、三型分泌系统等相关。
1.2 三代测序技术的应用进展
三代测序技术也可单独用于食源性致病菌的抗逆机制研究,但目前的应用相对较少。例如,Nguyen等利用PacBio RS II平台对一株耐热的山夫登堡沙门氏菌ATCC 43845进行测序,获得了其基因组完成图。该菌的基因组大小为4.92 Mb,GC相对含量为52.2%,共有5 105 个基因。该菌的特色是具有两个通过基因水平转移而获得的TLPQC-1和TLPQC-2耐热基因座,位于一个341.3 kb大小的质粒上,这个质粒与IncHI2 R478质粒相似,但并不携带任何耐药基因。上述结果为这株典型的耐热山夫登堡沙门氏菌高温抗性形成机制的揭示提供了新视角。
1.3 二代与三代测序技术的联合应用进展
近年来,二代与三代测序技术常被联合用于食源性致病菌的耐药机制研究,主要研究思路是先对较大批量的菌株进行二代测序,然后挑选代表性菌株进行三代测序,并整合二代和三代测序数据来分析基因组特征。例如,Zheng Zhiwei等利用Illumina HiSeq平台对携带基因的33 株副溶血弧菌和2 株溶藻弧菌进行测序,并挑选2 株代表性菌株(Vb0624和Vb1636)进行Nanopore测序,发现这些菌株携带的基因上游是ISEcp1插入序列。其中,有32 株菌的基因位于染色体I的相同基因座上,有1 株菌的基因位于SXT/R391家族的新型整合性接合元件上,有1 株菌的基因位于IncP-1型质粒上。
同样借助MiSeq和Nanopore测序技术,Octavia等发现质粒携带的、或耐药基因与圣保罗沙门氏菌对第三代头孢菌素抗性的形成密切相关;González-Santamarina等发现多重耐药的德尔卑沙门氏菌和罗森沙门氏菌普遍携带耐药基因,包括四环素耐药基因(如、)、-内酰胺耐药基因(如、)、氯霉素耐药基因(如、)、磺胺耐药基因(如、)、喹诺酮耐药基因(如)等。
本课题组同时采用二代和三代测序技术对一株分离自鸡肉的泛耐药印第安纳沙门氏菌的基因组特征进行分析,获得了较精细的基因组完成图。这株菌基因组大小为5.01 Mb,包含4.77 Mb的基因组和0.24 Mb的质粒,其典型特点是具有28 个基因组岛、5 个沙门氏菌毒力岛和27 个耐药基因(位于IncHI2-IncHI2A质粒上)。这些较详细的基因组信息为研究细菌耐药性形成的分子机制奠定了基础。
由此可知,在食源性致病菌的抗逆机制研究中,全基因组测序技术主要用于代表菌株(如抗逆菌)的序列特征分析。二代测序技术具有高通量、低成本、高精准度等优势,但其序列读长限制增加了基因组拼接和后续数据分析的难度。以单分子测序为特点的三代测序技术虽克服了二代测序中存在的问题,但其测序错误率高,而且错误率是随机出现的。因此,将二代与三代测序技术联合使用可提高全基因组测序的准确度,这已成为基因组学技术在食源性致病菌抗逆机制研究中的应用趋势。
2 转录组学技术在食源性致病菌抗逆机制研究中的应用
转录组学技术可从整体水平上研究生物体(如食源性致病菌)在特定状态下(如胁迫因子)的基因转录水平和表达调控规律。转录组学技术主要包括基于杂交方法的基因表达谱芯片技术和基于测序方法的RNA-seq技术等。这些方法在沙门氏菌、单增李斯特菌、阪崎克罗诺杆菌、大肠杆菌O157:H7、空肠弯曲杆菌等致病菌抵御高温、低温、消毒剂、食品基质等逆境因子研究方面得到了较广泛的应用(表2),为食源性致病菌抗逆机制的深入解析提供了关键的基因和通路。
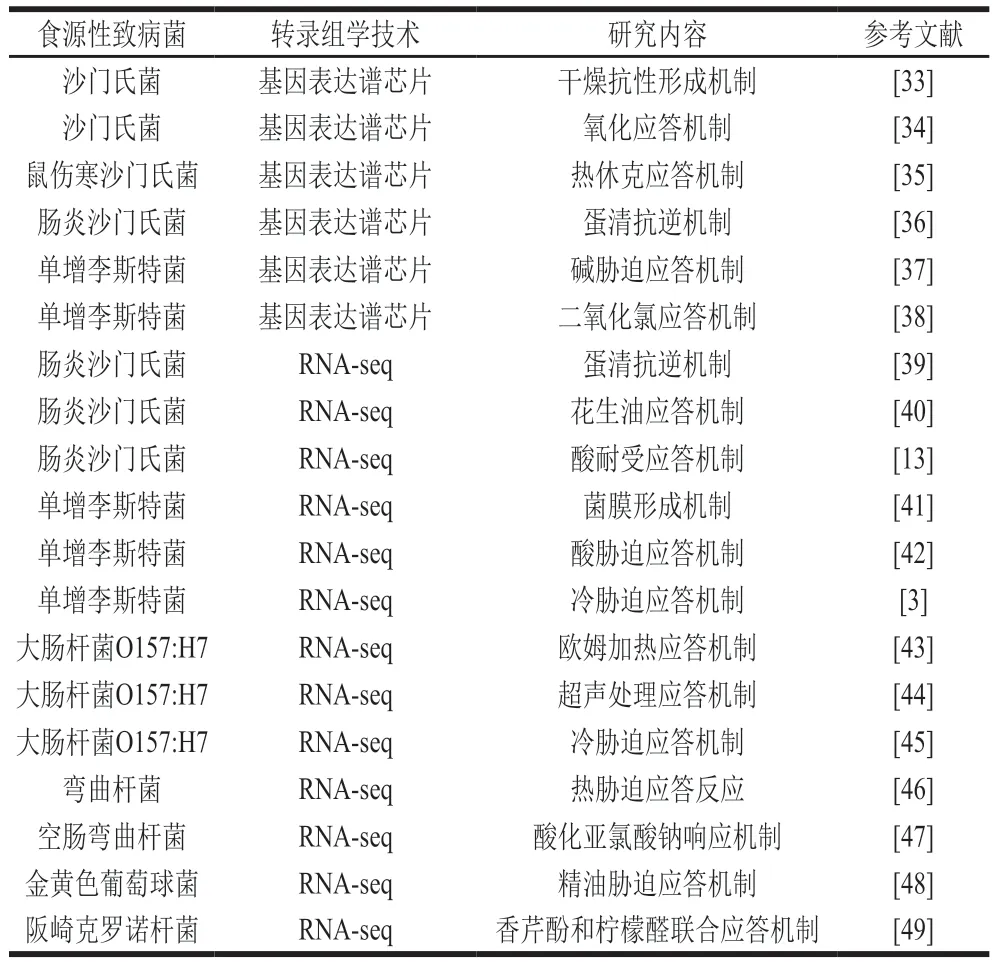
表2 转录组学技术在食源性致病菌抗逆机制研究中的应用案例Table 2 Application of transcriptomics technology in investigations on stress response mechanisms of foodborne pathogens
2.1 基因表达谱芯片技术的应用进展
基因表达谱芯片是基于核酸探针杂交的原理来检测基因的表达变化情况。目前,该技术已应用于沙门氏菌抵御干燥、次氯酸钠和高温等胁迫因子以及单增李斯特菌抵御碱和二氧化氯等胁迫因子的机制研究(表2)。
Li Haiping等以一株干燥抗性强的田纳西沙门氏菌和一株干燥抗性弱的鼠伤寒沙门氏菌为研究对象,通过基因表达谱芯片技术探索这两株菌在干燥胁迫下的转录谱差异,结果表明,田纳西沙门氏菌和鼠伤寒沙门氏菌分别有71 个基因(63 个基因表达上调、8 个基因表达下调)和94 个基因(85 个基因表达上调、9 个基因表达下调)的表达在干燥胁迫后发生显著变化,主要与脂肪酸、转运子、能量代谢、细胞膜、蛋白质合成、渗透胁迫等通路相关。其中,与鼠伤寒沙门氏菌相比,田纳西沙门氏菌的鞭毛合成和蛋白质合成降低、海藻糖合成增加、应激反应和细胞膜修饰被激活,表明这些是田纳西沙门氏菌形成干燥抗性的策略。
Wang Siyun等利用基因表达谱芯片技术探究沙门氏菌对次氯酸钠这一重要氧化型消毒剂的应答机制,结果表明,鼠伤寒沙门氏菌和肠炎沙门氏菌共有209 个基因的表达在次氯酸钠胁迫后发生了显著变化,这些基因主要与应激反应、核糖体合成、菌膜形成、能量代谢、半胱氨酸合成和铁硫簇组装等相关。此外,应激反应相关的33 个基因(如、)和毒力相关的19 个基因(如、)在鼠伤寒和肠炎这两种血清型的沙门氏菌中呈现出不同的表达模式,说明沙门氏菌可能启动一些血清型特异的方式来应答次氯酸钠胁迫。
2.2 RNA-seq技术的应用进展
RNA-seq技术主要借助高通量测序的方法来发掘差异表达基因。近年来,该技术在食源性致病菌的抗逆机制研究方面应用非常广泛,包括沙门氏菌应答酸、蛋清和花生油的机制探索,单增李斯特菌的菌膜形成机制研究,大肠杆菌O157:H7应答低温、超声和欧姆加热的机理解析(表2)。
Hu Shuangfang等通过RNA-seq技术探索肠炎沙门氏菌对酸胁迫的转录响应机制,发现酸胁迫导致该菌280 个基因的表达显著上调,274 个基因的表达显著下调。通过分析这些基因参与的生化代谢过程和信号转导通路,发现肠炎沙门氏菌主要通过降低能量损耗和蛋白乙酰化水平,启动应激反应和铁硫簇合成途径,并维持必要的细胞过程来应对酸胁迫。
曹启航采用RNA-seq技术对不同时期的菌膜和浮游状态单增李斯特菌进行测序,发掘到1 123 个与菌膜形成相关的基因,并通过实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)技术证实了转录组测序结果的可靠性。京都基因与基因组百科全书(Kyoto Ncyclopedia of Genes and Genomes,KEGG)通路分析结果进一步显示,差异表达基因主要与群体感应、细菌分泌、细菌趋化、鞭毛组装、磷酸转移酶系统等相关。这些研究结果为揭示单增李斯特菌菌膜这一重要抗逆态的形成机制奠定了基础。
RNA-seq技术也被用于研究肠炎沙门氏菌在蛋清(含有卵转铁蛋白、溶菌酶等抗菌因子)以及花生油(存在干燥和饥饿等胁迫环境)等食品基质中的存活机理。本课题组将RNA-seq技术用于肠炎沙门氏菌在蛋清逆境胁迫下的转录组响应机制研究,发现该菌在蛋清中孵育6、12、24 h后,分别有1 200、1 312、1 415 个基因的表达发生了显著变化;其中,表达显著上调的基因主要富集在碱性pH适应、渗透胁迫响应、铁吸收、DNA损伤修复、肽聚糖合成和交联、生物素合成等通路,表达显著下调的基因主要富集在翻译、核苷酸代谢、能量代谢、运动、沙门氏菌毒力岛等通路。此外,通过基因功能分析,揭示了包膜胁迫相关蛋白CpxR可正向调控基因的表达来响应蛋清逆境的胁迫。在致病菌应答花生油的研究中,Deng Xiangyu等借助RNA-seq分析发现肠炎沙门氏菌在花生油中干燥和饥饿胁迫等作用下几乎处于生理休眠状态,只有不足5%的基因转录成RNA。这些基因主要包括、、等热休克基因,、、等冷休克基因以及、等调控基因。此外,、、、、、等非编码RNA的表达也发生了显著变化,表明它们参与了肠炎沙门氏菌在花生油中的抗逆存活。
综上可知,基因表达谱芯片技术和RNA-seq技术均已被用于食源性致病菌的抗逆机制研究。然而,与基因表达谱芯片技术相比,RNA-seq技术具有多个优势,包括测定细菌完整转录组图谱、发现新转录本、获得基因转录起始位点等。因此,RNA-seq技术将成为食源性致病菌抗逆机制研究的主流转录组测序手段。
3 蛋白质组学技术在食源性致病菌抗逆机制研究中的应用
蛋白质组学技术主要用于研究一个生物体(如食源性致病菌)在特定状态下(如胁迫因子)的蛋白质整体表达水平和变化规律。在过去20 年间,双向电泳(two-dimensional electrophoresis,2-DE)、细胞培养条件下稳定同位素标记(stable isotope labeling by amino acids in cell culture,SILAC)、蛋白质非标记定量(label-free)、多维蛋白质鉴定(multidimensional protein identification technology,MudPIT)和同位素标记相对和绝对定量(isobaric tags for relative and absolute quantitation,iTRAQ)等多种蛋白质组学技术已被成功用于发掘食源性致病菌在物理因子(如高温、低温)、化学因子(如酸、盐、乙醇)和食品基质(如蛋清)胁迫下的差异表达蛋白质(表3),为抗性形成机制的揭示提供了必要的候选蛋白质。

表3 蛋白质组学技术在食源性致病菌抗逆机制研究中的应用案例Table 3 Application of proteomics technology in investigations on stress response mechanisms of foodborne pathogens
3.1 2-DE技术的应用进展
建立于1975年的2-DE技术是一项经典的蛋白质组学技术,其原理是基于蛋白质的等电点和分子质量差异来分离蛋白质,并可结合质谱技术来鉴定差异蛋白质。2-DE技术在单增李斯特菌的低温适应机制、克罗诺杆菌的渗透响应机制以及副溶血弧菌的乙醇耐受机制等研究方面得到了应用(表3)。
Cacace等借助2-DE技术开展蛋白质组学研究,并结合基质辅助激光解吸电离飞行时间质谱(matrixassisted laser desorption ionization time-of-flight mass spectrometry,MALDI-TOF MS)鉴定差异蛋白质,从而分析单增李斯特菌对低温的适应机制,结果发现,单增李斯特菌在4 ℃条件下,共有65 个蛋白质的表达发生显著变化(57 个蛋白质表达显著上调、8 个蛋白质表达显著下调),这些蛋白质主要与能量代谢、营养物质吸收、蛋白质合成、氧化应激和脂质合成等相关。
Riedel等通过2-DE和MALDI-TOF MS技术鉴定克罗诺杆菌响应渗透胁迫的相关蛋白质。他们分别采用物理干燥和直接添加氯化钠来营造两种不同类型的渗透胁迫,并在渗透处理的菌体中鉴定到80 个显著差异表达的蛋白点,这些蛋白点对应了53 个显著差异表达蛋白质。表达显著上调的蛋白质主要是DNA/RNA稳定酶、分子伴侣和氧化应激酶,表达显著下调的蛋白质主要是鞭毛结构蛋白和细胞隔膜相关蛋白。
Chiang等通过2-DE技术研究副溶血弧菌的乙醇耐受机制,发现乙醇胁迫导致该菌8 个蛋白质的表达上调、7 个蛋白质的表达下调,但是这些蛋白质大都未被鉴定。此外,免疫印迹分析发现,一个类似于GroEL的蛋白质的表达被乙醇胁迫所诱导,说明该蛋白质参与了副溶血弧菌的乙醇胁迫应答反应。
由此可知,2-DE技术过去在食源性致病菌的抗逆机制研究中得到了较广泛的应用。然而,由于该方法的灵敏度低、重复性差、蛋白质覆盖率低,无法对整个基因组所表达的全部蛋白质进行鉴定和定量。因此,SILAC、Label-free、MudPIT和iTRAQ等定量蛋白质组学研究方法应运而生。
3.2 SILAC技术的应用进展
SILAC技术是在添加有轻型、中型和重型同位素标记的必需氨基酸(如赖氨酸和精氨酸)的培养基中进行细胞培养,使得培养若干代细胞后,细胞内的蛋白质能够被同位素标记,然后将蛋白质等量混合并进行质谱鉴定。目前,该技术在食源性致病菌抗逆机制研究中的应用相对较少,主要集中于副溶血弧菌低温胁迫适应机制研究。例如,Ma Weixing等利用SILAC技术分析副溶血弧菌应对4 ℃低温胁迫的蛋白质表达谱变化,共鉴定到1 182 个蛋白质,并对其中的601 个蛋白质进行了定量分析,结果表明,低温胁迫导致副溶血弧菌51 个蛋白质的表达显著上调,129 个蛋白质的表达显著下调。KEGG通路分析结果显示,这些差异表达蛋白质主要集中于磷酸戊糖途径、糖酵解、三羧酸循环、转录、翻译等通路。在后续的SILAC技术优化过程中,可以重点针对价格昂贵、脱靶率高等问题展开攻关,从而扩大其在食品安全领域的应用范围。
3.3 Label-free技术的应用进展
Label-free技术无需同位素标记,通过比较质谱峰强度或质谱分析次数,测定不同组别样品中的蛋白质表达差异。目前,Label-free技术在食源性致病菌抗逆机制研究中的应用相对较少,主要用于探究大肠杆菌的热应激反应。例如,Tian Xiaojing等利用Label-free技术探究大肠杆菌O157:H7对欧姆加热的应答反应,共鉴定到2 633 个蛋白质。其中,高强度(10 V/cm)和低强度(5 V/cm)的欧姆加热分别导致169 个和84 个蛋白质的表达发生显著变化,这些蛋白质主要集中于二羧酸代谢、ABC转运、氨基酸合成、甘油磷脂代谢、核糖体代谢等通路。由于Label-free技术成本较低,并可提高蛋白质定量的准确性和低丰度蛋白质的检测效率,因此在未来研究食源性致病菌的抗逆机制时可以合理选用。
3.4 MudPIT技术的应用进展
MudPIT是多维蛋白质鉴定技术,该技术先通过特异性的胰蛋白酶消化产生多肽,然后进行多维毛细管液相色谱分离,最后进行电喷雾串联质谱分析。目前,MudPIT技术主要用于肠炎沙门氏菌应答低温等离子体胁迫以及单增李斯特菌应答乳酸链球菌素、氢氧化钠胁迫方面的研究(表3)。
Miyamoto等利用MudPIT技术探索单增李斯特菌对乳酸链球菌素的应答机制,发现有13 个蛋白质的表达发生了显著变化(9 个蛋白质表达显著上调、4 个蛋白质表达显著下调),以上蛋白质主要与代谢过程、氧化应答、运动性等相关。此外,Ritter等借助MudPIT技术分析肠炎沙门氏菌在低温等离子体处理下的蛋白质表达谱变化,共在处理组菌体中鉴定到249 个特异性表达的蛋白质,这些蛋白质主要与乙二醛酶I、ABC转运系统底物结合蛋白、转录激活因子、氧化还原酶等相关。MudPIT技术可对样品量较少的蛋白质进行快速分析,但不能提供蛋白质翻译后修饰的相关信息,因此可根据研究目的合理地将该技术用于食源性致病菌抗逆机制研究。
3.5 iTRAQ技术的应用进展
iTRAQ是美国AB SCIEX公司推出的体外同位素标记新技术,采用同位素标记多肽的氨基基团,并结合高精度的串联质谱分析,从而对不同样品中的蛋白质进行定量。该方法灵敏度高、重复性好,近年来在阪崎克罗诺杆菌、金黄色葡萄球菌、沙门氏菌、空肠弯曲杆菌等重要食源性致病菌的抗逆机制研究中得到了较广泛的应用(表3)。
Hu Shuangfang等利用iTRAQ技术发掘阪崎克罗诺杆菌应对干燥胁迫的相关蛋白质,共鉴定到87 个表达显著上调的蛋白质和146 个表达显著下调的蛋白质。基因本体论(gene ontology,GO)和KEGG分析结果显示,渗透胁迫相关蛋白质的合成被干燥胁迫所诱导,而毒力、黏附和鞭毛相关蛋白质的表达在干燥胁迫后受到抑制,表明这些通路参与了阪崎克罗诺杆菌干燥抗性的形成。
Thai等以氟喹诺酮诱导的金黄色葡萄球菌耐药菌株为研究对象,利用iTRAQ技术发掘到147 个与耐药性形成相关的蛋白质,并借助荧光定量PCR实验确证了蛋白质组学结果的可靠性。String分析结果进一步显示,代谢途径、氨酰-tRNA合成和核糖体相关蛋白质的互作关系密切,暗示了这些通路在金黄色葡萄球菌氟喹诺酮耐药性形成中可能发挥重要作用。
本团队将iTRAQ技术用于肠炎沙门氏菌这一重要食源性致病菌的抗逆机制研究,主要通过该技术发掘沙门氏菌抗逆相关的蛋白质,并借助荧光定量PCR技术和基因敲除技术鉴定关键抗逆蛋白质。例如,He Shoukui等通过iTRAQ技术发掘到肠炎沙门氏菌乙醇抗性形成相关的138 个蛋白质,这些蛋白质主要与ABC转运子、代谢、调控子、核糖体和毒力岛等通路相关。基因功能分析结果进一步表明,ABC转运子途径的和嘌呤代谢通路的在抗性形成过程中发挥负向调控作用。此外,Qin Xiaojie等将iTRAQ技术应用于肠炎沙门氏菌在蛋清逆境中的存活机制研究,发现分别有273、284 个和303 个蛋白质的表达在50%、80%和100%蛋清的胁迫下发生显著变化,大多数表达显著上调的蛋白质与铁吸收、氨基酸合成、转运子、调控子和应激反应相关,大多数表达显著下调的蛋白质与能量代谢、运动和毒力相关。其中,应激反应途径的硫酯酶基因缺失导致肠炎沙门氏菌在蛋清中的存活能力显著降低,这可能与细胞膜的破裂和细胞形态的改变相关。
综上可知,在众多蛋白质组学研究方法中,2-DE技术过去在食源性致病菌的抗逆机制研究中应用较多,但该技术具有灵敏度低、重复性差、蛋白质覆盖率低等缺点。因此,iTRAQ等定量蛋白质组学技术目前常用于发掘食源性致病菌抗逆相关蛋白质。
4 代谢组学技术在食源性致病菌抗逆机制研究中的应用
代谢组学技术是以生物体(如食源性致病菌)的所有代谢物为研究对象,考察分子质量小于1 000 Da的小分子在特定状态下(如胁迫因子)的含量变化规律。根据研究对象的差异,代谢组学可分为非靶向代谢组学(分析未知化合物)和靶向代谢组学(分析已知化合物)。根据分析手段的不同,代谢组学可分为气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)代谢组学和核磁共振(nuclear magnetic resonance,NMR)代谢组学等。这些技术已在单增李斯特菌、大肠杆菌、鼠伤寒沙门氏菌、金黄色葡萄球菌等多种致病菌抵御环境压力的研究方面取得了一些应用(表4),在一定程度上推动了食源性致病菌抗逆机制的探索进程。

表4 代谢组学技术在食源性致病菌抗逆机制研究中的应用案例Table 4 Application of metabolomics technology in investigations on stress response mechanisms of foodborne pathogens
4.1 GC-MS技术的应用进展
GC-MS是以离子荷质比(电荷-质量比)测量为基础的分析仪器,具有灵敏度高、分辨率高、重现性好、公共数据库定性方便等优势。近年来,GC-MS技术在食源性致病菌应答低温、酸、盐、抗生素等多种胁迫因子的研究中得到了应用(表4)。例如,Singh等借助GC-MS技术分析单增李斯特菌对8 ℃低温胁迫的代谢应答响应,发现64 个代谢物的含量发生显著变化(56 个代谢物的含量显著增加、8 个代谢物的含量显著降低)。其中,胞内氨基酸、糖类、有机酸、多胺和相容性溶质等物质的含量增加,这些物质可抑制冰晶的形成,保护单增李斯特菌免受低温的损害。此外,吴芮庭采用GC-MS技术分析了鼠伤寒沙门氏菌敏感菌株、耐药质粒pHXY0908携带菌株、替加环素耐药并携带pHXY0908菌株的代谢组学差异,发现氨基酸代谢、嘧啶代谢和ABC转运是重要的代谢通路,其中氨基酸代谢通路中的-天冬氨酸是关键代谢物,可作为深入研究耐药机制的切入点。
4.2 NMR技术的应用进展
NMR技术具有制样简单、重复性好、检测无偏向性等优点,可检测微生物细胞内发生的生物化学变化。目前,NMR技术在食源性致病菌抗逆方面的应用研究主要是由新加坡国立大学Yang Hongshun博士课题组开展的。该课题组成功利用该技术探索了大肠杆菌对电解水、乳酸、超声等胁迫因子的代谢应答响应(表4)。例如,Liu Qin等利用NMR技术探索大肠杆菌对电解水的代谢应答机制,发现亚抑菌浓度的电解水导致28 个代谢物(包括氨基酸、核苷酸、有机酸)的含量发生显著变化。这些代谢物富集在30 个通路中,其中5 个通路与电解水应激反应密切相关,分别为氨酰-tRNA生物合成,缬氨酸、亮氨酸和异亮氨酸生物合成与降解,甘氨酸、丝氨酸和苏氨酸代谢,丙氨酸、天冬氨酸和谷氨酸代谢,以及精氨酸和脯氨酸代谢。
鉴于GC-MS技术和NMR技术在致病菌抗逆机制研究方面的优势,后续研究可进一步拓展这些技术的应用范围。此外,利用这些技术发掘出的关键代谢物,有望作为食源性致病菌抗逆菌株的生物标志物,用于抗逆菌株检测技术的建立。
5 多组学技术联合分析在食源性致病菌抗逆机制研究中的应用
食源性致病菌在应对外界胁迫时,会启动不同的生理生化代谢系统,以适应环境变化。因此,食源性致病菌抗逆性的形成是多个代谢通路协调作用的复杂调控过程,仅从基因、sRNA、蛋白质或代谢物等层次中的任一方面都无法完整揭示其中的分子机制。多组学联合分析是突破单一组学研究瓶颈的有效方法,可从转录到代谢层面反映致病菌变化的全过程,实现不同层次数据的整合互补,从而推动食源性致病菌抗逆机制的全面解析。在过去数年间,多组学联合分析技术已被用于食源性致病菌的抗逆机制研究,包括金黄色葡萄球菌对细菌素和单宁的应激反应、单增李斯特菌的碱耐受反应以及空肠弯曲杆菌的酰胺醇类耐药机制等方面(表5)。

表5 多组学技术联合分析在食源性致病菌抗逆机制研究中的应用案例Table 5 Application of multi-omics technologies in investigations on stress response mechanisms of foodborne pathogens
Du Hechao等应用转录组学和蛋白质组学技术探究耐甲氧西林的金黄色葡萄球菌对亚抑菌浓度细菌素Plantaricin GZ1-27的应激反应,发现有1 090 个基因和418 个蛋白质的表达发生显著变化。其中,75.9%(173/228)的基因在mRNA和蛋白质水平上的变化趋势一致,说明转录组学和蛋白质组学数据之间的关联性较好。生物信息学分析结果进一步显示,在转录和翻译层面均发生显著变化的基因主要集中在菌膜形成、DNA复制与损伤修复、应激反应、嘌呤代谢和氨基酸代谢等途径。细菌素Plantaricin GZ1-27引起的菌膜形成相关基因和蛋白质的表达变化,的确导致金黄色葡萄球菌菌膜形成受到抑制,在一定程度上证实了多组学技术联合分析在食源性致病菌抗逆机制研究方面的应用优势。
此外,借助转录组学和代谢组学联合分析,Liu Miaomiao等揭示了金黄色葡萄球菌耐甲氧西林菌株通过渗透压、pH值、氨基酸合成与代谢、三羧酸循环、铁离子代谢等方面的调控来应答亚抑菌浓度的单宁胁迫,Fleury等阐明了金黄色葡萄球菌通过调控渗透压稳态、氧化应激、金属离子转运、ATP合成来应答高温胁迫。通过整合基因组学和转录组学数据,Kim等发现苯扎氯铵的使用会导致铜绿假单胞菌外排泵基因的过表达以及基因的突变,从而诱导该菌对多黏菌素B和其他抗生素产生耐药性。此外,李会通过转录组学、蛋白质组学和代谢组学等3 种组学技术联合分析,发现空肠弯曲杆菌酰胺醇类耐药性的形成主要与鞭毛组装、ABC转运蛋白、核糖体、趋化蛋白相关。
综上可知,多组学技术联合分析比单一组学分析在食源性致病菌抗逆机制研究方面更具优势。例如,转录组学与代谢组学数据的关联,可实现差异基因和差异代谢物的共表达分析,促进基因和代谢物变化之间的因果关系探究,进而锁定关键基因、代谢物和通路,系统解析致病菌的抗逆机制。因此,可将多组学技术联合分析合理用于抗逆基因、sRNA、蛋白质和代谢物的发掘工作,从而推动食源性致病菌抗逆分子机制的探索进程。
6 结 语
基因组学、转录组学、蛋白质组学和代谢组学等技术具有通量较高的优势,已在食源性致病菌抗逆机制解析方面得到了较为广泛的应用。综合目前的文献报道来看,通过比较外源理化因子施加与不施加条件下食源性致病菌的组学特征,或者解析抗逆菌株与敏感菌株的组学特征差异,进而对差异基因、sRNA、蛋白质和代谢物进行GO功能聚类和KEGG代谢通路等方面的生物信息学分析,是组学技术在食源性致病菌抗逆机制研究中的主流研究思路。这些研究结果显示,食源性致病菌抗性的形成并不是某个基因、sRNA、蛋白质或代谢通路单独作用的结果,而是多个基因、sRNA、蛋白质和多个代谢物协调作用的综合表现,涉及多个网络的调控。
在这一研究领域,以后可以重点考虑开展以下方面的工作:1)实现从单一组学研究到多组学整合分析的转变,从而更全面更精准地发掘关键抗逆元件,并且强化高通量组学技术在抗逆基因、sRNA和蛋白质功能分析和互作模式构建方面的应用,从而揭示食源性致病菌抗性形成的调控网络和过程机制;2)建立以抗逆基因、抗逆sRNA、抗逆蛋白质、抗逆代谢物和关键代谢通路为主体的抗性组数据库,并且推动以这些抗逆元件为靶标的新型控菌技术的建立,从而为保障食品安全和公众健康作出重要贡献。
