中长链游离脂肪酸及其受体FFAR1和FFAR4对健康作用的研究进展
2022-10-28郑子晴鲁丁强庞广昌
郑子晴,牛 博,鲁丁强,2,*,庞广昌,2,*
(1.天津商业大学生物技术与食品科学学院,天津 300134;2.天津市食品生物技术重点实验室,天津 300134)
游离脂肪酸是血浆中脂肪酸的非酯化形式。中长链游离脂肪酸不仅是人体的重要能量来源,也作为信号分子在机体中发挥作用。近年来的研究发现中长链游离脂肪酸可通过激活肠道、味蕾等部位的相应膜受体调节食欲和新陈代谢,与肥胖、脂代谢紊乱、2型糖尿病等多种代谢疾病的发生发展密切相关。
目前已确认存在多种游离脂肪酸受体(free fatty acid receptors,FFARs),包括FFAR1、FFAR2、FFAR3、FFAR4、GPR84和GPR119等,均属于G蛋白偶联受体家族(G-protein-coupled receptors,GPCRs)成员,可激活多种生理功能,包括促进胰岛素和肠降血糖素分泌、脂肪细胞分化、抗炎、促进神经元反应、调节食欲等。本综述重点讨论了饮食中的中长链游离脂肪酸作为膳食营养发挥的作用,以及通过调节其受体(包括FFAR1和FFAR4)对健康的影响,同时讨论这两种受体重叠或互补的生理功能。
1 中长链游离脂肪酸作为膳食营养发挥作用
日常饮食中,中长链游离脂肪酸的摄入量和种类影响肥胖、糖尿病等代谢疾病的发展,但其潜在的有益功能却没有得到足够重视,例如构成磷脂膜、介导受体信号传导、调节机体能量稳态。血浆中的游离脂肪酸来自于脂肪酶分解储存的甘油三酯(triacylglycerol,TAG),这些脂肪酸的酰基链长度、不饱和度以及在TAG分子内位置的不同,进一步导致其营养特性和生理功能的不同(表1)。研究表明,植物或海洋藻类中的油酸、亚油酸(linoleic acid,LA)和亚麻酸可降低患心血管疾病的风险,而动物来源的脂质含有高水平的饱和长链脂肪酸(long chain fatty acids,LCFA),例如棕榈酸和硬脂酸,是导致心脑血管疾病的危险因素;另外,与疾病相关的饱和脂肪酸主要是LCFA,而不是中链脂肪酸(medium chain fatty acids,MCFA)。

表1 中长链脂肪酸结构、功能及分类Table 1 Structures, functions and classification of medium- and longchain fatty acids

续表1
1.1 中长链脂肪酸饮食对健康的影响
欧洲营养与营养学学会建议健康成年人从膳食脂肪得到的能量占能量总摄入的20%~35%。MCFA主要存在于动物乳汁、椰子油、棕榈仁油中;其作为食品添加剂广泛应用于人造黄油、烹饪油、巧克力涂层、干酪加工、植物油、蛋黄酱和调味品。MCFA也可在食品加工中作为疏水性风味物质的介质,赋予食品良好的光泽。研究发现大脑可以利用MCFA作为葡萄糖的替代供能物质,摄入MCFA可以提高脑酮水平,从而改善老年人和阿尔兹海默症患者的认知功能。
LA和ALA是机体的必需脂肪酸,由于人类缺乏在碳原子数超过9或10的脂肪酸中引入双键的能力,因此必须从饮食中获得LA和ALA。LA和ALA可以通过一系列延伸、去饱和转化为其他LCFA,如-3脂肪酸EPA和DHA以及-6脂肪酸花生四烯酸。但在人体内ALA向EPA和DHA的转化效率较低,需要额外通过摄入鱼类、贝类和海鲜获得EPA和DHA。-3和-6脂肪酸是合成类花生酸(如白三烯(leukotrienes,LTs)、前列腺素(prostaglandins,PGs)、血栓素和消退素)的前体物质。相比于利用-3脂肪酸EPA合成PGE和LTB,利用-6脂肪酸花生四烯酸合成的PGE和LTB是形成血栓的有效介质。此外,-6/-3比率失衡以及-6多不饱和脂肪酸的过多摄入会增加炎症信号水平,从而导致肥胖和糖尿病发病率增高。事实上,在冰岛和阿拉斯加土著人中观察到经常食用富含-3多不饱和脂肪酸的食物可降低这些代谢性疾病的发病率。
1.2 中长链脂肪酸在体内的代谢途径
MCFA、LCFA的吸收代谢方式有很大不同。MCFA包括己酸、辛酸、癸酸和月桂酸,碳链长度比LCFA短且具水溶性,通过被动扩散在肠腔被快速吸收,吸收后的MCFA以游离形式通过门静脉运输到肝脏,立即被利用转化成能量,不在肝脏、肌肉和脂肪内累积。MCFA不需要肉碱作为载体,可跨线粒体膜运输,迅速在肝线粒体中发生β氧化降解,产生过量的乙酰辅酶A,从而生成酮体。因此,对于有高能量需求的个体来说,摄入MCFA是一个很好的选择,例如术后以及发育迟缓的群体建议补充MCFA。辛酸、癸酸甘油酯分子质量小、溶解性好、易消化吸收、可快速氧化供能,在血液中可被快速清除,在临床上常作为营养辅助剂加快身体痊愈。
相比较之下,LCFA不直接扩散到肠道毛细血管,它们通过脂肪酸转位酶(fatty acid translocase,FAT或CD36)和脂肪酸转运蛋白4(fatty acid transport protein 4,FATP-4)被肠道吸收,然后重新组装成TAG,被胆固醇和蛋白质包裹,形成乳糜微粒,乳糜微粒通过淋巴系统将TAG输送到组织中。
血浆中的游离脂肪酸来自于脂肪酶分解储存的TAG,其可作为肌肉收缩和全身代谢的供能物质。小肠不仅是中长链脂肪酸消化的主要场所,还是中长链游离脂肪酸吸收的场所,吸收率高达95%,其中大部分被十二指肠和空肠肠上皮细胞吸收。吸收的游离脂肪酸发生β氧化,经柠檬酸循环分解为CO和水,以ATP的形式释放大量能量。因此,中长链游离脂肪酸可为各种组织提供能量。
2 FFAR1和FFAR4所介导的生物学效应
游离脂肪酸不仅是重要的能源物质,还能在机体中作为信号分子通过激活相应受体发挥一系列生物学效应。已有研究表明,机体内游离脂肪酸及其代谢物通过激活过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor gamma,PPARγ)促进脂肪细胞分化和转化来促进脂肪储存,进一步研究发现游离脂肪酸也能直接作用于细胞膜受体发挥功能。GPR40和GPR120分别在2003年和2005年被鉴定为LCFA/MCFA受体和LCFA受体,随后被重命名为FFAR1和FFAR4。其中FFAR1主要在胰岛β细胞、肠道L和K细胞、免疫细胞、味蕾和中枢神经系统细胞中表达;而FFAR4在肠内分泌细胞、味觉细胞、脂肪细胞和免疫细胞,特别是在哺乳动物促炎巨噬细胞和成熟的脂肪细胞中高度表达。FFAR1和FFAR4负责监测细胞外中长链游离脂肪酸浓度,激活细胞内信号转导途径,最终通过一系列细胞反应发挥能量调节、免疫稳态和神经元功能(表2)。

表2 FFAR1和FFAR4的G蛋白信号、表达组织/细胞和生物学功能Table 2 G protein signals, expression tissues/cells and biological functions of FFAR1 and FFAR4
中长链游离脂肪酸作用于FFAR1和FFAR4发挥生物学功能的信号途径如图1所示。FFAR1和FFAR4都能与G蛋白家族偶联,激活磷脂酶C(phospholipase C,PLC)和磷脂酰肌醇信号通路,促进质膜磷脂酰肌醇-4,5-二磷酸(phosphatidylinositol-4,5-bisphosphate,PIP2)生成肌醇三磷酸(inositol-trisphosphate,IP3)和二酰基甘油(diacylglycerol,DAG),然后IP3转移到内质网,导致内质网释放Ca,而DAG通过刺激蛋白激酶C(protein kinase C,PKC)促进胰岛素分泌;FFAR4与G蛋白偶联也能激活细胞外信号调节激酶(extracellular regulated protein kinases,ERK) 1/2信号。-arrestin2也是FFAR1和FFAR4信号的负调节因子,阴碍G蛋白与FFAR1和FFAR4的结合,降低FFAR1和FFAR4对游离脂肪酸信号的敏感性。另外,-arrestin2作为支架蛋白将FFAR1和FFAR4信号通路与丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)级联,从而影响细胞增殖和免疫功能。不同的是,FFAR1与G和G蛋白偶联,通过G/G偶联途径降低/增加环腺苷酸磷酸(3’-5’-cyclic adenosine monophosphate,cAMP)水平;而FFAR4与G或G蛋白家族不偶联,胰岛β细胞和原代胰岛细胞中并未检测到cAMP的产生。虽然FFAR4与其配体的亲和力与FFAR1与其配体的亲和力相近,但这两种受体仅有10%的氨基酸同源性,相似的配体特异性可能是趋同进化的结果。

图1 中长链游离脂肪酸受体的配体特异性和信号通路[4]Fig. 1 Ligand specificity and signal pathways of medium- and longchain free fatty acid receptors[4]
2.1 介导味觉信号传感
脂肪酸味被认为是第六种味道,啮齿动物和人类的舌头上都存在传感脂肪酸的受体。FFAs的口腔感觉被描述为“scratchy(瘙痒)”,但只有中长链游离脂肪酸会引起这种“fatty(脂肪味)”或“油腻感”。识别摄入的游离脂肪酸是形成饱腹感和最合理能量摄入的关键,因此游离脂肪酸的味觉信号传感不可或缺。FFAR1和FFAR4在舌头味蕾细胞(分布于叶状乳头和轮廓乳头)中表达。口腔中的脂肪酶水解TAG释放游离脂肪酸,从而激活FFAR1和FFAR4传导这种“脂肪”味道。Cartoni等比较了野生型和、基因敲除(/)小鼠对脂肪酸的偏好和味觉神经反应,发现在短期或长期脂肪酸偏好测试中,和小鼠对油酸和LA的味觉神经反应减弱,对脂肪酸的偏好受到抑制,表明这两种受体能传感脂肪酸味觉信号;另外,作者指出FFAR1主要在舌后部表达,而FFAR4主要在舌前部和后部表达。
然而,在人类的味蕾中还没有发现FFAR1,因此,FFAR1对于人类味蕾中的脂肪酸味觉信号传感可能并不重要。然而FFAR1在人类小肠中的表达量比FFAR4和GPR119高;而FFAR4是人类大肠中表达最高的营养受体之一,其表达量与体脂率呈正相关。FFAR1和FFAR4是否通过在肠道和胰腺中表达从而调节肥胖群体对脂肪酸的偏好,还需要进一步的研究。
与FFAR1相比,FFAR4可能对人类味觉反应系统更重要。Xu Qiuda等研究FFAR4对不同脂肪酸的传感动力学,发现FFAR4对14 种常见的短、中、长链天然脂肪酸均有响应,说明FFAR4上有脂肪酸羧基的特异性识别位点,但发挥下游信号激活的识别位点仍有待进一步探索。该作者还发现人和大鼠对同种脂肪酸的传感灵敏度并不相同,这可能是因为人与大鼠FFAR4氨基酸序列相似性仅为82%,且不同物种之间FFAR4对配体的亲和力存在差异。尽管Cartoni等的研究结果表明,在48 h脂肪酸偏好测试或短暂测试中,基因敲除()小鼠对脂肪酸的偏好减弱,说明FFAR4在味蕾中介导脂肪酸味觉传感;然而,Ancel等的研究表明,口腔舌侧FFAR4对于小鼠口服脂肪酸后口腔对其的味觉传感并不是必需的,CD36和FFAR4在调节脂肪酸偏好中发挥了不同但互补的功能。Stone等也报道在摄食行为测试中基因缺陷型小鼠无法传感脂肪酸或偏好非脂肪酸类的FFAR4激动剂。Ozdener等则认为在脂肪酸的味觉感知过程中,CD36和FFAR4对游离脂肪酸信号传感的作用并不重叠,游离脂肪浓度较低时仅通过CD36诱导Ca信号。而Shanmugamprema等进一步研究发现CD36在脂肪味觉信号传导中发挥的作用可能是将脂肪酸分子从唾液和血浆转移实际的受体如FFAR4。
显然,FFAR4介导的脂肪酸味觉传感作用在大鼠、小鼠和人类中还存在争议,因此,进一步的详细研究对于确认FFAR4在不同物种中介导脂肪酸味觉信号传感和摄食偏好中发挥的作用是至关重要的。
2.2 调节神经系统功能
FFAR1在大脑皮层、海马区、杏仁核、下丘脑、小脑和脊髓神经元中广泛表达。研究表明FFAR1信号可诱导神经元分化并促进神经突触生长和分支。Zamarbide等发现在人神经母细胞瘤细胞中,FFAR1信号通过诱导cAMP响应元件结合蛋白(cAMP responsive element binding protein,CREB)和ERK1/2的磷酸化来促进突触和神经可塑性基因(如脑源性神经营养因子(the brain-derived neurotrophic factor,BDNF)的表达。
除了与中枢神经系统发育相关,FFAR1信号还与焦虑症、抑郁症和阿尔茨海默症等精神障碍疾病相关,发挥的功能取决于配体类型。Chatterjee等发现辅助口服辛酸和正癸酸能显著改善阿尔茨海默症患者语言记忆和认知水平。Harauma等的研究表明低-3多不饱和脂肪酸饮食的啮齿动物表现出攻击性和抑郁行为,且高水平饱和脂肪酸饮食的啮齿动物也表现出焦虑和攻击行为。海马单胺系统调节焦虑样行为,Aizawa等通过分析野生型小鼠与基因缺陷小鼠的情绪行为,发现基因缺陷型小鼠海马、下丘脑的去甲肾上腺素水平升高,也更容易表现出焦虑及抑郁行为;说明基因缺陷可导致海马区单胺水平增加,去甲肾上腺素神经元发育异常,产生焦虑和抑郁行为;该作者还发现在蔗糖偏好测试中,基因缺陷型小鼠蔗糖偏好降低且摄入量减少。蔗糖偏好测试一般用于评估抑郁行为,其特征是无快感。这些都表明FFAR1信号有助于抑制抑郁行为。
FFAR4信号调节神经系统功能可能是通过减轻神经炎症来改善摄食行为和能量稳态。研究证实摄入-3脂肪酸如DHA和EPA有助于控制情绪,这表明FFAR4信号在调节情绪中的潜在作用。尽管能在人和龋齿动物中枢神经系统中检测到FFAR4的表达,但人们对其在中枢神经系统中发挥的作用仍知之甚少,需要进一步的研究来阐明FFAR4信号在神经系统中的重要性。
2.3 介导抗炎作用
激活FFAR1和FFAR4可在体内产生抗炎活性。Shen Lulu等研究发现,FFAR1、FFAR4及其下游蛋白-arrestin2在感知-3脂肪酸后会抑制富含亮氨酸的核苷酸结合寡聚结构域的重复序列受体蛋白(nucleotidebinding oligomerization domain leucine-rich repeatcontaining receptor protein,NLRP)3炎症体的组装和活化,NLRP3炎症体是一种细胞内多聚体蛋白复合物,在人类糖尿病等炎症性疾病发病机制中起重要作用。Nagatake等研究发现在小鼠和食蟹猴接触性超敏反应模型中,花生四烯酸的代谢产物17,18-环氧花生四烯酸通过激活FFAR1来抑制中性粒细胞移动从而发挥抗过敏和抗炎作用。
FFAR4能介导巨噬细胞抗炎作用。FFAR4被GPCR激酶磷酸化,然后与-arrestin2偶联,随后内化为FFAR4-arrestin2信号复合物。该复合物与TAB1结合,抑制TAB1介导的TAK1激活,TAK1通过MKK4/JNK和IKKβ/NF-κB信号途径抑制下游促炎信号传导;同时,该抗炎机制还依赖于-arrestin2介导的ERK1/2的激活,进一步抑制NF-κB的信号转导。Oh等发现采用FFAR4的合成激动剂化合物A(compound A,cpdA)治疗后,抑制了高脂饮食喂养的肥胖小鼠原发性巨噬细胞炎症过程中的磷酸化调节激酶如IKKβ、JNK、TAK1的磷酸化从而发挥抗炎作用。
Anbazhagan等利用人肠上皮细胞Caco-2和小鼠肠上皮内分泌细胞系STC-1的体外模型研究肠上皮细胞中FFAR4激活依赖性抗炎通路时发现,Caco-2细胞中观察到上述抗炎信号通路,而在STC-1细胞中没有观察到因FFAR4-arrestin2偶联产生的抗炎反应。Mobraten等研究也发现Caco-2细胞表达FFAR4但不表达FFAR1。但用FFAR4激动剂GW9508和TUG-891处理后,STC-1分泌GLP-1水平所增加。这些现象表明FFAR4在同一组织的不同细胞类型中诱导不同的信号通路。因此这种细胞类型特异性效应可能为开发靶向不同信号通路的药物来治疗炎症性疾病提供新的思路。
此外,Shewale等研究发现小鼠肝脏Kupffer细胞、循环单核细胞和中性粒细胞均表现出多不饱和脂肪酸激活的FFAR4抗炎作用,饲喂富含-3脂肪酸的蓝蓟油和富含-6脂肪酸的琉璃苣油显著降低了野生型小鼠脾中性粒细胞增多症和单核细胞增多症;抑制了肝巨噬细胞促炎基因的表达;尽管通常认为-6脂肪酸是促炎介质的前体,但作者发现在激活白细胞FFAR4的抗炎作用以及配体特异性方面,-3和-6这两类多不饱和脂肪酸作用相似,可能的原因是多不饱和脂肪酸氧化增加从而引发了抗炎作用,值得注意的是,只有小剂量的-6脂肪酸才可以激活FFAR4产生抗炎作用,饮食剂量的-6多不饱和脂肪酸会抵消这种抗炎作用。尽管很多研究确定了DHA和EPA的抗炎作用,但FFAR4是否是-3脂肪酸发挥抗炎作用的真正介质仍有疑问。Hirasawa等通过体外实验发现在含1%牛血清白蛋白的培养基中,FFAR4不会被DHA激活,即使在FFAR4过表达的细胞系统中,FFAR4对-3脂肪酸的半最大效应浓度(half maximal effective concentration,EC)也相对较高(1~10 mmol/L)。长期高剂量-3脂肪酸治疗会引起FFAR4脱敏,然而长期食用-3脂肪酸对机体有益。Yamada等也指出,补充EPA可以抑制高脂肪、高蔗糖饮食小鼠脂肪组织中的炎症信号转导,但并未证明这种EPA诱导的效应是通过FFAR4产生的。Paerregaard等发现与喂食-6脂肪酸的基因敲除小鼠相比较,喂食-3多不饱和脂肪酸的敲除小鼠抗炎脂肪因子、脂联素循环蛋白水平增加,空腹胰岛素水平下降,内脏脂肪组织中促炎症分子的mRNA表达量减少;因此作者提出-3脂肪酸发挥抗炎和胰岛素抵抗的作用可能独立于FFAR4信号,而与抗炎、胰岛素敏感性脂肪因子、脂联素水平的增加相关。
总体来说,大量体内外实验表明FFAR1和FFAR4信号与抗炎作用有关,但是否介导-3多不饱和脂肪酸的抗炎作用仍有争议,有待进一步的分子生物学验证。
2.4 调节食欲和改善肥胖
肥胖是长期能量消耗和摄入之间不平衡的结果,肥胖引起的慢性炎症与胰岛素抵抗和2型糖尿病等疾病的发展直接相关。中长链脂肪酸与肥胖间的关系较复杂。虽然餐后血浆游离脂肪酸水平的增加会导致胰岛素分泌量增加,但长期高脂尤其是高饱和脂肪酸饮食,会促使β细胞凋亡;同时机体中的脂肪酸也会激活摄食奖励系统,导致摄入更多脂肪。在正常状态下,当摄入的脂肪酸超过肠道的吸收能力时,肠道中的FFAR1和FFAR4向大脑传递“油腻”的味道,停止进食,因此FFARs的功能缺失会导致机体过度摄入脂肪。Ichimura等报道缺陷大鼠储存的脂肪比野生型大鼠多得多,肥胖和胰岛素抵抗也更严重。Stone等发现喂食-3脂肪酸后野生型小鼠的胰岛素敏感性增强,但在缺陷的高脂饮食小鼠中并未观察到此效应。综上,FFAR1和FFAR4的功能障碍可能是导致肥胖和肥胖相关代谢紊乱的重要原因。
FFAR1和FFAR4在胃肠道上皮细胞中表达,负责识别各种摄入的脂肪酸,促进肠内分泌细胞释放饱腹感信号,如CCK、GLP-1和PYY,通过抑制生长素释放肽的释放来减缓胃排空,促进胰岛素分泌和抑制食欲。体内和体外实验证实了游离脂肪酸与合成激动剂激活的FFAR1和FFAR4信号能促进葡萄糖刺激的胰岛素分泌(glucose-stimulated insulin secretion,GSIS),机制包括以下两方面:1)中长链游离脂肪酸激活FFAR1下游PKD1磷酸化和FFAR1依赖的肌动蛋白解聚,从而增强GSIS的第二阶段;2)LCFA激活FFAR4促进GLP-1的分泌来促进胰腺细胞的GSIS。
Ichimura等通过体内体外实验均证明了小鼠缺陷显著降低了[Ca]信号传导和CCK分泌,而使用ALA能增加促进野生型T-REx 293细胞的[Ca]反应。Drzazga等研究表明,急性棕榈酸盐治疗促进了人胰岛细胞的GSIS,而FFAR4拮抗剂ANT203部分抑制了这些影响。Itoh等证明了在缺陷小鼠中游离脂肪酸对GSIS的影响减弱,而胰岛β-细胞FFAR1特异性过表达抑制了高脂饮食诱导的肥胖小鼠高血糖症的发展。Ludwig等发现在DIO小鼠模型中,饮食中的DHA和EPA可通过减少肝TAG积累、降低血浆非酯化脂肪酸(nonestesterified fatty acid,NEFA)浓度以及改善血浆胰岛素水平发挥抗肥胖作用。Hira等指出,LA或ALA的肠道代谢产物,如13-氧代-顺式-9(13-oxo--9)、顺式-15-18:2(-15-18:2),在鼠STC-1细胞系中也能通过激活FFAR1刺激CCK分泌。
FFAR4功能失调会导致小鼠和人类肥胖。Ichimura等发现与高脂饮食喂养的野生型小鼠相比,缺陷小鼠表现出严重的肥胖表型,包括体质量增加、脂肪肝、脂肪生成增多和脂肪细胞炎症。Sankoda等发现缺陷小鼠CCK分泌水平显著降低,间接介导了GIP的分泌量减少。此外,棕色脂肪细胞的产热活性和白色脂肪细胞的褐变是保护机体免受肥胖和代谢疾病影响的关键机制。Quesada-López等发现FFAR4被-3多不饱和脂肪酸或者合成激动剂激活后会诱导FGF-21的释放,促进棕色脂肪细胞活性和白色脂肪细胞褐变,改善肥胖。
然而最近有报道指出,同时激活FFAR4和FFAR1这两种受体比单独激活任一受体对调节能量平衡和改善下丘脑炎症效果更好。因此,可进一步研究FFAR1和FFAR4激活途径是否有叠加放大信号的效果。
2.5 参与镇痛作用
FFAR1信号的激活可能有利于减轻疼痛。FFAR1激活后通过调节内源性阿片系统或单胺系统(也称为下行疼痛控制系统)来发挥抗伤害作用,即FFAR1激活后可促进内源性阿片肽-内啡肽的释放,并激活大脑中去甲肾上腺素和5-羟色胺神经元,从而控制疼痛。Nakamoto等研究发现,与野生型小鼠相比,缺陷小鼠足底切口诱发的机械性疼痛加剧,下丘脑和中脑中包括DHA在内的几种游离脂肪酸分泌量增加。另外,侧脑室注射DHA或GW9508可显著减轻福尔马林诱导的小鼠疼痛,使用FFAR1拮抗剂GW1100来抑制FFAR1信号会加剧小鼠的机械性疼痛。在静脉注射DHA和GW950810 20 min后,下丘脑-内啡肽的免疫性反应增加。这也证明了中长链游离脂肪酸发挥镇痛作用是通过激活FFAR1信号来调节内源性阿片肽的释放从而减轻疼痛,而不是脊髓。
与FFAR1不同的是,在嗅球、纹状体、海马、中脑、下丘脑、延髓、小脑和大脑皮层以及脊髓这些与疼痛作用相关的区域并未观察到FFAR4的表达,因此还没有充分的证据表明FFAR4参与镇痛作用。
3 FFAR1和FFAR4合成激动剂的研究进展
FFARs作为调节能量代谢的潜在治疗靶点受到广泛关注。虽然FFAR1在促进胰岛素和肠促胰岛素分泌方面具有突出的优势,FFAR4在肠促胰岛素分泌、胰岛素增敏和抗炎作用方面具有巨大的潜力;但其天然配体均是高供能物质,因此通过饮食方法来治疗代谢性疾病存在局限性。人工合成的小分子激动剂既可以起到激活下游信号通路产生相应生物学功能,又不会被分解代谢供能以及产生糖脂毒性,是治疗肥胖和代谢紊乱的理想药物。目前FFAR1和FFAR4合成激动剂研究取得了重要进展(表4),包括对受配体结构-功能关系的理解。大量研究已经证明配体结构中的羧基对FFAR1、FFAR4与配体的结合和激活必不可少。研究证明FFAR1与其配体结合的关键是其跨膜(transmembrane,TM)螺旋束顶部附近5.39和7.53位置的一对Arg残基与内源性游离脂肪酸(天然配体)以及各种合成配体中的羧基之间形成离子相互作用;然而,FFAR4的这两个带正电荷的残基(Arg和Arg)并不保守。相反,Arg99是FFAR4与其配体羧基相互作用的关键残基,配体停靠在FFAR4的TM-2,3和TM-5,7之间的一个公共结合口袋中,羧基锚定在TM-2中的Arg99上。此外,Hudson等指出W198与W207之间形成π-π堆积相互作用,因此W198与W207也是FFARs与配体结合的关键残基;比较明确的是疏水效应在FFAR4与激动剂的结合中起重要作用;作者还认为在FFAR4中,配体需要以“V”型的形式与识别口袋结合,而FFAR1中,配体结构需要以较窄的“U”型形式以挤压到螺旋结构之间。相比于FFAR1的狭窄空腔,FFAR4结合腔更大,更可能暴露于细胞外侧。
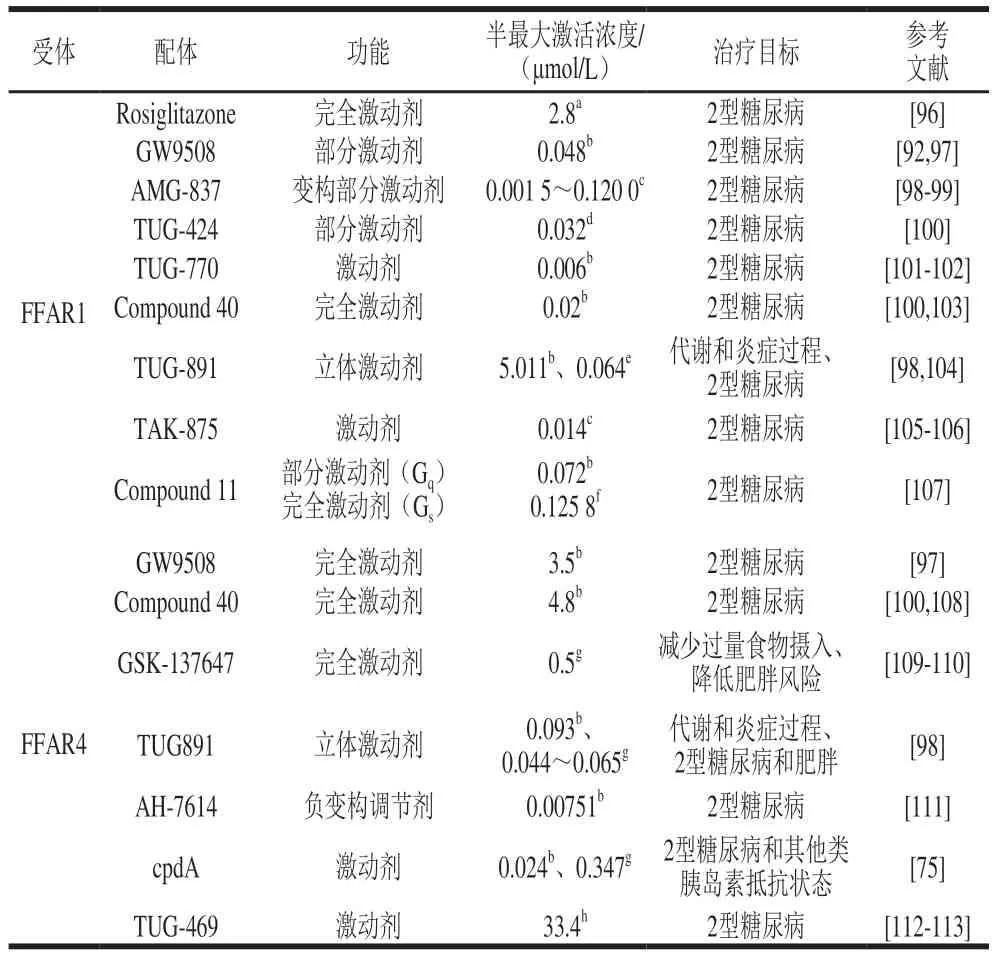
表4 FFAR1和FFAR4的合成激动剂Table 4 Synthetic agonists of FFAR1 and FFAR4
目前已经鉴定了一种能激活FFAR1的共同结构:苯丙酸部分(酸头)或酸性生物电子等排体充当氢键基团,和作为疏水基团的芳香族或杂芳香族环(芳基尾),该结构类似于脂肪酸,如图2所示。GW9508是FFAR1的一种合成激动剂(表4),是一种部分激动剂和变构调节剂,也是迄今为止在体外和临床前研究最广泛的FFAR1激动剂,可改善多不饱和脂肪酸对FFAR1的效应,刺激Ca释放。Li Meng等研究表明GW9508通过激活FFAR1调节AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)-ACC信号通路从而改善了C57BL/6小鼠肝X受体(liver X receptor,LXR)诱导的肝脂质积累。TAK-875也是一种强效、选择性和口服生物可利用的FFAR1激动剂。Tsujihata等证明了TAK-875在不影响胰高血糖素分泌的情况下能增强GSIS,并改善糖尿病模型大鼠在空腹或餐后的高血糖症。

图2 FFAR1合成激动剂的典型分子结构[93]Fig. 2 Typical molecular architectures of synthetic FFAR1 agonists[93]
2014年,Srivastava等观察到了人FFAR1-TAK-875复合物的X射线晶体结构(图3),这有助于全面理解FFAR1的结合口袋,以设计更有竞争力的候选化合物。尽管TAK-875在II期临床试验中表现出良好的控制血糖效果,但其III期临床试验因为患者发生严重的肝毒性而终止。

图3 FFAR1-TAK-875复合物的X射线晶体结构[99]Fig. 3 Crystal structure of FFAR1-TAK-875 complex[99]
迄今为止,TUG-891是最具选择性和效力的FFAR4激动剂,并已证明能增强脂肪细胞的抗炎作用。Zhang Dan等报道GSK137647能促进啮齿动物细胞的胰岛素释放,改善糖尿病小鼠的餐后高血糖症。2017年,Adams等报道了一系列含有联苯环的选择性FFAR4激动剂,以Compound 18(Merck公司)为代表,它们在啮齿动物体内能发挥生物活性,其结构见图4A。基于此,Zhang Xiangying等发现了以SR13(图4B)为代表的一些具有联苯支架的化合物,其均具有高FFAR4选择性和显著降血糖作用。作者指出FFAR4上的Arg、Trp和Trp对SR13与FFAR4的结合有不同程度的贡献,SR13羧基附近的苯环中心与Phe苯环之间存在π-π堆积相互作用;此外,还发现SR13在FFAR4和FFAR1之间的选择性取决于它能否通过优先构象进入配体结合位点,即SR13的优先构象和FFAR1的狭窄入口袋之间的巨大差异决定了它对FFAR1的激动剂活性较低。

图4 Compound 18(Merck公司)[102](A)和SR13[103](B)结构Fig. 4 Structures of Compound 18 (Merck)[102] (A) and SR13[103] (B)
近年来科学家们对FFAR1和FFAR4激动剂结构功能关系的理解有了很大进展,但激动剂在生理环境中如何靶向受体发挥作用仍有许多未解决的问题,目前还没有合成激动剂通过三期临床试验。合成激动剂的研究仍面临很多难题。首先,某些远离疏水核心结合位点的氨基酸可能对激动剂与受体的直接结合不重要,但是对FFAR1和FFAR4的激活很重要。比如Hudson等发现FFAR4氨基酸中的Trp突变为丙氨酸时,许多FFAR4激动剂失去活性,尽管它远离激动剂结合位点。Zhang Xiangying等的研究也证实了FFAR4的Trp残基对其与SR13的结合没有影响。因此小分子化合物与受体结合后如何激活受体启动下游信号还需深入研究。其次,需要阐明FFAR1和FFAR4激动剂偏效性。GPCRs的信号传递有偏信号,即激动剂配体可以选择性地激活受体的一种信号通路,而不是激活来自同一受体的其他下游信号通路。比如,据报道,FFAR4的抗炎作用是由-arrestin2介导的,而促GLP-1分泌作用可能是由G介导的,不同受体模型基于-arrestin2相互作用分析产生的结果是否也转化为G蛋白介导的Ca信号通路需要阐明。因此,激动剂效应分析应该明确信号通路之间是否重叠或转化。事实上,鉴于目前所有FFAR1和FFAR4配体之间的化学相似性:包括带负电荷的羧基和延伸的疏水尾,需要增加合成激动剂的种类多样性,才能识别对受体具有真正偏好的化合物。最后,激动剂功效评价需要进一步研究。虽然不同物种之间的FFAR1整个序列是高度保守的,且蛋白质水平上小鼠和大鼠FFAR1同源性为95%,与人FFAR1同源性分别是83%和82%,但是人、小鼠和大鼠FFAR1之间结合口袋周围的氨基酸残基非常不同。特别是人FFAR1结合口袋中的Leu在大鼠体内被Phe所取代,这导致了某些激动剂的FFAR1激活活性具有物种差异性。然而,人和猴子之间FFAR1的氨基酸序列在配体结合位点附近几乎相同,只在残基143位有一处不同,但该残基远离结合口袋;因此,在某些情况下,猴子可能是研究受体-激动剂结构功能关系更好的动物模型。
4 结 语
长期高脂摄入将会导致胰腺β细胞凋亡和炎症反应增加,而游离脂肪酸对机体的健康作用未得到充分重视。中长链游离脂肪酸作为机体能量来源和信号分子,通过激活FFAR1和FFAR4,在机体能量平衡和免疫代谢中介导味觉信号传感、调节食欲、抗炎、胰岛素增敏和调节新陈代谢。目前一系列具有特定结构的小分子化合物已被证明能与FFAR1和FFAR4结合并进一步激活下游信号通路产生生理功能。然而中长链游离脂肪酸及其受体对机体健康作用研究仍具有许多挑战。首先,FFAR1和FFAR4的激活能否清除代谢性疾病还不清楚。其次,目前大多数体内实验评价激动剂功效采用的模型都是大鼠和小鼠,基于二者与人中长链游离脂肪酸受体结合口袋周围氨基酸残基的差异性,激活的下游信号通路以及产生的生物学效应是否真实代表人类还需要更多数据支撑。再次,FFAR1和FFAR4的分子信号机制与生理功能的关系还需进一步探究。最后,合成激动剂对FFAR1和FFAR4的选择性机制还需要进一步阐明,这将有助于开发更多不同功效的小分子激动剂。
