美食蕉的降血糖活性及其对糖脂代谢指标、激素的影响
2022-10-28傅金凤涂师运
傅金凤,涂师运,2,3,王 娟,3,*,盛 鸥
(1.华南理工大学食品科学与工程学院,广东 广州 510641;2.广东省农业科学院果树研究所,农业农村部南亚热带果树生物学与遗传资源利用重点实验室,广东省热带亚热带果树研究重点实验室,广东 广州 510640;3.广东省香蕉精深加工与综合利用工程技术研究中心,广东 广州 510641)
国际糖尿病联盟数据表明,2021年全球约有5.37亿成年人(20~79 岁)患有糖尿病,预计到2045年,这一数字会上升至7.83亿,在大多数国家,糖尿病患者的比例正在增加;据评估,2021年中国是世界上糖尿病患者人数最多的国家(1.409亿)。糖尿病以高血糖浓度为特征,同时会引起机体发生糖类、脂肪、蛋白质、水和电解质等物质的代谢紊乱。
糖尿病会引起很多并发症,降低患者生活品质,增加患者和社会的医疗负担。因此,寻找具有降血糖活性的天然产物对开发降血糖膳食补充剂具有重大意义。青香蕉(即未成熟(或催熟)的香蕉,此时香蕉果皮一般为绿色或淡绿色)富含抗性淀粉、膳食纤维等抗消化性碳水化合物,具有良好的减肥、降血糖物质基础。美食蕉(spp., Plantain AAB group)是广东省农业科学院果树研究所选育改良的新品种香蕉,其主要特点是种植抗病性好(高抗枯萎病)、亩产高、抗性淀粉含量高。因此,本研究以青美食蕉为原料,探究其对高糖高脂结合链脲佐菌素(streptozotocin,STZ)诱导的糖尿病大鼠的降血糖作用,以期为开发辅助降血糖功能食品提供参考。
1 材料与方法
1.1 动物、材料与试剂
120 只SPF级雄性SD大鼠(初始体质量70~100 g)购于广东省医学实验动物中心,生产许可证号:SCXK(粤)2018-0002,使用许可证号:SYXK(粤)2019-0136,动物实验经华南农业大学实验动物伦理审查委员会审核批准,并在该校实验动物中心进行。
青美食蕉由广东省农业科学院果树研究所提供。维持饲料(无氮浸出物55%(质量分数,下同)、粗蛋白18%、水分10%、粗灰分8%、粗纤维5%、粗脂肪4%、钙1%~2%、磷0.6%~1.2%)由华南农业大学实验动物中心提供;高糖高脂饲料(维持饲料47.6%、猪油10%、蔗糖20%、蛋黄粉15%、酪蛋白5%、胆固醇1.2%、胆酸钠0.2%、碳酸氢钙0.6%、石粉0.4%)由广东省医学实验动物中心提供。
STZ 美国Sigma公司;葡萄糖(食品级) 重庆和平制药有限公司;其他试剂均为分析纯。游离脂肪酸(free fatty acid,FFA)、胰岛素、C肽、胰高血糖素、胰高血糖素样肽-1(glucagon like peptide-1,GLP-1)、胰淀素、脂联素、瘦素、饥饿素、肾上腺素、生长激素、甲状腺素、肝糖原和糖皮质激素酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒武汉贝茵莱生物科技有限公司。
1.2 仪器与设备
血糖仪 瑞士罗氏公司;PHS-25 pH计 上海仪电科学仪器股份有限公司;BAS124S-CW电子天平 赛多利斯科学仪器(北京)有限公司;BS-380全自动生化分析仪 深圳迈瑞生物医疗电子股份有限公司。
1.3 方法
1.3.1 美食蕉粉的制备
选取表皮青绿,果指饱满、棱角分明的青美食蕉,经过去皮、切片、热风干燥(60 ℃、72 h)、粉碎后,过100 目筛,得到美食蕉粉,其主要成分(以干基计)如下:抗性淀粉(56.09±1.64)%、总膳食纤维(5.09±0.76)%、总碳水化合物(84.97±3.60)%、蛋白质(3.51±0.23)%、灰分(2.47±0.35)%,能量(1 563.33±51.29)kJ /100 g。
1.3.2 糖尿病大鼠模型的建立
通过高糖高脂饲料结合STZ诱导建立糖尿病大鼠模型。120 只雄性SD大鼠饲养于华南农业大学实验动物中心的标准化动物房,温度(21±2)℃,相对湿度60%~70%,12 h/12 h光暗交替,饲养期间每笼4 只,自由饮食。适应性喂养1 周后,依据国食药监保化[2012]107号文件中附件3“辅助降血糖功能评价方法”,将大鼠随机分为2 组,正常组(=24)以维持饲料继续饲养56 d,在饲喂第43、46、53天按3 mL/kg腹腔注射柠檬酸/柠檬酸钠缓冲液(0.1 mmol/L、pH 4.4,后同),注射前禁食不禁水12 h;造模组(=96)以高糖高脂饲料饲养56 d,并在饲喂第43、46、53天对大鼠腹腔注射30 mg/kgSTZ(用柠檬酸/柠檬酸钠缓冲液冰浴条件下配制10 mg/mL STZ溶液,现用现配)进行造模,注射前禁食不禁水12 h。饲喂第56天对大鼠进行后尾尖采血(采血前禁食不禁水12 h),用血糖仪测定大鼠空腹血糖浓度,将空腹血糖浓度大于11.1 mmol/L的大鼠纳入糖尿病模型。采血后测定大鼠体质量,即美食蕉干预前(第0周)大鼠体质量。
1.3.3 动物实验设计及分组
实验动物共分为6 组,每组12 只。将造模成功的48 只糖尿病大鼠随机分为4 组:模型对照组(DM组,每天灌胃1 mL/kg蒸馏水)、美食蕉低剂量组(LP组,每天灌胃1.0 g/kg美食蕉)、美食蕉中剂量组(MP组,每天灌胃2.0 g/kg美食蕉)、美食蕉高剂量组(HP组,每天灌胃4.0 g/kg美食蕉);24 只正常大鼠随机分为2 组:空白对照组(NC,每天灌胃1 mL/kg蒸馏水)、美食蕉高剂量空白对照组(NH组,每天灌胃4.0 g/kg美食蕉)。灌胃美食蕉时用去离子水配制质量浓度0.4 g/mL的美食蕉溶液进行灌胃。糖尿病大鼠饲喂高糖高脂饲料,正常大鼠饲喂维持饲料,连续干预8 周。
1.3.4 大鼠体质量、摄食量、饮水量及排尿量测定
每天固定时间记录垫料、饲料、水的质量,第+1周第2天称量大鼠体质量为第周大鼠体质量,干预8 周后大鼠体质量为第8周大鼠体质量。分别按照公式(1)~(3)计算大鼠每周体质量增长率、每日摄食量或饮水量及排尿量。第周的摄食量/饮水量/排尿量为这1 周每日摄食量/饮水量/排尿量的平均值,单位为g/d。

式中:m为第天的饲料或水的质量;m为第+1天的饲料或水的质量。
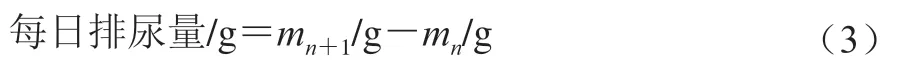
式中:m为第+1天的垫料质量;m为第天的垫料质量。
1.3.5 空腹血糖浓度的测定
每周第1天对大鼠进行尾尖取血(采血前大鼠禁食不禁水12 h)并利用血糖仪测定空腹血糖浓度。
1.3.6 糖耐量的测定
口服葡萄糖耐受实验(oral glucose tolerance test,OGTT)在干预7 周后进行。实验大鼠禁食不禁水12 h,测定空腹血糖浓度(即BG),30 min后各剂量组灌胃不同剂量(1.0、2.0、4.0 g/kg)的美食蕉,NC组和DM组灌胃1 mL/kg蒸馏水,随后各组立即经口给予5.0 mL质量分数20%葡萄糖溶液,经口给予葡萄糖溶液后分别于0.5、1.0、1.5、2.0 h时尾尖取血,利用血糖仪测定大鼠血糖浓度,并据此绘制糖耐量曲线,按照式(4)计算曲线下面积(area under curve,AUC)。
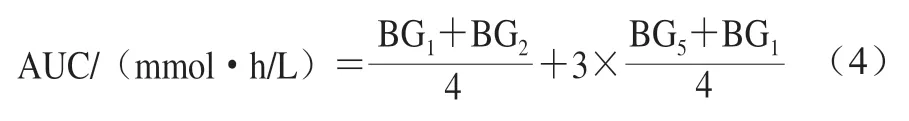
式中:BG、BG和BG分别表示给予葡萄糖溶液后0、0.5、2.0 h时的血糖浓度/(mmol/L)。
1.3.7 血清相关指标测定
干预8 周后,所有大鼠禁食不禁水12 h,称量体质量,按照0.4 mL/100 g腹腔注射10%(质量分数)水合氯醛麻醉,用5 mL的采血管由腹主动脉取血,收集的血液在常温下静置30~60 min,自动凝血后4 ℃、3 000 r /min离心15 min,取上层血清分装于2 mL尖头离心管中,-20 ℃保存备用。
采用全自动生化仪测定血清葡萄糖、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)浓度。
采用ELISA试剂盒测定大鼠血清FFA、胰岛素、C肽、胰高血糖素、GLP-1、胰淀素、脂联素、瘦素、饥饿素、肾上腺素、生长激素、甲状腺素、肝糖原和糖皮质激素水平,具体操作按试剂盒说明书进行。
1.4 数据处理及分析
采用Excel 2010软件进行数据处理处理,结果以平均值±标准差表示。采用Origin 9.1软件作图。采用SPSS Statistic 24.0软件进行单因素方差分析,采用LSD检验进行显著性分析,<0.05表示差异显著。
2 结果与分析
2.1 美食蕉对糖尿病大鼠体质量、体质量增长率、摄食量、饮水量及排尿量的影响
糖尿病会导致机体对葡萄糖吸收利用不充分,使脂肪和蛋白质分解加速,消耗过多,出现形体消瘦和体质量下降的症状。由图1A、B可知,干预期间正常大鼠的体质量持续增加,而糖尿病大鼠的体质量始终显著低于正常大鼠(<0.05),与马永强等的研究结果一致。干预2~8 周内,NH组大鼠的体质量均低于NC组,同时,第2、3、4、7周NH组大鼠体质量增长率显著低于NC组,说明在实验灌胃剂量范围内,美食蕉干预对正常大鼠无副作用,且在一定程度上呈现出减缓正常大鼠体质量增加的趋势,与课题组前期研究美食蕉具有减肥功能的结论一致。
干预8 周期间,DM组和美食蕉干预组(LP、MP、HP)体质量无显著性差异(>0.05)。干预第1~5周,各组糖尿病大鼠体质量呈波动变化,从第6周开始,糖尿病大鼠出现体质量持续降低的现象,说明高糖高脂饲料结合STZ造模的糖尿病大鼠后期病情加重,导致体质量降低。干预第8周时,LP组体质量增长率为(-5.77±3.38)%,显著大于DM组((-14.00±9.60)%)(<0.05),表明美食蕉干预能在一定程度上改善因糖尿病而引发的消瘦症状。
如图1C所示,正常大鼠的平均摄食量比较稳定,NH组大鼠的摄食量均低于NC组,虽然差异不显著(>0.05),但说明美食蕉具有饱腹感,能降低摄食量,这可能是其减缓正常大鼠体质量增加的原因。干预1~8 周内,各组糖尿病大鼠平均摄食量均显著高于正常大鼠(<0.05)。DM组在干预期间的摄食量呈先增后降的趋势,其中干预第4周时,DM组的摄食量突然加大,是NC组的1.99 倍,可能是糖尿病病情加剧导致;第6~8周期间DM组的平均摄食量逐渐减少,与该阶段体质量降低的结果一致。与DM组相比,美食蕉干预组均能显著降低糖尿病大鼠的摄食量。表明美食蕉对缓解糖尿病多食症状具有一定的作用。
如图1D所示,NC组和NH组大鼠的饮水量变化趋势平稳,表明美食蕉不影响正常大鼠的饮水。各组糖尿病大鼠每天平均饮水量均显著高于正常大鼠(<0.05)。与DM组相比,美食蕉干预均能显著降低糖尿病大鼠的平均饮水量,表明美食蕉能够减缓糖尿病大鼠多饮的症状。
如图1E所示,除LP组以外,各组大鼠排尿量的变化趋势和饮水量变化趋势相同,NH组和NC组大鼠的排尿量大致相同且在干预期间变化很小。各组糖尿病大鼠排尿量均显著高于正常大鼠(<0.05)。与DM组相比,美食蕉干预均能显著降低糖尿病大鼠的排尿量(<0.05)。因此,美食蕉在缓解多尿症状方面也具有一定效果。
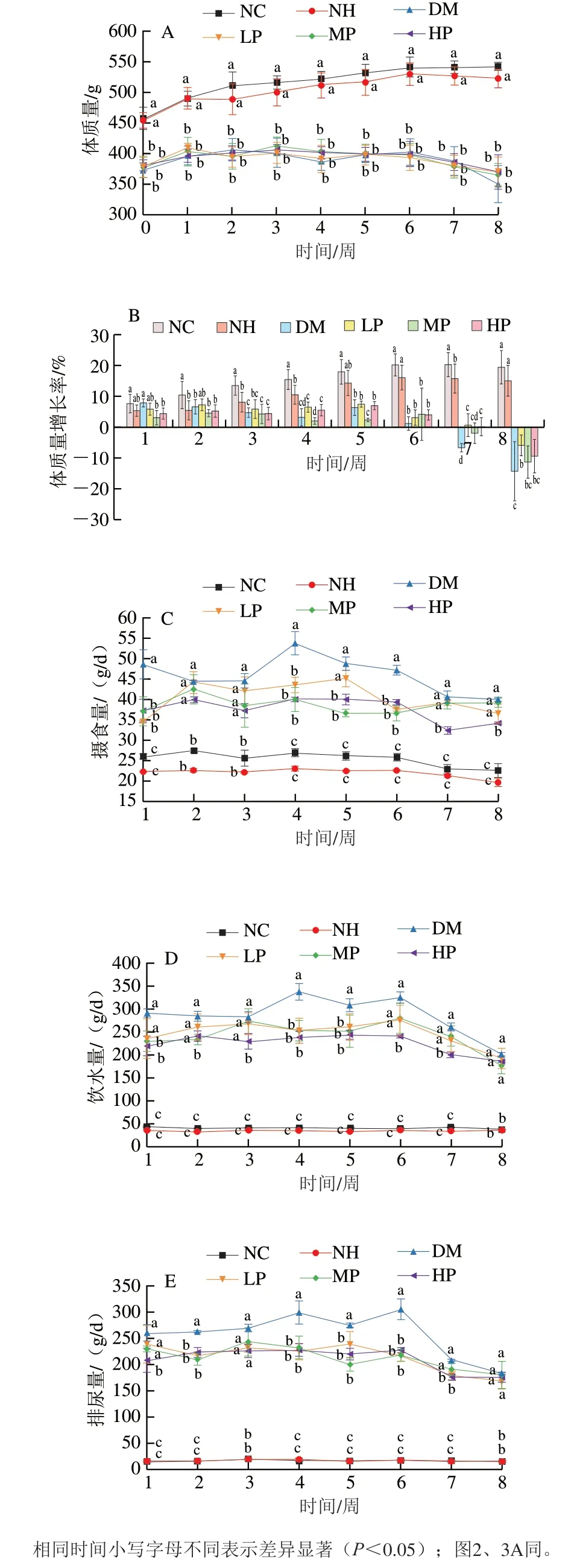
图1 美食蕉对大鼠体质量(A)、体质量增长率(B)、摄食量(C)、饮水量(D)、排尿量(E)的影响Fig. 1 Effect of plantain on body mass (A), body weight growth rate (B),food intake (C), water intake (D) and urine (E) levels of rats
2.2 美食蕉对糖尿病大鼠空腹血糖浓度及糖耐量的影响
由图2可知,正常大鼠的空腹血糖浓度在干预期间基本保持在一个相对稳定的水平,其中NH组大鼠的空腹血糖浓度几乎和NC组重叠,表明美食蕉不影响正常大鼠的空腹血糖浓度。与正常大鼠相比,糖尿病大鼠空腹血糖浓度均显著升高(<0.05)。美食蕉干预MP、HP组空腹血糖浓度均呈现先上升后下降的趋势,1~6 周空腹血糖浓度逐渐上升,说明糖尿病病情逐渐加重。除第4周LP组外,干预8周期间美食蕉干预组糖尿病大鼠的空腹血糖浓度均低于DM组,且美食蕉在干预初期(1~2 周)的降血糖效果较好,与DM组相比,低、中、高剂量组分别降低了6.25%、7.95%、12.30%(第1周)和3.84%、5.17%、10.68%(第2周)。此外,各干预组(除LP组)空腹血糖浓度在第6周达到峰值,HP组大鼠空腹血糖浓度((24.36±1.00)mmol/L)较DM组((27.20±1.76)mmol/L)下降了10.45%,两者存在显著性差异(<0.05)。以上结果表明,美食蕉能降低糖尿病大鼠空腹血糖浓度,且在干预初期(1~2 周)的效果较好,后期干预效果不明显,可能是随着糖尿病病情的发展,饲料干预对空腹血糖浓度的影响不显著。
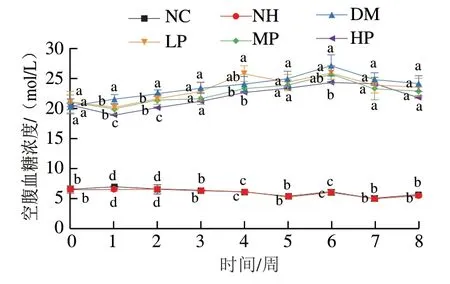
图2 美食蕉对大鼠空腹血糖浓度的影响Fig. 2 Effect of plantain on fasting blood glucose in rats
2.3 美食蕉对糖尿病大鼠糖耐量的影响
口服葡萄糖耐受实验是一种葡萄糖负荷实验,可以反映胰岛β细胞功能和机体对血糖浓度的调节能力。通常来说,餐后血糖浓度会暂时升高,达到峰值后逐渐回落恢复到正常水平并保持在一个比较稳定的范围内,这表明机体对葡萄糖有较强的耐受能力,即糖耐量正常。如图3A所示,灌胃葡萄糖溶液后,各组糖尿病大鼠的血糖浓度呈迅速上升趋势,0.5 h到达峰值,后期呈缓慢下降趋势;NH和NC组在0~0.5 h时间段内血糖浓度略微上升,后期基本保持稳定。0.5 h时,与DM组相比,MP、HP组血糖浓度峰值显著降低;随着时间的推移,在2.0 h时,各组血糖浓度较峰值均有所下降,其中LP、HP组基本恢复到受试前的血糖水平,均显著低于DM组(<0.05)。这表明,和正常大鼠相比,糖尿病大鼠在血糖调节方面呈现出糖耐量降低的特征症状,而美食蕉干预能降低血糖水平。
利用糖耐量AUC分析各实验组大鼠对葡萄糖吸收利用的情况,AUC数值越高表明在相同时间内干预物抑制糖尿病大鼠餐后血糖浓度升高效果越差,反之亦然。如图3B所示,NH、NC组AUC无显著性差异(>0.05),表明美食蕉干预对正常大鼠的糖耐量不会产生副作用。DM组AUC显著升高,表明糖尿病大鼠糖耐量受损。与DM组相比,MP、HP组AUC有所下降,MP组的AUC较DM组减小了8.33%(<0.05),表明美食蕉干预对糖尿病大鼠调节血糖浓度能力有提升作用。
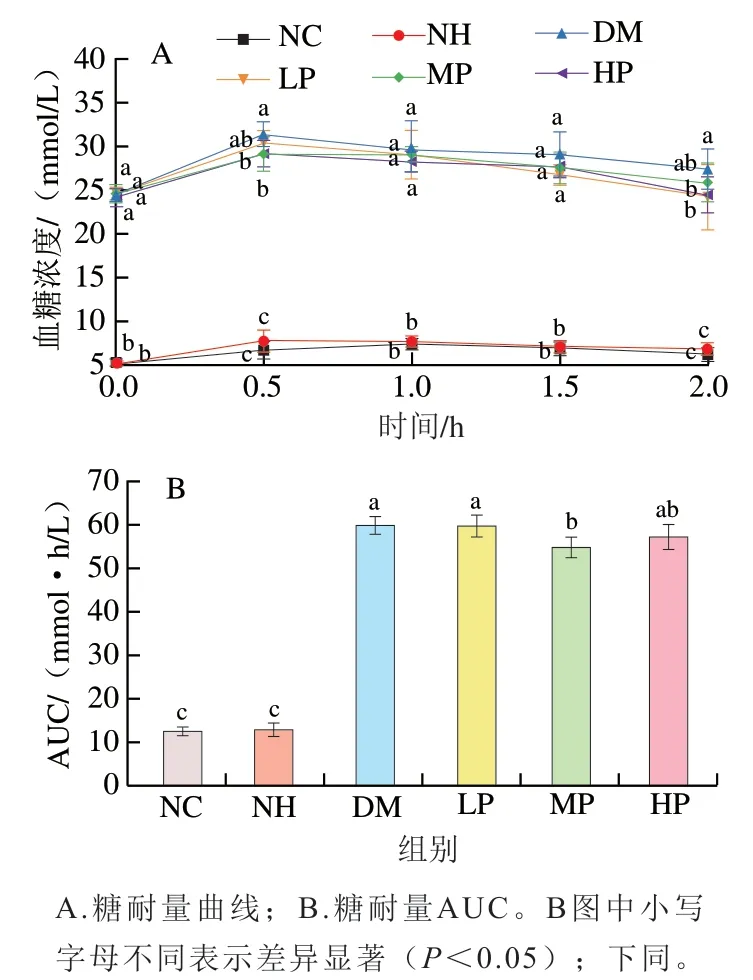
图3 美食蕉对大鼠葡萄糖耐受能力的影响Fig. 3 Effect of plantain on glucose tolerance in rats
2.4 美食蕉对糖尿病大鼠脂代谢的影响
研究表明,糖尿病会引起高血压和高胆固醇水平,其发展往往与高脂血症相关,因此在糖尿病病程中对脂代谢的监测十分必要。图4显示了美食蕉干预对糖尿病大鼠血脂水平的影响。NC组和NH组大鼠的TG、TC、HDL-C和LDL-C浓度均无显著性差异(>0.05),表明在实验干预剂量范围内,美食蕉对正常大鼠的脂代谢无副作用。与NC组相比,DM组大鼠血清TG、TC、LDL-C浓度显著升高,HDL-C浓度显著降低(<0.05),表明糖尿病大鼠出现血脂代谢紊乱的现象,与王云威等的研究结果一致。
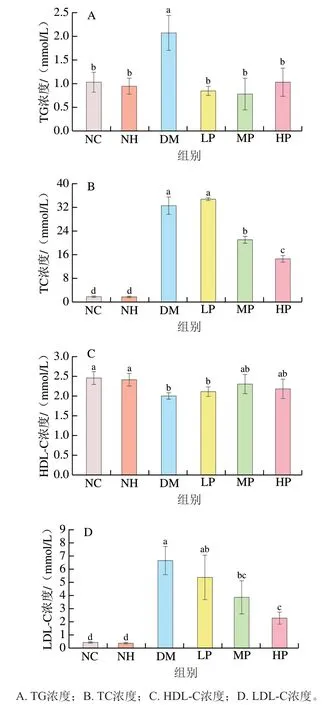
图4 美食蕉对大鼠血脂水平的影响Fig. 4 Effect of plantain on lipid profiles in rats
美食蕉干预8 周后,与DM组相比,LP、MP、HP组血清TG浓度分别下降59.06%、62.32%和50.12%(<0.05),MP、HP组血清TC和LDL-C浓度显著下降(<0.05),其中TC浓度分别降低35.51%和55.23%,LDL-C浓度分别降低41.81%和65.67%。虽然美食蕉各干预组HDL-C浓度较DM组并无显著差异(>0.05),但均略有上升,且MP、HP组与正常组水平相当。研究表明,以TC和LDL-C浓度升高为主要特征的血脂异常是动脉粥样硬化性心血管疾病发生的危险因素,美食蕉干预能够显著降低血清TG、TC和LDL-C浓度,同时HDL-C浓度略有上升,表明美食蕉对糖尿病大鼠的脂代谢紊乱有改善作用。
2.5 美食蕉对糖尿病大鼠游离脂肪酸的影响
血脂紊乱时,FFA浓度的增加导致其在胰岛、肝脏等靶组织中沉积,造成葡萄糖运转障碍,引起胰岛素抵抗;同时脂质过氧化物的形成亦会引起胰岛细胞凋亡,抑制胰岛素信号转导,因此降低血清FFA浓度对脂代谢有积极影响。
如图5所示,NC组和NH组大鼠的血清FFA浓度无显著性差异(>0.05),表明美食蕉干预对正常大鼠血清FFA水平无影响。DM组FFA浓度达到(883.96±23.60)μmol/L,是NC组的3.25 倍,美食蕉干预后血清FFA浓度较DM组显著降低(<0.05),且呈剂量-效应关系,LP、MP、HP组分别降低了30.10%、37.92%和49.53%,这表明美食蕉可能是通过降低血清FFA浓度来改善糖尿病的血脂代谢紊乱。
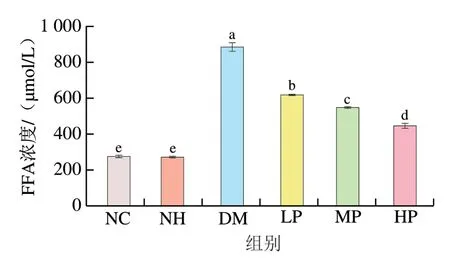
图5 美食蕉对大鼠血清FFA浓度的影响Fig. 5 Effect of plantain on free fatty acid levels in serum of rats
2.6 美食蕉对糖尿病大鼠糖代谢的影响
葡萄糖摄取是指肝脏、肌肉及脂肪等组织从外周通过主动运输的方式将葡萄糖转运至细胞内的过程,糖代谢的紊乱使得靶细胞对葡萄糖的摄取量降低,糖原合成减少,胰岛素抵抗增加。如图6所示,NC组和NH组无显著差异(>0.05),说明美食蕉对正常大鼠血清葡萄糖浓度无影响。DM组血清葡萄糖浓度((28.40±2.07)mmol/L)是NC组的3.34 倍。与DM组相比,LP、MP、HP组血清葡萄糖浓度分别显著降低10.70%、10.19%和13.94%(<0.05),表明美食蕉能够降低糖尿病大鼠的血清葡萄糖浓度,有效缓解高血糖症状,对糖代谢起到较好的调节作用。
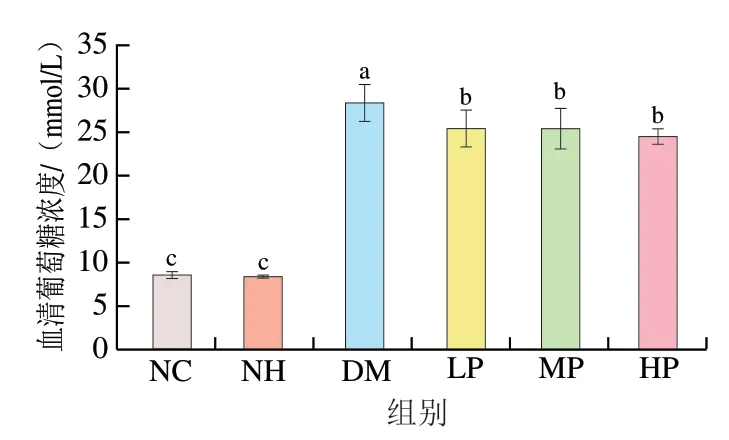
图6 美食蕉对大鼠血清葡萄糖浓度的影响Fig. 6 Effect of plantain on serum glucose in rats
2.7 美食蕉对糖尿病大鼠胰岛素和C肽分泌的影响
C肽也由胰岛β细胞分泌,与胰岛素具有共同前体——胰岛素原。胰岛素原的生物活性较弱,会分解形成一分子胰岛素和一分子C肽,又由于C肽较胰岛素在代谢过程中不易被肝脏降解,因此血清C肽水平在一定程度上能反映胰岛细胞分泌功能是否正常。如图7所示,NC组和NH组在血清胰岛素、C肽水平上无显著差异(>0.05),但NH组血清胰岛素水平高于NC组(<0.05),表明在实验干预剂量范围内,美食蕉能提高正常大鼠胰岛细胞的分泌功能,从而增加胰岛素水平。与NC组相比,DM组胰岛素水平和C肽质量浓度显著上升(<0.05),造成高胰岛素血症,与吴睿婷等的研究结果一致,表明高血糖能反馈性促进胰岛素分泌,进一步加重胰岛素抵抗,造成高胰岛素血症。与DM组相比,LP、MP、HP组胰岛素和C肽的水平均显著下降(<0.05),且呈剂量-效应关系,其中胰岛素水平分别下降了28.54%、39.50%和49.14%,C肽质量浓度分别下降了24.19%、35.85%和45.00%。结果表明美食蕉干预能缓解高胰岛素血症,改善糖尿病症状。
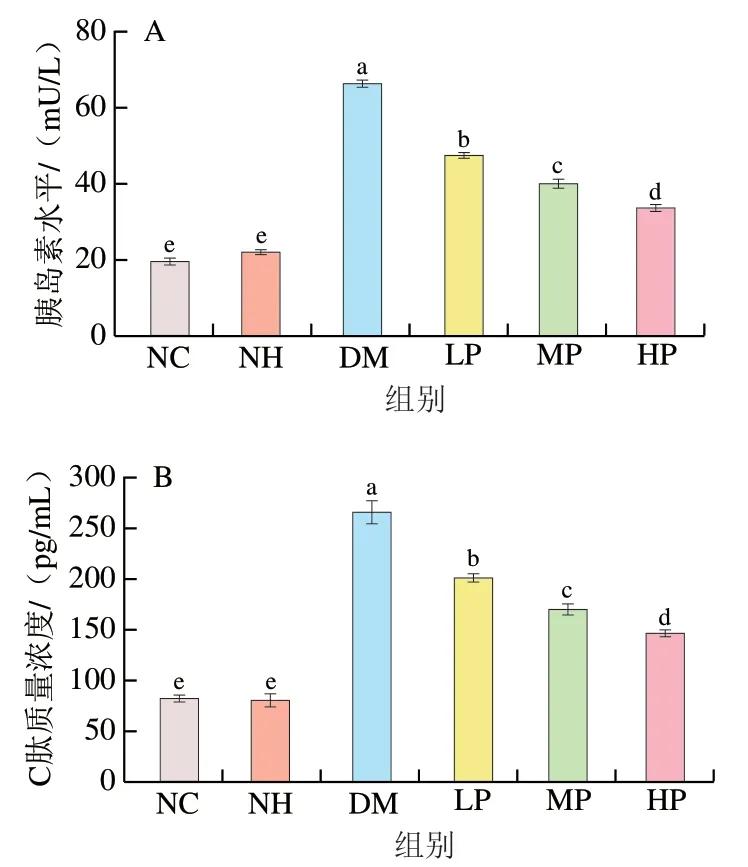
图7 美食蕉对大鼠胰岛素(A)和C肽(B)水平的影响Fig. 7 Effect of plantain on insulin (A) and C-peptide (B) levels in rats
2.8 美食蕉对糖尿病大鼠胰高血糖素样肽-1和胰淀素分泌的影响
GLP-1是由回肠末端和结肠的L细胞所分泌的葡萄糖浓度依赖的肠促胰素。由图8可知,NC组和NH组大鼠在GLP-1和胰淀素水平上无显著差异(>0.05),表明美食蕉对正常大鼠GLP-1和胰淀素的分泌并无不良影响。DM组GLP-1浓度显著提高,是NC组的3.59 倍(<0.05),美食蕉干预后血清GLP-1浓度显著下降(<0.05),LP、MP、HP分别较DM组降低21.97%、35.53%和43.24%。这说明美食蕉可能是通过降低GLP-1浓度从而降低胰岛素分泌,达到改善糖尿病大鼠高胰岛素血症的作用效果。
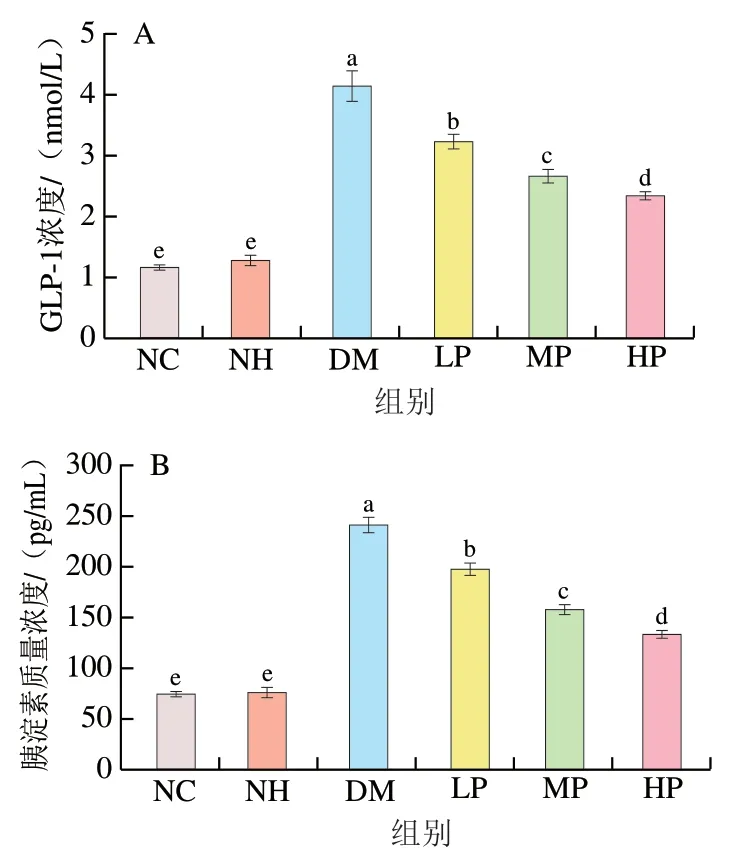
图8 美食蕉对大鼠GLP-1(A)和胰淀素(B)水平的影响Fig. 8 Effect of plantain on GLP-1 (A) and amylin (B) levels in rats
胰淀素由与胰岛素一起分泌的胰淀素多肽生成,可调节葡萄糖代谢。研究表明,糖尿病患者常伴有胰淀素沉积的现象,高胰岛素血症导致胰淀素多肽过量分泌,从而生成大量胰淀素,进而对胰岛β细胞产生毒性,导致胰岛功能的下降以及β细胞的凋亡。DM组胰淀素质量浓度显著增加至NC组的3.28 倍(<0.05),美食蕉干预后,与DM组相比,LP、MP、HP组胰淀素质量浓度分别显著下降18.38%、34.91%和44.62%(<0.05)。说明美食蕉改善糖尿病症状的途径之一可能是减轻高胰淀素血症,从而保护胰岛功能。
2.9 美食蕉对糖尿病大鼠糖脂代谢相关激素的影响
激素的调节对于血糖浓度的相对稳定至关重要,血糖平衡主要由降低血糖水平的胰岛素以及升高血糖水平的胰高血糖素、肾上腺素、糖皮质激素、甲状腺素等激素的综合调节作用维持。此外,脂肪因子常与能量摄入和消耗以及胰岛素敏感性等机体状态相关并通过内分泌系统传递到代谢相关器官,从而调节代谢。
如表1所示,糖代谢相关激素方面,NC组和NH组的胰高血糖素、肾上腺素、糖皮质激素、甲状腺素、生长激素以及饥饿素水平无显著差异(>0.05),表明美食蕉对正常大鼠的糖代谢无副作用。DM组胰高血糖素、肾上腺素、甲状腺素和饥饿素水平分别显著升高至NC组的2.78、3.03、2.82、3.72 倍(<0.05);与DM组相比,LP、MP、HP组在各激素水平上均有不同程度的下降,胰高血糖素质量浓度分别下降14.47%、28.00%和40.89%,肾上腺素质量浓度分别下降19.70%、36.78%和46.94%,甲状腺激素质量浓度分别下降18.22%、26.54%和43.12%,饥饿素质量浓度分别下降26.75%、35.77%和48.93%。另一方面,与NC组相比,DM组的糖皮质激素和生长激素质量浓度分别下降48.21%和71.77%(<0.05),美食蕉干预后,MP、HP组糖皮质激素质量浓度较DM组分别升高14.12%和38.22%,LP、MP、HP组生长激素质量浓度较DM组分别升高46.31%、73.62%和102.36%。
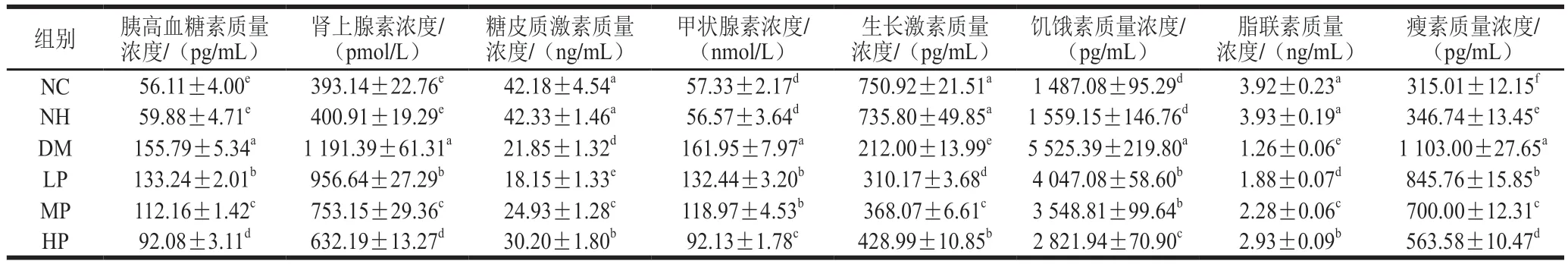
表1 美食蕉对大鼠糖脂代谢相关激素的影响Table 1 Effect of plantain on hormones related to glucose metabolism in rats
脂代谢相关激素方面,NC组和NH组大鼠的脂联素质量浓度无显著差异(>0.05),NH组瘦素质量浓度显著高于NC组(<0.05),表明美食蕉对正常大鼠脂代谢有积极影响,可能是其减肥功能的作用机制之一。DM组瘦素质量浓度是NC组的3.50 倍,差异显著(<0.05),表明糖尿病大鼠存在高瘦素血症的情况,可能会进一步发展成瘦素抵抗,与DM组相比,LP、MP、HP组瘦素质量浓度分别显著下降23.32%、36.54%和48.90%(<0.05)。DM组脂联素质量浓度较NC组显著下降67.91%(<0.05),LP、MP、HP组脂联素质量浓度较DM组分别显著提高49.71%、81.57%和133.51%(<0.05)。
综上所述,美食蕉干预一方面有效降低糖尿病大鼠胰高血糖素、肾上腺素、甲状腺素和饥饿素水平,另一方面升高糖皮质激素和生长激素水平,从而对糖尿病大鼠的糖代谢起到良好的调节作用;可有效缓解糖尿病大鼠高瘦素血症以及改善脂联素水平较低的症状,从而对糖尿病大鼠脂代谢起到良好的调节作用。
3 结 论
青香蕉具有良好的降血糖物质基础,因而本研究以青美食蕉为原料,探究其对高糖高脂结合STZ诱导的糖尿病大鼠的降血糖作用及对糖脂代谢指标、激素水平的影响。结果表明,美食蕉干预能在一定程度上缓解糖尿病“三多一少”的症状,减轻糖尿病大鼠多食、多饮、多尿症状,维持糖尿病大鼠体质量,改善由糖尿病引起的消瘦;美食蕉能有效降低糖尿病大鼠的血清葡萄糖浓度,并且提高其葡萄糖耐受能力,同时有效缓解糖尿病引起的糖脂代谢紊乱。在脂代谢方面,美食蕉能降低血清TG、TC、LDL-C和FFA浓度。糖代谢方面,通过降低血清胰岛素、C肽、胰淀素和GLP-1的水平,减缓高胰岛素血症和高胰淀素血症,从而保护胰岛功能。美食蕉改善糖脂代谢紊乱的激素调节机制可能是:其一,降低胰高血糖素、肾上腺素、甲状腺素和饥饿素水平,升高糖皮质激素和生长激素水平,从而改善胰岛细胞的活性和功能;其二,降低异常升高的瘦素水平,升高脂联素水平,抑制高瘦素血症的产生,增强脂肪酸氧化作用,降低血脂水平。因此,美食蕉具有一定的辅助降血糖功能,在功能食品领域具有开发应用的潜力。
