虾青素DHA单酯对脂多糖诱导炎症反应的保护作用
2022-10-28伍露露王晓旭罗京义李艺洋王志高薛长湖
伍露露,王晓旭,罗京义,李艺洋,王志高,徐 杰,薛长湖
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
炎症反应是人类免疫系统的重要生理反应过程,可保护身体免受刺激并恢复受损的组织结构和功能。然而,过度和不受控制的炎症反应会诱发各种慢性病和机体紊乱,包括糖尿病、癌症、心血管疾病、关节炎、自身免疫性疾病和炎症性肠病等。近年来,炎症是生物医学研究人员关注的主要研究领域之一。
脂多糖(lipopolysaccharide,LPS)是革兰阴性菌细胞壁中特有的成分,适量的LPS能够激发机体的免疫反应,浓度过高则会引起强烈的炎性反应,促使炎性因子大量分泌,使其成为多种炎症模型构建的首选诱导剂。虾青素(3,3’-二羟基-,’胡萝卜素-4,4’-二酮基)是类胡萝卜素中唯一一种能够穿透血-脑屏障和血-视网膜屏障的活性物质。研究表明,虾青素具有抗炎、抗癌、抗衰老、增强机体免疫力和降低氧化损伤等生理功能。自然界中的虾青素以游离态、单酯或双酯的混合形式存在。二十二碳六烯酸(docosahexaenoic acid,DHA)是-3多不饱和脂肪酸,对胎儿大脑及视力的发育和成人神经系统的正常运作十分重要。游离DHA可以通过结合并激活质膜受体和胞质受体来调节炎症。本课题组前期采用体外和体内消化模型研究了14 种不同分子结构虾青素酯的稳定性和生物利用度,结果表明具有长链和饱和脂肪酸的虾青素酯比其他类型的虾青素酯更稳定,虾青素单酯的生物利用度高于游离虾青素(free astaxanthin,F-Asta),虾青素DHA单酯(astaxanthin DHA monomer,AST-DHA)在14 种虾青素酯中具有最高的生物利用度,这种新型活性物质可能在机体内发挥虾青素和DHA的协同作用。
小胶质细胞(BV2细胞)被证明是中枢神经系统的固有免疫细胞,响应中枢神经系统疾病,特别是神经炎症相关疾病的病理刺激。近年来,斑马鱼疾病模型广泛应用于生命科学的各个领域,如免疫学、肿瘤学、神经科学等。斑马鱼因其生命周期短、繁殖率高、易于饲养,且胚胎的光学透明性可以对体内炎症进行无创动态成像,被公认是有效的体内抗炎实验模型。本实验主要利用以上两种模型探究AST-DHA抗炎活性。
1 材料与方法
1.1 材料与试剂
BV2细胞 中国科学院上海生化与细胞研究所;合成虾青素(纯度10%) 浙江巴仕曼生物科技有限公司;DHA(纯度80%) 中国海洋大学食品科学与人类健康实验室制备;野生型斑马鱼(AB品系)国家斑马鱼资源中心;LPS、2’,7’-二氯二氢荧光素二乙酸酯(2’,7’-dichloro-dihydrofluorescein diacetate,DCFHDA)、3-乙氧酰基苯胺甲磺酸盐(ethyl 3-aminobenzoate methanesulfonate,MS222) 上海阿拉丁生化科技公司;活性氧(reactive oxygen species,ROS)、丙二醛(malondialdehyde,MDA)测定试剂盒 南京建成生物工程研究所;总RNA提取试剂盒 美国Bio Tek公司;EvaGreen qPCR Master Mix试剂盒 加拿大ABM公司;胎牛血清-培养基 美国Gibco公司;Griess试剂 北京索莱宝科技有限公司。
1.2 仪器与设备
斑马鱼养殖设备 上海海圣生物实验设备有限公司;HF90/HF240 CO培养箱 上海力新仪器有限公司;LRH-70恒温恒湿培养箱 上海一恒仪器有限公司;PZMIII体视显微镜、PV830斑马鱼显微注射系统 美国WPI公司;Ti2-E荧光显微镜 日本Nikon公司;iCycler iQ5系统实时荧光定量聚合酶链式反应扩增仪、680型酶标仪 美国Bio-Rad公司;超微量分光光度计 美国Thermo Scientific公司。
1.3 方法
1.3.1 F-Asta和AST-DHA的制备
参考杨鲁等方法,以DHA与虾青素作为反应底物合成AST-DHA,具体反应条件为虾青素250 mg、DHA 282 mg、无水丙酮5 mL、4-二甲氨基吡啶100 mg、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐100 mg,充氮后避光并进行磁力搅拌,在25 ℃反应3 h。合成的产物通过硅胶柱纯化后,用C色谱柱进行梯度洗脱,流动相为甲醇和甲基叔丁基醚,采用高效液相色谱-质谱法对纯化后样品进行分析,鉴定得到纯化后F-Asta纯度为(96.2±0.5)%,AST-DHA纯度为(94.0±0.6)%。
1.3.2 细胞培养及形态观察
BV2细胞培养于含有质量分数1%青霉素及链霉素的10%(质量分数,下同)胎牛血清-培养基中。细胞在37 ℃、5% CO下无菌培养。细胞以1∶4隔天传代,以1×10个/mL孔接种于12 孔细胞培养板中,每孔接种0.5 mL,待细胞贴壁后,加入含质量浓度0、100、200、400 μg/mL LPS的2%胎牛血清-培养基培养24 h和48 h,显微镜下观察细胞形态变化。
1.3.3 四甲基偶氮唑蓝法检测细胞存活率
BV2细胞以5×10个/mL接种于96 孔板中,每孔接种100 μL。待细胞贴壁后,加入含质量浓度0、100、200、400 μg/mL LPS的2%胎牛血清-培养基。持续孵育24 h或48 h后,弃去培养基,每孔加200 μL 3-(4,5-二甲基噻唑)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2--tetrazolium bromide,MTT)溶液(用质量浓度0.5 mg/mL、pH 7.4磷酸盐缓冲溶液配制),继续孵育4 h,终止培养,吸取并丢弃孔内培养上清液,每孔加100 μL酸化异丙醇(HCl浓度为1 mol/L,(盐酸)∶(异丙醇)=1∶8),振荡10 min,使结晶物充分溶解。在570 nm波长处测定吸光度。细胞存活率计算如公式(1)所示。

1.3.4 Griess法检测细胞内NO产生量
采用Griess方法,取1.3.3节加入不同质量浓度LPS孵育24 h或48 h的细胞培养基上清液与Griess试剂等体积混合,反应5 min后,于550 nm波长处测定吸光度。以NaNO浓度为横轴、吸光度为纵轴绘制标准曲线,根据NaNO标准曲线计算培养基上清液中NO产生量。标准曲线方程为=0.072+0.048(=0.997),线性关系良好,以NaNO浓度表征NO产生量。
1.3.5 LPS诱导的炎症细胞模型及实验分组
炎症细胞模型虾青素干预实验分成4 组:空白对照组、模型组、F-Asta组和AST-DHA组。用质量浓度400 μg/mL LPS处理BV2细胞48 h构建炎症细胞模型;模型组、F-Asta组和AST-DHA组均用LPS处理,同时F-Asta组和AST-DHA组分别添加终质量浓度200 ng/mL的F-Asta和AST-DHA。
1.3.6 斑马鱼胚胎的获得及实验分组
斑马鱼成鱼养殖于循环水系统中,温度控制在(28±1)℃,pH值控制在7.0±0.5,每天明/暗时间为14 h/10 h。
选择成年斑马鱼,雌鱼与雄鱼数量按照1∶1的比例置于配鱼盒内,中间放置隔板,次日清晨抽去隔板,30 min后将鱼卵收集于培养皿中,加入胚胎培养液,置于28 ℃恒温培养箱中培养。
1.3.7 LPS诱导的斑马鱼炎症及实验分组
炎症造模:将LPS粉末用斑马鱼胚胎培养液配制成质量浓度1 mg/mL的母液备用,实验时将母液用培养液稀释为质量浓度10、15、20 μg/mL的工作液。在斑马鱼胚胎发育至2 d(day post fertilization,dpf)自然破膜后,挑选发育正常的斑马鱼胚胎移入6 孔板中,每孔30 条,每个质量浓度组设3 个重复孔。模型组中预先加入5 mL不同质量浓度LPS溶液,空白对照组加入5 mL培养液。将给药后的6 孔板放入28 ℃恒温培养箱中,待其发育至3 dpf检测胚胎体内ROS水平。
虾青素干预实验分组:分成4 组,空白对照组、模型组、F-Asta组和AST-DHA组。空白对照组在24 孔板中加入2 mL胚胎培养液;模型组、F-Asta组和AST-DHA组加入2 mL质量浓度15 μg/mL的LPS溶液。每组设置3 个重复孔,每孔30 条胚胎(2 dpf)。将给药后的胚胎放入28 ℃恒温培养箱中培养。
F-Asta和AST-DHA通过显微注射的方式注射入受精后2 h(hour post fertilization,hpf)斑马鱼胚胎中,分别吸取10 μL质量浓度200 ng/mL的F-Asta和AST-DHA溶液于玻璃注射针中,注射液滴大小为2 nL。将2 hpf左右的斑马鱼胚胎排列摆放至琼脂板上,在体视显微镜下进行注射。每个实验组需注射约200 个胚胎。待胚胎发育至2 dpf,挑选健康的胚胎进行下一步实验。
1.3.8 体视显微镜观察胚胎发育情况
在各组胚胎发育至72 hpf时,体视显微镜下观察胚胎畸形情况,按式(2)计算畸形率。

1.3.9 免疫荧光分析ROS水平
将3 dpf斑马鱼胚胎转移至24 孔板中,每孔5 条胚胎,用2 mL荧光探针染料DCFH-DA溶液(质量浓度5 μg/mL)处理,在28.5 ℃避光孵育1 h。将胚胎用胚胎培养液冲洗3 次,并在观察前用体积分数0.016% MS222将斑马鱼胚胎麻醉。在荧光显微镜下观察并拍照,使用Image J图像处理软件分析荧光成像图片并计算平均荧光强度,ROS水平以平均荧光强度表示。
1.3.10 MDA含量测定
待胚胎发育至4 dpf时,从每组中取10 个斑马鱼胚胎,用磷酸盐缓冲溶液洗涤3 次,按照试剂盒说明书要求测定胚胎MDA含量,结果以蛋白计,重复3 个平行。
1.3.11 实时荧光定量聚合酶链式反应测定促炎因子的表达
按照试剂盒说明书提取BV2细胞和斑马鱼的总RNA,用超微量分光光度计测定不同实验组RNA浓度;参照反转录试剂盒说明书步骤反转录为cDNA;以cDNA为模板,加入相关引物进行实时荧光定量聚合酶链式反应(quantitative polymerase chain reaction,qPCR),扩增各目的基因。扩增结束后,分别以和为内参基因,用2相对定量法计算各基因的相对表达量。引物序列如表1所示。

表1 qPCR的基因引物Table 1 Gene-specific primers for qPCR
1.4 数据处理与分析
所有实验至少重复3 次,结果以平均值±标准差表示。用GraphPad Prism 8.0软件作图并进行统计学分析,多组数据之间统计学差异分析采用单因素方差分析,<0.05被认为有显著性差异。
2 结果与分析
2.1 AST-DHA对BV2细胞炎症的作用
2.1.1 LPS对细胞形态、细胞存活率及NO产生量的影响
用质量浓度0、100、200、400 μg/mL的LPS处理BV2细胞24 h和48 h,观察BV2细胞形态,细胞活力及NO产生量的变化,由此确定构建BV2细胞炎症模型的LPS质量浓度。由图1A可知,加入不同质量浓度LPS培养48 h,空白对照组和质量浓度100 μg/mL LPS组细胞形态正常,多为小的圆形或具有长的突触。而LPS质量浓度达到200 μg/mL时,细胞胞体明显变大,突触变短。LPS质量浓度400 μg/mL时细胞状态改变更加明显。由图1B可知,100 μg/mL以上LPS诱导BV2细胞48 h可以极显著降低细胞存活率(<0.01),与空白对照组相比,细胞存活率下降了约50%。而各质量浓度LPS诱导24 h后细胞存活率均与空白对照组无显著差异(>0.05)。NO是炎症进程中的重要信使,与免疫调节作用密切相关。由图1C可知,在质量浓度100、200、400 μg/mL LPS诱导BV2细胞48 h,其NO产生量与空白对照组相比极显著升高(<0.01)。质量浓度100 μg/mL和200 μg/mL LPS处理24 h时,细胞NO产生量与空白对照组相比变化不显著(>0.05)。综合上述结果,后续实验用质量浓度400 μg/mL LPS处理BV2细胞48 h构建炎症细胞模型。


图1 LPS诱导BV2细胞炎症模型的建立Fig. 1 Establishment of BV2 cell model of LPS-induced inflammation
2.1.2 AST-DHA对BV2细胞炎症因子表达水平的影响
细胞中促炎因子表达水平的上升会加速细胞炎症的进展。常见的促炎因子有TNF-α和IL-1β。由图2可知,模型组中和表达水平均高度显著高于空白对照组(<0.000 1、<0.001),分别约为对照组的1.5 倍和1.4 倍,而AST-DHA组和mRNA相对表达量接近于空白对照组,说明AST-DHA显著降低了LPS诱导的BV2细胞中炎症因子的表达水平(<0.001、<0.01),F-Asta对细胞中的表达作用效果不显著(>0.05)。结果表明,AST-DHA能够下调炎症细胞中炎症因子的表达水平,对LPS诱导的细胞炎症具有改善作用。

图2 AST-DHA降低BV2细胞中炎症因子mRNA表达水平Fig. 2 Astaxanthin DHA monoester decreased the mRNA expression of inflammatory factors in BV2 cells
2.2 AST-DHA对LPS诱导的斑马鱼炎症的保护作用
2.2.1 LPS诱导斑马鱼炎症模型的建立
ROS通常是寿命短活性高的小分子,包括氧衍生的自由基,如超氧阴离子自由基和羟自由基等。体内高水平的ROS可以诱导氧化应激反应,导致各种细胞或组织损伤。将斑马鱼胚胎暴露在质量浓度0、10、15、20 μg/mL的LPS中,染色后,荧光显微镜下检测ROS水平。图3结果显示,用LPS处理斑马鱼胚胎后,当质量浓度达到15 μg/mL时绿色荧光强度最强,与空白对照组相比染色效果最明显,后续实验采取该质量浓度LPS处理斑马鱼胚胎建立炎症模型。

图3 不同质量浓度LPS诱导的炎症斑马鱼胚胎体内ROS荧光图(4×)Fig. 3 Fluorescence images of ROS in zebrafish embryos with inflammation induced by different concentrations of LPS (4 ×)
2.2.2 AST-DHA对炎症斑马鱼胚胎发育畸形的调节作用
斑马鱼具有胎身透明的特点,因此其发育过程在显微镜下清晰可见。在体视显微镜下观察到正常发育至48 hpf的斑马鱼胚胎(图4A)和经LPS诱导各组典型的发育阴滞胚胎(图4A)。发育阴滞的情况有卵黄囊水肿、尾部发育不全、眼部发育不全和脊索畸形等。如图4B所示,模型组畸形率是空白对照组的2 倍多,F-Asta组和AST-DHA组斑马鱼胚胎畸形率与模型组相比高度显著下降(<0.001、<0.000 1),尤其是AST-DHA组,其畸形率接近于空白对照组。以上结果表明,AST-DHA对炎症斑马鱼胚胎的发育具有保护作用。

图4 AST-DHA对炎症斑马鱼胚胎畸形率的影响Fig. 4 Effect of astaxanthin DHA monoester on the rate of embryo malformation in zebrafish with inflammation
2.2.3 AST-DHA对斑马鱼体内ROS水平的影响
如图5A所示,注射AST-DHA的斑马鱼荧光强度明显低于模型组。进一步采用Image J软件分析荧光成像图像并计算平均荧光强度。如图5B所示,与模型组相比,F-Asta和AST-DHA均能有效抑制炎症斑马鱼体内ROS的产生(<0.001、<0.000 1)。AST-DHA组斑马鱼的ROS水平较F-Asta组极显著降低(<0.01),其ROS水平接近于空白对照组。以上结果表明AST-DHA较F-Asta具有更好的降低炎症斑马鱼体内ROS产生量的效果。

图5 AST-DHA对炎症斑马鱼胚胎体内ROS水平的影响Fig. 5 Effect of astaxanthin DHA monoester on ROS levels in zebrafish embryos with inflammation
2.2.4 AST-DHA对斑马鱼胚胎体内MDA含量的影响
体内MDA水平常用来反映过氧化程度,反映机体清除氧自由基的能力。由图6可知,模型组与空白对照组相比,斑马鱼胚胎体内MDA含量高度显著上升(<0.000 1),约为对照组的2.5 倍。与模型组相比,AST-DHA和F-Asta均能高度显著减少炎症斑马鱼胚胎体内MDA含量(<0.000 1),且AST-DHA组MDA含量的下降较F-Asta组更明显(<0.01)。结果表明,LPS的暴露会导致斑马鱼胚胎体内过氧化物MDA含量增加,AST-DHA可以缓解这种应激状态。

图6 AST-DHA对炎症斑马鱼胚胎体内MDA含量的影响Fig. 6 Effect of astaxanthin DHA monoester on MDA content in zebrafish embryos with inflammation
2.2.5 AST-DHA对斑马鱼体内炎症因子的调节作用
由图7可知,LPS处理后斑马鱼胚胎体内促炎因子和水平较空白对照组极显著升高(<0.01)。F-Asta对mRNA表达水平无显著作用(>0.05),但能显著降低mRNA表达(<0.05);AST-DHA能显著降低和的表达水平(<0.01、<0.05)。结果表明,虾青素对LPS诱导的斑马鱼胚胎炎症反应有改善作用,并且AST-DHA较F-Asta下调炎症因子的效果更好。
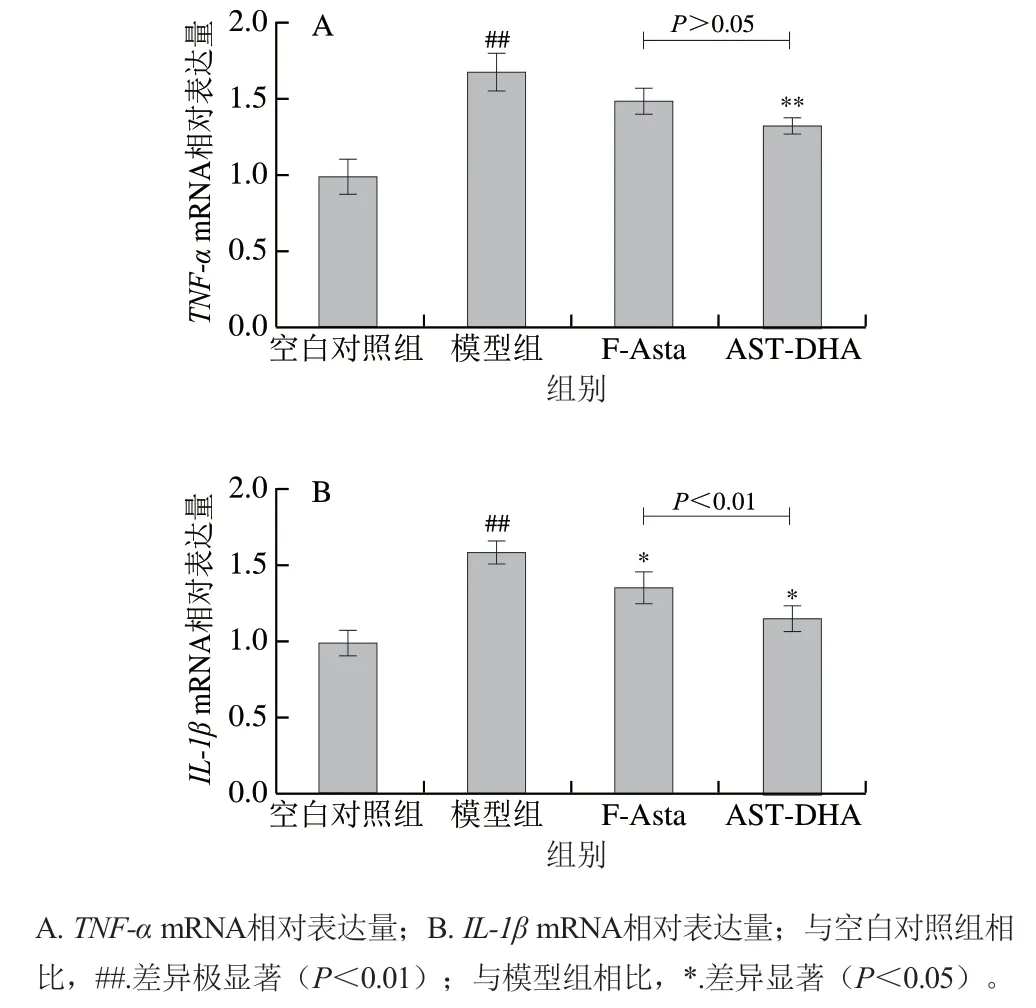
图7 AST-DHA对炎症斑马鱼胚胎体内炎症因子表达水平的影响Fig. 7 Effect of astaxanthin DHA monoester on the expression of inflammatory factors in zebrafish embryos with inflammation
3 讨 论
虾青素是一种具有抗氧化特性的类胡萝卜素,可作为食品补充剂使用,它是一种亲脂化合物,生物利用度低,与其他类胡萝卜素类似。F-Asta和虾青素酯均具有很强的生物学活性。Rao等发现,相比于F-Asta,虾青素酯的抗癌活性更强,认为虾青素酯在生物体内具有更优的生物利用度。Kamath等对虾青素单/双酯、F-Asta的单线态氧猝灭能力进行了比较,表明相对于其他实验组虾青素酯具有更好猝灭能力。本课题组前期考察了脂质基质效应对虾青素酯生物利用度的影响,发现长链脂肪酸含量的增加有利于虾青素酯生物利用度的提高,在此基础上合成了AST-DHA并优化了反应条件。
斑马鱼具有与人类相似的形态和生理功能,被广泛应用于药理学研究。目前研究表明,斑马鱼的免疫系统与人类有着很高的相似度,几乎所有的人类免疫系统细胞在斑马鱼中均存在。本实验中利用斑马鱼胚胎身体透明的特点,观察斑马鱼胚胎发育过程并通过活体染色来监测体内ROS水平变化。巨噬细胞、中性粒细胞和嗜酸性粒细胞通过产生ROS以破坏入侵的细菌和病毒颗粒,因此ROS可被认为是炎症反应强度的指标。体内产生过量的ROS可能导致细胞和组织损伤。抑制ROS过度产生可以有效阴止炎症反应的进展,这种抑制可以被视为潜在的抗炎药物开发目标。本实验结果说明LPS可引起斑马鱼的炎症反应并促进ROS生成,而F-Asta和AST-DHA可减少斑马鱼体内ROS产生量,表现出良好的抗炎活性,AST-DHA降低ROS水平的效果更优于F-Asta。
炎症反应是体内常见的生物反应过程,可促进激活巨噬细胞等炎症细胞释放肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素(interleukin,IL)-1β等促炎症因子。TNF-α是体内重要的早期炎症反应生物标志物,可提高对中性粒细胞的吞噬作用,促进IL-1β等促炎因子的产生,刺激局部炎症反应。过量的TNF-α可诱导生成线粒体ROS,导致分枝杆菌和受感染的巨噬细胞程序性坏死。IL-1β是一种强效促炎性细胞因子,可诱导合成前列腺素,活化免疫细胞,促进成纤维细胞的增殖。研究表明,体外和体内毒物会增加斑马鱼体内TNF-α和IL-1β的表达水平。本研究发现,细胞和斑马鱼模型中AST-DHA组的炎症应激反应较模型组显著降低,效果优于F-Asta组。
4 结 论
本研究利用不同质量浓度LPS处理BV2细胞和斑马鱼,通过对体内外模型生化指标的检测、染色结果的观察以及qPCR检测,确定了AST-DHA对LPS诱导的炎症的保护作用,且AST-DHA较F-Asta表现出更好的抗炎活性,这可能得益于虾青素与DHA的协同作用,为AST-DHA生物活性的研究和相关功能性食品的开发提供理论依据。
