吉妥单抗复兴史
2022-10-20吴仪刘睿吕弋
吴仪,刘睿,*,吕弋
1四川大学化学学院,成都 610064
2四川大学分析测试中心,成都 610064
瑞典病理学家Folke Henschen曾说,“人类的历史即其疾病的历史”。随着现代医学、化学与生物学的发展,我们探究出更多病理,研发出更多药物,制定出更多方案,在战胜疾病上取得了空前辉煌的成就;但我们也不得不承认,如何对抗癌症依然是架在人类面前的一座大山。从20世纪初期的放射疗法,中后期的化学疗法,到21世纪的靶向治疗,每个时代的科学家都试图用最新的理论和工具治疗癌症,而使用抗体偶联药物(Antibody-drug conjugate, ADC)的靶向治疗则是近5年最引人注目的新兴浪潮。
各位观众可能会问:ADC是什么?它的概念从何而来?它有怎样的优势、又面临怎样的挑战?该领域有什么可能的发展方向?本次访谈邀请到了首个被美国食品药品监督管理局(FDA)批准上市的ADC——吉妥单抗(Gemtuzumab ozogamicin,商品名Mylotarg)先生,将聚焦他的传奇奋斗历程,为各位揭开ADC家族神秘的面纱。
1 ADC家族
(在下文中,用A代指主持人,B代指吉妥单抗。)
A:吉妥单抗先生,您好。
B:您好。
A:很高兴您能来到本次访谈。ADC药物近几年在癌症化疗领域崭露头角,但是公众对它的组成和作用都不甚了解。而您是ADC家族里资历最老的前辈,历经行业的低谷和新高潮,所以我们邀请您作一个具体的介绍。
B:非常荣幸。
A:让我们从观众和我个人都最感兴趣的问题开始吧。请先生简单地介绍一下ADC家族。
B:我的家族全名叫抗体偶联药物,是一种新型药物。就像字面含义一样,ADC由抗体、小分子药物和偶联两者的连接子3部分组成(图1a)。不同部分各司其职:抗体利用抗原-抗体的特异性结合原理识别带有抗原决定簇的患病细胞,把ADC引到细胞附近;连接子是针对患病组织环境专门设计的结构,在体液中稳定存在,但在患病细胞周围或内部可自动释放小分子药物;小分子药物对患病细胞的结构或基因组有一定破环性,可导致细胞死亡[1](图1b)。
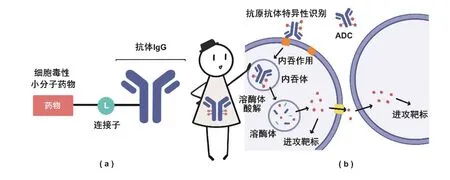
图1 ADC分子的结构和作用方式
A:这种结构与普通癌症用药相比有什么特殊之处呢?
B:普通药物只有小分子药物一个组分,将随人体的循环系统对所有细胞无差别地发挥药理作用,可能影响正常细胞的生理结构和功能,产生极大的毒副作用。ADC在药物上偶联了具有识别作用的抗体,使得药物可以精确作用于患病细胞,而不易损伤正常细胞。
A:所以ADC作为一种化疗药物,最大的特色是提升了安全性。
B:可以这样理解,但ADC的优势不止于此。精确用药使得ADC可以使用更大剂量或更高毒性的药物,提升抗癌效果,对儿童和60岁以上老年人等常规药物耐受性较差的人群非常友好[2]。
2 百年前的“魔术子弹”
A:这样看来,抗体在ADC中起到了相当重要的作用。我们常说“靶向治疗”药物,其实“靶”只存在于病原体上,是抗体有选择性、方向性地运动并作用于特定“靶标”部位,带来后续的治理效果。不得不说,免疫学的推进对药物的设计方案更新有极大意义呢。
B:你说的很对。不过实际上,靶向治疗的概念在百年之前就已经被提出了。化学疗法之父,德国科学家Paul Ehrlich由细胞的特异性染色现象构思出了靶向治疗的初始概念。
A:这位Ehrlich先生似乎还是1908年的诺贝尔医学和生理学奖得主?
B:是的。他是一名少见的跨领域奇才,在有机化学、药物化学、免疫学和血液学中都有重要研究成果。现在看来,他还拥有足以跨越时代的超前直觉:他希望找到一种药物,能只攻击病原体,直接作用于预期的细胞亚结构,而对人体细胞没有毒副作用[3]。Ehrlich将这种药物称为“魔术子弹”。
A:与其说“魔术子弹”,他构想的药物更像一枚导弹,可以精确制导,指哪儿打哪儿。
B:一开始科学家确实是这样构想的。19世纪末被发现的放射化学技术就曾用于肿瘤的精确治疗,其进攻靶点完全由人工控制,也就是“指哪儿打哪儿”。但是这种治疗形式只能打击已被发现的原发肿瘤,很难清除微小的肿瘤细胞残留。在成像技术尚不发达的20世纪前期,能用于放疗的癌症往往已处于中晚期。所以“靶向”的概念更接近利用人体循环系统与免疫系统主动进攻病原体。
3 靶向治疗的黎明
A:也就是说,从探讨“靶向”的概念开始,人们就有了把抗体用于治疗的构想了。
B:是的。人们认识到,机体将针对不同的抗原表位产生一一对应的抗体,只要找到只存在于病原细胞的靶点,就能通过与之匹配的抗体进攻异常细胞。不过,科学家首先想到的是我们ADC的旁系——单克隆抗体,简称为单抗。
A:说到这里,我始终抱有一个疑问:“单克隆”是什么意思呢?单抗和我们身体中的抗体相比有什么区别呢?
B:这是个好问题。单抗只受一种抗原决定簇刺激生成、扩增,只能识别某一特定的抗原表位,具有更高的专一性。而从人体提取的抗体往往是多克隆抗体(多抗),是受到多种决定簇刺激形成的混合物。科学家筛选出抗原上具有生物活性的靶点,制备、输入与之对应的单抗,它会阻断细胞信号通路或诱发细胞产生错误的信号分子,使受体细胞失活[4]。
A:您刚刚提到治疗时只输入单抗一种药物,这是否说明选择的位点必须同时满足能刺激生成抗体和能构成细胞的信号通路两个条件呢?
B:您指出的正是单抗所面临的最大问题。单抗药物只能结合单一靶点,发挥单一的生物活性,抗原可以调整多通路信号系统规避它的影响。此外,单抗药物需要抗原靶点同时兼备生物活性和特异性,也导致一些癌症不能使用该疗法[5]。
A:所以科学家设计了一种新结构,抗体仅需要保留靶向运输的特异性,而让其他药物结构承担灭活细胞的生物活性。
B:没错,所以我们的ADC家族逐渐受到了他们的关注。
4 超前的先锋
A:这时吉妥单抗先生就从家族里脱颖而出了呢。平心而论,您认为自己为什么能第一个被FDA批准上市呢?是因为适应症的紧迫性,还是因为结构相对简单?
B:两者都有吧。先说适应症,我面向的人群主要是急性髓细胞白血病(AML)患者。这是一种相当危险的癌症,发生频率高,5年生存率低,还容易引发骨髓增生异常综合征(MDS)等副作用。这种副作用被称为继发性AML,让这种癌症更加凶险:一方面,AML的快速且严重的病程需要用比正常化疗更高的剂量来控制,而病人不得不承担显著的药物副作用[6];另一方面,AML的高复发率意味着病变细胞对标准治疗水平有一定耐药性——事实上,在我出面前根本没有AML成功治愈的案例。
A:面对这种凶险的疾病,您怎样选择抗体进攻靶点呢?
B:我选择的CD33是一个备受关注的靶点。它存在于成熟的正常造血细胞和AML细胞上,但不存在于正常造血干细胞上。研究表明,CD33在90%的患者的AML细胞上表达[7],满足ADC靶点的基本条件。
A:吉妥单抗先生有提到ADC是由抗体、小分子药物和连接子组成的,方便向我们介绍一下您的这三部分是怎样选择的吗?
B:当然可以,我可以站起来,让各位更容易看清我的结构(图2)。这三部分分别是人源CD33抗体(Gemtuzumab)、抗肿瘤药物卡奇霉素(Calicheamicin)和连接子。接着刚才关于抗体的话题,我选用了亲和力高、半衰期较长、几乎没有杀伤细胞毒作用(ADCC)活性的IgG4[8]。它的内源性氨基酸如赖氨酸、组氨酸、酪氨酸和参与链间二硫化物合成的半胱氨酸都是不错的连接位点[9]。我用的是赖氨酸末端的氨基结构,它与连接子形成酰胺偶联物,可以让释放药物后的抗体更容易被溶酶体蛋白水解为两性离子衍生物,降低免疫原性。

图2 吉妥单抗的结构
A:连接子一般是怎样的结构呢?您和家族里的各位使用的连接子相似吗?
B:大家的连接子都有细微差别。因为它需要在人体内环境中保持稳定,在特定组织或细胞处才释放药物,所以连接子一般都是由科学家“独家定制”的。以我自己为例,在进入人体后,我将与AML细胞上的CD33抗原特异性结合,诱发内吞作用进入细胞溶酶体;随后连接子水解,释放出卡奇霉素进攻DNA双链,进而导致细胞死亡[10]。所以我的连接子引入了腙键作为水解位点,在37 °C下、pH 7.4时24 h水解率为6%;而在溶酶体pH 4.5的环境中,对应的水解率为97%[9],相差就很大了。
因为脂肪醛和酮生成的腙过于不稳定,所以我用稳定性和活性更好的芳香醛类代替了脂肪醛;而另一边,苯乙酮类化合物在溶酶体等酸性条件下能更快地释放出咖啡霉素衍生物,所以采用了“芳香醛+苯乙酮”的强共轭结构,能增进卡利霉素和抗体之间的亲脂性相互作用,进一步降低了中性环境的水解程度(从6%到2%)[9],使临床使用更具安全性。
A:刚刚吉妥单抗先生提到,您需要进入细胞内部释放一种名为卡奇霉素的药物。能否简单地为我们解释一下它是怎样杀灭患病细胞的呢?
B:卡奇霉素是一种天然抗肿瘤药物,含有一个烯二炔头部和一个由4个糖单元与异常取代的芳香环组成的碳水化合物尾部。尾部在溶液中形成特定的螺旋构象,能整齐地嵌入DNA螺旋的小沟中。头部负责发挥药理作用:烯二炔单元含有一个桥头堡烯烃的双环结构,它限制了烯二炔的柔韧性,使卡奇霉素在正常环境中保持稳定。然而,如果引入还原剂,卡奇霉素最前端的甲基三硫醚将被还原,引发分子内Michael反应,去除约束烯二炔的桥头烯烃,激发伯格曼环化反应。当链部更柔软的自由基结构遇见一条脱氧核酸链的小沟时,它会迅速从该脱氧核酸的相反链中提取氢原子,导致两条DNA链同时造成损伤(图3)。我身上的是卡奇霉素的母体,它还具有独特的甲基三硫键,让还原结构最靠近双环核心,可以增快反应速度与选择性[9]。

图3 卡奇霉素的作用原理
A:真是相当复杂又精妙的作用途径啊!请问除了您以外,还有别的家族成员使用这种药物作为药效部分吗?
B:我的小弟奥英妥珠(Inotuzumab ozogamicin,商品名Besponsa)也使用这种药物,他和我一样负责对抗AML,只是分属的靶点不同。卡奇霉素的烯二炔结构给药学家带来了许多灵感,我相信它的作用机制能活用到更多抗癌药物的设计中。
5 随访滑铁卢
A:刚刚吉妥单抗先生为我们介绍了他精密的结构,想必给各位观众留下了深刻的印象。不过我听说,在您正式上市后,曾引发一阵不小的风波,这是真的吗?
B:唉,此事说来话长呐。2004年,我在一项随机研究测试中出现了重大失误:当我和较低剂量的常规化疗药物一起治疗时,不仅没有改善临床疗效,还带来了更高的早期死亡率。一些患者还有更大风险罹患一种致命的肝脏并发症——肝小静脉闭塞病[11]。这份报告一公之于世,欧美等国家都愤愤不平,可让我头疼了。
A:我听说,因为这次试验,您在2009年主动申请退市了。
B:没错。那时候参与研发的辉瑞公司和前惠氏公司的科学家都围着我团团转,希望能发现问题的突破口。
A:现在吉妥单抗先生已经重新回到对抗癌症的第一线上了,如果再回想第一次失误的经历,您认为关键的问题是什么呢?
B:我认为影响药效的最大因素还是偶联结构。引入新结构远不像拼积木一样简单,偶联在增强药效与特异性的同时也带来了安全问题:连接子的体内水解率是否与血浆或血清实验中的相同?这原本是一个简单的化学分析问题,却因为ADC是一种组成复杂的混合物,变得非常困难。
A:为什么说ADC是一种混合物呢?三部分之间相连的作用力不都是化学键吗?
B:因为卡奇霉素并不是随机与抗体的赖氨酸偶联的。依据预期,卡奇霉素应该主要分布在8个赖氨酸上,两个重链上各有4个;但实际上,可能大约一半的抗体携带的药物很少,而另一半抗体载药量达到了平均负载的两倍[9](图4),使ADC药剂本质上是载药量不同的抗体的混合物。这种现象可能是因为高度亲脂性卡奇霉素的聚集状态,导致任何初始共轭点附近的局部高浓度,也可能是因为在铰链区附近的赖氨酸位点与抗原结合时构象变化,导致偶联稳定性变化。这一问题在ADC家族里广泛存在。

图4 不同DAR的ADC
A:可是,即使载药量不同,ADC本身的组分并没有发生改变,这会给药效带来什么影响呢?
B:拿我自己的经历举例,最终的研究报告表示,造成不良反应主要是因为原方案剂量过高。如果多次少量地用药,肝静脉阻塞疾病的风险和早期死亡率就会下降至安全水平[12]。这一现象被归因于CD33结合效率的改变:高剂量给药时,CD33位点在药物半衰期内处于饱和甚至超饱和[13];如果ADC的载药量相当分散,可能局部位点结合效率过高,其他位点还处于未饱和的状态,不仅治疗效率降低,引发并发症的风险也大大增加,可能会再一次重演2004年的悲剧。
A:原来如此,我明白了。那怎样确保生产出的ADC的载药量分布符合安全标准呢?
B:科学家也持有相同的疑问。为此,他们给反映抗体-药物的实际偶联情况设定了一个检测指标——药物-抗体比(DAR)。它是药物的稳定性和安全性的决定性因素,也是评判不同合成方法优劣的重要指标。DAR的分析主要分为两类,一是测定DAR的分布,表征不同DAR值的ADC分子数量各自占总ADC分子数的比例;二是检测平均DAR值,即体系中总的药物分子和抗体分子的摩尔浓度之比[14]。每一种在FDA进行审批的ADC都必须使其DAR分布在一定范围内才能被允许上市,DAR也因此被称为ADC质量检测的核心指标。
A:听了您前面的叙述,我已经深刻认识到这个指标对ADC药物的重要性了。那么,这个新指标可以用什么方法检测呢?您说这种现象使ADC的化学分析尤其困难,这又是为什么呢?
B:这个问题困扰了我们很久呢。如果只从结构出发,ADC包括大分子和小分子特征,大分子成分可用酶联免疫吸附法(ELISA)定量,利用特异性免疫反应捕捉抗体,间接测量分析物浓度;小分子药物则可以通过高效液相色谱(HPLC)或液相色谱串联质谱(LC-MS/MS)从血浆/血清中提取检测(图5)。但这样只能测定一批药物的DAR平均值。

图5 DAR平均值的测定
A:您提到过,只测定DAR的平均值并没有达到ADC质量测定的标准。这是不是意味着科学家需要研发一种新方法测定DAR分布呢?
B:实际上,一些传统方法改进后就能测定DAR分布。例如,一些功能的色谱柱可以区分载药量差别较少的ADC。
A:方便为我们介绍几种最常用的方法吗?
B:目前常用的是尺寸排阻色谱(Size exclusion chromatography,SEC)和疏水作用色谱(Hydrophobic interaction chromatography,HIC)两种色谱柱。当然,也有亲和捕获毛细管色谱等适用于DAR分布测定的新性色谱柱[1]。
A:这两种色谱柱分别使用了什么分离原理呢?在分离不同DAR的ADC之后,一般会选用什么检测器来定量呢?
B:排阻色谱法可以获得分散性聚合物的相对分子质量分布情况。色谱柱的填料是多孔凝胶,仅允许直径小于孔径的组分分子进入。使用时,较大的分子被排斥,在色谱柱中停留时间较短,很快被洗出,保留时间小;较小的分子则渗入凝胶孔,相对难以洗脱,保留时间较大。从结果上说,它就像一个特殊的筛子,先筛出体积较大的分子,再筛出体积小的分子(图6)[15,16]。

图6 排阻色谱法测定DAR分布的原理
A:这种方法似乎在蛋白质分离中也很常用。
B:是的,蛋白质是它的老顾客了。在选择检测器时,如果小分子药物在紫外或可见光下有发色基团,可使用紫外分光光度计测定吸光度确定DAR浓度[17];如果想得到更精确的检测结果,可以串联质谱分析:先用PNGase酶去除重链CH2结构域的N糖,用软件进行去卷积处理,去除电荷的影响,测定裸抗的相对分子质量。再检测获得ADC的去卷积质谱图,通过差值分析得到DAR的分布[18]。
A:吉妥单抗先生展示的这张图片上DAR不同的ADC的分辨率已经很清晰了呢。
B:是的,所以排阻色谱法应用非常广泛。不过,分子量差别大于10%时才可用这个方法分离,所以它不适合分离复杂的混合物[15,16]。对于我们ADC,负载药物量差别不大的抗体分子量差别也不大,很可能出现相邻值合并的情况,因此检出准确度有待提升。这时候往往会使用疏水作用色谱。
A:疏水作用色谱就是利用样品分子与固定相的疏水力作用的不同进行分离的技术吧?
B:您说的没错。疏水作用在生物系统中广泛存在,是调节蛋白质等生物大分子结构与生理活动的主要驱动力。当服务我们ADC时,疏水色谱柱一般使用琼脂糖等轻度疏水的固定相,搭配较短链的烷基(如丁基、己基、辛基等)、苯基或醚作为疏水配体。这些配体与我们的疏水部位受熵增或自由能等热力学因素驱动自发结合,减小水相中的疏水表面积,把疏水性较强的ADC留在了柱中。抗体与固定相配体之间的疏水相互作用强度一般由配体密度控制,而配体密度与抗体保留值之间的关系则取决于我们个头的大小[15,19]。
A:如果只是根据体积分离,这种方法与排阻色谱不是重合了吗?
B:是的。但排阻色谱的分离条件只取决于固定相,疏水色谱的选择性和保留值则受洗脱液的盐浓度、pH、温度和有机助剂同时调控[20]。举例来说,当洗脱液中盐的浓度很高,水分子的运动非常剧烈,难以在ADC的疏水部位周围形成空穴,疏水配体对我们的吸附力就更强。这些丰富的参数选择增大了检测的选择性,还便于随时调整,所以准确性往往比排阻色谱更好(图7)。

图7 疏水色谱法测定DAR分布的原理及影响因素
6 东山再起
A:看来科学家在ADC的质量分析上下了不少功夫。ADC家族经历了漫长的研发历程,如今受到临床医学、药学、生物化学和分析化学四个学科共同关注,也算是厚积薄发了。
B:这么说来,我们家族第二个步入实业的Adcetris获得批准也是2011年的事了,老三(Kadcyla)和老四(Besponsa)分别在2013年和2017年获得批准。大家确实都在行业低谷期熬了很久呢。
A:但是2017年,您再一次被FDA批准治疗首发AML成年患者及两岁以上继发性AML患者。重获公众的信任之后,ADC家族的发展也逐渐被看好。2018年,世界三大医药公司之一诺华宣布与专注于开发治疗癌症的靶向药物的生物医药公司Endocyte达成并购协议,主要瞄准的就是新型ADC成员带来的商机。
B:哦?您指的是177Lu-PSMA-617吗?他确实很厉害,可以靶向作用于前列腺特异性膜抗原(PSMA),把放射性同位素177Lu传递给肿瘤细胞,可以看作把搭载药物与放射治疗结合起来了。
A:是的,ADC家族真是人才辈出。这次被诺华招聘的消息很难不让人联想到您和家族“柳暗花明又一村”的经历。2019-2020一年间,共有5个ADC获批,相较之前增加了一倍多。目前,全球陆续共14个ADC药物上市,FDA批准上市了11个,还有上百个ADC药物正处于临床研究阶段[8]。ADC研究终于迎来了春天。
B:哈哈,谢谢您的衷心祝愿,我也希望如此。
A:随着时间的推进,我们的访谈将要迎来尾声。相信经过本次采访,各位观众对ADC家族的全貌有了更深入的了解。吉妥单抗先生,在节目的最后,能请您为屏幕前的中国观众致辞一段吗?
B:好的,谢谢主持人。各位来自中国的观众,你们好。2020年,我们家族首个由中国原创的成员维迪西妥(商品名:爱地希)问世[21]。据统计,目前中国与我们ADC合作的研究项目可达40个,占全球项目总数的20%,相信此后我们还有更多机会相见。不过,现在允许在中国进行治疗的ADC只有恩美曲妥珠单抗(Kadcyla)、维布妥昔单抗(Adcetris)和维迪西妥单抗[22],与国外相比还有巨大的市场。所以,我在此呼吁各位对ADC家族和靶向药物一族投入更多关注,让我们一起向对抗癌症、彻底治愈癌症的终极目标而努力吧!
A:感谢吉妥单抗先生真挚的问候与深切的呼吁。本次节目到此结束,感谢大家的收看!
