蒲公英多糖对ICR小鼠体质量和器官的影响
2022-10-20林美含徐兴军刘佳人强健孙溪康文锦
林美含,徐兴军,刘佳人,强健,孙溪,康文锦
蒲公英多糖对ICR小鼠体质量和器官的影响
林美含1,2,徐兴军1,2,刘佳人1,2,强健1,2,孙溪1,2,康文锦1,2
(齐齐哈尔大学 1. 生命科学与农林学院,2. 抗性基因工程与寒地生物多样性保护黑龙江省重点实验室,黑龙江 齐齐哈尔 161006)
为探讨蒲公英多糖对ICR小鼠体质量和器官的影响.将ICR小鼠按体质量(21.79±1.55)g随机分为对照组、蒲公英多糖低浓度组、蒲公英多糖中浓度组、蒲公英多糖高浓度组,每组12只,各组间体质量差异不显著(>0.05).对照组灌胃生理盐水,低浓度组灌胃浓度为150 mg/(kg·d)的蒲公英多糖,中浓度组灌胃浓度为300 mg/(kg·d)的蒲公英多糖,高浓度组灌胃浓度为600 mg/(kg·d)的蒲公英多糖,灌胃4周后,利用BS124S型电子天平测量体质量和器官质量,直尺测量肠道长度,石蜡切片法测定肠绒毛长度、绒毛宽度、粘膜层厚度及肠壁截面积.结果表明,蒲公英多糖使小鼠体质量、器官质量、小肠绒毛宽度显著降低(<0.05),并与蒲公英多糖浓度呈反比;蒲公英多糖能使消化道的长度、小肠绒毛高度、小肠肠壁截面积显著增加(<0.05),并与蒲公英多糖浓度呈正比;蒲公英多糖对小鼠大肠和直肠影响不显著(>0.05).
蒲公英多糖;ICR小鼠;石蜡切片
蒲公英()为菊科蒲公英属多年生草本植物,又名婆婆丁、白鼔丁等,种类繁多,分布在北半球温带地区[1-4],美洲地区、澳大利亚和新西兰也有分布[5].植物多糖广泛存在于植物体内,是维持有机体新陈代谢与机能运转的基础物质,也是蒲公英主要活性成分之一,具有抗肿瘤、抗病毒、抗氧化、抗辐射、降血糖、提高机体免疫力等多种药理作用和生物活性[6-10].蒲公英多糖除具有较强的抗氧化活性和抗菌活性外,还具有抗氧化应激、抗炎症反应、保护肝等作用[11-12].
本研究以不同剂量的蒲公英多糖连续灌胃小鼠,从生理学水平研究其对小鼠体质量、器官质量和肠道的影响,为进一步开发利用蒲公英提供理论依据.
1 材料与方法
1.1 实验材料
将48只SPF级别的ICR小鼠(Institute of Cancer Research,(21.79±1.55)g)在实验室适应性饲养1周后,按体质量随机分为对照组、低浓度组、中浓度组和高浓度组,每组3个重复,每个重复4只,各组间体质量差异不显著(>0.05).对照组灌胃生理盐水,低浓度组灌胃浓度为150 mg/(kg·d)的蒲公英多糖、中浓度组灌胃浓度为300 mg/(kg·d)的蒲公英多糖,高浓度组灌胃浓度为600 mg/(kg·d)的蒲公英多糖,各组小鼠自由进食、饮水,自然光照,灌胃4周.
1.2 实验方法
1.2.1体质量和各器官质量测量体质量和器官组织鲜质量、干质量采用BS124S型电子天平测量,精确到0.01 g.实验开始后,每天上午11时测定各组小鼠的初始体质量;灌胃不同浓度的蒲公英多糖4周后,测定各组小鼠终体质量及主要器官质量.
1.2.2肠道长度测量小鼠肠道分为大肠、小肠、直肠,用直尺测量肠道各部分的长度,记录数据.
1.2.3肠绒毛长度、绒毛宽度、粘膜层厚度以及肠壁截面积测量采用石蜡切片法对小鼠肠道组织进行制片[13],应用Nikon显微成像系统在10×20倍视野对肠道组织的绒毛高度、绒毛宽度、粘膜层厚度、肠壁截面积进行测量.
1.3 数据分析
采用SPSS 21.0对实验数据进行数据分析.组间比较采用一维方差分析,实验结果数据均以平均值±标准误差(Mean±SE)表示,>0.05表示组间差异不显著,0.05表示组间差异显著.
2 结果与分析
2.1 蒲公英多糖对小鼠体质量的影响
实验开始前,各组小鼠体质量差异均不显著(>0.05),随着灌胃时间的增加,各组小鼠体质量逐渐上升.灌胃第1周后,3种浓度实验组小鼠体质量分别低于对照组(0.99±0.88)g,(2.28±0.37)g,(3.48±0.81)g,且差异显著(<0.05),但其组间差异不显著(>0.05);灌胃4周后,各组小鼠体质量差异均显著(<0.05),且小鼠体质量随着灌胃的蒲公英多糖浓度的升高而降低(见表1).
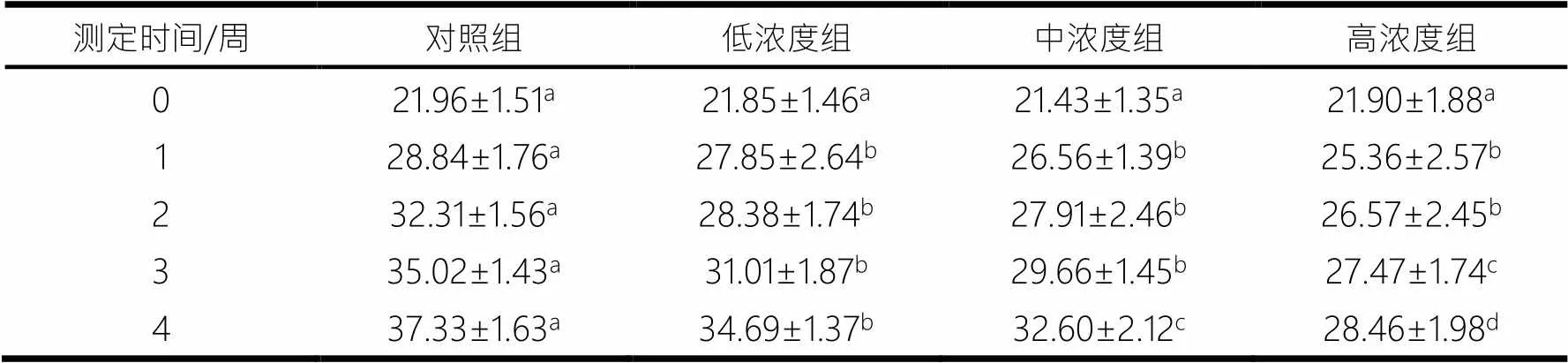
表1 不同浓度蒲公英多糖对小鼠体质量的影响 g
注:同一项目的同行肩标不同字母表示差异显著(<0.05),相同字母表示差异不显著(>0.05),下同.
2.2 蒲公英多糖对小鼠器官质量的影响
灌胃4周后,3种浓度实验组小鼠心脏、脾脏、肺脏、胃、肾脏和肝脏的鲜质量均显著低于对照组(<0.05),且各组组间器官鲜质量差异均显著(<0.05).3种浓度实验组小鼠心脏、肺脏、胃、肾脏和肝脏干质量均显著低于对照组(<0.05),且各组组间器官干质量差异均显著(<0.05)(见表2).
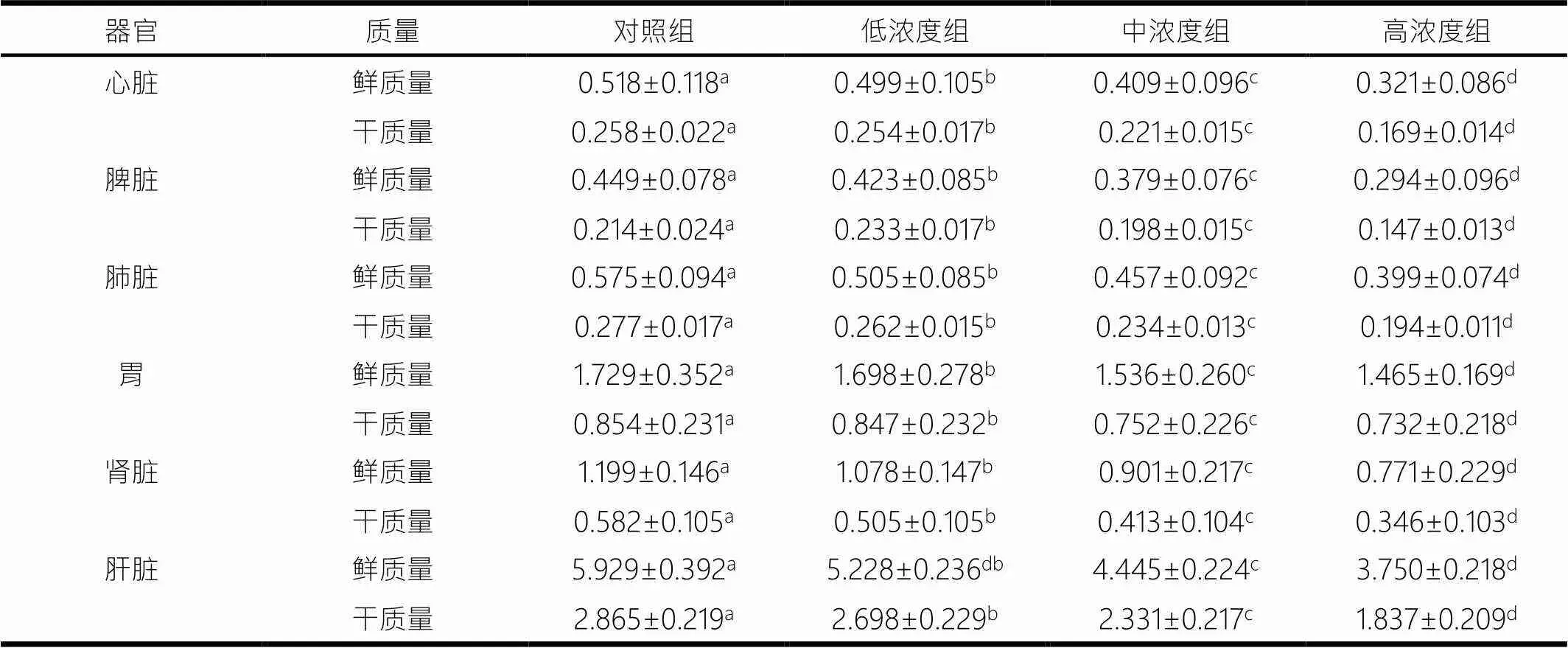
表2 不同浓度蒲公英多糖对器官质量的影响 g
2.3 蒲公英多糖对小鼠消化道的影响
不同浓度蒲公英多糖对小鼠消化道的影响见表3,各组小鼠消化道切片见图1.由表3和图1可见,灌胃4周后,3种浓度实验组小鼠小肠长度、小肠绒毛高度、小肠壁截面积、大肠长度均显著高于对照组(<0.05),小肠绒毛宽度显著低于对照组(<0.05).其中低浓度组小鼠小肠绒毛高度与中浓度组小鼠小肠绒毛高度差异不显著(>0.05),高浓度小鼠小肠绒毛高度与低浓度和中浓度小鼠小肠绒毛高度差异显著(<0.05).各组组间小肠长度、大肠长度、小肠绒毛宽度、小肠壁截面积差异均显著(<0.05).各组组间大肠绒毛高度、大肠绒毛宽度、大肠肠壁截面积、直肠长度、直肠绒毛高度、直肠绒毛宽度和直肠肠壁截面积差异均不显著(>0.05).
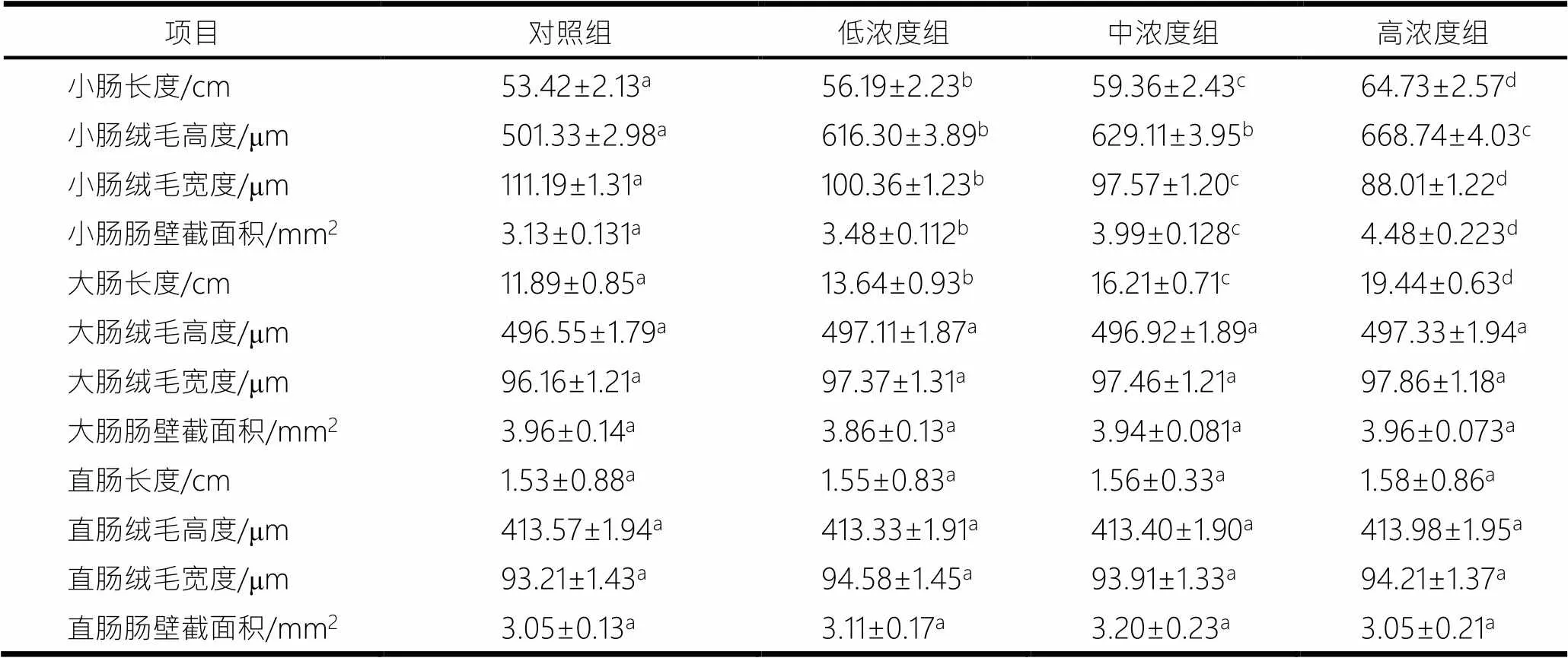
表3 不同浓度蒲公英多糖对小鼠消化道的影响
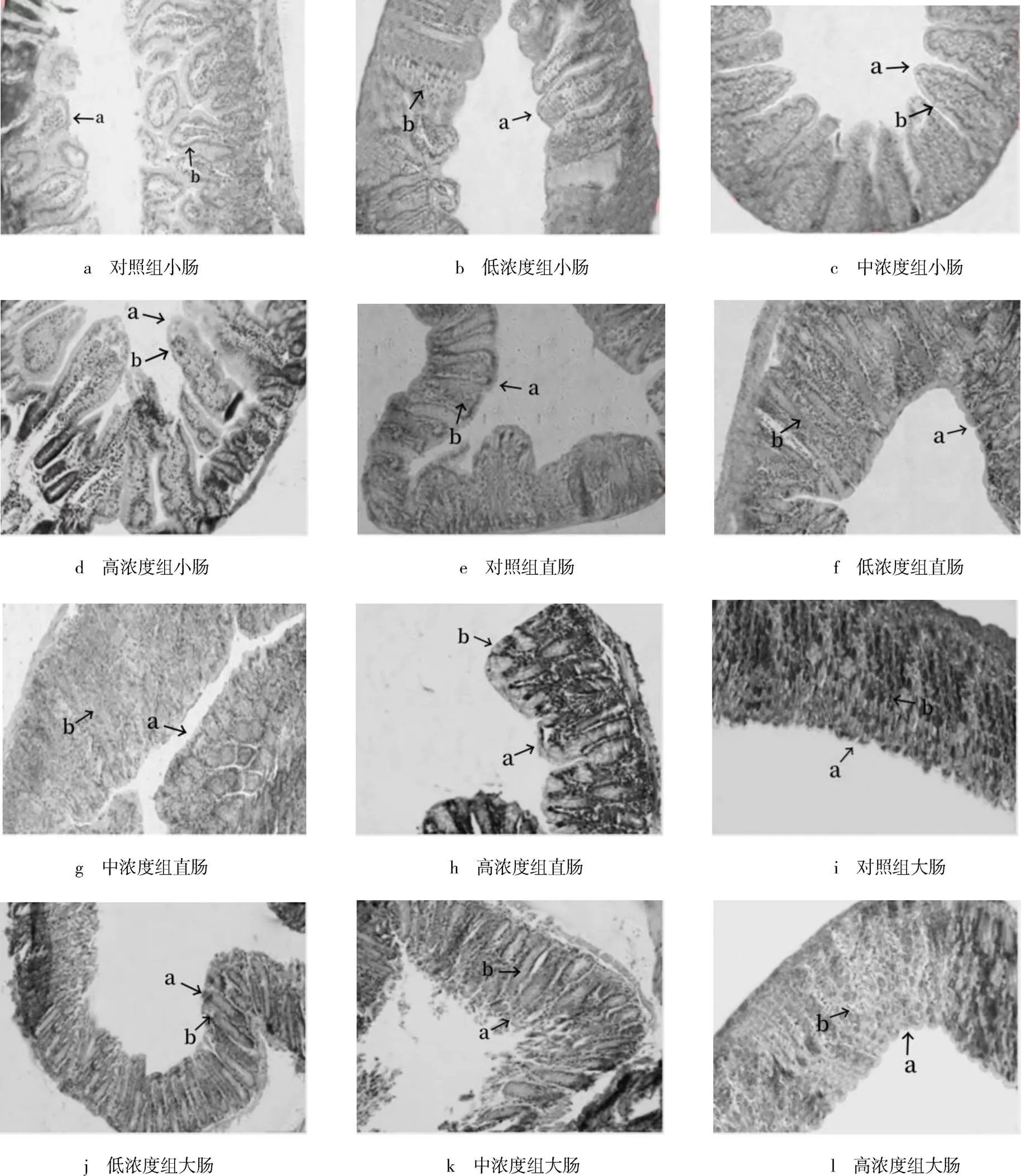
图1 各组小鼠消化道切片
注:a为绒毛高度;b为绒毛宽度,且均为HE×20.
3 讨论
体质量变化是体现动物生理状态的外在表现形式[14-15],而多糖对体质量变化具有重要影响.杨铁琦[16]等研究表明,玉竹多糖可使糖尿病老年大鼠的体质量显著下降,认为玉竹多糖对胰岛素细胞的破坏有抑制作用,可以改善胰岛素功能,促进机体代谢,使体质量降低.周东月[17]等发现,黄连多糖能够使糖尿病大鼠体质量和肾质量降低,且质量的降低与抑制氧化应激反应有关.于美汇[18]等研究表明,黑木耳酸性多糖能够降低高血脂症小鼠体质量和肝脏质量,且随黑木耳酸性多糖剂量的增加抑制体质量增长的能力越强,呈现出一定的剂量依赖关系,认为黑木耳多糖能够降低血脂,改善因摄入过多脂质导致脂肪堆积的现象.Sun[19]等研究发现,龙须菜多糖能够减少小鼠体质量增加,减少肝脏和脂肪组织中的脂肪积累.本实验中3种浓度蒲公英多糖实验组小鼠的体质量和器官质量均显著下降,与上述实验结果一致,并且小鼠脏器的颜色形状等较对照组无明显变化,证明蒲公英多糖对小鼠无毒害作用.小鼠器官质量、体质量降低的原因可能是由于蒲公英多糖能够改善ICR小鼠胰岛素功能,降低血脂,促进机体代谢,减少脂肪堆积,并且器官质量的降低也是体质量降低的原因之一.
肠道是机体消化吸收营养物质的主要场所,同时还具有屏障作用[20-22].消化道长度、绒毛和肠壁截面积等形态结构的变化会对营养物质的吸收产生重要的影响.有人在肉鸡日粮中添加芦荟多糖,发现肉鸡小肠绒毛高度和密度以及粘膜层厚度增加,证明芦荟多糖能改善肠道绒毛生长[23].黄玉章[24]等研究发现,日粮中添加黄芪多糖可提高罗非鱼肠绒毛长度、肌层厚度、增加肠道黏液细胞和上皮内淋巴细胞的数量.本实验中,蒲公英多糖能够显著增加ICR小鼠小肠的绒毛高度和肠壁截面积,显著减少小肠绒毛宽度,且小鼠消化道全长显著增加,小鼠体质量的降低和消化道长度的变化可能存在一定关系.蒲公英多糖能显著降低ICR小鼠体质量,当小鼠体质量降低到一定程度时,小鼠显著增加消化道的长度和小肠绒毛高度、截面积,以促进消化吸收,与体质量达到动态平衡;虽然营养物质吸收更多,但细胞内脂肪的分解程度增大,脂肪累积减少,从而使体质量降低.本实验中,小鼠结肠和直肠没有明显变化,说明蒲公英多糖主要影响的部位是小肠.
4 结论
研究结果表明,随着蒲公英多糖浓度的增加,ICR小鼠体质量、器官质量和小肠道绒毛宽度显著降低,小肠肠道长度、绒毛高度和肠壁截面积显著增加.表明蒲公英多糖能改善小肠绒毛生长状况,增加小肠肠壁厚度,提高小肠对营养物质吸收的能力.
[1] 刘华清,王天麟.蒲公英水溶性化学成分研究[J].中药材,2014,37(6):989-991.
[2] 段红波,梁引库.蒲公英多酚的提取及其活性研究[J].中国食品添加剂,2017(3):80-86.
[3] Zhang J C,Chen J.The effects of Taraxacum officinale extracts(TOE)supplementation on physical fatigue in mice[J].African Journal of Traditional,Complementary,and Alternative Medicines(AJTCAM),2011,8(2):128-133.
[4] Xue Y S,Zhang S M,Du M,et al.Dandelion extract suppresses reactive oxidative species and inflammasome in intestinal epithelial cells[J].Journal of Functional Foods,2017,29:10-18.
[5] Mingarro D M,Plaza A,Galan A,et al.The effect of five Taraxacum species on in vitro and in vivo antioxidant and antiproliferative activity[J].Food & Function,2015,6(8):2787-2793.
[6] Yu Y,Shen M Y,Song Q Q,et al.Biological activities and pharmaceutical applications of polysaccharide from natural resources:A review[J].Carbohydrate Polymers,2018,183:91-101.
[7] 王浩南,吴雨蒙,张永清,等.丹参花与根部多糖抗氧化活性及其组成研究[J].辽宁中医药大学学报,2020,22(11):38-43.
[8] 康文锦,徐兴军,刘佳人,等.蒲公英多糖对小鼠体内抗氧化酶活性及相关基因表达的影响[J].动物营养学报,2020,32(12):5910-5915.
[9] Huang D,Gu Y.Comparison of DPPH Scavenging Ability of Flavonoid and Polysaccharide from Dandelion(Taraxacum mongolicum)[J].Animal Husbandry and Feed Science,2016,8(6):336-338,343.
[10] 刘炜熹,陈帅,刘磊,等.蒲公英多糖的研究进展[J].食品研究与开发,2020,41(10):214-219.
[11] 郭慧静,陈国刚,赵志永.蒲公英多糖的分级醇沉及其降血糖和抗氧化活性研究[J].农产品加工,2021(7):1-5,10.
[12] 陈献宇,刘圣君,金玉杰.蒲公英多糖对急性肾损伤大鼠的保护作用研究[J].中国临床药理学杂志,2021,37(11):1367-1370.
[13] 陈晓瑛,伏枥龙,王国霞,等.3种添加剂对花鲈消化酶活力、前肠组织结构及营养物质表观消化率的影响[J].动物营养学报,2020,32(12):5985-5993.
[14] Mercer J G,Adam C L,Morgan P J.Towards an Understanding of Physiological Body Mass Regulation:Seasonal Animal Models[J].Nutritional Neuroscience,2000,3(5):307-320.
[15] Omori K,Sogabe A,Hamaoka H,et al.Storage and the regulation of body mass in animals:A general growth equation based on an energy balance model[J].Ecological Modelling,2009,220(20):2618-2623.
[16] 杨铁琦,李军鸽,桂海莹,等.玉竹多糖对糖尿病老年大鼠体重及血糖、血脂水平的影响[J].中国老年学杂志,2015,35(18):5056-5057.
[17] 周东月,王春璐,任艳平,等.黄连多糖通过抑制氧化应激和炎症反应减轻糖尿病大鼠肾损伤的实验研究[J].中国比较医学杂志,2019,29(3):37-42.
[18] 于美汇,赵鑫,尹红力,等.黑木耳酸性多糖对高血脂症小鼠的降血脂作用[J].食品科学,2016,37(15):232-236.
[19] Sun X,Duan M,Liu Y,et al.The beneficial effects of Gracilaria lemaneiformis,polysaccharides on obesity and the gut microbiota in high fat diet-fed mice[J].Journal of Functional Foods,2018,46:48-56.
[20] 石梦玄.动物双歧杆菌对小鼠肠道黏膜损伤的缓解作用及其机理研究[D].邯郸:河北工程大学,2016.
[21] 燕磊,安沙,蒋梦宇,等.日粮蛋白水平对单胃动物肠道消化吸收功能及健康影响的研究进展[J].中国畜牧杂志,2021,57(3):53-59.
[22] 汤小朋,刘旭光,方热军.表皮生长因子对断奶仔猪肠道健康的调控作用[J].动物营养学报,2021,33(2):614-621.
[23] 戴必胜,蒋林,陈少雄.中草药和芦荟多糖对肉仔鸡肠道微生态、免疫功能及生产性能的影响[J].中国家禽,2007(16):21-24.
[24] 黄玉章,林旋,王全溪,等.黄芪多糖对罗非鱼肠绒毛形态结构及肠道免疫细胞的影响[J].动物营养学报,2010,22(1):108-116.
Effects of dandelion polysaccharides on the body weight and organs of ICR mice
LIN Meihan1,2,XU Xingjun1,2,LIU Jiaren1,2,QIANG Jian1,2,SUN Xi1,2,KANG Wenjin1,2
(1. School of Life Sciences,Agriculture and Forestry,2. Heilongjiang Provincial Key Laboratory of Resistance Gene Engineering and Protection of Biodiversity in Cold Areas,Qiqihar University,Qiqihar 161006,China)
To investigate the effect of dandelion polysaccharide on the body weight and organs of ICR mice.The ICR mice were randomly divided into control group,low-concentration dandelion polysaccharide group,medium-concentration group and high-concentration dandelion polysaccharide group according to their body weight(21.79±1.55)g,with 12 mice in each group.There was no significant difference in body weight among the groups(>0.05).The control group was given normal saline,the low concentration group was given dandelion polysaccharide with a concentration of 150 mg/(kg·d),the middle concentration group was given dandelion polysaccharide with a concentration of 300 mg/(kg·d),and the high concentration group was given by gavage dandelion polysaccharide with a concentration of 600 mg/(kg·d)was administered orally for 4 weeks.The body mass and organ mass were measured with a BS124S electronic balance,the length of the intestinal tract was measured with a ruler,and the length of the intestinal villi,the width of the villi,and the thickness of the mucosal layer and the cross-sectional area of the intestinal wall.The results showed that dandelion polysaccharide significantly reduced the body weight,organ mass and small intestinal villus width of mice(<0.05),and was inversely proportional to the concentration of dandelion polysaccharide.The area increased significantly(<0.05),and was proportional to the concentration of dandelion polysaccharide,dandelion polysaccharide had no significant effect on the large intestine and rectum of mice(>0.05).
dandelion polysaccharide;ICR mice;paraffin section
1007-9831(2022)09-0043-06
Q4
A
10.3969/j.issn.1007-9831.2022.09.010
2022-05-13
黑龙江省省属高等学校基本科研业务费科研项目(YSTSXK201882);齐齐哈尔大学研究生创新科研项目(YJSCX2019046);黑龙江省大学生创新创业训练计划项目(202010232066);2020年度黑龙江省省属高等学校基本科研业务费科研项目(135509133)
林美含(2000-),女,黑龙江牡丹江人,在读本科生.E-mail:751267490@qq.com
徐兴军(1969-),男,黑龙江齐齐哈尔人,教授,硕士,从事动物生理研究.E-mail:xxj0605@163.com
