基于质谱进行低丰度靶向蛋白质定量的实验教学设计*
2022-10-19朱秀珍李晓华
朱秀珍,李晓华
(南方科技大学化学系,广东深圳 518055)
0 引 言
测定蛋白质表达水平的变化,尤其是检测低丰度蛋白质的差异变化,可以进一步探索蛋白质生物功能,认识细胞的分子机制,有助于发现疾病和药物治疗的新生物标志物,对疾病早期诊断和精准靶向治疗具有重要意义.
在已有临床检验中,酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)是蛋白质定量分析的常规技术,也是临床上生物标志物分析的主要方法.然而,由于拥有抗体试剂的候选标志物很少,且研发新抗体耗时长,花费高,导致ELISA在多重蛋白质生物标志物的测定应用方面具有一定限制[1].
蛋白质组学可以实现大规模鉴定和评估蛋白质的表达水平高低.生物质谱已成为蛋白质组学领域最有效的研究手段[2-7].Calvo 等[2]综述了生物质谱在靶向蛋白质组学的应用,介绍了如何建立合适的色谱、质谱方法,以用于检测低丰度蛋白质和修饰肽段;Aebersold 和 Mann[4]综述了基于质谱的蛋白质组学取得的成就和面临的挑战,介绍了质谱在研究蛋白质的组成、结构、功能和调控的应用.蛋白质组学研究主要为发现蛋白质组学和定向蛋白质组学.发现蛋白质组学以鸟枪法为例,质谱选取丰度最高的一批母离子进行碎裂.由于生物样品的蛋白质含量可以相差几个数量级,样品的复杂性使得发现蛋白质组学难以测定低丰度蛋白.而在定向蛋白质组学中,质谱选取特定的目标蛋白质进行分析,其他干扰信号均被排除,能够实现低丰度蛋白的高灵敏度测定[8].近年来,定向蛋白质组学中基于多重反应监测(multiple reaction monitoring,MRM)的蛋白质定量技术,因能精确定量分析复杂样品中的特定蛋白质得以迅速发展[9-10].
目前,已有一些基于质谱的蛋白质分析实验教学研究.岑卫健和朱平川[3]设计了双向电泳-基质辅助激光解吸飞行时间质谱,分析蛋白质的实验教学方案;万建等[7]开发了针对研究生的定性蛋白质组学实验教学设计.文献调研显示,低丰度蛋白质由于相对含量低,难以检测,目前尚缺乏基于质谱的低丰度靶向蛋白质定量测定实验教学研究.为使学生了解生物质谱的前沿研究技术,满足培养卓越拔尖创新型人才的教学要求,本文使用南方科技大学化学系实验教学中心的液相色谱-三重四级杆质谱联用仪,从方法建立、色谱分离、质谱检测到数据分析,探索基于质谱MRM技术的蛋白质定量教学实验.
1 基本原理
1.1 MRM技术
MRM技术是基于高分辨、高精度质谱仪的离子监视技术,通常在三重四级杆质谱仪上进行,其技术原理如图1所示.在3个串联的四级杆中,有且仅有被预先选择的拥有特定质荷比(m/z)的母离子能够顺利通过第一级四级杆(Q1),而其他未被选择的离子将被排除;在第二级四级杆(Q2)中,来自Q1的母离子将在预设的撞击能量下经过碰撞诱导解离模式(collision-induced dissociation,CID)发生碎裂,而后类似于Q1;第三级四级杆(Q3)用来过滤子离子,只有符合设定值的母离子-子离子对信号被特异性地检测到.通过两级过滤策略,去除了大量干扰离子,有效降低了背景噪声及干扰,因而MRM质谱扫描具有灵敏度高、重现性好和准确度高的优点[11-14].

图1 三重四级杆多重反应监测技术原理
1.2 肽段二级质谱碎裂机制
多肽键能在不同的共价键位置打断形成不同的碎片离子.根据共价键理论和键能比较,最容易产生的是酰胺键断裂的b-y模式,原理如图2所示[15].三重四级杆中的CID碎裂模式通常只产生较少的b离子,这些离子的信号比较弱,相比之下,CID碎裂更倾向于产生y离子,生成的y离子信号也比较强.在MRM实验中,选择母离子-子离子对时,会优先考虑y离子.

图2 多肽二级质谱的b-y模式碎裂[15]
1.3 质谱MRM方法建立
MRM用于蛋白质定量时,是根据待分析的目标蛋白质氨基酸序列,选择蛋白质特异性肽段及其对应的高响应子离子,利用高响应子离子的信号强度反映该蛋白质的表达丰度.每个蛋白质特异性肽段一般选择2~4个母离子-子离子对[1].
在建立MRM方法时,肽段及其子离子的选择一般有2种策略.(1)根据已有实验数据进行选择,其又可以细分为2类,一类是从已有的发现蛋白质组学实验数据中,总结出感兴趣的肽段;另一类是根据现有的整合了不同实验平台、不同搜库软件的数据库选择,如:PeptideAtlas、SRMAtlas和 MRMAtlas等,这些数据库存储了以往实验产生的蛋白质特异性肽段和其相应的母离子-子离子对.(2)通过生物信息学计算工具,预测蛋白质特异性肽段[16].
2 教学实验设计
2.1 仪器和试剂
高效液相色谱Ultimate 3000(Thermo Fisher公司,美国);三重四极杆质谱仪TSQ Vantage(Thermo Fisher公司,美国);牛血清白蛋白酶解标准品(New England Biolabs公司,美国);聚酪氨酸(Tyr)-1,3,6校正液;液相色谱质谱(liquid chromatograph-mass spectrometry,LC-MS)级纯乙腈(Fisher公司,美国);屈臣氏蒸馏水;LC-MS级纯甲酸(Fluka公司,瑞士).
2.2 样品制备
将牛血清白蛋白酶解标准品用蒸馏水溶解,配成物质的量浓度为 1 μmol/L的溶液,分装冷冻保存.实验前将样品用含0.1%甲酸的水溶液稀释,配制成 10、20、50、100和 200 nmol/L 系列标准溶液备用.
2.3 质量校准
连接管路并打开注射泵.在调谐界面中点击菜单栏设置(setup)中的注射泵和取样回路(syringe pump&sample loop)进入流速更改界面,设置流速(flow rate)为 5.0 μL/min,注射器类型(syringe type)为 Hamilton,注射体积(volume)为 500 μL,扫描模式为Q1MS全扫描,扫描范围为100~1 100 m/z.泵入聚Tyr-1,3,6校正液,采集外标物Tyr1(181.85 Da)、Tyr3(508.01 Da)和Tyr6(997.17 Da)谱图,若误差值大于0.70 Da,应校准直至软件通过.
2.4 色谱分离
色谱柱:赛默飞世尔Hypersil GOLD™C18反相色谱柱,柱长15.0 cm,柱内径2.1 mm,粒径5.0 μm.
流动相:A相为含有0.1%甲酸的纯水;B相为含有0.1% 甲酸的乙腈.流速为200.0 μL/min,柱温50℃,洗脱梯度条件列于表1.色谱流出样品直接通过电喷雾离子源(electron spray ionization,ESI)进入质谱.液相色谱进样量10 μL.

表1 色谱洗脱梯度程序
2.5 质谱检测
液相色谱分离后的多肽组分进入质谱进行检测分析.在总结文献和数据库资料的基础上,选取了3条肽段,每条肽段选取了2个母离子-子离子对进行分析,肽段序列和其母离子-子离子对信息如表 2所示[8].主要质谱参数:ESI喷雾电压3.5 kV;质谱正离子模式采集;鞘气4.5 L/min,辅助气11.0 L/min,吹扫气0;离子传输管温度320℃;质谱采集时间35.0 min;循环时间0.1 s;碰撞能量设置为28 V.

表2 多肽片段离子对设置[8]
2.6 数据分析
LC-MS分析结束后,以物质的量浓度为50 nmol/L样品为例,得到总离子流图(total ion chromatogram,TIC)如图3所示.在数据分析软件(Xcalibur)中用定性浏览器(qual browser)打开数据文件,输入肽段母离子质荷比,从TIC图中提取各条肽段的离子流图(图4),分别选取特定肽段,输入其2个子离子的质荷比,得到子离子的离子流图,积分得到相应的峰面积(area,AA).值得注意的是,每条肽段设置的2个子离子,因是源自同一条肽段碎裂产生,其保留时间应该一致.若源自于同一母离子的2个子离子保留时间不一致,则是假阳性峰,定量时应排除.
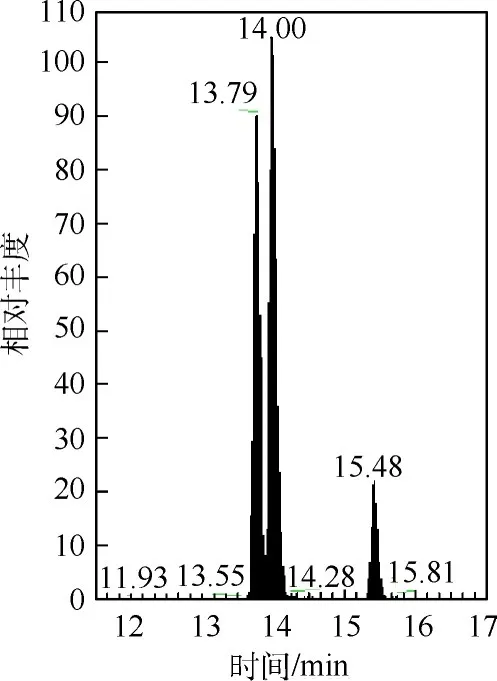
图3 总离子流图
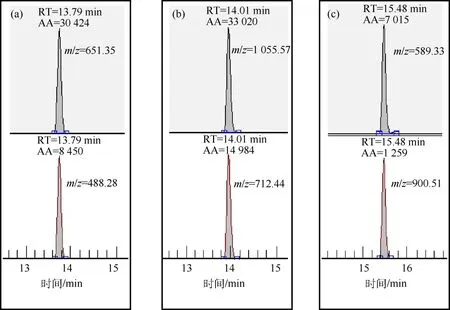
图4 不同母离子的子离子积分(a)464.25;(b)547.32;(c)653.36
以样品物质的量(c)浓度为横坐标,3条肽段的子离子积分面积总和为纵坐标,绘制标准曲线,拟合 得 到 线 性 方 程 为 y=2.80×103c-2.25×104,R2=0.994 9.
不同样品间,根据目标肽段的子离子峰面积值,进行相对定量分析,也可以通过加入标准肽段实现精确绝对定量分析[17-20].曹东等[21]介绍了基于内标法的蛋白质绝对定量方法,包括基于同位素标记的肽段、同位素标记的氨基酸、同位素标签标记的肽段等作为内标的蛋白质绝对定量方法.与相对定量分析相比,绝对定量分析不同的是,由于内标肽和内源性肽具有相同的序列,因此,具有相同的液相色谱保留时间和质谱离子化效率.通过比较二者子离子信号强度,可获取内源性多肽的量和对应蛋白质的量.因教学时长限制,对此仅向学生作扩展介绍,并鼓励感兴趣的学生继续从事相关方向的项目研究.
3 教学效果
3.1 教学特色
在本实验过程中,学生自主使用液相色谱-三重四极杆质谱仪对样品进行测试分析,了解了质谱全扫描和MRM扫描的特点.教学难点是质谱分析方法的建立,本文以相关前沿文献,实验和理论相结合,提升学生对生物质谱、蛋白质组学等前沿研究领域的知识技术储备,拓宽了学生的视野,激发了研究兴趣.
3.2 学生成绩分布
分析实验报告完成情况,学生参与实验的积极性等,统计近3年学生实验成绩分布情况如表3所示.95.0%的学生都能顺利完成实验并撰写完整的实验报告,90.0%的学生实验成绩达到优良.

表3 近3年学生实验成绩分布
3.3 学生满意度
分析2018—2021年学生评教情况,学生满意度为100%.近3年教师教学质量评价得分分别为96、96和98分.因原有的仪器分析实验课测定对象为离子、小分子,本实验引入蛋白质大分子的分析,丰富了仪器实验教学内容,拓宽了实验教学的广度,也收到了较满意的教学效果.
4 结束语
本文将学科前沿研究技术转化为教学实验,介绍了基于质谱MRM技术的蛋白质定量的原理、方法和实验流程.实验首先用标准品进行仪器的质量校准,然后以胰蛋白酶酶解的牛血清白蛋白为样品,选择分析了3条肽段,获得了总离子流图和各条肽段的子离子峰面积.整个实验教学需3~4学时,操作简便,可重复性高,适合在本科和研究生实验教学中应用.未来将进一步顺应时代发展,探索实验教学内容的改革创新,更加注重学科前沿交叉技术在实验教学中的运用,以满足新时代培养卓越创新人才的要求.
