高脂饮食诱导肥胖对大鼠心脏、肝脏线粒体呼吸功能的影响
2022-10-18邹志卓许松姬
邹志卓 , 黄 鹤 , 许松姬
(延边大学医学院,吉林 延边朝鲜族自治州 133000)
肥胖是一种能量摄入大于能量消耗的代谢性疾病[1]。当今社会,随着经济发展、饮食结构调整和运动量减少,肥胖人数逐年增加[2]。肥胖是现今影响全球的公共卫生问题,是很多疾病的高危因素,如高血压、高血脂、脂肪肝、动脉粥样硬化、癌症等[3]。关于肥胖引起心血管疾病的研究很多,其中肥胖引起的脏器线粒体损伤[4-5]也受到广泛关注。本试验拟通过高脂饮食诱导大鼠肥胖,观察肥胖对其心脏、肝脏线粒体呼吸功能的影响,通过检测大鼠脏器线粒体呼吸控制率(Respiratory control ratio,RCR)和纯化线粒体磷氧比(Adenosine diphosphate/ Oxygen,ADP/O),直观反映饮食诱导肥胖对其心脏、肝脏线粒体呼吸功能的影响,为进一步研究肥胖相关心血管疾病的线粒体损伤机制提供理论依据。
1 材料与方法
1.1 实验动物 SD清洁级雄性大鼠108只,体重(230±10)g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016—0006,饲养于吉林医药学院动物实验室。
1.2 主要试剂 心脏和肝脏组织线粒体分离缓冲液A、B(自制);磷酸盐(Phosphate buffered saline,PBS)缓冲液、ADP/O检测试剂盒、RCR检测试剂盒,均购自上海杰美基因医药科技有限公司。
1.3 分组及处理 大鼠适应性饲养1周。自由饮水和摄食,记录每天进食量,每周称量体重1次。高脂饲料饲养2周后,根据体重增加量降序排序,位于体重增加量上1/3的大鼠作为饮食诱导肥胖(Diet-induced obesity,DIO)组,位于体重增加量下1/3的大鼠作为饮食诱导肥胖抵抗(Diet-induced obesity resistance,DR)组,位于体重增加量中间的为正常对照(Control,CON)组,每组36只。DIO组和DR组给予高脂饲料,CON组给予基础饲料,持续喂养18周。
1.4 线粒体提取 为观察饮食诱导肥胖过程中心脏和肝脏线粒体呼吸功能的动态变化,在饮食诱导肥胖过程中第8、10、12、14、16周和第18周,分别从CON组、DIO组和DR组中每组随机选取6只大鼠处死,立即取心脏和肝脏组织置于预冷的PBS中。洗去血液,充分剪碎、匀浆,在4 ℃条件下使用低温离心机3 000 g离心5 min,弃上清,取沉淀。心脏组织用心脏分离缓冲液A(120 mol/L NaCl,20 mol/L HEPES,2 mol/L MgCl2,1 mol/L EGTA,5 g/L 牛血清白蛋白;pH 7.4),600 g离心10 min,取上清,再次离心(4 ℃,17 000 g,10 min),沉淀用心脏缓冲液B(300 mol/L 蔗糖,2 mol/L HEPES,0.1 mol/L EGTA;pH 7.4)重悬即制成心脏线粒体悬液。肝脏组织用肝脏分离缓冲液A (0.22 mol/L甘露醇,0.07 mol/L蔗糖,0.02 mol/L HEPES,2 mol/L Tris-HCl,1 mol/L EDTA;pH 7.2),于4 ℃条件下1 000 g离心10 min,取上清,再次离心(4 ℃,16 000 g,4 min),弃上清,取沉淀后使用肝脏缓冲液B(0.22 mol/L甘露醇,0.07 mol/L蔗糖,0.01 mol/L Tris-HCl,1 mol/L EDTA;pH 7.2)重悬即制成肝脏线粒体悬液。心脏和肝脏部分所有操作均在0~4 ℃进行。
1.5 ADP/O水平的测定 预热氧电极仪到37 ℃后加入2 mL介质液(Reagent A)到反应玻璃槽,开始记录氧浓度O1。1 min后加入50 μL待测的心脏线粒体悬液和肝脏线粒体悬液,持续1 min后加入10 μL底物液(Reagent B)。持续记录直至下行斜线出现拐点,记录氧浓度O2,继续加入10 μL底物液(Reagent B),记录氧浓度O3,持续记录直至下行斜线出现拐点,记录氧浓度O4,按照公式(1)和公式(2)计算氧浓度降低值和线粒体磷氧比(ADP/O)。
氧浓度降低值=(O1-O2)+(O3-O4)
(1)
ADP/O=
(2)
1.6 RCR水平的测定 将2 mL介质液(Reagent A)加入到反应玻璃槽,开始记录氧浓度。1 min后加入50 μL待测的心脏线粒体悬液和肝脏线粒体悬液,持续1 min后加入10 μL底物液(Reagent B)——开始Ⅳ态呼吸。持续记录2 min,出现氧浓度缓慢下降,继续加入20 μL底物液(Reagent C)——开始Ⅲ态呼吸,持续记录直至下行斜线出现拐点,记录数据,按照公式(3)分别测算Ⅲ态呼吸速率和Ⅳ态呼吸速率,

(3)
并按照公式(4)计算RCR。
(4)
1.7 统计分析 连续变量用平均值±标准差(Mean±SD)表示,并使用独立样本t检验进行比较。所有的数据分析使用IBM SPSS程序(26版,SPSS公司,美国芝加哥)进行,所有的图表使用GraphPad Prism软件(8版,GraphPad Prism,美国加州圣地亚哥)进行。
2 结果
2.1 饮食诱导肥胖大鼠的体重变化 各组大鼠初始体重无差异,试验第1周开始,DIO组体重明显高于DR组(P<0.001),第2周开始DIO组体重明显高于CON组(P<0.001)。试验第1、2、3、5、6、7、10、11周和第12周时,CON组大鼠体重明显高于DR组(P<0.05),见表1。
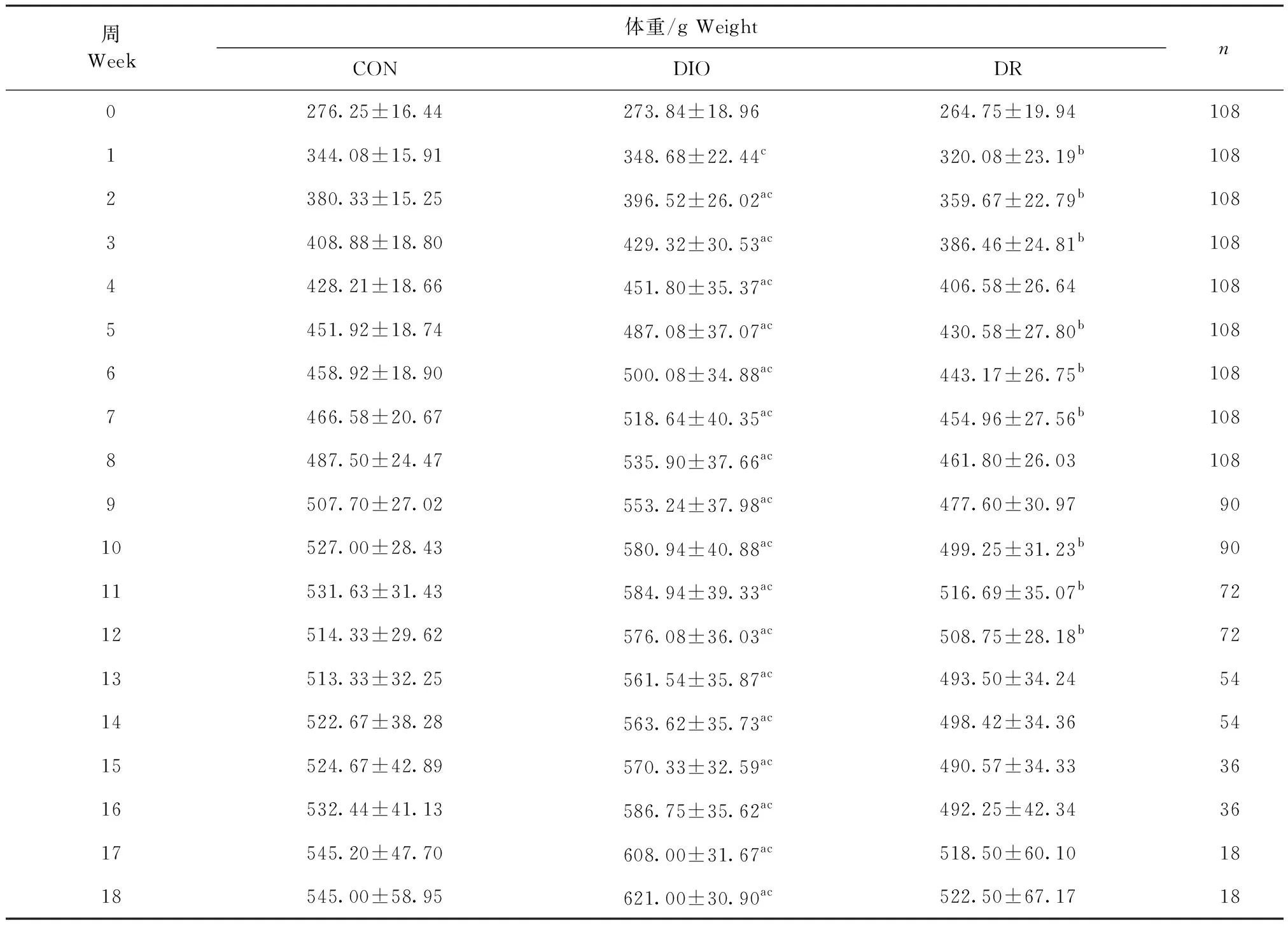
表1 大鼠每周体重变化情况Table 1 Weekly weight change in rats
2.2 心脏线粒体RCR和ADP/O测定 DIO组大鼠心脏线粒体RCR在试验第16周和第18周时显著低于CON组(P<0.05),DR组在第16周和第18周也表现出低于CON组的趋势,在第18周有统计学差异(P<0.05),见图1。ADP/O结果与RCR表现出相似的趋势,均在第16周和第18周时,DIO组与DR组ADP/O水平显著低于CON组(P<0.05),见图2。
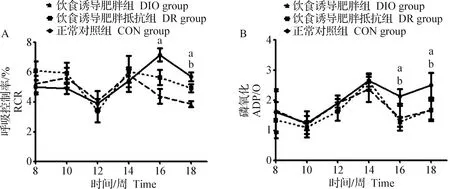
图1 大鼠心脏线粒体呼吸控制率(A)和磷氧比(B)Fig.1 Rat heart mitochondrial respiratory control rate (A) and P/O ratio (B)a:DIO组与CON组比较,P<0.05; b:DR组与CON组比较,P<0.05a:Comparison between DIO group and CON group, P<0.05; b:Comparison between DR group and CON group, P<0.05
2.3 肝脏线粒体RCR和ADP/O测定 大鼠肝脏线粒体呼吸功能表现出较心脏更强的抵抗能力,RCR结果仅在第16周时出现了DIO组显著低于CON组(P<0.05),其余时间点各组间均无统计学差异(P>0.05)(图2A)。ADP/O在第10周时,DIO组有高于CON组的趋势(P=0.057),在第18周时,DIO组ADP/O显著低于DR组(P<0.05),且有低于CON组的趋势(P=0.093)(图2B)。
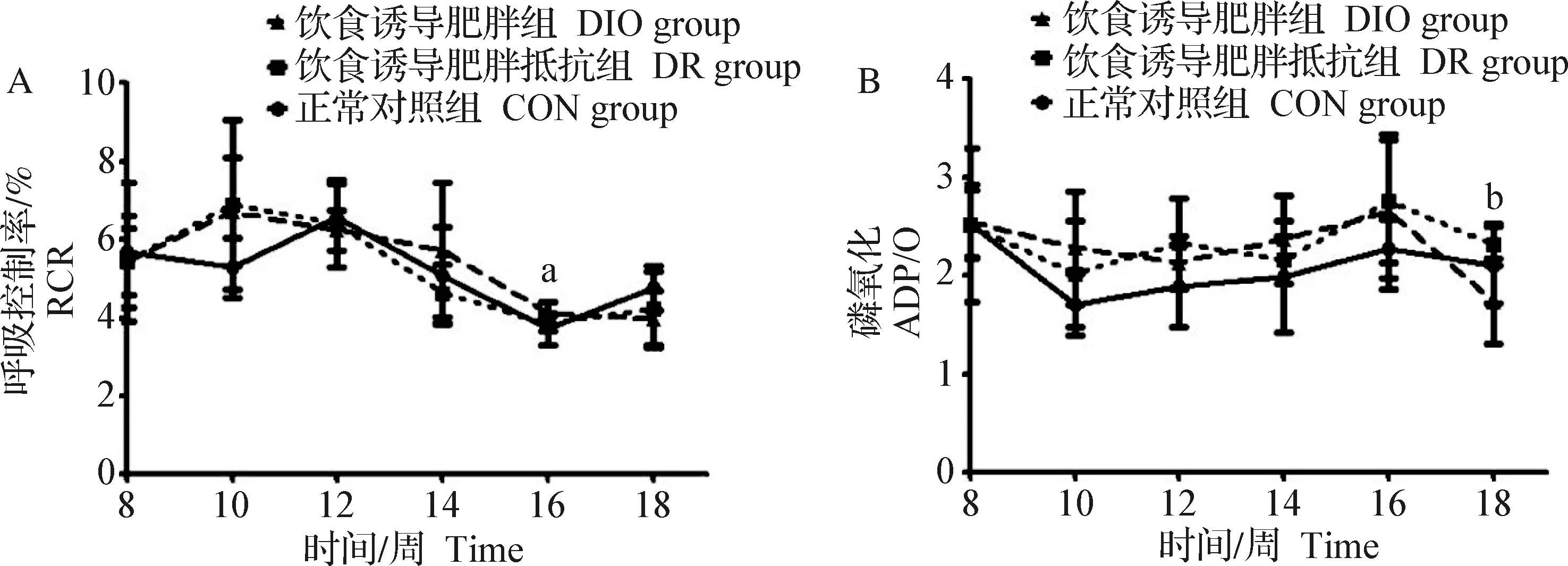
图2 大鼠肝脏线粒体呼吸控制率(A)和磷氧比(B)Fig.2 Rat liver mitochondrial respiratory control rate (A) and P/O ratio (B)a:DIO组与CON组比较,P<0.05; b:DIO组与DR组比较,P<0.05a:Comparison between DIO group and CON group,P<0.05; b:Comparison between DIO group and DR group,P<0.05
3 讨论
肥胖个体易发生心肌脂类蓄积[6]、心肌耗氧量和脂肪酸氧化增加以及心肌效能降低;心肌线粒体呼吸功能降低和ATP合成减少,氧化磷酸化减弱,心肌解偶联蛋白3(Uncoupling protein 3,UCP3)表达增加[7]。一旦线粒体受到外界因素影响,富含线粒体的心脏将很快出现相关反应[8]。本试验发现,第8~16周时,与肝脏相比,心脏各组各项指标都出现了十分明显的变化。心脏线粒体对肥胖所致的损伤最为敏感。通过第14~18周心脏指标的变化,发现心脏在第16周时下降趋势减缓,但因为试验时间原因,不能确定心脏是否已出现了失代偿[9]。与肝脏相比,心脏出现失代偿的趋势更为明显,并且从最开始测定各组指标时,心脏的波动比肝脏更剧烈,说明心脏的线粒体损伤更严重。
在保持机体代谢平衡的各种脏器中,肝脏起至关重要的作用[10]。除了脂类代谢主要在肝脏中发生外,肝脏同时与骨骼肌一起保持机体的血糖平衡。本试验发现,高脂饮食喂养大鼠肝脏并没有出现明显的失代偿,这可能便是肝脏在脂类代谢和维持血糖平衡中发挥重要作用的原因。
本试验显示,高脂饮食可以引起大鼠心脏、肝脏线粒体损伤,其中大鼠心脏对肥胖所致的线粒体损伤尤为敏感,且心脏各项指标在较短时间内出现波动,而肝脏也在之后的短时间内出现指标波动。DR组大鼠比DIO组大鼠的线粒体代偿能力更强,这种现象在不同脏器均有体现,在肝脏中DR组大鼠各项水平与CON组更相近。虽然本次试验并未出现明显的失代偿,但是根据各项指标趋势可以推测,随着时间的进行,DR组大鼠出现失代偿的时间将晚于DIO组。得出上述试验结果的可能原因:在高脂饮食诱导过程中,DIO组大鼠体内在肥胖过程中会逐渐出现生理性代偿作用,不同程度地缓冲适应高脂肥胖给机体带来的一系列生理性损害。与此同时,大鼠各脏器及其线粒体含量、鼠种不同、饲养环境、鼠龄等都可能是出现不同试验结果的影响因素。
