4个甘蔗主栽品种对干旱胁迫的生理响应
2022-10-17李如丹刀静梅全怡吉杨绍林张跃彬
刘 硕,樊 仙,李如丹,邓 军,刀静梅,全怡吉,杨绍林,张跃彬*
4个甘蔗主栽品种对干旱胁迫的生理响应
刘 硕1,2,樊 仙1*,李如丹1,邓 军1,刀静梅1,全怡吉1,杨绍林1,张跃彬1**
1. 云南省农业科学院甘蔗研究所,云南开远 661699;2. 云南大学资源植物研究院,云南昆明 650000
为探究短期干旱胁迫下甘蔗伸长期的生理响应,本研究以4个栽培推广面积较大的甘蔗品种‘云蔗08-1609’‘粤糖93-159’‘新台糖22号’和‘桂糖42号’为供试材料,采用人工盆栽控水法,设置正常浇水对照(土壤含水量占田间持水量的80%以上)和轻度干旱(50%~60%)、中度干旱(40%~50%)和重度干旱(30%~40%)3个干旱处理,研究不同甘蔗品种在干旱胁迫下抗氧化酶系统、抗坏血酸-谷胱甘肽(AsA-GSH)循环系统、植株受损状况以及脱落酸(ABA)含量的变化规律。结果表明:干旱胁迫导致4个甘蔗品种的SOD、POD、CAT和GR活性显著提高(<0.05,下同);AsA、GSH含量随着干旱时间显著上升;除‘云蔗08-1609’的GSSG表现出先升后降的趋势外,其他3个品种的GSSG含量不断上升;‘云蔗08-1609’的GSH/GSSG值不断上升,‘新台糖22号’不断下降,‘粤糖93-159’和‘桂糖42号’表现出先升后降;干旱胁迫造成4个品种的MDA和质膜透性显著增加,叶片相对含水率显著降低;除‘桂糖42号’的ABA含量表现为先上升后下降的趋势外,其他3个品种干旱胁迫下ABA含量表现为升-降-升的趋势。综上表明:干旱胁迫造成4个甘蔗品种的SOD、POD、CAT活性及GR、ABA、AsA、GSH、GSSG含量显著上升。MDA和质膜透性提高,绿叶率和叶片相对含水率下降。本研究发现不同品种甘蔗干旱胁迫下的响应规律各不相同,‘云蔗08-1609’在干旱胁迫下ABA和叶片相对含水率含量最高,SOD、CAT、POD和GR活性在干旱初期响应最快,质膜透性最小。‘新台糖22号’和‘桂糖42号’在AsA-GSH循环中具有较高的AsA、GSH、GSSG含量。‘粤糖93-159’具有较高的POD和CAT活性以及较低的MDA含量。
甘蔗;干旱胁迫;生理生化指标;ASA-GSH循环
近年来,伴随降雨减少及气温上升,我国干旱的发生程度日益加剧[1]。干旱是目前影响植物正常生长最严重的非生物胁迫,造成了植物生长受阻甚至死亡,最终导致质量和产量的下降[2-3]。甘蔗是世界重要的糖料作物和能源作物,在中国,约90%的食糖生产来自于甘蔗[4]。甘蔗生长阶段对于水分有着较高的要求,尤其在伸长期需水量巨大,缺水导致甘蔗茎的生长速度降低[5-6]。甘蔗在干旱条件下,自身会产生一系列生理生化变化以及保护性物质,以减轻干旱带来的伤害,主要体现在抗氧化调节、渗透调节以及细胞膜结构调节等[7-8]。目前,对于甘蔗抗旱性的研究在光合作用相关指标如:叶绿素荧光系统[9-10]、气孔调节能力[11-12]、光合速率[13]以及抗旱性评价[14-16]较多。在生理响应方面,抗氧化酶系统中超氧化物歧化酶(SOD)、过氧化氢酶(POD)、过氧化物酶(CAT)这3种酶是减轻活性氧毒害的关键酶,有研究表明耐旱性强的甘蔗品种具有较高的抗氧化酶活性[17-18]。MDA含量是反映脂质过氧化作用强弱的一个重要指标,干旱引起甘蔗细胞膜受损,造成丙二醛(MDA)上升和质膜透性增加,干旱胁迫下MDA的增幅与品种的抗旱性相关[19]。有研究发现,抗坏血酸-谷胱甘肽(AsA-GSH)循环系统也在清除活性氧的过程中发挥重要的作用,作为一种高等植物中含量最多的可溶性抗氧化剂,AsA和GSH也是植物应对逆境条件的重要物质[20]。任家慧等[21]在对马铃薯干旱胁迫的研究中发现,中度干旱胁迫下马铃薯AsA和GSH含量最高,清除H2O2的能力最强;孙建等[22]研究发现耐旱型芝麻品种的AsA和GSH含量高于敏感型品种;张翠梅等[23]发现,中强抗旱苜蓿品种主要通过增加AsA含量来适应干旱,中等抗旱和弱抗旱品种主要通过增加GSH含量来适应干旱。植物激素脱落酸(ABA)调控着植物发育和适应生物和非生物胁迫的许多关键过程。在胁迫条件下,植物在各种器官中合成ABA,启动气孔孔径调控和防御相关基因表达等抗环境胁迫等防御机制[24]。有研究表明,干旱胁迫造成核桃[25]、小麦[26]、苦荞[27]的内源ABA含量上升,以减轻干旱带来的损伤,外源喷施ABA也有助于提升植物的抗旱性[28]。干旱胁迫下甘蔗的生理响应在不同的品种间各有特点,目前关于甘蔗AsA-GSH循环和ABA响应的研究较少。本研究通过选取目前在中国栽培推广面积较大的4个甘蔗品种‘云蔗08-1609’‘粤糖93-159’‘新台糖22号’和‘桂糖42号’,采用伸长期控水试验测定不同干旱时间的生理变化,探究不同品种对干旱胁迫的响应,为抗旱栽培及抗旱分子育种提供理论依据。
1 材料与方法
1.1 材料
供试材料为‘云蔗08-1609’‘粤糖93-159’‘新台糖22号’和‘桂糖42号’4个品种,由云南省农业科学院甘蔗研究所提供(表1)。
试验地位于云南省开远市云南省农业科学院甘蔗研究所第一科研基地,于2021年2月将材料种苗进行桶植,土壤采用赤壤土,出芽后定植3颗,进行常规水肥管理。待甘蔗材料生长至9月伸长期在顶部遮雨大棚中进行人工控水干旱胁迫处理。
通过控制田间持水量,设置正常浇水对照(土壤含水量占田间持水量的80%以上)和轻度干旱(50%~60%)、中度干旱(40%~50%)、重度干旱(30%~40%)3个处理,每个处理进行3次重复。
1.2 方法
取各个处理的甘蔗+1叶叶片组织3 g左右,用液氮速冻后放置于–80 ℃超低温冰箱中保存,测定相关生理指标。叶片相对含水率采用称重法测定,绿叶率采用计数统计,叶片质膜透性采用电导法测定[32],按照UKEDA等[33]的方法测定叶片超氧化物歧化酶(SOD)活性,按照DOERGE等[34]的方法测定过氧化物酶(POD)活性,按照JOHANSSON等[35]的方法测定过氧化氢酶(CAT)活性,按照NISHIMOTO等[36]的方法测定还原型谷胱甘肽(GSH)含量,按照DU[37]等的方法测定还原型抗坏血酸(AsA)含量,按照YANG等[38]的方法测定脱落酸(ABA)含量,按照SPITZ等[39]的方法测定丙二醛(MDA)含量,谷胱甘肽还原酶(GR)活性和氧化型谷胱甘肽(GSSG)含量采用苏州梦犀公司试剂盒进行测定。
1.3 数据处理
采用Microsoft Excel 2021软件进行试验原始数据整理以及绘图,采用SPSS 21软件进行单因素方差(ANOVA)统计分析,Duncan’s法多重比较,差异显著性定义为<0.05,所有数据均为3个重复的平均值±标准误()。
2 结果与分析
2.1 干旱胁迫对甘蔗抗氧化酶系统的影响
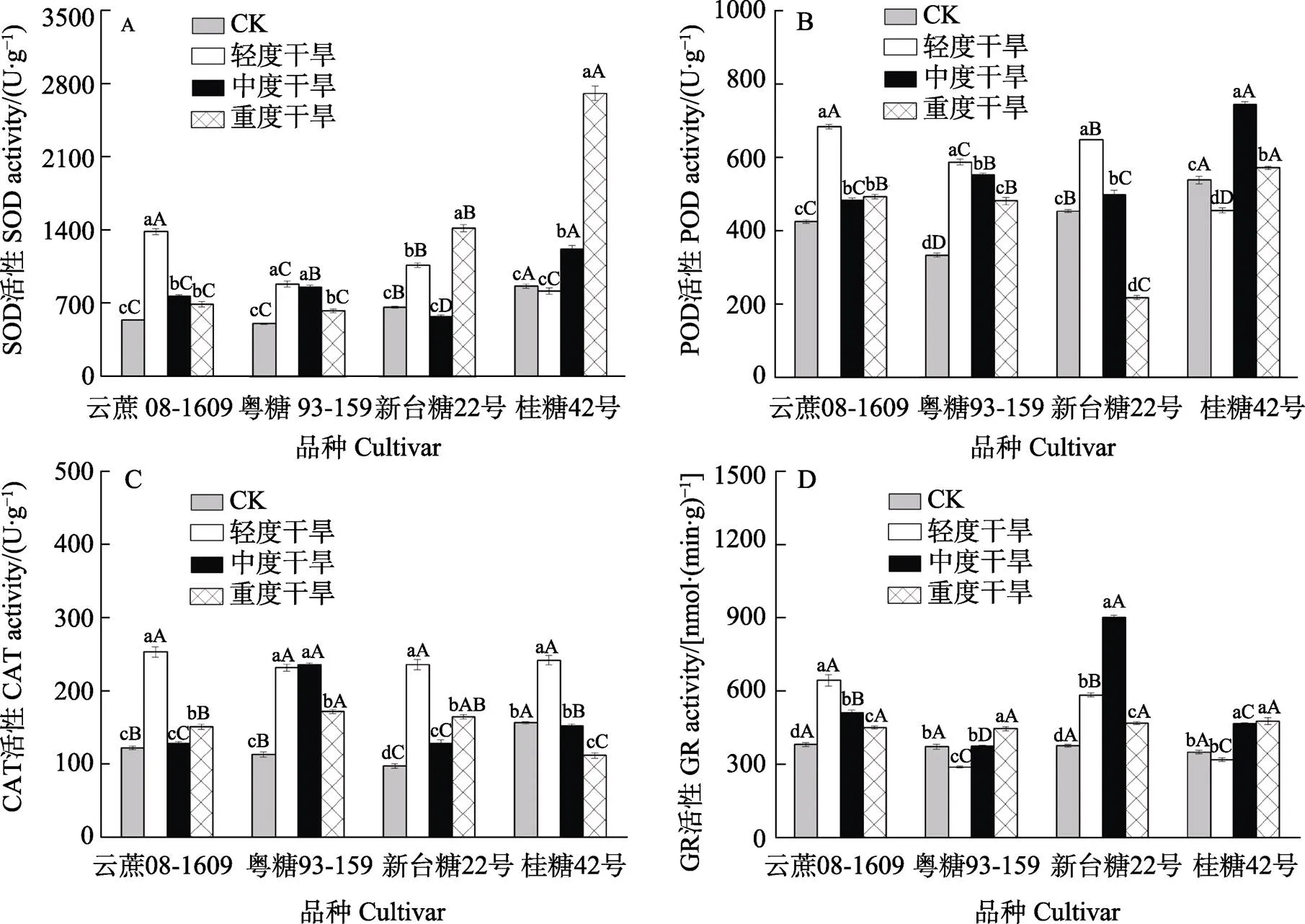
由图1A可以看出,4个甘蔗品种在重度干旱时SOD活性均显著高于正常浇水对照(<0.05,下同)。‘云蔗08-1609’和‘粤糖93-159’的SOD活性显示出先升高后降低的趋势,在轻度干旱时达到最高值。‘新台糖22号’和‘桂糖42号’在重度干旱时SOD活性显著高于其他干旱处理,较正常浇水分别提升了112.76%和213.07%,其中‘桂糖42号’在重度干旱时SOD活性最高,为2705.87 U/g。
由图1B可以看出,‘云蔗08-1609’‘粤糖93-159’和‘新台糖22号’3个品种在轻度干旱时POD活性显著高于其他干旱处理,‘桂糖42号’在中度干旱时显著高于其他干旱处理,4个品种POD活性均在达到最高值后开始降低。其中‘新台糖22号’在重度干旱时POD活性为4个品种中最低,为217.67 U/g。‘桂糖42号’在轻度干旱时POD活性最低,较正常浇水低83.62 U/g,随后才逐渐上升。
由图1C可以看出,‘云蔗08-1609’‘新台糖22号’和‘桂糖42号’3个品种在轻度干旱时CAT活性达到最高值,‘粤糖93-159’在中度干旱时达到最高值,但与轻度干旱无显著差异。‘云蔗08-1609’和‘新台糖22号’均表现出升-降-升的趋势,而‘粤糖93-159’和‘桂糖42号’则表现出先升后降的趋势。‘桂糖42号’在重度干旱时CAT活性显著低于其他干旱处理。‘粤糖93-159’在中度干旱和重度干旱均保持较高的CAT活性。
不同小写字母表示同一品种不同处理下差异显著(P<0.05);不同大写字母表示同一处理不同品种下差异显著(P<0.05)。
图1D为GR活性,‘云蔗08-1609’在轻度干旱时最高,增幅较正常浇水提升了68.66%;‘新台糖22号’在中度干旱时最高,增幅较正常浇水提升了139.52%;‘粤糖93-159’和‘桂糖42号’在重度干旱时最高,增幅较正常浇水分别提升了19.64%和36.06%。‘云蔗08-1609’和‘新台糖22号’在干旱期间GR活性先上升后下降,均显著高于正常浇水,‘粤糖93-159’和‘桂糖42号’则表现出先下降后上升。
2.2 干旱胁迫对甘蔗抗坏血酸-谷胱甘肽的影响
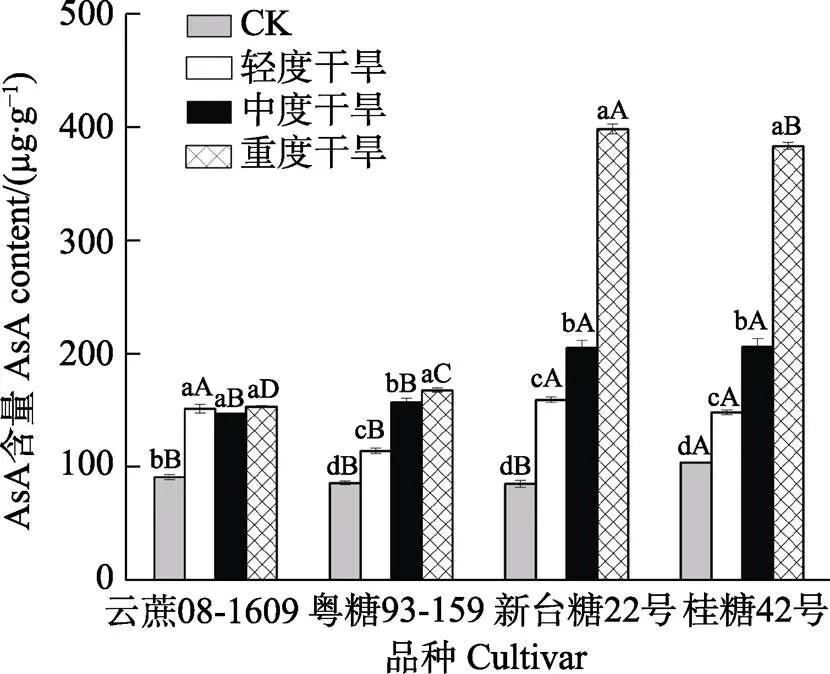
干旱胁迫下4个品种的AsA含量显著高于正常浇水,‘粤糖93-159’‘新台糖22号’和‘桂糖42号’的AsA含量均随着胁迫时间的增长显著提升,在重度干旱时达到最高值,分别为167.46、398.13和383.25 μg/g。重度干旱时,4个品种的AsA含量分别较正常浇水提升了68.24%、95.47%、368.42%和269.71%。‘云蔗08-1609’在干旱处理下的AsA含量变化不显著(图2)。
不同小写字母表示同一品种不同处理下差异显著(P<0.05);不同大写字母表示同一处理不同品种下差异显著(P<0.05)。
由表2可知,干旱胁迫导致‘云蔗08-1609’‘粤糖93-159’‘新台糖22号’和‘桂糖42号’的GSH、GSSG和总GSH较正常浇水显著增加。随着干旱胁迫加剧,‘云蔗08-1609’和‘桂糖42号’GSH逐渐上升,‘粤糖93-159’和‘新台糖22号’的GSH含量先上升后下降,‘新台糖22号’在重度干旱时GSH为4个品种中最高。‘粤糖93-159’‘新台糖22号’和‘桂糖42号’的GSSG含量在重度干旱时显著高于其他处理,‘云蔗08-1609’的GSSG含量在中度干旱时达到最高后开始降低。‘新台糖22号’的GSSG含量在各个干旱处理中均高于其他3个品种。‘云蔗08-1609’‘新台糖22号’和‘桂糖42号’的T-GSH含量在重度干旱时最高,且与其他处理差异显著,‘粤糖93-159’的T-GSH含量在中度干旱时显著高于其他处理。
除‘云蔗08-1609’外,其他3个品种的GSH/GSSG均随着干旱胁迫时间的增长而逐渐下降。‘云蔗08-1609’和‘粤糖93-159’在轻度干旱和中度干旱时GSH/GSSG差异并不显著,‘新台糖22号’和‘桂糖42号’在中度干旱和重度干旱时GSH/GSSG差异并不显著。
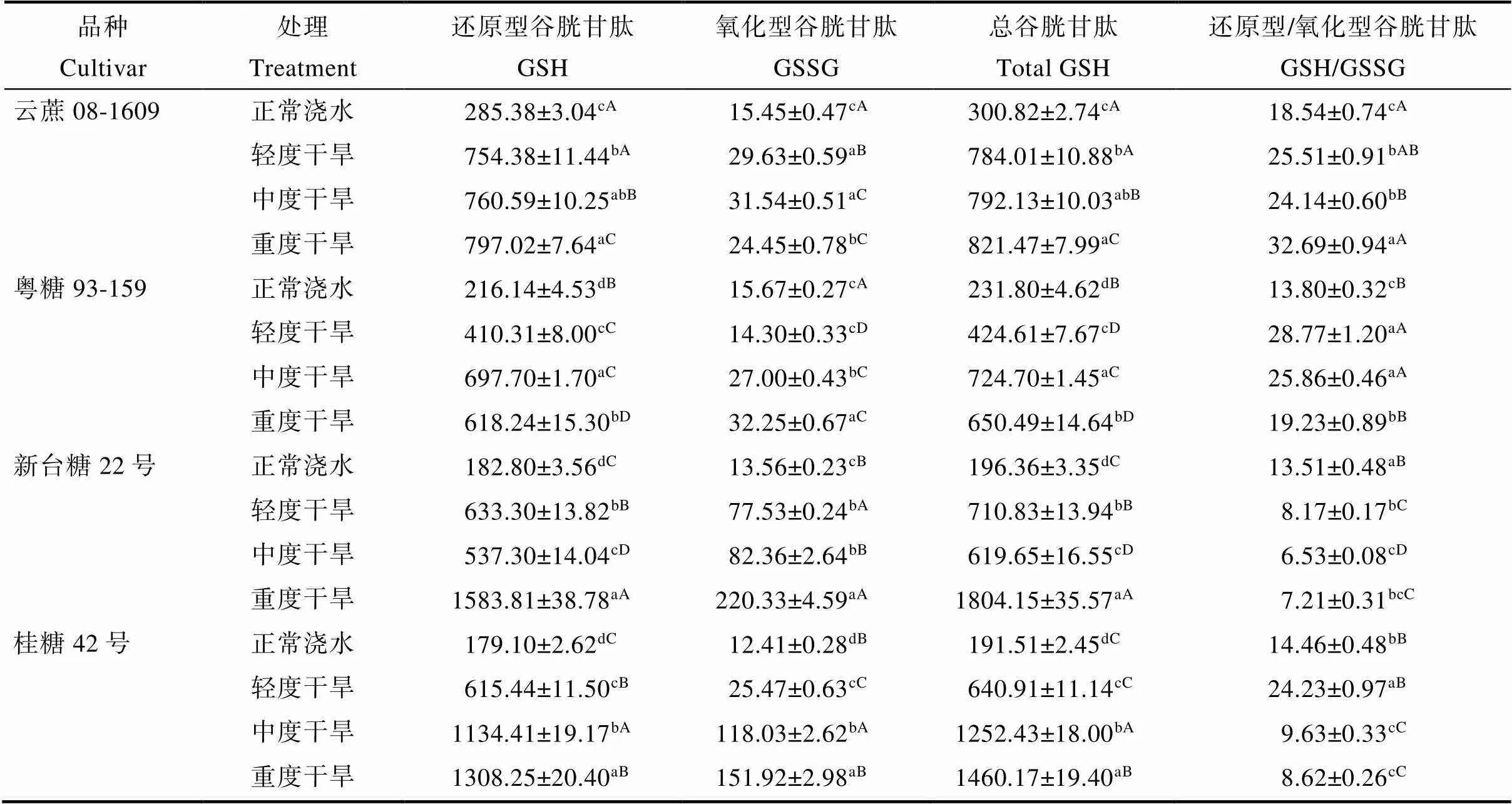
表2 干旱胁迫处理对甘蔗谷胱甘肽含量的影响
注:不同小写字母表示同一品种不同处理下差异显著(<0.05);不同大写字母表示同一处理不同品种下差异显著(<0.05)。
Note: Different lowercase letters indicate significant differences in the same variety under different treatments (<0.05); Different capital letters indicate significant differences in the same treatment under different varieties (<0.05).
2.3 干旱胁迫对甘蔗生理伤害的影响
图3A为不同干旱处理下甘蔗的MDA含量变化,从图中可以看出,重度干旱时‘云蔗08-1609’‘粤糖93-159’‘新台糖22号’和‘桂糖42号’的MDA含量均高于正常浇水,增幅分别为78.51%、109.61%、327.11%和237.50%,其中‘云蔗09-1609’增幅最小,‘新台糖22号’增幅最大。‘粤糖93-159’和‘桂糖42号’的MDA含量随着干旱胁迫的时长而不断上升,‘新台糖22号’的MDA含量在中度干旱时下降后开始上升,在重度干旱时显著高于其他品种。‘桂糖42号’在轻度干旱至中度干旱期间上升最快,在中度干旱时显著高于其他品种。‘粤糖93-159’在轻度干旱和重度干旱时MDA含量均显著低于其他3个品种。
图3B为不同干旱处理下甘蔗质膜透性的变化情况,可以看出质膜透性的变化趋势与MDA的变化较为类似。轻度干旱时,‘云蔗08-1609’‘粤糖93-159’‘新台糖22号’和‘桂糖42号’的质膜透性与正常浇水无显著差异。中度干旱时‘新台糖22号’和‘桂糖42号’的质膜透性显著提升。在重度干旱时4个品种的质膜透性均达到最大值,分别为25.98%、33.38%、78.03%和63.41%,‘新台糖22号’和‘桂糖42号’的质膜透性显著高于‘云蔗08-1609’和‘粤糖93-159’。4个品种在重度干旱时质膜透性比较为:‘新台糖22号’>‘桂糖42号’>‘粤糖93-159’>‘云蔗08-1609’。
从图3C可以看出,干旱胁迫对甘蔗叶片相对含水率造成了显著影响。轻度干旱较正常浇水‘云蔗08-1609’‘粤糖93-159’‘新台糖22号’和‘桂糖42号’的叶片相对含水率降幅分别为17.23%、21.34%、24.74%和15.99%;中度干旱较轻度干旱,4个品种的叶片相对含水率降幅分别为28.72%、37.35%、63.39%和66.40%;重度干旱较中度干旱,4个品种的叶片相对含水率降幅分别为5.48%、11.50%、25.70%和0.85%。在轻度干旱到中度干旱之间4个品种叶片相对含水率的降幅最大,在重度干旱时,4个品种的叶片相对含水率为‘云蔗08-1609’>‘粤糖93-159’>‘桂糖42号’>‘新台糖22号’。
图3D为4个干旱处理时‘云蔗08-1609’‘粤糖93-159’‘新台糖22号’和‘桂糖42号’的绿叶率变化,正常浇水处理时各品种叶片相对含水率均在90%以上,随着干旱程度加剧4个品种的叶片相对含水率均显著下降。在中度干旱处理时各品种叶片相对含水率的降幅最大。‘云蔗08-1609’在重度干旱处理时叶片相对含水率达到了51.83%,显著高于其他3个品种,表现出较好的保水能力。

不同小写字母表示同一品种不同处理下差异显著(P<0.05);不同大写字母表示同一处理不同品种下差异显著(P<0.05)。
2.4 干旱胁迫对甘蔗脱落酸含量的影响
由图4可知,在轻度干旱时,除‘粤糖93-159’提升不显著外,其他3个品种的ABA含量均显著提高,其中‘新台糖22号’和‘桂糖42号’均达到干旱胁迫处理的最高值,分别为1.43 μg/g和2.93 μg/g。‘云蔗08-1609’在正常浇水、中度干旱和重度干旱时ABA含量分别为1.39、2.21和2.41 μg/g,均高于其他品种。‘云蔗08-1609’‘粤糖93-159’和‘新台糖22号’的ABA含量变化趋势为升-降-升,重度干旱较中度干旱有所上升,而‘桂糖42号’则在轻度干旱后持续下降。4个品种干旱胁迫时ABA含量平均值分别为2.10、1.15、0.86和1.23 μg/g,‘云蔗08-1609’平均含量最高,‘新台糖22号’平均含量最低。
3 讨论
3.1 干旱胁迫下甘蔗抗氧化酶活性系统生理响应
3.2 干旱胁迫下甘蔗谷胱甘肽循环生理响应
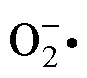
中度干旱时GR活性最高,其重度干旱时的GSH含量也是所有品种中最高的,说明GR在GSSG转化为GSH的过程中发挥了重要作用。干旱胁迫也显著提高了4个甘蔗品种的AsA含量,其中‘新台糖22号’和‘桂糖42号’还具有较高的GSH和GSSG含量,在重度干旱时达到最高,而‘云蔗08-1609’和‘粤糖93-159’的GSH和GSSG含量则变化幅度不明显。有研究认为,轻度水分胁迫下ASA-GSH循环对植物抗旱能力起良好的作用,提高了植物对水分胁迫的适应能力[44]。在本研究中,‘新台糖22号’和‘桂糖42号’在轻度干旱时GSH含量均提高了2.4倍,在重度干旱其GSH含量较正常浇水提高了7倍以上。有研究认为GSH的大量增加会造成进一步的氧化胁迫[45],通过对MDA和质膜透性等数据的分析,发现‘新台糖22号’和‘桂糖42号’在干旱后期MDA和质膜透性较高,可能由于高GSH导致,但需要进一步研究。
3.3 干旱胁迫下甘蔗的形态及伤害响应
干旱胁迫影响下,植物体内活性氧的产生与清除间的平衡被打破,导致自由基大量积累引起膜脂过氧化作用加剧,膜脂过氧化物产物丙二醛(MDA)增加。MDA已成为抗旱性研究中一个具有代表性的指标,有很多研究都表明在相同干旱胁迫强度下,MDA含量增幅小的品种较耐旱,增幅大的品种耐旱性差[15, 46]。本研究中,干旱胁迫显著提升了4个品种的MDA含量,在轻度干旱时,4个品种的MDA含量变化表现相似,在重度干旱时不同品种则产生不同的变化,‘云蔗08-1609’和‘粤糖93-159’在重度干旱时MDA含量低于‘新台糖22号’和‘桂糖42号’。质膜透性反映了细胞的受损情况,植物细胞膜受损程度因品种、干旱强度、持续时间等因素有所不同。在干旱胁迫下,细胞质膜损伤引起透性增大,使细胞对内含物失去控制造成电解质大量外渗,因此质膜透性已成为重要的抗旱指标,在许多研究中有所应用[47]。本研究中,4个甘蔗品种的质膜透性随着干旱时间的增加而不断上升,表现出与MDA含量类似的趋势。在轻度干旱之前,4个品种的质膜透性变化幅度较小,说明在前期干旱时甘蔗对细胞膜的损伤有所调节,表现出一定的耐旱作用。轻度干旱至中度干旱时,‘新台糖22号’和‘桂糖42号’的质膜透性上升幅度增加,高于‘云蔗08-1609’和‘粤糖93-159’,说明在干旱胁迫对‘新台糖22号’和‘桂糖42号’细胞膜损伤较高。在重度干旱时‘新台糖22号’质膜透性最高,‘云蔗08-1609’最低,说明‘新台糖22号’细胞已受到严重损伤,‘云蔗08-1609’则表现出较好的细胞状态。叶片相对含水率是表现叶片细胞水分的重要指标,缺水导致细胞许多生理过程受到影响。叶片相对含水率可以较好地反映出作物的抗旱性,有研究表明相对含水量较高的叶片有较高的渗透调节功能和较强的抗旱性[12]。本研究发现4个品种的叶片相对含水率在轻度干旱时均在70%以上,说明前期干旱对细胞水分造成的影响较小。从轻度干旱至中度干旱,‘新台糖22号’和‘桂糖42号’的降幅突然变大,到重度干旱时仅为20%左右,细胞水分严重减少。而‘云蔗08-1609’则保持在50%的叶片相对含水率,这也与该品种在丙二醛和质膜透性上的表现相似。干旱胁迫对甘蔗叶片形态造成了显著影响,本研究中4个品种在干旱胁迫下叶片绿叶率显著降低。综上,‘云蔗08-1609’在干旱胁迫时表现出较高的细胞水分含量,较低的MDA积累以及细胞膜损伤,‘新台糖22号’和‘桂糖42号’在干旱持续一段时间后受到损害加重。
3.4 干旱胁迫下甘蔗脱落酸生理响应
关于植物激素对抗旱性的相关研究已越来越深入,其中脱落酸(ABA)参与调节干旱胁迫已被广泛研究。ABA通过保卫细胞和生长,以及通过诱导编码酶和其他参与细胞脱水耐性的蛋白质的基因,在调节植物水分状况方面发挥着关键作用[48]。本研究表明,干旱胁迫下ABA响应速度是所选生理指标中提升最快的。‘新台糖22号’和‘桂糖42号’在轻度干旱时ABA含量提升超过6倍,但是在中度干旱时降幅也是最大的。‘云蔗08-1609’的ABA含量在正常浇水时是4个品种中最高的,在干旱各个期间仍保持较高水平。ABA在生物体内最主要的功能是其作为胁迫激素参与了植物对外界胁迫条件的适应。ABA对保持细胞的水分状况有着重要作用,从而导致植物对干旱的忍耐能力提高[49]。本研究中,ABA含量较高的‘云蔗08-1609’具有较高的叶片相对含水率,在干旱胁迫下受到较小的影响。
4 结论
作为甘蔗主栽品种,干旱胁迫下‘云蔗08-1609’‘粤糖93-159’‘新台糖22号’和‘桂糖42号’的抗氧化酶活性、抗坏血酸-谷胱甘肽循环物质和脱落酸含量增加、MDA、质膜透性下降。不同甘蔗品种在干旱胁迫下产生不同的生理响应,‘云蔗08-1609’在干旱胁迫下ABA含量最高,SOD、CAT、POD和GR活性在干旱初期响应最快。‘新台糖22号’和‘桂糖42号’在AsA-GSH循环中具有较高的AsA、GSH、GSSG含量。‘粤糖93-159’具有较高的POD和CAT活性。
[1] 赵琳, 李 威, 叶殿秀, 刘绿柳, 孙林海, 王 凌, 常 蕊, 廖要明, 姜允迪. 2020—2021年度华南江南等地秋冬连旱气候特征及成因分析[J]. 中国防汛抗旱, 2021, 31(6): 6-10.
ZHAO L, LI W, YE D X, LIU L L, SUN L H, WANG L, CHANG R, LIAO Y M, JIANG Y D. Climatic characteristics and causes of continuous drought in autumn and winter in southern China, Jiangnan and other places from 2020 to 2021[J]. Journal of Wheat Crops, 2015, 35(6): 777-784. (in Chinese)
[2] LOBELL D B, SCHLENKER W, COSTA-ROBERTS J. Climate trends and global crop production since 1980[J]. Science, 2011, 333(6042): 616-620.
[3] 杨 帆, 苗灵凤, 胥 晓, 李春阳. 植物对干旱胁迫的响应研究进展[J]. 应用与环境生物学报, 2007(4): 586-591.
YANG F, MIAO L F, XU X, LI C Y. Research progress on plant responses to drought stress[J]. Chinese Journal of Applied and Environmental Biology, 2007(4): 586-591. (in Chinese)
[4] LI Y R, YANG L T. Sugarcane agriculture and sugar industry in China[J]. Sugar Tech, 2015, 17(1): 1-8.
[5] 陆国盈, 韩世健, 杨培忠, 裴铁雄, 班华松. 甘蔗伸长中后期干旱胁迫对产量和工艺品质的影响效应[J]. 广西蔗糖, 2002(4): 3-7.
LU G Y, HAN S J, YANG P Z, PEI T X, BAN H S. Effects of drought stress on yield and process quality in the middle and late stages of sugarcane elongation[J]. Guangxi Sugarcane, 2002(4): 3-7. (in Chinese)
[6] MISRA V, SOLOMON S, MALL A K, PRAJAPATI C P, HASHEM A, ABD ALLAH E F, ANSARI M I. Morphological assessment of water stressed sugarcane: a comparison of waterlogged and drought affected crop[J]. Saudi Journal of Biological Sciences, 2020, 27(5): 1228- 1236.
[7] DO THANH TRUNG, 李 健, 张风娟, 邢永秀, 杨丽涛, 李杨瑞, NGUYEN THI HANH. 干旱胁迫下不同甘蔗品种叶片抗氧化酶活性和渗透调节物质含量的变化[J]. 热带作物学报, 2018, 39(5): 858-866.
DO T T, LI J, ZHANG F J, XIN Y X, YANG L T, LI Y R, NGUYEN T H. Changes of antioxidant enzyme activities and osmotic regulatory substance contents in leaves of different sugarcane cultivars under drought stress[J]. Chinese Journal of Tropical Crops, 2018, 39(5): 858-866. (in Chinese)
[8] 李鸿博, 蔡伟俊, 谢雨彤, 邓权清, 陈健文, 沈万宽. 甘蔗新品系对干旱胁迫的生理响应及抗旱性评价[J]. 华南农业大学学报, 2019, 40(6): 51-58.
LI H B, CAI W J, XIE Y T, DENG Q Q, CHEN J W, SHEN W K. Physiological responses and drought resistance evaluation of new sugarcane lines to drought stress[J]. Journal of South China Agricultural University, 2019, 40(6): 51-58. (in Chinese)
[9] 安东升, 曹 娟, 黄小华, 周 娟, 窦美安. 基于Lake模型的叶绿素荧光参数在甘蔗苗期抗旱性研究中的应用[J]. 植物生态学报, 2015, 39(4): 398-406.
AN D S, CAO J, HUANG X H, ZHOU J, DOU M A. Application of chlorophyll fluorescence parameters based on Lake model in the study of drought resistance of sugarcane seedlings[J]. Chinese Journal of Plant Ecology, 2015, 39(4): 398-406. (in Chinese)
[10] 赵培方, 赵 俊, 刘家勇, 昝逢刚, 夏红明, P. A. JACKSON, J. BASNAYAKE, N. G. INMAN-BAMBER, 杨 昆, 赵丽萍, 覃 伟, 陈学宽, 赵兴东, 范源洪. 干旱胁迫对甘蔗4个生理指标遗传变异的影响[J]. 中国农业科学, 2017, 50(1): 28-37.
ZHAO P F, ZHAO J, LIU J Y, ZAN F G, XIA H M, JACKSON P A, BASNAYAKE J, INMAN-BAMBER N G, YANG K, ZHAO L P, QIN W, CHEN X K, ZHAO X D, FAN Y H. Effects of drought stress on genetic variation of four physiological indexes in sugarcane[J]. Chinese Agricultural Science, 2017, 50(1): 28-37. (in Chinese)
[11] 刘三梅, 杨清辉, 陈朝在, 杨飞燕, 陈湧林, 肖关丽. 干旱胁迫对甘蔗不同生育时期光合特性的影响[J]. 云南农业大学学报(自然科学), 2016, 31(3): 398-403.
LIU S M, YANG Q H, CHENG C Z, YANG F Y, CHEN Y L, XIAO G L. Effects of drought stress on photosynthetic characteristics of sugarcane at different growth stages[J]. Journal of Yunnan Agricultural University (Natural Science), 2016, 31(3): 398-403. (in Chinese)
[12] 张风娟, 李 健, 杜成忠, 杨丽涛, 李杨瑞, 邢永秀. 不同甘蔗品种叶片气孔对水分胁迫的响应[J]. 广西植物, 2014, 34(6): 821-827.
ZHANG F J, LI J, DU C Z, YANG L T, LI Y R, XING Y X. Response of leaf stoma in different sugarcane varieties to water stress[J]. Guangxi Plants, 2014, 34(6): 821-827. (in Chinese)
[13] 高三基, 罗 俊, 陈如凯, 张木清, 潘大仁. 甘蔗品种抗旱性光合生理指标及其综合评价[J]. 作物学报, 2002(1): 94-98.
GAO S J, LUO J, CHEN R K, ZHANG M Q, PAN D R. Photosynthetic physiological indexes of drought resistance of sugarcane varieties and their comprehensive evaluation[J]. Chinese Journal of Crops, 2002(1): 94-98. (in Chinese)
[14] 王天菊, 王先宏, 杨清辉. 26份割手密种质材料的抗旱性差异评价[J]. 热带作物学报, 2017, 38(9): 1645-1652.
WANG T J, WANG X H, YANG Q H. Differential evaluation of drought resistance among 26 Geshoumi germplasm materials[J]. Chinese Journal of Tropical Crops, 2017, 38(9): 1645-1652. (in Chinese)
[15] 田春艳, 边 芯, 俞华先, 郎荣斌, 董立华, 桃联安, 周清明, 安汝东, 孙有芳, 杨李和, 经艳芬. 云瑞甘蔗创新亲本抗旱性综合评价[J]. 植物遗传资源学报, 2019, 20(3): 610-623.
TIAN C Y, BIAN X, YU H X, LANG R B, DONG L H, TAO L A, ZHOU Q M, AN R D, SUN Y F, YANG L H, JIN Y F. Comprehensive evaluation of drought resistance of innovative parents of Yunrui sugarcane[J]. Journal of Plant Genetic Resources, 2019, 20(3): 610-623. (in Chinese)
[16] 兰 靖, 陈 永, 陆玉朵, 韩世健, 裴铁雄, 陆国盈, 李贤宇, 周洁琼. 6个甘蔗品种(系)的抗旱性差异评价[J]. 西南农业学报, 2014, 27(4): 1374-1381.
LAN J, CHEN Y, LU Y D, HAN S J, PEI T X, LU G Y, LI X Y, ZHOU J Q. Differential evaluation of drought resistance among six sugarcane varieties (lines)[J]. Southwest Agricultural Journal, 2014, 27(4): 1374-1381. (in Chinese)
[17] VILELA R D, BEZERRA B K L, FROEHLICH A, ENDRES L. Antioxidant system is essential to increase drought tolerance of sugarcane[J]. Annals of Applied Biology, 2017, 171(3): 451-463.
[18] ZHANG Y B, YANG S L, DAO J M, DENG J, SHAHZAD A N, FAN X, LI R D, QUAN Y J, BUKHARI S A H, ZENG Z H. Drought-induced alterations in photosynthetic, ultrastructural and biochemical traits of contrasting sugarcane genotypes[J]. PLoS One, 2020, 15(7): e0235845.
[19] 桂意云, 杨荣仲, 周 会. 干旱及复水条件下甘蔗的生理响应与抗旱性简易鉴定[J]. 广东农业科学, 2009(9): 19-21.
GUI Y Y, YANG R Z, ZHOU H. Physiological responses and drought resistance of sugarcane under drought and rehydration conditions[J]. Guangdong Agricultural Science, 2009(9): 19-21. (in Chinese)
[20] MILLER G, SUZUKI N, CIFTCI-YILMAZ S, MITTLER R. Reactive oxygen species homeostasis and signalling during drought and salinity stresses[J]. Plant, Cell & Environment, 2010, 33(4): 453-467.
[21] 任家慧, 杨 淼, 王 玥, 黄 钰, 李 润, 胡锦飙, 肖关丽. 基于云南主栽马铃薯品种抗氧化防御系统对干旱胁迫的响应研究[J]. 西南农业学报, 2020, 33(6): 1158-1164.
REN J H, YANG M, WANG Y, HUANG Y, LI R, HU J B, XIAO G L. Response of antioxidant defense system to drought stress in main potato varieties in Yunnan[J]. Southwest Agricultural Journal, 2020, 33(6): 1158-1164. (in Chinese)
[22] 孙 建, 颜小文, 乐美旺, 饶月亮, 颜廷献, 叶艳英, 周红英. 芝麻不同抗旱基因型对花期干旱胁迫的生理响应机理[J]. 中国农业科学, 2019, 52(7): 1215-1226.
SUN J, YAN X W, YUE M W, RAO Y L, YAN T X, YE Y Y, ZHOU H Y. Physiological response mechanism of different drought-resistant genotypes of sesame to drought stress at flowering stage[J]. Chinese Agricultural Science, 2019, 52(7): 1215-1226. (in Chinese)
[23] 张翠梅, 师尚礼, 吴 芳. 干旱胁迫对不同抗旱性苜蓿品种根系生长及生理特性影响[J]. 中国农业科学, 2018, 51(5): 868-882.
ZHANG C M, SHI S L, WU F. Effects of drought stress on root growth and physiological characteristics of different drought-resistant alfalfa cultivars[J]. Chinese Agricultural Science, 2018, 51(5): 868-882. (in Chinese)
[24] LIM C, BAEK W, JUNG J, KIM J, LEE S. Function of ABA in stomatal defense against biotic and drought stresses[J]. International Journal of Molecular Sciences, 2015, 16(12): 15251-15270.
[25] 廖健明, 黄晓露, 梁钟芳, 李慈代, 蓝金宣, 李宝财, 梁文汇. 干旱胁迫下薄壳山核桃实生苗内源激素的变化规律[J]. 广西林业科学, 2020, 49(4): 511-517.
LIAO J M, HUANG X L, LIANG Z F, LI C D, LAN J X, LI B C, LIANG W H. Changes of endogenous hormones in the seedlings of pecan pecan under drought stress[J]. Guangxi Forestry Science, 2020, 49(4): 511-517. (in Chinese)
[26] 张 平, 张 慧, 刘俊娜, 环秀菊, 王倩朝, 李 莉, 刘永江, 覃 鹏. 干旱及复水处理对抗旱性不同小麦品种/系苗期生理生化指标的影响[J]. 西北农业学报, 2020, 29(12): 1795-1802.
ZHANG P, ZHANG H, LIU J N, HUAN X J, WANG Q Z, LI L, LIU Y J, QIN P. Effects of drought and rewatering treatments on physiological and biochemical indexes of different wheat varieties/lines with drought resistance at seedling stage[J]. Northwest Agricultural Journal, 2020, 29(12): 1795-1802. (in Chinese)
[27] 董馥慧, 裴红宾, 张永清, 杨 甜, 薛小娇. 干旱胁迫与复水对苦荞生长及叶片内源激素含量的影响[J]. 中国农业科技导报, 2019, 21(12): 41-48.
DONG F H, PEI H B, ZHANG Y Q, YANG T, XUE X J. Effects of drought stress and rewatering on growth and endogenous hormone content of tartary buckwheat[J]. China Agricultural Science and Technology Herald, 2019, 21(12): 41-48.(in Chinese)
[28] 孙 哲, 范维娟, 刘桂玲, 田昌庚, 张 鹏, 柳洪鹃, 杨 俊, 赵丰玲, 史春余. 干旱胁迫下外源ABA对甘薯苗期叶片光合特性及相关生理指标的影响[J]. 植物生理学报, 2017, 53(5): 873-880.
SUN Z, FAN W J, LIU G L, TIAN C G, ZHANG P, LIU H J, YANG J, ZHAO F L, SHI C Y. Effects of exogenous ABA on photosynthetic characteristics and related physiological indexes of sweet potato leaves at seedling stage under drought stress[J]. Chinese Journal of Plant Physiology, 2017, 53(5): 873-880. (in Chinese)
[29] 夏红明, 赵培方, 刘家勇, 赵 俊, 昝逢刚, 陈学宽, 杨 昆, 杨洪昌, 姚 丽, 赵丽萍, 吴转娣, 覃 伟, 吴才文. 早熟高糖甘蔗新品种云蔗081609的选育[J]. 中国糖料, 2018, 40(5): 6-9.
XIA H M, ZHAO P F, LIU J Y, ZHAO J, ZAN F G, CEHN X K, YANG K, YANG H C, YAO L, ZHAO L P, WU Z D, QIN W, WU C W. Breeding of a new early-maturing high- sugar sugarcane variety Yunzhe 081609[J]. China Sugar, 2018, 40(5): 6-9. (in Chinese)
[30] 韦文科. 特早熟高糖甘蔗新品种粤糖93-159简介[J]. 广西蔗糖, 2001(4): 52-53.
WEI W K. A brief introduction of a new high-sugar sugarcane variety Yuetang 93-159[J]. Guangxi Sugarcane, 2001(4): 52-53. (in Chinese)
[31] 王伦旺, 廖江雄, 谭 芳, 唐仕云, 黄家雍, 李 翔, 杨荣仲, 李杨瑞, 黄海荣, 经 艳, 邓宇驰. 高产高糖抗倒伏甘蔗新品种桂糖42号的选育及高产栽培技术[J]. 南方农业学报, 2015, 46(8): 1361-1366.
WANG L W, LIAO J X, TAN F, TANG S Y, HUANG J Y, LI X, YANG R Z, LI Y R, HUANG H R, JING Y, DENG Y C. Breeding and high-yielding cultivation techniques of a new sugarcane variety Guitang 42 with high yield and high sugar resistance to lodging[J]. Southern Agricultural Journal, 2015, 46(8): 1361-1366. (in Chinese)
[32] 李合生. 植物生理生化实验原理和技[M]. 北京: 高等教育出版社, 2000.
LI H S. Principles and techniques of plant physiological and biochemical experiments[M]. Beijing: Higher Education Press, 2000. (in Chinese)
[33] UKEDA H, KAWANA D, MAEDA S, SAWAMURA M. Spectrophotometric assay for superoxide dismutase based on the reduction of highly water-soluble tetrazolium salts by xanthine-xanthine oxidase[J]. Biosci. Biotechnol. Biochem., 1999, 63(3): 485-488.
[34] DOERGE D R, DIVI R L, CHURCHWELL M I. Identification of the colored guaiacol oxidation product produced by peroxidases[J]. Anal Biochem, 1997, 250(1): 10-17.
[35] JOHANSSON L H, BORG L A. A spectrophotometric method for determination of catalase activity in small tissue samples[J]. Anal Biochem, 1988, 174(1): 331-336.
[36] NISHIMOTO S, KOIKE S, INOUE N, SUZUKI T, OGASAWARA Y. Activation of Nrf2 attenuates carbonyl stress induced by methylglyoxal in human neuroblastoma cells: increase in GSH levels is a critical event for the detoxification mechanism[J]. Biochemical and Biophysical Research Communications, 2017, 483(2): 874-879.
[37] DU J, CULLEN J J, BUETTNER G R. Ascorbic acid: chemistry, biology and the treatment of cancer[J]. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer, 2012, 1826(2): 443-457.
[38] YANG R C, YANG T, ZHANG H J, QI Y, XING Y X, ZHANG N, LI R, WEEDA S, REN S X, OUYANG B, GUO Y D. Hormone profiling and transcription analysis reveal a major role of ABA in tomato salt tolerance[J]. Plant Physiology and Biochemistry, 2014, 77: 23-34.
[39] SPITZ D R, OBERLEY L W. An assay for superoxide dismutase activity in mammalian tissue homogenates[J]. Analytical Biochemistry, 1989, 179(1): 8.
[40] 窦俊辉, 喻树迅, 范术丽, 庞朝友, 宋美珍. SOD与植物胁迫抗性[J]. 分子植物育种, 2010, 8(2): 359-364.
DOU J H, YU S X, FAN S L, PANG C Y, SONG M Z. SOD and plant stress resistance[J]. Molecular Plant Breeding, 2010, 8(2): 359-364. (in Chinese)
[41] 林宇丰, 李 魏, 戴良英. 抗氧化酶在植物抗旱过程中的功能研究进展[J]. 作物研究, 2015, 29(3): 326-330.
LIN Y F, LI W, DAI L Y. Research progress on the function of antioxidant enzymes in plant drought resistance[J]. Crop Research, 2015, 29(3): 326-330. (in Chinese)
[42] FOYER C H, NOCTOR G. Ascorbate and glutathione: the heart of the redox hub[J]. Plant Physiology, 2011, 155(1): 2-18.
[43] 周 艳, 刘慧英, 邓嘉欣, 霍靖欣, 刘锴栋. GSH/GSSG对盐胁迫下番茄幼苗谷胱甘肽化修饰和抗氧化系统的影响[J]. 分子植物育种, 2021, 19(6): 1995-2003.
ZHOU Y, LIU H Y, DENG J X, HUO J X, LIU K D. Effects of GSH/GSSG on glutathionylation and antioxidant system of tomato seedlings under salt stress[J]. Molecular Plant Breeding, 2021, 19(6): 1995-2003. (in Chinese)
[44] 尹永强, 胡建斌, 邓明军. 植物叶片抗氧化系统及其对逆境胁迫的响应研究进展[J]. 中国农学通报, 2007(1): 105-110.
YIN Y Q, HU J B, DENG M J. Research progress of plant leaf antioxidant system and its response to stress[J]. China Agricultural Science Bulletin, 2007(1): 105-110. (in Chinese)
[45] SGHERRI C L M, LOGCINI B, PULIGA S, NAVARI F. Antioxidant system in sporobolus stapfianus: changes in response to desiccation and rehydration[J]. Phytochem, 1994(35): 561-565.
[46] 陆国盈, 劳丽萍, 韩世健, 裴铁雄, 汤雪莲, 秦洪波. 5个甘蔗新品种(系)的抗旱性研究[J]. 安徽农业科学, 2011, 39(3): 1341-1345.
LU G Y, LAO L P, HAN S J, PEI T X, TANG X L, QIN H B. Study on drought resistance of five new sugarcane varieties (lines)[J]. Anhui Agricultural Science, 2011, 39(3): 1341-1345. (in Chinese)
[47] 李晓君, 罗正清, 陆昌强, 唐吉昌, 周 中, 曹 琦. 20个甘蔗品种(系)的抗旱性比较[J]. 热带作物学报, 2020, 41(12): 2482-2491.
LI X J, LUO Z Q, LU C Q, TANG J C, ZHOU Z, CAO Q. Comparison of drought resistance of 20 sugarcane varieties (lines)[J]. Chinese Journal of Tropical Crops, 2020, 41(12): 2482-2491. (in Chinese)
[48] ZHANG J H, JIA W, YANG J C, ISMAIL A M. Role of ABA in integrating plant responses to drought and salt stresses[J]. Field Crops Research, 2006, 97(1): 111-119.
[49] 李智念, 王光明, 曾之文. 植物干旱胁迫中的ABA研究[J]. 干旱地区农业研究, 2003(2): 99-104.
LI Z N, WANG G M, ZENG Z W. Research on ABA in plant drought stress[J]. Agricultural Research in Arid Regions, 2003(2): 99-104. (in Chinese)
Physiological Responses of Four Major Sugarcane Cultivars to Drought Stress
LIU Shuo1,2, FAN Xian1*, LI Rudan1, DENG Jun1, DAO Jingmei1, QUAN Yiji1, YANG Shaolin1,ZHANG Yuebin1**
1. Sugarcane Research Institute, Yunnan Academy of Agricultural Sciences, Kaiyuan, Yunnan 661699, China; 2. Institute of Resource Plants, Yunnan University, Kunming, Yunnan 650000, China
In order to explore the changing trend of sugarcane physiological response during elongation under drought stress, four main sugarcane cultivars in China, ‘Yunzhe 08-1609’, ‘Yuetang 93-159’, ‘ROC22’ and ‘Guitang 42’, were used as the test materials. By adopting the method of artificial potted water control (soil water content accounted for more than 80% of field capacity), and 3 different gradients of drought stress treatment of mild drought (50%–60%), moderate drought (40%–50%) and severe drought (30%–40%) were set. In this experiment, the antioxidant enzyme system, ascorbic acid-glutathione (AsA-GSH) circulation system, plant damage status and abscisic acid (ABA) content in different sugarcane cultivars under drought stress were measured and studied. The test results showed that the activity of SOD, POD, CAT and GR in the 4 sugarcane cultivars significantly increased by drought stress (<0.05, the same below); the content of AsA and GSH increased significantly with the drought time. The GSSG content in the other 3 cultivars except for ‘Yunzhe 08-1609’ continued to rise, showing a trend of first rising and then falling; the GSH/GSSG value in ‘Yunzhe 08-1609’ continued to rise, that in ‘ROC22’ continued to decline, that in ‘Yuetang 93-159’ and ‘Guitang 42’ showeda continuous increase. The MDA and plasma membrane permeability in the 4 cultivars increased significantly, and the relative water content in leaves decreased significantly; except for ‘Guitang 42’ which ABA content showed a trend of first increase and then decrease, the other 3 cultivars showed a trend of increasing first and then decreasing. Under drought stress, the ABA content showed a trend of rising-falling-rising. To sum up, drought stress caused a significant increase in SOD, POD, CAT, GR activity and ABA, AsA, GSH and GSSG contents in the 4 sugarcane cultivars. The permeability of MDA and plasma membrane increased, and the relative water content of leaves decreased. ‘Yunzhe 08-1609’ had the highest ABA and relative water content in leaves under drought stress, while SOD, CAT, POD and GR activity responding the fastest at the early stage of drought, and the plasma membrane permeability was the lowest. ‘ROC 22’ and ‘Guitang 42’ had higher AsA, GSH and GSSG contents in the AsA-GSH cycle. ‘Yuetang 93-159’ had higher POD and CAT activity and lower MDA content. The growth characteristics of sugarcane cultivars were different in different climate conditions and growth stages. ‘Yunzhe 08-1609’ was suitable for planting in Yunnan climatic conditions. In this experiment, the drought resistance performance in Yunnan was better; ‘Guitang 42’ was widely planted in Guangxi, suitable for the climatic conditions of Guangxi. ‘Yuetang 93-159’ was a high-sugar variety but has poor drought resistance. ‘ROC22’ has been cultivated for many years and faces the problem of characteristic degradation. Therefore, this study discussed the response characteristics of the 4 cultivars under drought stress, and the drought resistance should be analyzed in combination with field experiments.
spp.; drought stress; physiological and biochemical indexes; ASA-GSH cycle
S566.1
A
10.3969/j.issn.1000-2561.2022.09.009
2022-01-25;
2022-03-04
国家现代农业产业技术体系建设项目(No. CARS-170205);云南省重大科技专项计划(No. 202102AE090028)。
刘 硕(1997—),男,硕士研究生,研究方向:甘蔗抗逆生理。*同等贡献作者:樊 仙(1987—),女,硕士,副研究员,研究方向:甘蔗栽培生理。**通信作者(Corresponding author):张跃彬(ZHANG Yuebin),E-mail:ynzyb@sohu.com。
