茶渣纤维素水凝胶固定化酶的研究
2022-10-08罗艺献顾苏宜黄建忠
晋 豆,罗艺献,顾苏宜,黄建忠,祁 峰
茶渣纤维素水凝胶固定化酶的研究
晋 豆,罗艺献,顾苏宜,黄建忠,祁 峰
(1. 福建师范大学 工业微生物发酵技术国家地方联合工程研究中心 生命科学学院,福建 福州 350117; 2. 福建师范大学 细胞逆境响应与代谢调控福建省高校重点实验室,福建 福州 350108)
采用不同目数的茶渣制备茶渣纤维素微纤丝水凝胶(TW-CNFs/hydrogels),将其作为微载体固定米根霉脂肪酶(ROL)和米曲霉α-淀粉酶(AOA)。通过扫描电镜(SEM)、傅里叶红外光谱(FT-IR)、对脂肪酶和淀粉酶及载体进行形态学分析等表征,结果表明:茶渣纤维素微纤丝表面存在大量蜂窝状的空隙,当茶渣纤维素微纤丝水凝胶被制成后,在空间分布上还带有明显的不规则和聚集堆叠的特性,酶分散和固定在各个空隙和堆叠的空间内;载体中茶渣的浓度越高,制备的茶渣纤维素微纤丝水凝胶固定化酶的酶活性越高;当pH为10时,已固定脂肪酶活性达到最高值,而游离脂肪酶的酶活降低85%左右;当pH为10时,固定淀粉酶的酶活比游离淀粉酶的高50%以上。相比游离酶,茶渣纤维素微纤丝水凝胶上固定的酶最适pH都向碱性偏移,说明固定化酶更具有耐碱性,pH稳定性和极端环境耐受性有显著性提高。
固定化酶;茶渣纤维素微纤丝;水凝胶;米根霉脂肪酶;米曲霉α-淀粉酶
近年来,利用茶渣纤维素制作水凝胶的各种应用引起了人们的极大兴趣,Huihua H等将茶渣利用离子液体进行处理,通过加入壳聚糖、天然大分子聚合物等添加物的方式,提高茶叶纤维素复合水凝胶的热稳定性、力学性能、载药率与药物释放率。另外研究还表明,含κ-卡拉胶、瓜尔胶和可溶性淀粉等添加物的茶渣水凝胶材料载体,具有细胞毒性低与较好的细胞相容性等优点[1-2]。除此之外,Zhijun L等利用碱性化学法从不同嫩度的茶渣中提取纤维素,将茶渣纤维素进行改性后制备成茶渣纤维素水凝胶,研究发现成熟叶纤维制备的水凝胶对于水杨酸钠的载药率与释放率最高[3-4]。
聚合物水凝胶会构成一个交联的三维亲水网络结构,在聚合物链内保留水相,为酶提供一个适宜的生理环境,有利于维持酶构象,并协助执行酶的催化功能。近年来各种复合水凝胶材料已经被利用开发为酶固定化的载体。Bilal M 等开发一种琼脂糖-壳聚糖聚合物混合水凝胶,用于固定化辣根过氧化物酶,该研究使辣根过氧化物酶具有更广的工作pH和温度稳定性,以及高的回收效率[5]。Jang E等先通过共价结合葡萄糖氧化酶于二氧化硅纳米颗粒表面,再通过水凝胶包埋结合来固定化酶,实验结果表明通过这种方式固定化酶会大大提高酶的稳定性及重复利用性[6]。Huihua H等利用含磁性四氧化三铁的茶纤维素水凝胶固定木瓜蛋白酶,此种固定方法使木瓜蛋白酶对磁场敏感,且具有顺磁性与较高的热稳定性[7]。复合水凝胶材料具有合成方便、环保、成本效益高等显著性能,所以作为固定化载体材料具有巨大的应用潜力,人们对其研究和应用越来越感兴趣[8-9]。
在现有技术启发下,制成了以茶渣为原料的纤维素微纤丝(cellulose nanofibrils, CNFs)基水凝胶,并对固定化酶效果进行了初步研究,研究将脂肪酶和淀粉酶固定在茶渣纤维素水凝胶上,构建一种新的固定化酶模式,既可以提高资源利用率,同时又有利于提高酶的稳定性和可循环性,是一种具有巨大工业应用潜力的固定化酶方式。
1 实验
1.1 材料
茶渣购自福建仙洋洋生物科技有限公司、无水硫酸钙(CaSO4)购自阿拉丁化学有限公司、聚乙烯醇(PVA)购自Sigma-Aldrich公司、海藻酸钠购自上海麦克林生化科技有限公司、实验用水为双蒸水。
1.2 方法
1.2.1 蛋白含量测定
蛋白标准曲线:测定固定化酶固定后的残余蛋白含量采用的是Bradford法[10],其原理是在酸性溶液中考马斯亮兰G-250染液能与蛋白质结合,使染料的最大吸收峰的位置由465 nm变为595 nm,在一定的浓度范围内,测定的A595吸光度值与蛋白质浓度成正比。
脂肪酶蛋白标准曲线:为了使脂肪酶的三个浓度(5、25和250 μg/mL)的吸光值都能落在蛋白标准曲线范围内,制作了脂肪酶的三个蛋白标准曲线,曲线方程分别是1=0.002 6+0.322,2=0.020 9-0.058 2,3=0.013 7+0.019。
淀粉酶蛋白标准曲线:曲线方程是3=0.013 7+0.019,2=0.998 6。
对硝基苯酚标准曲线:pNP标准曲线的方程式为=0.039 8+0.207 1,2=0.995 9,式中,y是pNP在波长410 nm处吸光值,为pNP浓度(μmol/L)。
蛋白浓度测定采用考马斯亮蓝法测定蛋白浓度,首先用酶标仪测在595 nm 处的吸光度值,根据吸光度值,在标准曲线上查出其对应蛋白浓度(μg/mL)计算出待测酶液的酶浓度,从而得出固定化效率,如式(1)所示。

1.2.2 酶活测定
脂肪酶酶活测定采用对硝基苯酚法[11]来测定脂肪酶酶活性,此法的原理是通过脂肪酶催化反应将底物p-NPP水解后生成对硝基苯酚,在碱性条件下,对硝基苯酚在410 nm处有最佳吸光度,通过吸光度的大小可以推测出对硝基苯酚的浓度。因此,将测定p-NP酯底物p-NPL(C12)转化成测量对硝基苯酚(p-NP)的释放量,测定游离脂肪酶的酶活性,如式(2)所示。
脂肪酶酶活力公式:
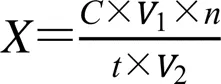
式中,为脂肪酶酶活力U /(1 mL脂肪酶酶液),为pNP浓度(μmol/L),1为反应液总体积(mL),为酶液稀释倍数,为反应时间(min),2为酶液体积(mL)。
淀粉酶酶活测定采用3-5-二硝基水杨酸法[12]测定α淀粉酶酶活性。等体积的淀粉溶液内加入等体积不同浓度的淀粉酶,在25℃下静置10分钟,与分解出来的还原糖充分反应。然后分别加入1 mL DNS,立即置于沸水浴中反应5 min,采用分光光度计测定540 nm处吸光度以及麦芽糖标准曲线。淀粉酶酶活性的单位定义是在25℃条件下,每分钟释放1 μmol麦芽糖所需的酶量,如式(3)所示。
淀粉酶酶活力计算公式:
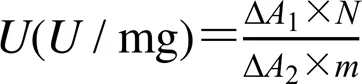
式中,∆1为样品管与空白管的吸光值之差,∆2为标准管与标准空白管的吸光值之差,为标准管中麦芽糖的物质的量(μmol),为样品管中酶的质量(mg)。
1.2.3 茶渣纤维素微纤丝水凝胶固定化酶的制备
1.2.3.1 纤维素微纤丝预处理
用双蒸水将茶渣清洗干净并烘干,将茶渣表面上的灰尘以及一些杂质去除。将茶渣用粉碎机粉碎10分钟,重复操作该过程,待茶渣彻底粉碎成细末状。用35目、100目和300目的筛网分别过筛得到相应的级别的纤维素微纤丝,将茶渣预处理得到的纤维素微米纤维称为茶渣纤维素微纤丝。
1.2.3.2 茶渣纤维素微纤丝水凝胶的制备
在Liu S L[13]文献基础上操作方法改进为:称取分别为5%(wt)、10%(wt)的茶渣纤维素微纤丝,制备均匀混合的茶渣纤维素微纤丝、0.5% PVA和海藻酸钠悬浊液,加入到分液漏斗中,使其缓慢滴入CaSO4溶液中得到凝胶小球,然后筛选大小形状均匀的小球,再进一步硬化茶渣纤维素微纤丝水凝胶小球。将制备得到的茶渣纤维素微纤丝水凝胶放入4℃冰箱保存。
1.2.3.3 茶渣纤维素微纤丝水凝胶固定化酶
在Luo Y X[14]文献基础上操作方法改进为:将其SiO2微载体替换成茶渣纤维素微纤丝水凝胶,选取每组大小均匀的6个凝胶球,进行交联剂双环氧试剂新戊二醇二缩水甘油醚(NGDED)交联,选取不同浓度的脂肪酶(ROL)和淀粉酶(AOA)加入未进行交联剂活化和已进行交联剂活化的茶渣纤维素微纤丝水凝胶中孵育,得到固定酶的载体水凝胶洗涤后,保存于4℃冰箱备用。
1.2.4 固定化酶表征
扫描电子显微镜(SME)、透射电镜(TEM),将35目(A)、100目(B)和300目(C)茶渣纤维素微纤丝水凝胶粉碎干燥,进行观察研究;傅里叶变换红外光度计(FT-IR),将纯水凝胶、茶渣纤维素微纤丝水凝胶及固定上酶的茶渣纤维素微纤丝水凝胶微球干燥后以溴化钾压片进行预处理,分辨率为1 cm-1,扫描范围为400~4000 cm-1,进行观察研究。
1.2.5 固定化酶与游离酶的酶学性质比较
1.2.5.1 交联剂浓度对固定化酶酶活的影响
为了评价不同浓度交联剂的茶渣纤维素微纤丝水凝胶固定化酶对于酶活的影响,将制备好的已进行交联剂活化的茶渣纤维素微纤丝水凝胶催化反应,测定酶活力,以最高酶活数据为100%酶活力,探讨有无交联剂情况下的酶活力变化。
1.2.5.2 固定化酶的最适pH
测定pH分别为3、4、5、6、7、8、9、10、11、12下固定化酶步骤得到的已固定酶的茶渣纤维素微纤丝水凝胶与游离酶脂肪酶(ROL)和淀粉酶(AOA)的酶活力,以最高酶活数据为100%酶活力,探讨在不同pH下的酶活力变化。
1.2.5.3 固定化酶的pH稳定性
pH为3、4、5、6、7、8、9、10、11、12时将已固定酶的茶渣纤维素微纤丝水凝胶与游离酶脂肪酶(ROL)和淀粉酶(AOA)温育3 h,以最高酶活数据为100%酶活力,探讨在不同pH酶的稳定性。
1.2.5.4 固定化酶的重复利用性
为了评价已固定酶的茶渣纤维素微纤丝水凝胶可重复使用性,将固定化的脂肪酶(ROL)和淀粉酶(AOA)进行重复催化反应10个循环。将固定化的茶渣纤维素微纤丝水凝胶直接除去上清进行分离,每个循环后用0.02 mol/L磷酸盐缓冲液洗涤三遍,然后进行下一批次的反应。以第一次酶活数据为100%酶活力,探讨固定化酶的重复使用性。
2 结果与讨论
2.1 茶渣纤维素微纤丝固定化酶的表征
2.1.1 茶渣纤维素微纤丝水凝胶固定化酶的SEM结果
图1是三种含或不含茶渣纤维素微纤丝的水凝胶的外貌形态图,从图中可以看出,不含茶渣纤维素微纤丝的水凝胶是呈透明的白色小球,大小均一;含5%茶渣纤维素微纤丝水凝胶小球表面光滑,大小均一分散;而含10%茶渣纤维素微纤丝水凝胶小球表面有些粗糙,大小比5%茶渣纤维素微纤丝水凝胶的小球稍微大一些,颜色也更深,这是含茶渣纤维素微纤丝浓度不同所致。
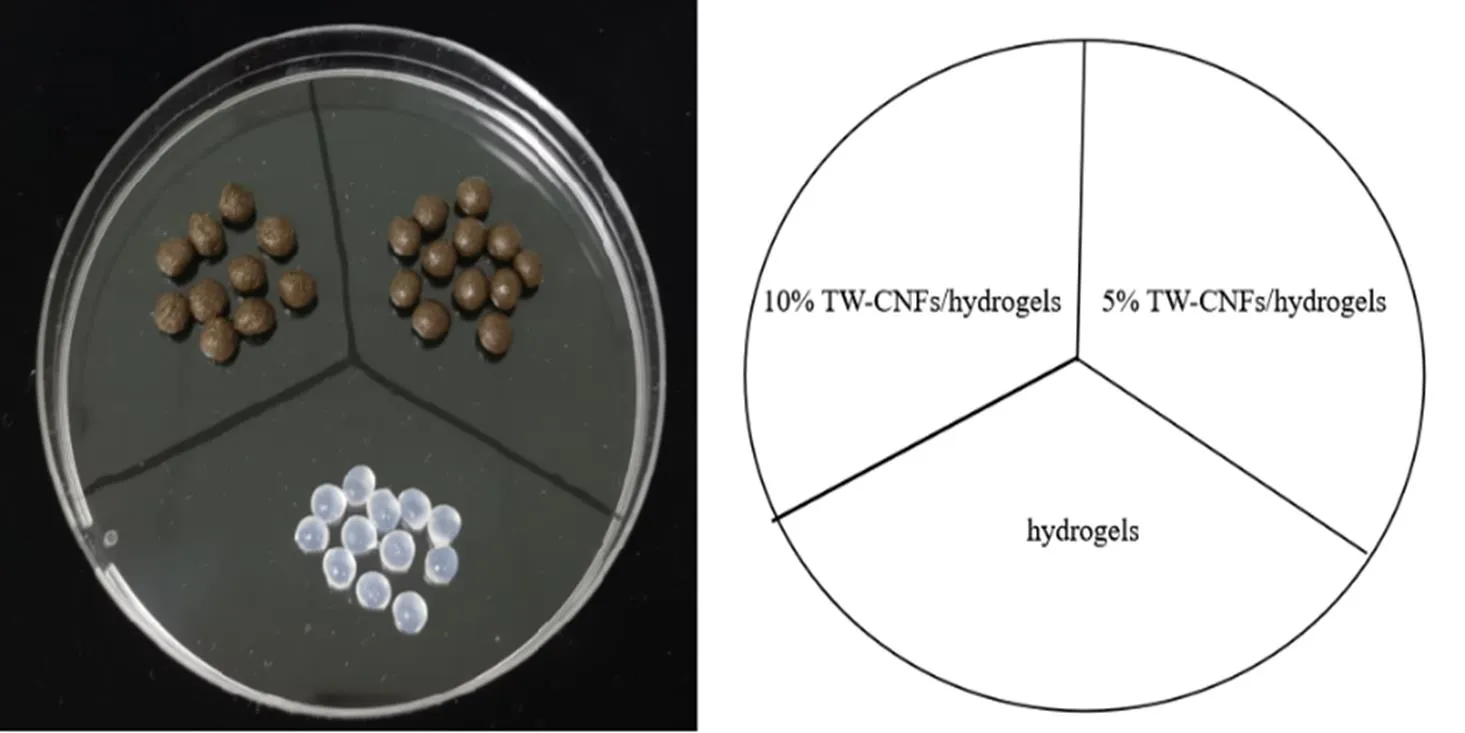
图1 三种水凝胶的外貌图
如图2a~3c分别是粉碎成35目、100目和300目的茶渣纤维素微纤丝的扫描电镜图,可以看出,茶渣纤维素微纤丝表面粗糙,其主体明显呈现颗粒状,含有大量排列的蜂窝形状的大孔结构,而且在空间分布上还带有明显的不规则和聚集堆叠的特性,从结果上来看,这明显增加了茶渣纤维素微纤丝的高表面积。高表面积会增加茶渣纤维素微纤丝载体上官能团的数量,从而提高酶吸附效率。

图2 茶渣纤维素微纤丝的扫描电镜图
2.1.2茶渣纤维素微纤丝水凝胶固定化酶的TEM
为了获得清晰的茶渣纤维素微纤丝水凝胶轮廓,利用透射电镜观察了分散的已固定化酶的茶渣纤维素微纤丝水凝胶。如图3a~3c分别是35目、100目和300目的茶渣纤维素微纤丝固定化酶的透射电子显微镜图。从图3可以看出,茶渣纤维素微纤丝表面有很多凹凸结构,其较大的比表面积和孔隙率,使其具有良好的吸附能力。推测图中箭头所指部分可能是酶和茶渣微粒的聚集体,酶的聚集体牢固地吸附在茶渣纤维素微纤丝的缝隙中,从而提高了酶的稳定性和可重复利用性。

图3 茶渣纤维素微纤丝固定化酶的透射电子显微镜
2.1.3 傅里叶远红外光谱(FT-IR)分析
实验结果如图4,由图4的固定脂肪酶的5%茶渣纤维素微纤丝水凝胶(ROL@5% TW-CNFs/hydrogels)以及固定淀粉酶的5%茶渣纤维素微纤丝水凝胶(AOA@5 % TW-CNFs/hydrogels)的红外光谱图可以看出,在3350 cm-1处有一个较宽的吸收峰可能是纤维素的羟基(-OH)伸缩振动引起的,在2860 cm-1和2990 cm-1处的吸收峰是甲基、亚甲基中C-H的伸缩振动吸收峰,在1640 cm-1处有N=O的振动峰,在1040 cm-1处可能是C-O的伸缩振动峰,这是因为茶渣纤维素微纤丝的分子结构中自身存在(C-2或C-3)的C-O键和伯醇(C-6)的C-O键,这与先前报道的纤维素特征峰分析一致[15]。说明脂肪酶已成功吸附到茶渣纤维素微纤丝水凝胶上了。此外,AOA@5%茶渣纤维素微纤丝水凝胶在1640 cm-1处也有N=O明显的伸缩振动峰,而在游离酶(hydrogels)或已经固定脂肪酶和淀粉酶的水凝胶(ROL/AOA@hydrogels)的红外光谱图中相对应的位置并未见到明显的N=O的振动峰,说明淀粉酶和脂肪酶的氨基与茶渣纤维素微纤丝水凝胶载体表面的羟基通过共价结合了,而水凝胶因为不含有茶渣纤维素微纤丝,表面没有能与酶的氨基共价结合的官能团。
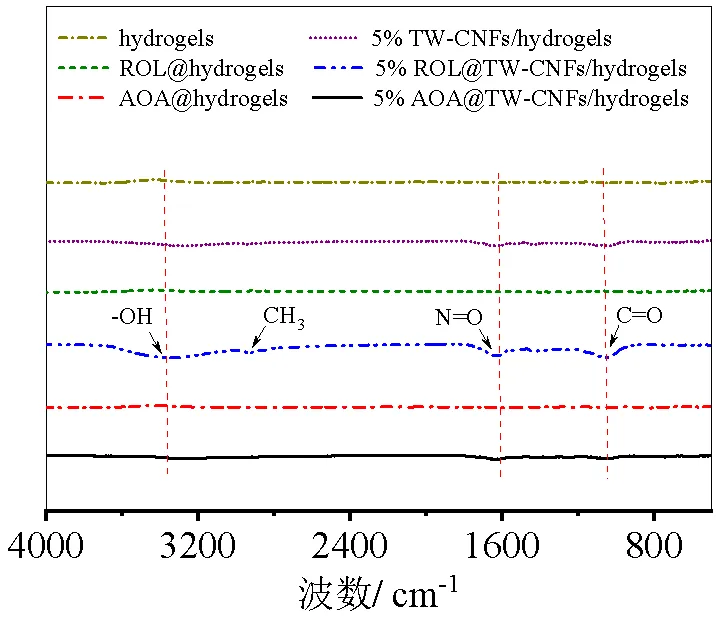
图4 傅里叶红外光谱分析
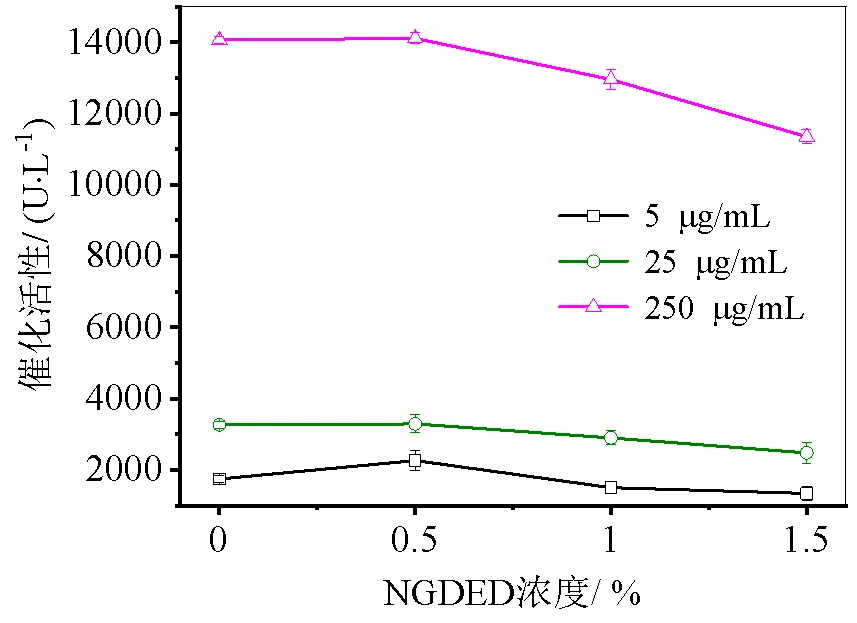
图5 不同新戊二醇二缩水甘油醚浓度交联2%茶渣纤维素微纤丝水凝胶固定化淀粉酶
2.2 固定化酶的条件优化
2.2.1 交联剂浓度对固定化酶酶活的影响
酶与茶渣纤维素微纤丝水凝胶结合是茶渣上的羟基与酶分子表面的氨基结合;利用交联剂结合酶的机制是交联剂新戊二醇二缩水甘油醚的环氧基茶渣纤维素微纤丝水凝胶结合是茶渣上的羟基结合,然后新戊二醇二缩水甘油醚的羟基再与酶分子的氨基结合,形成稳定的化学键。以2%茶渣纤维素微纤丝水凝胶固定化淀粉酶为例,分别用不同浓度的交联剂双环氧试剂新戊二醇二缩水甘油醚(0.5%、1%、1.5%)先交联载体2%茶渣纤维素微纤丝水凝胶,得到的交联载体再固定化淀粉酶,然后探讨交联剂浓度对固定化酶酶活的影响。实验结果如图5所示,随着交联剂的浓度提高,其相对应的酶活性越低,即酶活测定结果交联剂浓度1.5%<1%<0.5%,而对照组游离酶的酶活仅次于0.5%的。可以推断造成这样的原因,首先与可能是2%茶渣纤维素微纤丝水凝胶与酶分子的结合位点数量是有限的,所有位点都结合后,酶活性即会达到最大值。酶与新戊二醇二缩水甘油醚结合的位点与水凝胶结合位点相同,当新戊二醇二缩水甘油醚浓度达到0.5%时,新戊二醇二缩水甘油醚与茶渣纤维素微纤丝水凝胶上所有位点都结合,所以实验结果表明两组酶活基本相同。然而随着新戊二醇二缩水甘油醚浓度的增大,酶活性降低。推测原因可能是过高的交联剂浓度会度会阻断茶渣纤维素微纤丝水凝胶表面的结合位点,甚至会破坏酶的活性中心,致使酶失活变性[16]。而没有交联剂的酶活和0.5%交联剂浓度的酶活差不多,因此,考虑到交联剂会一定的有毒性及会降低固定化酶的酶活,后续实验采用无添加交联剂进行固定化。
2.2.2 不同茶渣纤维素微纤丝浓度对固定化酶的影响
以固定淀粉酶为例,分别用不同淀粉酶浓度(5、25、250 μg/mL)固定在含不同浓度的茶渣纤维素微纤丝水凝胶表面上,探讨不同茶渣纤维素微纤丝浓度的茶渣纤维素微纤丝水凝胶对固定化酶的影响。得到的实验结果如图6所示,从图6可以看出,随着茶渣纤维素微纤丝的量越高,其相对应的酶活性也越高;此外,已固定茶渣纤维素微纤丝水凝胶的酶活性也会随酶浓度增加而升高。说明随茶渣纤维素微纤丝的浓度增加,其水凝胶表面含的羟基就越多,越容易与酶发生结合,从而使酶活性升高。然而,当茶渣纤维素微纤丝浓度越高时,形成的水凝胶形状会受到一定的牵引力难以形成球状,因此,使用5%已固定酶的茶渣纤维素微纤丝水凝胶和10%已固定酶的茶渣纤维素微纤丝水凝胶进行继续研究。
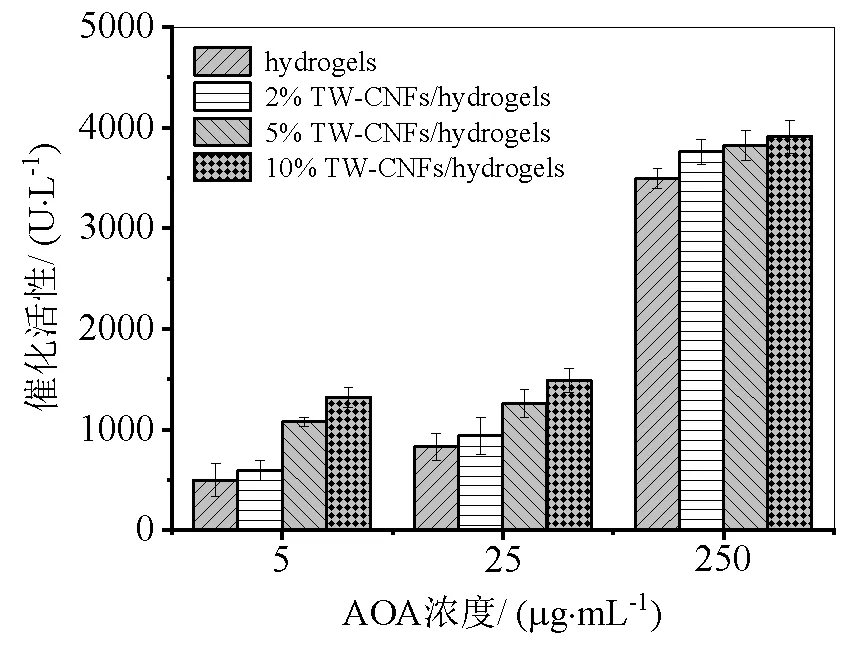
图6 不同茶渣纤维素微纤丝浓度固定化淀粉酶
2.3 茶渣纤维素微纤丝水凝胶固定化酶的酶学性质
2.3.1 茶渣纤维素微纤丝水凝胶固定化酶的最适pH
将游离酶与已经固定脂肪酶和淀粉酶的水凝胶及不同浓度茶渣纤维素微纤丝的已经固定脂肪酶和淀粉酶的茶渣纤维素微纤丝水凝胶置于pH为3、5、7、9、10、11的缓冲液中与底物进行反应,然后测定其酶活。从图7a可以看出,在pH为3~9时,游离脂肪酶的酶活高于已经固定脂肪酶的水凝胶和两种已经固定脂肪酶的茶渣纤维素微纤丝水凝胶的酶活,这可能是由于茶渣纤维素微纤丝水凝胶载体具有高度的pH敏感性,在低pH溶液时茶渣纤维素微纤丝水凝胶载体的网络结构会收缩从而使底物与酶的接触通道关闭,所以酶反应的进行就减慢了[17]。当pH为9时,已经固定脂肪酶的水凝胶和两种已经固定脂肪酶的茶渣纤维素微纤丝水凝胶的酶活与游离脂肪酶的酶活相差不大,而游离脂肪酶的酶活性达到最高值,随后一直降低,说明游离脂肪酶的最适pH为9;而当pH为10时,已经固定脂肪酶的水凝胶和两种已经固定脂肪酶的茶渣纤维素微纤丝水凝胶的酶活性达到最高值,而游离脂肪酶的酶活降至85%左右,且固定化酶的酶活在pH为10~11环境中都始终高于游离脂肪酶,说明茶渣纤维素微纤丝水凝胶固定化脂肪酶可以有效提高其作用pH范围。上述结果与先前报道的结果相似,他们通过调控微晶纤维素颗粒到20~200 nm范围,在有机溶剂中固定脂肪酶,结果表明在pH=10条件下,固定化脂肪酶具有最佳活性,在碱性条件下比可溶性酶更稳定[18]。同样,在图7b中,已经固定淀粉酶的茶渣纤维素微纤丝水凝胶的酶活性的最适pH也都是10,与游离淀粉酶最适pH为5相比,固定化酶的最适pH为10,这大大增加了淀粉酶的最适pH,增强了固定化淀粉酶的耐碱性。然而,游离淀粉酶经过固定后,在pH范围为5~9内的酶活性有一定的波动,而游离淀粉酶的酶活高于已经固定淀粉酶的茶渣纤维素微纤丝水凝胶的酶活,原因可能与上述一样,水凝胶载体的特殊结构在低pH溶液中减慢酶与底物的反应,并且经过有载体的包裹,可以使酶分子的碱敏感度降低。同样,在pH为10以上时,已经固定淀粉酶的茶渣纤维素微纤丝水凝胶的酶活都比游离淀粉酶的高50%以上,说明制备的已经固定淀粉酶的茶渣纤维素微纤丝水凝胶适合在强碱性环境中进行催化反应。这些结果与溶菌酶在细菌纤维素微米纤维(BCNFs)上的物理吸附固定一致,也是导致其最佳pH的增加,说明在纤维素微纤丝上固定化酶可以增加其最适pH,进一步增强酶的耐碱性[19]。
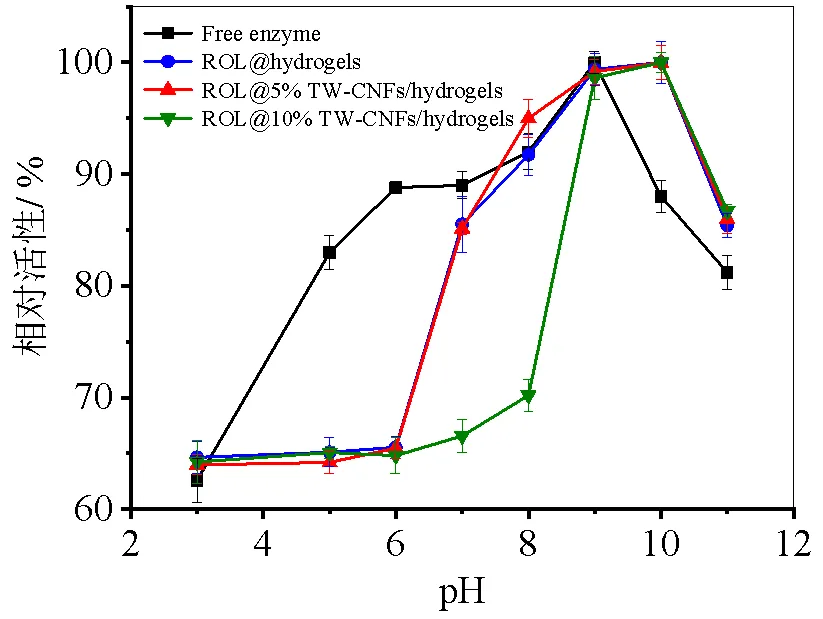
图7 茶渣纤维素微纤丝水凝胶固定化脂肪酶(a)和固定化淀粉酶(b)的最适pH
2.3.2 茶渣纤维素微纤丝水凝胶固定化酶的pH稳定性
将游离酶和已经固定酶的水凝胶及已经固定酶的含不同浓度茶渣纤维素微纤丝的水凝胶置于pH为3、5、7、9、10、11的缓冲液中孵育3小时后与底物进行反应,然后测定其酶活,以未在缓冲液中孵育过已经固定酶的茶渣纤维素微纤丝水凝胶的酶活为初始酶活。从图8a可以看出,不含茶渣纤维素微纤丝的水凝胶及含不同浓度茶渣纤维素微纤丝的水凝胶的pH稳定性明显比游离脂肪酶的好,而已经固定脂肪酶的水凝胶的相对酶活保持在80%左右,无论在酸性还是碱性条件下,被固定化的脂肪酶都比游离脂肪酶的相对酶活高,说明水凝胶和茶渣纤维素微纤丝水凝胶固定化脂肪酶可以有效提高其pH稳定性。
同样,从图8b也可以看到,固定淀粉酶的水凝胶和两种固定淀粉酶的茶渣纤维素微纤丝水凝胶的pH稳定性都比游离淀粉酶的高,而且当pH为10时游离淀粉酶的酶活性都降至20%以下,未含茶渣的固定淀粉酶的水凝胶在pH为9时也急剧下降,且当pH为10已经下降至30%,但固定淀粉酶的茶渣纤维素微纤丝水凝胶仍可以保持在110%以上的酶活力。说明增加了茶渣微米纤维的水凝胶结构可以起到对酶分子的保护作用,而水凝胶载体与淀粉酶之间的相互作用能够增加其pH稳定性。一些研究已经证明在大多数情况下,与游离酶相比,将酶固定在微米有机或微米杂化材料上其pH的稳定性会增加[20]。而纤维素基水凝胶是一种有机微米杂化材料,其特殊的结构对酶固定化的稳定性会显著提高。

图8 茶渣纤维素微纤丝水凝胶固定化脂肪酶(a)和固定化淀粉酶(b)的pH稳定性
3 结论
茶渣纤维素微纤丝水凝胶是一个含有很多无序空隙的球体。为了研究茶渣纤维素微纤丝水凝胶固定化酶的可行性,制成了茶渣纤维素微纤丝含量为5%和10%的水凝胶作为酶的载体。脂肪酶和淀粉酶可以在不存在交联剂的情况下有效连接和固定在茶渣纤维素微纤丝水凝胶上。从实验结果可以明显看出茶渣微米纤维素水凝胶上固定的酶最适pH都向碱性偏移了,说明利用茶渣纤维素微纤丝水凝胶固定化的酶更具有耐碱性,极端环境耐受性有显著性提高;除此之外茶渣纤维素微纤丝水凝胶固定脂肪酶和淀粉酶的pH稳定性和可重复利用性也均有提高。综上所述茶渣纤维素微纤丝水凝胶可以作为一种理想且容易获得的材料应用于固定化酶领域。
[1] 刘智钧. 从茶渣中提取纤维素及其水凝胶的制备、表征及应用[D]. 华南理工大学, 2017.
[2] Liu Z J, Huang H H. Preparation and characterization of cellulose composite hydrogels from tea residue and carbohydrate additives[J]. Carbohydrate Polymers, 2016, 147: 226-233.
[3] 黄惠华, 厉剑剑, 刘丽斌, 等. 一种将茶渣改性制备水凝胶的方法及该水凝胶的应用[M]. 2014.
[4] 刘智钧, 谭展榆, 黄惠华. 不同嫩度茶叶纤维素水凝胶的制备及其表征[J]. 现代食品科技, 2016, 32(4): 166-170.
[5] Bilal M, Rasheed T, Zhao Y P,. Agarose-chitosan hydrogel-immobilized horseradish peroxidase with sustainable bio-catalytic and dye degradation properties[J]. International Journal of Biological Macromolecules, 2019, 124: 742-749.
[6] Jang E, Park S, Park S,. Fabrication of poly(ethylene glycol)-based hydrogels entrapping enzyme-immobilized silica nanoparticles[J]. Polymers for Advanced Technologies, 2010, 21(7): 476-482.
[7] Liu Z J, Li D X, Dai H J,. Preparation and characterization of papain embedded in magnetic cellulose hydrogels prepared from tea residue[J]. Journal of Molecular Liquids, 2017, 232: 449-456.
[8] Mei S, Han P P, Wu H,. One-pot fabrication of chitin-shellac composite microspheres for efficient enzyme immobilization[J]. Journal of Biotechnology, 2018, 266: 1-8.
[9] Mandin S, Moreau S, Talantikite M,. Cellulose nanofibrils/xyloglucan bio-based aerogels with shape recovery[J]. Gels, 2021, 7(1): 13.
[10] Chen J, Luo H, Tao M,. Quantitation of nucleoprotein complexes by UV absorbance and Bradford assay[J]. Biophysics Reports, 2021, 7(06): 429-436.
[11] 李蓓, 李晓晖, 衣杰荣. 对硝基苯酚法对雅致放射毛霉脂肪酶特性的研究[J]. 食品工业科技, 2011, 32(11): 220-222, 263.
[12] 杨泉女, 周权驹, 吴松健, 等. 3,5-二硝基水杨酸法与酶法测定甜玉米还原糖和蔗糖含量的比较[J]. 中国农业科技导报, 2017, 19(11): 125-131.
[13] Liu S L, Wu Q L, Sun X X,. Novel alginate-cellulose nanofiber-poly(vinyl alcohol) hydrogels for carrying and delivering nitrogen, phosphorus and potassium chemicals[J]. International Journal of Biological Macromolecules, 2021, 172: 330-340.
[14] Luo Y X, Jin D, He W J,. A SiO2microcarrier with an opal-like structure for cross-linked enzyme immobilization[J]. Langmuir, 2021, 37(48): 14147-14156.
[15] 欧志华. 纤维素与纤维素醚的傅里叶变换红外光谱比较[C]// 纤维素与纤维素醚的傅里叶变换红外光谱比较. 第七届全国商品砂浆学术交流会(7th NCCM), 中国硅酸盐学会房屋建筑材料分会、中国建筑学会建筑材料分会、中国硅酸盐学会水泥分会, 中国广东广州. 85-92.
[16] Titoiu A M, Necula-Petrareanu G, Visinescu D,. Flow injection enzymatic biosensor for aldehydes based on a Meldola blue-Ni complex electrochemical mediator[J]. Microchimica Acta, 2020, 187(10): 12.
[17] Trachsel L, Johnbosco C, Lang T,. Double-network hydrogels including enzymatically crosslinked poly-(2-alkyl-2-oxazoline)s for 3D bioprinting of cartilage-engineering constructs[J]. Biomacromolecules, 2019, 20(12): 4502-4511.
[18] Yang Y X, Zhao M, Yao P P,. Comparative studies on enzyme activity of immobilized horseradish peroxidase in silica nanomaterials with three different shapes and methoxychlor degradation of vesicle-like mesoporous SiO2as carrier[J]. Journal of Nanoscience and Nanotechnology, 2018, 18(4): 2971-2978.
[19] Tamborini L, Previtali C, Annunziata F,. An enzymatic flow-based preparative route to vidarabine[J]. Molecules, 2020, 25(5): 11.
[20] Gan J S, Bagheri A R, Aramesh N,. Covalent organic frameworks as emerging host platforms for enzyme immobilization and robust biocatalysis - A review[J]. International Journal of Biological Macromolecules, 2021, 167: 502-515.
Study of Tea Waste Nanofibrils Cellulose Hydrogel for Enzyme Immobilization
JIN Dou, LUO Yi-xian, GU Su-yi, HUANG Jian-zhong, QI Feng*
(1. National and Local Joint Engineering Research Center for Industrial Microbial Fermentation Technology, College of Life Science, Fujian Normal University, Fuzhou 350117, China;2. Fujian Provincial Key Laboratory of Cell Stress Response and Metabolic Regulation, Fujian Normal University,Fuzhou 350108, China)
Tea waste cellulose nanofibrils hydrogels (TW-CNFs/ Hydrogels) were pre-constructed by various mesh sizes of tea waste and then utilized them as nanofibrils for immobilize Rhizopus oryzae’s lipase (ROL) and Aspergillus oryzae’s α-amylases (AOA). To characterize the lipase, amylase and the carrier, we utilize the scanning electron microscope (SEM) and Fourier transform infrared (FT-IR) for morpheological analysis. The results showed that: There is a large number of honeycomb pores on the surface of the tea waste cellulose nanofibrils. Whentea waste cellulose nanofibrils hydrogels is aggregated, the spatial distribution of tea waste cellulose nanofibrils hydrogel had obvious characteristics with irregularity and stacking and the enzyme is dispersed and fixed in each and stacking space. The higher the concentration of tea residue from the carrier, the higher the enzyme activity of the prepared tea waste cellulose nanofibrils hydrogel immobilized. When pH was 10, the activity of fixed lipase reached the highest value, while the activity of free ratios decreased by about 85%. At pH 10, the enzymatic activity of fixed amylase was more than 50% higher than that of free amylase. Compared with the free enzyme, the optimal pH of the enzyme fixed on the tea waste cellulose nanofibrils hydrogel shifted to alkaline, indicating that the immobilized enzyme was more alkaline resistant and the pH stability and extreme environmental tolerance were improved significantly.
immobilized enzyme; tea waste cellulose nanofibril; hydrogel; Rhizopus oryzae’s lipase; Aspergillus oryzae’s α-amylases
1004-8405(2022)03-0011-10
10.16561/j.cnki.xws.2022.03.06
2022-08-30
国家自然科学基金项目(32272287)。
晋 豆(1996~),女,硕士;研究方向:生物材料工程。
通讯作者:祁峰(1980~),男,教授;研究方向:主要研究方向为代谢工程和生物材料工程。f.qi@fjnu.edu.cn
Q814.2
A
