机械—酶消化法制备大鼠膈肌单细胞悬液的最佳消化酶浓度组合筛选
2022-09-21何杰王宁张杉杉刘青铃周舟陈谡吴学东
何杰,王宁,张杉杉,刘青铃,周舟,陈谡,吴学东
1 攀枝花学院附属医院普外科,四川攀枝花 617000;2 大理大学第一附属医院小儿外科
膈肌是身体最主要的呼吸肌,在正常潮式呼吸中,大约80%的呼吸工作由膈肌完成。除参与呼吸运动外,膈肌还可以通过调节腹内压参与调节姿势稳定性;膈肌收缩引起腹压增加,有助于排尿、排便和分娩;膈肌还与血液循环系统以及淋巴液的回流相关[1]。因此,从细胞和亚细胞角度研究作为基本功能单位的膈肌细胞的变化,对揭示膈肌的作用及其机制具有重要意义。流式细胞术可以对组织细胞及亚细胞结构进行分析,制备高质量的单细胞悬液是流式细胞术研究的前提。组织分离、酶解和机械解离是使细胞外基质降解和单细胞分离的三个重要步骤,常用的方法是机械法和机械—酶消化法。机械法适用于一些质地较嫩的组织,如肝脏、脾脏等,这些组织质地松软,易于研磨和碾碎,通过机械法即可获得较为满意的效果。机械—酶消化法是将实体组织剪碎,再根据不同组织选用相应的消化酶,制成单细胞悬液。我们的前期研究显示,采用机械—酶消化法制备的大鼠膈肌单细胞悬液优于单纯的机械法或酶消化法[2-3]。2019 年 6 月—2020 年 6 月,本研究在此基础上,探索机械—酶消化法制备大鼠膈肌单细胞悬液的最适宜的消化酶浓度,旨在为研究膈肌获得更优质的单细胞悬液。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康成年SD大鼠6只,购自成都达硕实验动物有限公司,4~5 周龄,体质量80~130 g,雌雄兼用。本实验通过大理大学伦理委员会审查。
1.1.2 主要试剂 胰蛋白酶、胶原酶Ⅰ型、胶原酶Ⅳ型以及胎牛血清(FBS)、台盼蓝均购自Sigma 公司;磷酸盐缓冲液(PBS)购于Hyclone 公司;流式抗体鼠抗CD11b PE(120030-83)和细胞染色缓冲液(Staining Buffe)购于eBoscience Inc;10%水合氯醛溶液由大理大学第一附属医院制剂室提供。
1.1.3 主要仪器 恒温水浴锅(上海圣科仪器设备有限公司);台式离心机(美国贝克曼库尔特);流式细胞仪(美国BD公司);普通光学显微镜(厦门Motic公司);细胞计数板(上海精密仪器公司)。
1.2 消化酶浓度的组合 将胰蛋白酶稀释为0.125%、0.250%、0.375%、0.500%、0.625%,胶原酶Ⅰ型稀释为0.050%、0.100%、0.150%、0.200%、0.250%,胶原酶Ⅳ型稀释为0.050%、0.100%、0.150%、0.200%、0.250%。将三种消化酶按照从低浓度到高浓度依次组合为五个浓度组,即:胰蛋白酶0.125%+胶原酶Ⅰ0.050%+胶原酶Ⅳ0.050%、胰蛋白酶0.250%+胶原酶Ⅰ0.100%+胶原酶Ⅳ0.100%、胰蛋白酶0.375%+胶原酶Ⅰ0.150%+胶原酶Ⅳ0.150%、胰蛋白酶0.500%+胶原酶Ⅰ0.200%+胶原酶Ⅳ0.200%、胰蛋白酶0.625%+胶原酶Ⅰ0.250%+胶原酶Ⅳ0.250%。三种消化酶各0.27 mL,组合成0.81 mL的混合液。
1.3 大鼠膈肌单细胞悬液的制备 采用机械—酶消化法。大鼠腹腔注射10%水合氯醛溶液麻醉,切开胸部和腹部,暴露并迅速完整取出膈肌,放入预冷的平皿中,PBS液反复冲洗。用眼科剪将所得大鼠膈肌剪为糊状,分成12份,A、B、C、D、E组及对照组各2份。A~E组各取0.1 g膈肌组织,装入含有不同浓度组合消化酶的EP 管,对照组加入等量PBS 溶液。37 ℃恒温水浴锅消化30 min,期间每隔5 min 吹打1 次。用200目滤网滤至离心管中,1 000 r/min离心5 min,弃上清,加入等量PBS震荡,漂洗2次,再离心、弃上清。加入等体积2%FBS 终止消化。每组最终获得0.5 mL单细胞悬液,放入4 ℃冰箱保存待检。
1.4 单细胞悬液中细胞计数方法 取膈肌单细胞悬液,按1∶1 的比例加入台盼蓝混匀,静置2 min。滴入细胞计数板,显微镜下观察细胞形态、杂质,计数每个小方格的活细胞、死细胞和细胞团块数目,以活细胞数/(活细胞数+死细胞数)×100%计算细胞存活率。
1.5 单细胞悬液质量评价 采用流式细胞术。选用流式抗体Anti-Rat CD11b PE 荧光染色标记样品中的中性粒细胞。将单细胞悬液加入5 mL 的BD 流式管,FBS 漂洗,1 200 r/min 离心 5 min,重复 1 次。加入2µL 鼠抗CD11b PE 抗体原液,震荡混匀,常温下避光孵育30 min。加入1 mL 含3%FBS 的细胞染色缓冲液,1 200 r/min离心5 min,洗去多余的抗体。加入400 µL 含3% FBS 的细胞染色缓冲液重悬,置4 ℃冰箱待检。应用Cell Quest 软件自动获取每组3×105个细胞,ModFit LT 软件进行图像分析。分析前侧相散点图,设门圈定后,计算荧光标记的CD11b阳性细胞数占活细胞总数的百分比,获得中性粒细胞在活细胞中的标记率。当细胞总量恒定,荧光标记的CD11b 阳性细胞数所占的比值越高,代表单细胞悬液的质量越好。
1.6 统计学方法 采用SPSS25.0 统计软件。计量资料以表示,经方差齐性检验显著性均大于0.05,故采用两样本均数比较的t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组单细胞悬液中细胞计数结果比较 见表1。A~E 组获得活细胞数量最多的是B 组,最少是E 组;死细胞数最少的是C 组,最多是B 组;细胞团块 C 组最少,E 组最多;存活率 C 组最高,E 组最低;单细胞悬液浓度B 组最高,E 组最低;A~E组获得的活细胞数均高于对照组,其中B 组和C组活细胞数量和单细胞悬液浓度高于其他各组(P均<0.05)。
表1 各组细胞计数结果比较()
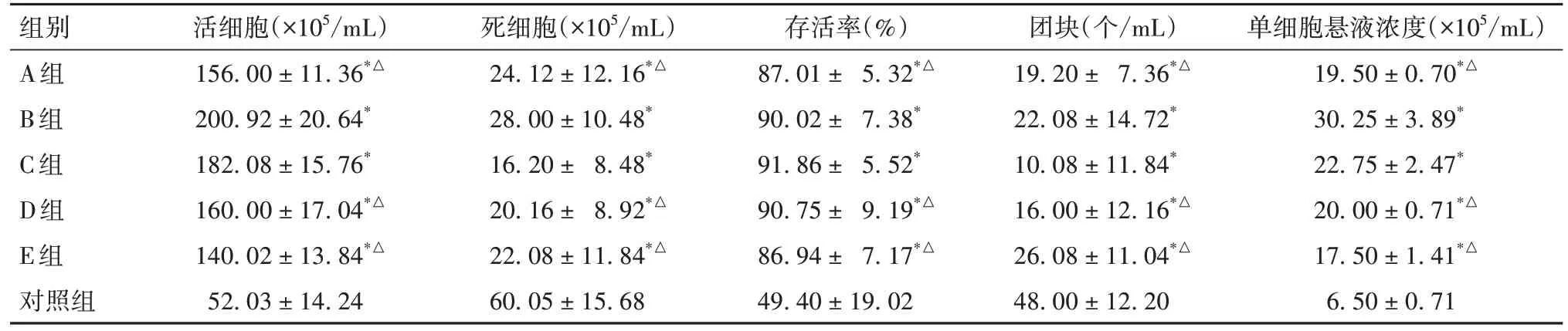
表1 各组细胞计数结果比较()
注:与对照组比较,*P<0.05;与B、C组比较,△P<0.05。
组别A组B组C组D组E组对照组单细胞悬液浓度(×105/mL)19.50±0.70*△30.25±3.89*22.75±2.47*20.00±0.71*△17.50±1.41*△6.50±0.71活细胞(×105/mL)156.00±11.36*△200.92±20.64*182.08±15.76*160.00±17.04*△140.02±13.84*△52.03±14.24死细胞(×105/mL)24.12±12.16*△28.00±10.48*16.20± 8.48*20.16 ± 8.92*△22.08±11.84*△60.05±15.68存活率(%)87.01 ± 5.32*△90.02± 7.38*91.86± 5.52*90.75 ± 9.19*△86.94 ± 7.17*△49.40±19.02团块(个/mL)19.20 ± 7.36*△22.08±14.72*10.08±11.84*16.00±12.16*△26.08±11.04*△48.00±12.20
2.2 各组单细胞悬液质量比较 见表2。C 组D11b 阳性的中性粒细胞数、CD11b 阳性细胞占活细胞的百分比均高于其他各组(P均<0.05)。
表2 各组被抗体CD11b标记细胞结果比较()

表2 各组被抗体CD11b标记细胞结果比较()
注:与对照组比较,*P<0.05;与C组比较,△P<0.05。
组别A组B组C组D组E组对照组CD11b阳性细胞占活细胞百分比(%)11.48±2.52*△14.98±2.16*△29.95±3.47*19.02±2.85*△15.85±0.38*△2.03±0.86 D11b阳性细胞(×103/mL)2.54±1.34*△3.67±1.43*△5.72±2.52*4.18±1.74*△3.38±0.94*△0.54±0.17
3 讨论
膈肌功能与许多疾病的发生和发展相关联,并且随着不同的疾病而改变,但具体的机制尚未完全阐明[4-6]。细胞作为器官功能的基本结构单位,从细胞及亚细胞结构层面进行研究对揭示呼吸系统疾病发生时膈肌功能变化或膈肌的变化与呼吸系统疾病的关系将是关键的步骤,制备优质的膈肌大鼠单细胞悬液是前提[7-9]。根据需要研究的组织,单细胞悬液的制备方法各有不同,但多采用机械法或酶消化法,也有利用机械法结合酶法进行消化的。膈肌属于骨骼肌,用单纯机械法或单纯用酶法制备膈肌单细胞悬液均难以获得理想的结果,课题组前期利用机械法结合酶法成功制备了膈肌组织单细胞悬液,而且通过探索发现,机械法结合酶法进行消化比用单纯的机械法或酶法获得单细胞悬液的质量较高,但如何获得优质的膈肌单细胞悬液仍需要进一步探索。研究显示,不同酶浓度消化组织获得的单细胞悬液质量是不一样的[10-14],低浓度不利于组织的充分消化,而酶浓度过高将会破坏细胞表面的抗原,均无法获得优质的单细胞悬液[15-16]。
作为骨骼肌的膈肌,通过机械剪碎和酶的消化,难以获得大量完整的肌细胞单细胞悬液,但已知膈肌是对缺氧最为敏感的器官,缺氧与炎症反应相关联和炎症能导致器官结构与功能的变化,中性粒细胞浸润程度体现炎症反应的程度。当炎症因子刺激时,中性粒细胞表面的CD11b 活化,在成熟的中性粒细胞表面可以大量表达CD11b[17-18],通过标记CD11b 可以检测膈肌中性粒细胞的数量,进而了解膈肌的状态,也可以评价单细胞悬液的质量。因此,本研究在前期工作基础上,结合机械法和酶法并利用不同酶浓度组合对膈肌组织进行消化,探索获得高质量膈肌单细胞悬液的最适宜酶浓度。
本研究利用新鲜膈肌组织,采用机械剪碎并用不同浓度的多种酶组合进行消化制备单细胞悬液,在光镜下计数悬液中的活细胞数、死细胞数、细胞存活率、细胞团块和单细胞悬液的浓度,当酶浓度组合为胰蛋白酶0.375%、胶原酶Ⅰ0.150%、胶原酶Ⅳ0.150%和胰蛋白酶0.250%、胶原酶Ⅰ0.100%、胶原酶Ⅳ0.100%时,能获得较高质量的单细胞悬液,悬液中有较多的活细胞数和较高的悬液浓度与细胞存活率,而且悬液中死细胞数和细胞团块均较少。在对以上两种酶浓度组合消化获得的单细胞悬液的进一步研究中,经流式抗体CD11b 标记后用流式细胞术进行检测,以酶浓度组合为胰蛋白酶0.375%、胶原酶Ⅰ0.150%和胶原酶Ⅳ0.150%时被标记的阳性细胞数量最多,细胞标记率最高。因此认为,酶浓度组合为胰蛋白酶0.375%、胶原酶Ⅰ0.150%和胶原酶Ⅳ0.150%是制备膈肌单细胞悬液最适宜的酶浓度。
