升金湖和菜子湖越冬白额雁肠道寄生线虫多样性研究
2022-09-17李清月龚治忠冯佳慧刘刚
李清月, 龚治忠, 冯佳慧, 刘刚
升金湖和菜子湖越冬白额雁肠道寄生线虫多样性研究
李清月, 龚治忠, 冯佳慧, 刘刚*
安徽医科大学生命科学学院, 合肥 230032
肠道寄生虫是鸟类中常见的病原体之一, 可以传播给人类及其他动物, 引起严重的人禽共患病。通过采集菜子湖和升金湖60份越冬白额雁粪便样本, 以肠道寄生线虫特异引物作为标记基因进行高通量测序, 分析两个湖泊越冬白额雁的肠道寄生线虫感染种类、多样性及其群落组成结构。将3299430条reads归属为肠道寄生线虫门, 共定义3249个肠道寄生线虫的OTUs, 鉴定到4个目, 91属和191种; 4个目分别为小杆目(Rhabditida)(62.12 %)、垫刃目(Tylenchida)(32.20%)、疏毛目(Araeolaimida)(3.40%)和单宫目(Monhysterida)(2.27%), 其中小杆目为优势物种。Shannon-wiener指数和Simpson指数显示, 菜子湖越冬白额雁的肠道寄生线虫alpha多样性高于升金湖越冬白额雁, 而差异性不显著, PCA聚类分析表明, 两个湖泊中越冬白额雁肠道寄生线虫群落的组成结构相似。系统发育关系显示, 样品与湖泊匹配度不高, 部分样品分布不均匀。升金湖和菜子湖越冬白额雁的肠道寄生线虫群落群落结构相似, 可能是由于食物来源相似、食性相似、栖息地环境类似等因素引起寄生虫间的交叉传播与感染导致。通过本研究,初步掌握升金湖和菜子湖越冬白额雁的肠道寄生线虫感染现状, 为进一步探讨越冬白额雁的寄生虫流行病学研究积累基础资料。
肠道寄生线虫; 白额雁; 多样性
0 前言
鸟类是许多疾病的宿主和传播媒介, 携带多种病毒、细菌和寄生虫等病原体, 可以传播给其他动物甚至人类, 引起严重的人禽共患病, 由于具有极强的扩散能力和广泛的分布范围, 鸟类为疾病的传播带来了潜在风险[1-3]。肠道寄生虫是鸟类中最常见、对其威胁最为明显的病原体之一, 肠道寄生虫能够增加鸟类种群的死亡率, 降低出生率, 进而调节鸟类的种群数量[1-2,4-6]。野生鸟类在迁徙过程中接触不同生境和中间媒介, 促使寄生虫传染给新的个体, 并传播到新的地区, 使寄生虫的传播途径更加多元化和复杂化。野生鸟类作为寄生虫的传播媒介, 为寄生虫的传播提供了极大的便利, 为跨区域人禽共患病的传播埋下隐患。
研究表明, 雁形目等长距离迁徙的水鸟携带大量球虫、线虫、吸虫和绦虫等肠道寄生虫感染, 其中线虫是鸟类携带的肠道寄生虫中最常见的病原体之一[5,7]。然而, 目前对鸟类肠道寄生线虫的研究仍然落后于其他脊椎动物肠道寄生虫和微生物[8-9]。近年来, 对鸟类肠道寄生虫的研究主要集中在珍稀鸟类如鹤类, 目前有研究发现沙丘鹤()、灰鹤()和白头鹤()易感染艾美尔球虫()、禽蛔虫()、前盲囊线虫(Porrocaecum)、四棱线虫()等肠道寄生虫[5,10]; 黑鹳()感染呵欠鸟凯塞玛吸虫()等寄生虫[11]; 而丹顶鹤()和东方白鹳()则普遍感染棘口吸虫()等寄生虫[12-13]; 也有学者在野生鸿雁()粪便中检出隐孢子虫(), 初步鉴定为贝氏隐孢子虫()[14], 然而人们对肠道寄生线虫的流行病学了解甚少[5,15]。一直以来, 肠道寄生线虫与野生候鸟以及人禽共患病的等公共卫生问题息息相关, 对宿主的健康起着至关重要的作用, 在过去的二十年中, 肠道寄生线虫引起的健康问题如导致人类和动物严重腹泻现象, 已受到世界卫生组织的高度重视[3,16]。
菜子湖(30.75°—30.97°N, 117.00°—117.15°E)和升金湖(30.25°—30.50°N, 116.92°—117.25°E)及其密切相联的江河共同构成的江湖复合湿地生态系统, 蕴藏着丰富的水生资源, 是长江中下游沿江重要的湿地, 也是东亚-澳大利亚迁徙水鸟的重要迁徙停歇地和越冬地[17-18]。季节性的水位变化为大量水鸟提供了充足的活动空间和食物, 其中包括雁形目(Anseriformes)中的小天鹅()、白额雁)、鸿雁()、小白额雁()、豆雁()和灰雁()等常见的越冬迁徙水鸟[17-19]。白额雁作为长距离迁徙的水鸟, 是重要的湿地指示物种(IUCN, 2019), 由于其强大的飞行能力和广泛的地理分布, 在传播寄生虫病、疱疹病毒和禽流感等传染病中扮演重要角色[20-22]。近年来, 随着鸟类肠道寄生虫研究的不断深入, 白额雁肠道寄生线虫已成为公共卫生和鸟类学的重要研究课题[23]。本研究使用高通量技术平台对白额雁肠道线虫进行测序, 由此鉴定菜子湖和升金湖越冬白额雁肠道寄生线虫的感染种类, 并结合生物信息学技术分析两个湖泊之间的肠道线虫的丰富度及其多样性, 揭示白额雁肠道线虫多样性机制, 确定影响白额雁肠道线虫种类组成的驱动因素, 探讨越冬白额雁肠道线虫与外界环境之间的关系, 为更深层次研究越冬白额雁的寄生虫流行病学奠定了一定的基础。
1 材料和方法
1.1 样品的采集与保存
2018年12月, 从菜子湖的梅花大圩村和于家嘴村以及升金湖的杨峨头村和王坝村分别采集越冬白额雁的粪便样本共60份。在采集粪便之前, 用双筒望远镜观察觅食雁群至少1小时, 确定周围没有其他鸟群活动, 或与其他集群有明显的障碍物(如田埂、河沟等)间隔后方能采集, 等到白额雁取食结束后, 根据白额雁留下的足迹或觅食坑, 确定为白额雁觅食地点, 采样时佩戴一次性PE手套, 仔细辨别并采集新鲜粪便样本, 每采集一份更换一次手套, 采集后迅速将样品放入无菌20 mL样品收集管中, 并做好标签, 放于冰上运到实验室后置-80℃超低温冰箱冷冻保存。
1.2 鸟类物种鉴定、DNA提取和PCR 扩增
采用德国 QIAamp Fast DNA Stool Mini Kit 粪便微生物基因组 DNA 提取试剂盒来提取粪便样品中的总DNA, 提取方法严格按照试剂盒说明书的具体操作步骤进行, DNA 提取样品保存在-20℃冰箱中以备后续实验使用。利用线粒体16S rRNA特异性引物进行PCR扩增测序, 根据测序结果确认鸟类为白额雁。
从每个样本中提取50 ng的纯化DNA作为扩增模板, 选择线虫特异引物区作为标记基因进行PCR扩增, 引物序列为A‐NF1(5’-GCC TCC CTC GCG CCA TCA GGG TGG TGC ATG GCC GTT CTT AGT T-3’)和 B-18S r2b(5’-GCC TTG CCA GCC CGC TCA GTA CAA AGG GCA GGG ACG TAA T-3’)。PCR反应条件: 95 ℃预变性10 min, 95 ℃变性30 s, 50 ℃退火30 s, 72 ℃延伸30 s, 40个循环后, 72 ℃延伸10 min, 放于 4 ℃冰箱保存, 随后利用2%(w/v)的Tris-硼酸-EDTA(TBE)琼脂糖凝胶来评估扩增质量。
1.3 Illumina Miseq 测序和数据分析
使用MiniElute PCR纯化试剂盒(Axygen)纯化PCR扩增产物, 并使用Applied Biosystems GeneAmp PCR System 9700进行定量。将PCR产物在Illumina Miseq测序平台进行高通量测序。
基于高通量测序得到Fastq的原始数据, 使用Trimmomatic (version 0.33)软件对这些原始数据进行数据质量控制, 采用滑动窗口法, 过滤其中质量值小于20并且读长小于50 bp的低质量数据, 得到可用于后续分析使用的 clean reads; 通过Flash软件对 clean reads进行拼接组装, 组装时设置overlap参数为200 bp, 以保证拼接序列的质量, 使用QIIME(version 1.9.1)软件对组装结果进行质量筛选, 保证后续分析中用到的基因序列同时满足一下多个标准: 1)序列中不包含缺失, 2)单碱基重复小于8, 3)长度大于200 bp; 为避免嵌合体对后续分析结果的影响, 使用UCHIME (version 4.1)软件去除 clean reads 中的嵌合体数据, 再通过USEARCH (version 7.1 htp:// drive5.com/uparse)将高质量序列以97%的序列相似度为阈值进行OTUs聚类。以上经过多次质量控制的高质量OTU数据均已提交至NCBI (MN114085-MN114092)。
寄生线虫的多样性通过Shannon-wiener指数进行计算, 使用Mothur分析软件, 在97% OTU水平上计算了Rarefaction分析和alpha多样性指数(基于丰度的覆盖率估算Shannon-Wiener和Simpson指数)。稀释性曲线由R v.2.8.1中的vegan工具包完成, 以检测数据的可靠性。运用R语言工具对97% 相似水平的OTU样本进行统计构建Venn图。通过PCA聚类分析两个湖泊的白额雁种群之间寄生虫群落结构的差异, 使用R v.2.8.1中的vegan工具包(版本2.0-2)(R Development Core Team, 2006)绘制热图。统计多个样本中所共有以及独有的OTU数目, 通过层次聚类中的加权组平均法UPGMA构建进化树。
2 结果与分析
2.1 高通量测序结果分析
对60个粪便样品进行特异性进行测序, 进行序列的过滤和修剪后, 共获得3319530条reads, 对得到的序列进行不同分类水平上的鉴定, 其中3299430条reads鉴定为肠道线虫。采用对序列进行随机抽样的方法, 以抽到的序列数与它们所能代表OTU的数目构建稀释性曲线, 稀释性曲线在测序量较少时, 随着测序量的增加OTU的数量会显著增加, 而随着测序量的逐渐增大新增OTU的数量逐渐变缓, 并趋于平坦, 说明测序数据量渐进合理, 本研究中的样品测序数据量达到20000条时, 稀释曲线趋于平坦, 说明本研究中的寄生虫多样性符合实际情况(图1)。所有序列经过聚类后共得到3249个肠道寄生线虫OTU, 每个样本的OTU数目从1 到1408不等(97 %相似), 其中3028个OTU(93.2 %)属于两个湖泊共有, 而其他19个OTU和16个OTU分别隶属于菜子湖和升金湖(图2)。
2.2 肠道寄生线虫的组成
从60个粪便样品中获得的所有序列隶属于4个目, 91属和191种(图3)。通过对两个湖泊越冬白额雁肠道线虫OTU含量构建韦恩图, 在属的水平, 菜子湖和升金湖分别鉴定到84个属和51个属, 占总数的89.6%和63.7%, 其中51个属为两湖共有(56.0%); 而在种的水平, 菜子湖鉴定到171个线虫物种(64.5%), 升金湖鉴定到93个物种(51.4%), 其中87个种为两湖共有(48.1%)。鉴定出线虫的主要目为小杆目(Rhabditida)(62.12 %)、垫刃目(Tylenchida)(32.20%)、疏毛目(Araeolaimida)(3.40%)和单宫目(Monhysterida)(2.27%), 其中小杆目为优势物种(图3)。
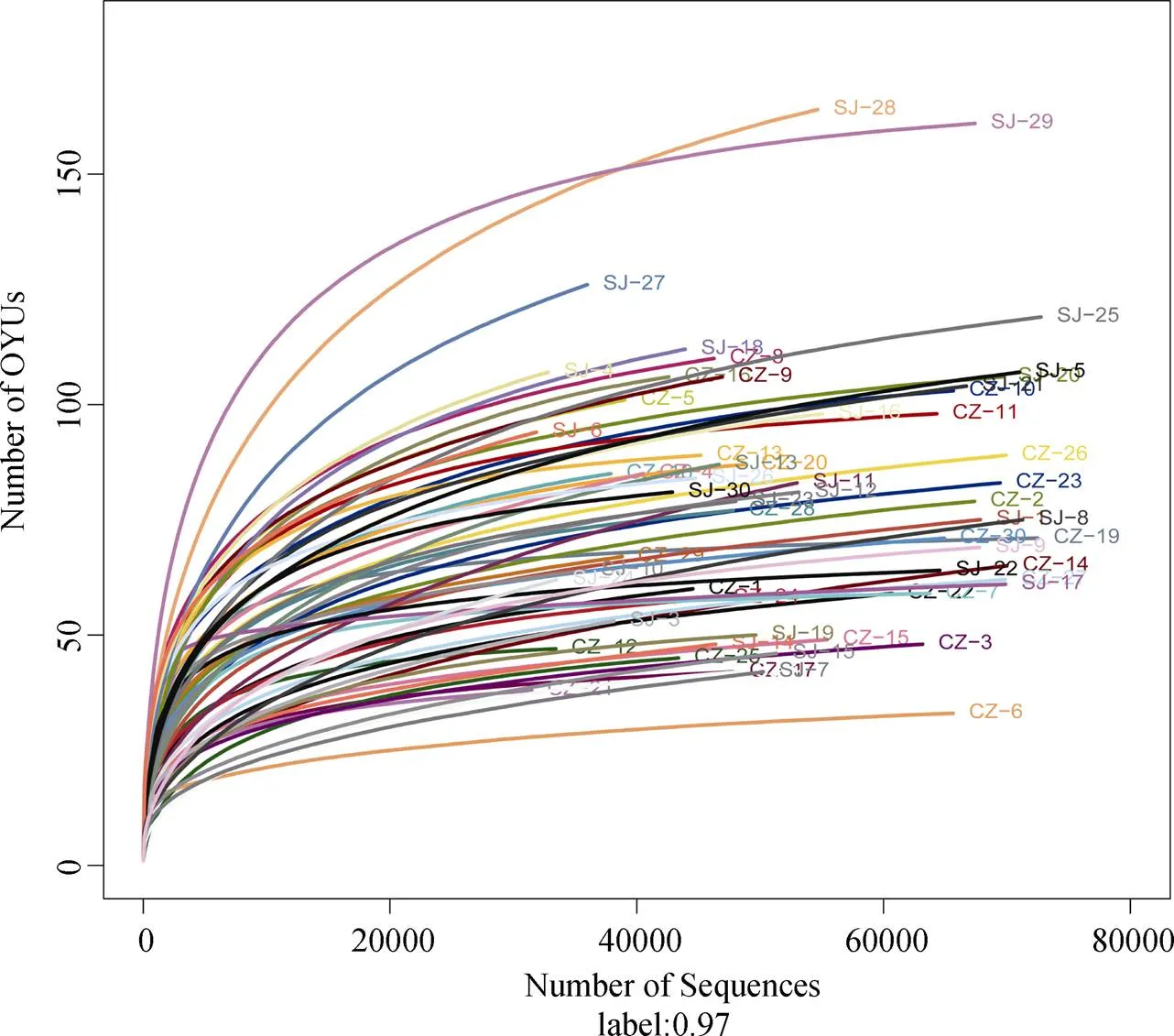
图1 菜子湖(CZ)和升金湖(SJ)越冬白额雁肠道寄生线虫高通量测序的稀释曲线
Figure 1 Intestinal parasitic nematode characteristics between Caizi Lake (CZ)and Shengjin Lake(SJ)
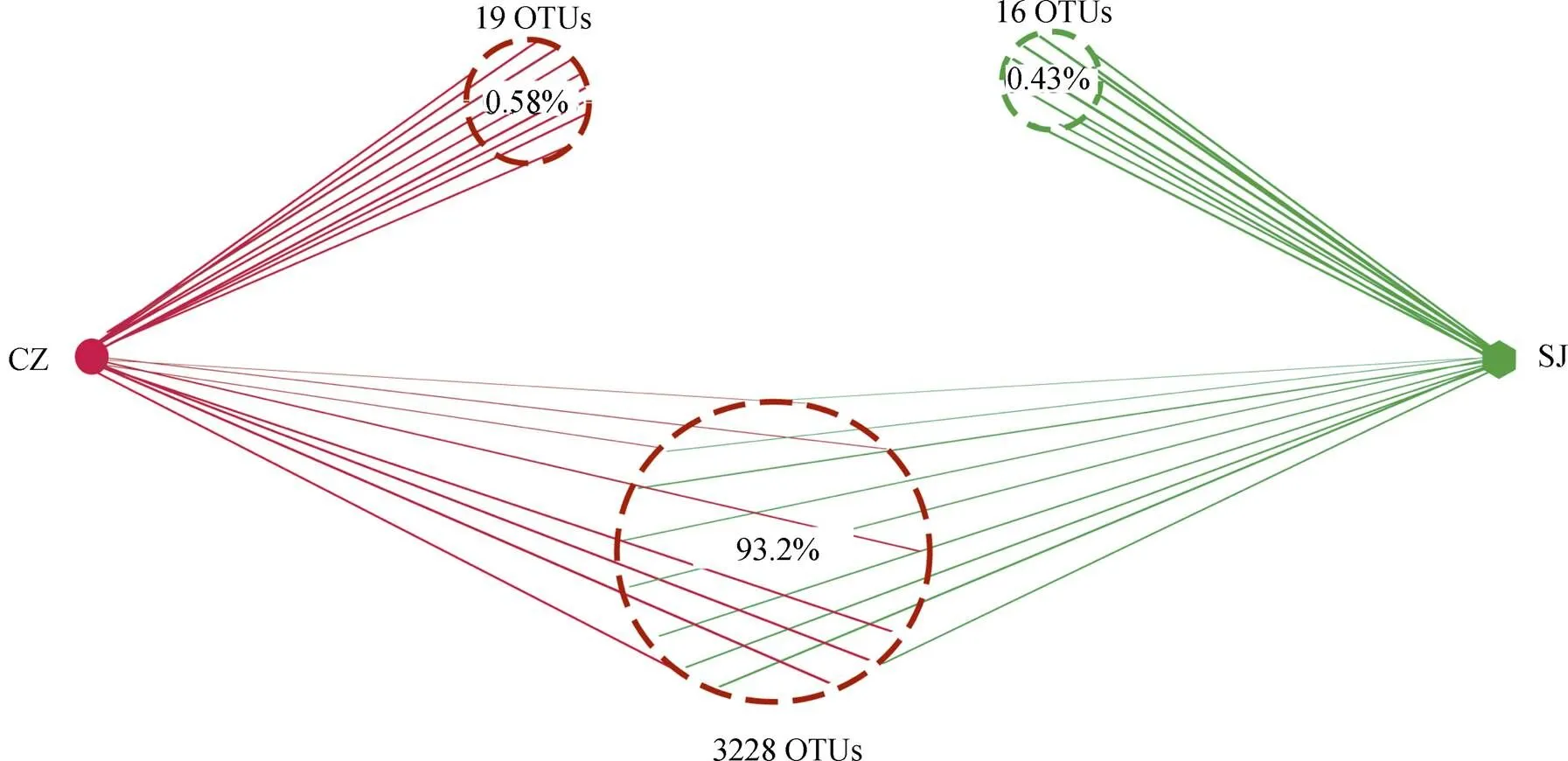
图2 菜子湖(CZ)和升金湖(SJ)白额雁肠道寄生线虫重叠和特异的OTUs
Figure 2 OTU richness for intestinal parasitic nematode from lesser white-fronted geese from CZ and SJ Lakes
2.3 Alpha多样性分析
为进一步了解菜子湖和升金湖越冬白额雁肠道寄生虫丰度和多样性变化, 基于97% 相似度归类的OTU计算60个样品alpha多样性指数, Shannon- wiener指数和Simpson指数的结果表明, 菜子湖和升金湖越冬白额雁肠道寄生线虫的多样性无显著差异(> 0.05; 图5)。
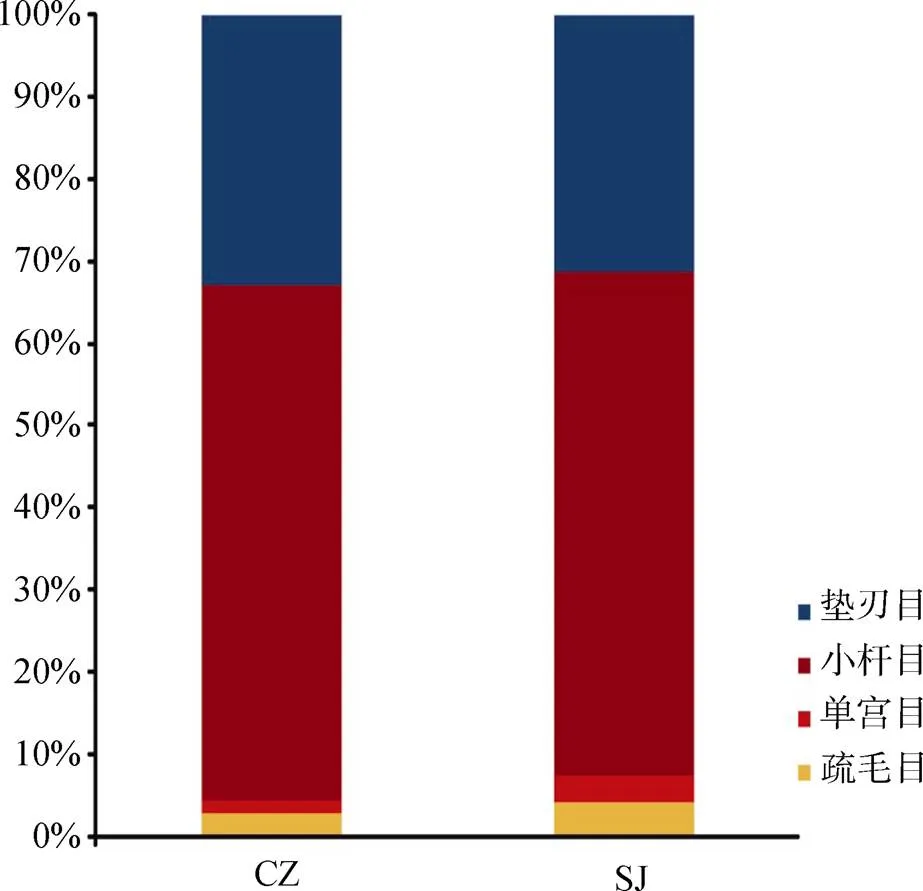
图3 60个白额雁粪便样本中的线虫分布图
Figure 3 Distribution of the 4 main nematode orders found in 60 fecal samples from wintering greater white-fronted geese.
2.4 Beta多样性分析
PCA聚类结果显示, 两个湖泊白额雁肠道寄生线虫的群落组成相似性较高, 部分样本在两个湖泊之间呈现不规则分布状态(图6)。基于群落组成在OTU水平上进行层次聚类分析显示, 系统发育关系分为5大类群, 形成的拓扑结构与菜子湖和升金湖的地理区域匹配度不高(图7)。
3 讨论
寄生虫的感染往往导致宿主免疫力下降、体重减轻, 甚至死亡, 感染较严重的宿主在面临疾病, 捕食者等不利因素影响时极易受到威胁[5,24-25]。白额雁作为一种重要的湿地指示物种, 随着人为干扰和生境的变化, 在迁徙途中, 增加了寄生虫感染的风险, 然而, 相较于其他鸟类, 该物种的肠道寄生线虫更具有代表性[26]。本研究对菜子湖和升金湖越冬白额雁的肠道寄生线虫多样性研究表明, 在本研究两个湖泊越冬白额雁种群中, 最常见的肠道寄生线虫为小杆目(64.62%,=60), 其中包括几种重要的小杆目物种, 例如、、和等。小杆目通常存在于土壤环境、脊椎动物和人类体内, 其中湿地是其主要栖息环境, 生境中丰富的水生动物和水资源为该物种提供了极为丰富的生存资源。此外, 线虫中较为常见的还有蛔虫属(), 主要寄生在家禽与迁徙水鸟体内, 可通过水生环境与周围生境中的物种传播, 能够引起等严重的人禽共患病[27]。先前有研究在白头鹤粪便样品中检测出5种寄生线虫, 分别为毛细线虫(spp.)、类圆线虫(spp.)、禽蛔虫(spp.)、毛圆线虫(spp.)和钩虫(Ancylostomatidae), 其中感染率最高的为禽蛔虫[28], 该属物种也是线虫中较为常见的人禽共患寄生虫病的病原体之一, 在本次研究中也发现了该属物种在菜子湖和升金湖的越冬白额雁种群中广泛分布。经过以上研究的初步统计, 已发现多个严重致病病原体的存在, 其中本研究结果中所发现的和等小杆目物种均极易感染人类, 可能造成人蛔虫病的发生和流行, 人蛔虫病是一种易被忽视的寄生虫疾病, 它是由肠道寄生线虫感染所引起, 全球约有7亿人感染, 成人感染蛔虫病时常出现食欲不振、腹痛, 腹泻、便秘、荨麻疹等症状, 严重时可导致肠道穿孔甚至死亡; 儿童感染时则会出现流涎、磨牙、烦躁不安等, 重者出现营养不良等症状[29-31]。近些年随着人类活动对湿地生态的干扰, 白额雁与人类直接或间接接触的几率大大增高, 两个湖泊湿地附近人类生活区域的公共卫生风险也随之增加。
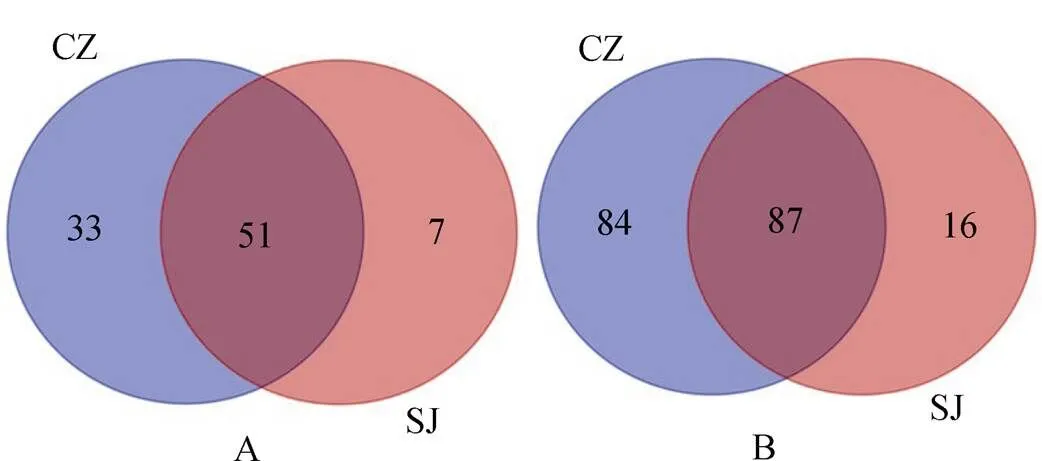
图4 韦恩图显示菜子湖(CZ)和升金湖(SJ)越冬白额雁粪便样品中线虫属水平(A)和种水平(B)的异同
Figure 4 Nematode genus (A) and species (B) compositions from the samples

图5 菜子湖(CZ)和升金湖(SJ)越冬白额雁肠道寄生线虫的Shannon-Wiener指数(左)和Simpson指数(右)
Figure 5 Shannon-Wiener index (left) and Simpson index (right) for the intestinal parasitic nematodes in the wintering greater white-fronted goose fecal samples from CZ lake and SJ lake
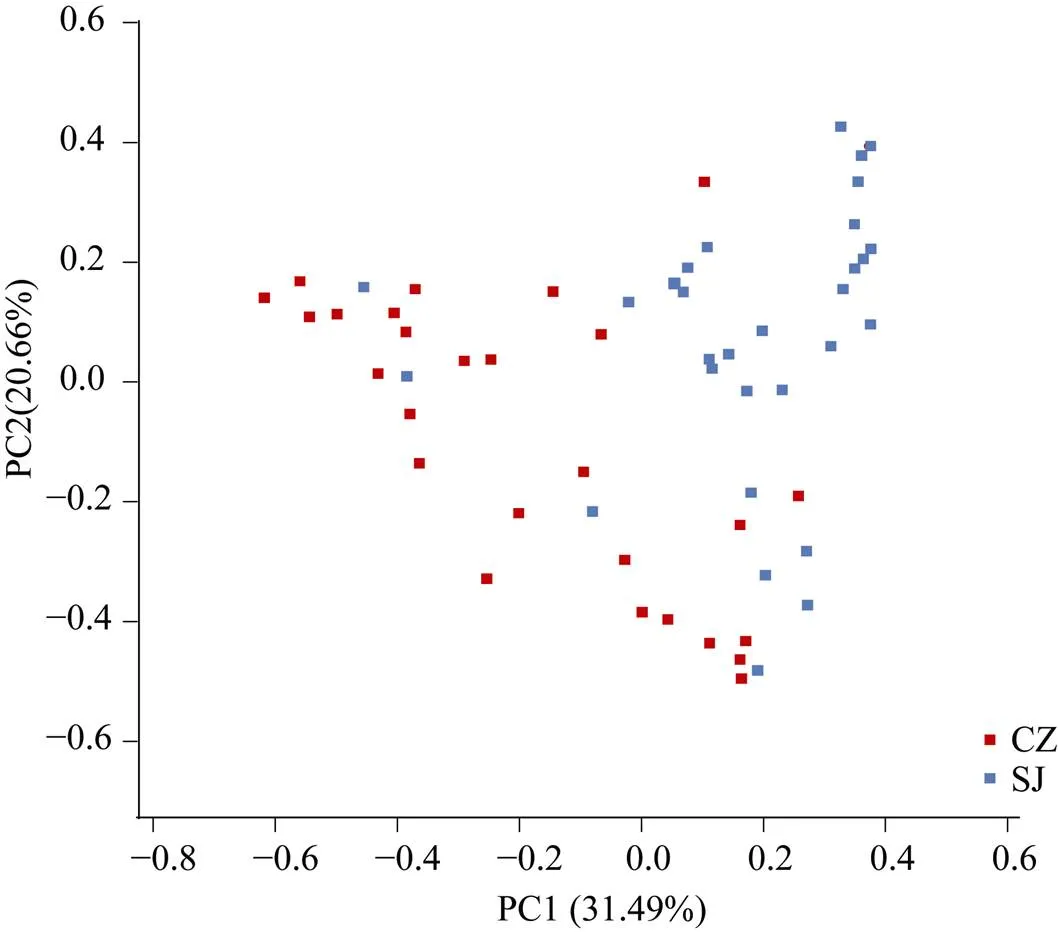
图6 两个湖泊物种基于加权UniFrac的PCA分析(蓝色代表来自升金湖的样本, 红色代表来自菜子湖的样本)
Figure 6 Principal coordinate analysis plot of weighted UniFrac distances for the species sampled from two lake s(Each point represents the gut parasitic nematode community of an individual goose. Blue=greater white-fronted goose from Shengjin Lake; Red=greater white-fronted goose from Caizi Lake)
肠道寄生虫群落具有一定的可塑性, 肠道寄生虫的组成和结构可能会受到遗传因素(宿主本身)的影响, 有研究人员发现, 栖息于鄱阳湖的几种雁体内肠道寄生虫和微生物的差异性显著, 表明了遗传因素确实会影响肠道寄生虫和微生物的组成和结构[26]。本研究通过alpha多样性分析发现, 升金湖和菜子湖越冬白额雁的肠道寄生线虫群落差异性不显著, 说明在两个湖泊之间的越冬白额雁肠道寄生虫之间的群落结构相似, 这与肠道菌群结构有所不同[9], 说明宿主并非白额雁肠道寄生线虫群落结构形成的决定性因素, 可能是由于菜子湖和升金湖为越冬白额雁提供了相似的食物来源。肠道寄生虫的分化受到了这些因素的约束, 因此在两个研究区域间并未产生明显的差异。
过高的种群密度被认为能够增加寄生虫感染的风险, 并且在寄生虫传播中起到关键性作用, 有研究报道称, 日本越冬白头鹤种群球虫感染率高达90% 以上, 而中国长江中下游越冬白头鹤的球虫感染率明显较低, 表明了种群密度在寄生虫传播中起到关键性作用[26]。近些年来, 随着经济发展, 大量原始湿地被不断开垦利用, 人为扰动不断增强, 候鸟越冬湖泊湿地生态过程受到严重干扰, 迫使部分越冬白额雁种群集中在更小的栖息地中, 产生了较高的种群密度, 增加了个体间的接触, 使得白额雁种群面临寄生虫疾病暴发的风险增加。除此之外, 栖息地环境和食性也是影响动物肠道寄生虫多样性的主要因素, 能够影响肠道寄生虫群落的组成结构, 有研究表明, 在同一栖息地中, 宿主间的肠道寄生虫的组成、种类和丰度具有高度相似性[8,26,31]。本研究发现的所有OTUs中, 有93.2%的OTUs是两个湖的白额雁共有的, 菜子湖和升金湖分别仅发现了19个(0.58%)和16个(0.49%)不同的OTUs, 说明两个湖泊的白额雁肠道寄生线虫组成及丰度存在差异, 但在OTU水平的韦恩图(图 4)显示, 两个湖泊白额雁的肠道线虫相似性更高。另外有研究表明, 越冬白额雁肠道中的线虫群落结构可能与从觅食生境(例如稻田和草地)获得的食物有关[26]。随着人类社会经济的发展, 鸟类觅食生境正面临着不断衰退、减少和碎片化的威胁, 菜子湖和升金湖作为浅水内陆湖泊, 环境复杂, 附近不仅有大量的水稻田, 还有植物资源丰富的草滩, 以及冬季枯水期暴露出来的大量的泥滩, 本研究发现两个湖泊中白额雁的越冬食物来源差异不大, 且食性相似, 均以菜子湖和升金湖的稻田和草地为觅食地, 喜食苔草、禾本科植物和双子叶植物等植物。此外, 生态环境因素如宿主对栖息地的利用或者其他资源的可获得性, 也能够影响寄生虫集群的组成[32]。有研究发现, 寄生虫群落组成的相似性往往随着地理距离或环境因素呈负相关[33]。本研究中两个地区寄生虫的感染种类和感染率虽然存在变化, 但其丰富度指数、多样性指数并不具有显著的统计学差异, 相似的多样性系数表明, 大多数物种均存在于两个湖泊, 且一些种类处于较高的优势地位。以上结果表明, 栖息地的环境因素对白额雁肠道线虫群落组成影响不明显, 并不是决定线虫系统发育和群落结构的重要因素, 可能是由于菜子湖与升金湖提供的生态栖息环境相似。
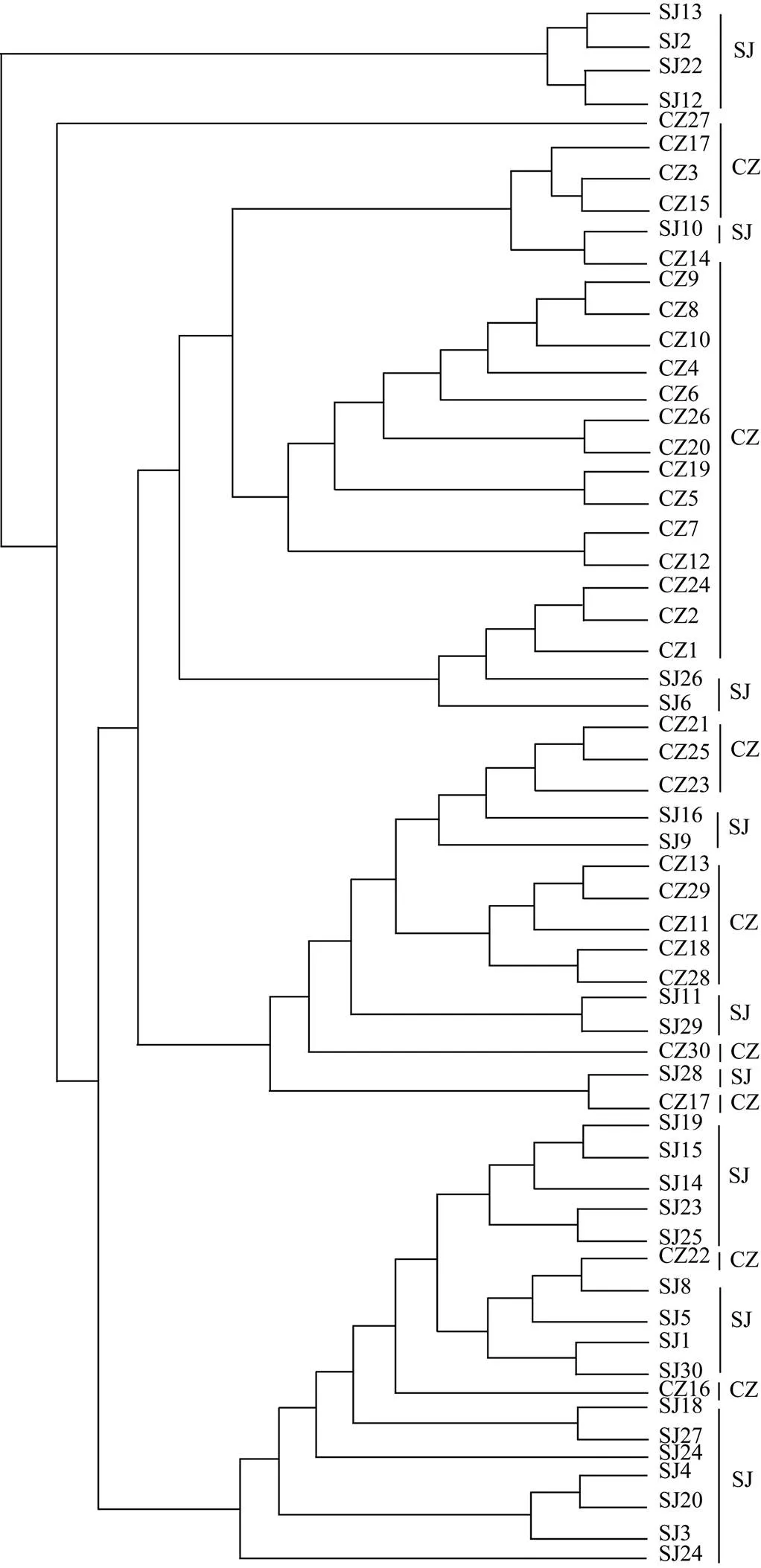
注: 图中CZ与SJ后标数字均为菜子湖与升金湖的粪便样品名称。
Figure 7 Weighted UniFrac tree analysis of the intestinal parasitic nematodes isolated from the wintering greater white-fronted goose fecal samples
生境干扰可能为部分病原体创造适宜的生长环境和传播条件, 从而导致疾病爆发, 因此, 监测寄生虫多样性对于完善湿地管理和公共卫生具有非常重要的研究意义[5]。鉴于两个湖泊中寄生线虫群落结构的相似性以及与白额雁迁徙的限制, 结果表明, 由于相似的湿地环境与食物来源, 寄生虫可能无法被隔离在某一区域内。另外本研究发现了许多潜在的致病性肠道寄生线虫, 例如,和, 其中包括引起哺乳动物和鸟类疾病的几种寄生虫。本研究结果表明, 在菜子湖和升金湖的越冬白额雁种群中, 肠道寄生线虫感染对人和动物更为敏感, 两个湖泊的寄生虫流行极有可能在越冬期发生, 从而引起人类疾病和潜在的公共健康风险。
4 结论
本研究通过对越冬白额雁肠道寄生线虫的特异性区域高通量测序, 分析其感染种类、多样性及其群落组成结构。将3299430条reads归属为肠道寄生线虫门, 共定义3249个肠道寄生线虫的OTUs, 鉴定为4个目, 91属和191种, 分别为疏毛目、单宫目、小杆目和垫刃目, 最常见的是小杆目。结果显示, 菜子湖越冬白额雁的肠道寄生线虫alpha多样性高于升金湖越冬白额雁, 且两个湖泊中白额雁肠道寄生线虫群落的组成结构相似。升金湖和菜子湖越冬白额雁的肠道寄生线虫群落相似性较高, 可能是由于食物来源相似、食性相似、栖息地环境类似等因素导致两个湖泊的越冬白额雁群落结构相似。
[1] RAMEY A, PEARCE J, FLINT P, et alIntercontinental reassortment and genomic variation of low pathogenic avian influenza viruses isolated from northern pintails () in Alaska: examining the evidence through space and time[J]. Virology, 2010, 401: 179–189.
[2] REED C, BRUDEN D, BYRD K K, et alCharacterizing wild bird contact and seropositivity to highly pathogenic avian influenza A (H5N1) virus in Alaskan residents[J]. Influenza and Other Respiratory Viruses, 2014, 8(5): 516–523.
[3] CASALINSA L, MOLINAB M I, GULLOC M W, et al(Nematoda: Diplotriaenidae) causing severe disease in a new host from Argentine Patagonia:(Aves: Picidae)[J]. Parasites and Wildlife, 2019, 8: 106–110.
[4] CHAGAS C R, VALKIŪNAS G, MONTEIRO E F, et alDiversity and distribution of avian malaria and related haemosporidian parasites in captive birdsfrom a Brazilian megalopolis[J]. Malaria journal, 2017, 1716(1): 83.
[5] HUANG Wei, ZHOU Lizhi, ZHAO Niannian. Temporal- spatial patterns of intestinal parasites of the Hooded crane () wintering in lakes of the middle and lower Yangtze River floodplain[J]. Avian Research, 2014, 5(1): 40–48.
[6] LIU Gang, LI Qingyue, WANG Chong, et al. The complete mitochondrial genome offrom the wintering greater white-fronted goose in Shengjin Lake, China, and phylogenetic relationships amongspecies [J]. Parasitology Research, 2019, 118: 1299–1306.
[7] HONMA H, SUYAMA Y, WATANABE Y, et alAccurate analysis of prevalence of coccidiosis in individually identified wild cranes in inhabiting and migrating populations in Japan[J]. Environmental microbiology, 2011, 13: 2876–2887.
[8] ZHAO Guanghong, DONG Yuanqiu, ZHOU Lizhi, et alThe gut microbiome of hooded cranes () wintering at Shengjin Lake, China [J]. Microbiology Open. 2017, 6: e447.
[9] XIANG Xingjia, ZHANG Fengling, FU Rong, et alSignificant differences in bacterial and potentially pathogenic communities between sympatric hooded crane and greater white-fronted goose[J]. Fronties in Microbiology, 2019, 5(10): 163.
[10] 王荣军, 朱金凤, 张龙现, 等. 郑州动物园鹤球虫感染调查[J]. 河南农业大学学报, 2007, 41(1): 61–63.
[11] 赵世华, 林福德, 常建华, 等. 黑鹳的呵欠鸟凯撒玛吸虫病[J]. 野生动物, 1990, 11(2): 25.
[12] 李清武, 姜建民, 陈明非, 等.丹顶鹤卷棘口吸虫病[J]. 中国兽医杂志, 2004, 40(6): 53.
[13] 车桂翠, 张恩珠, 责亚华. 动物园动物体内寄生虫的调查[J]. 中国兽医杂志, 2000, 26(4): 26.
[14] 孙铭飞. 河南省禽类隐孢子虫种类鉴定及分子种系发育关系研究[D]. 郑州: 河南农业大学, 2005.
[15] FANKE J, WIBBELT G, KRONE O. Mortality factors and diseases in free-ranging Eurasian cranes () in Germany[J]. Journal of Wildlife Diseases, 2011, 47: 627–637.
[16] ATKINSON C T, DUSEK R J, WOODS K L, et alPathogenicity of avian malaria inexperimentally-infected[J]. Journal of Wildlife Diseases, 2000, 36(2): 197–204.
[17] BARTER M, CAO L, CHEN L,et al. Results of a survey for waterbirds in the lower Yangtze floodplain, China, in January-February 2004[J]. Forktail, 2005, 21: 1–7.
[18] CAO Lei, BARTER M, ZHAO Meijuan, et al. A systematic scheme for monitoring waterbird populations at Shengjin Lake, China: methodology and preliminary results[J]. Chinese Birds, 2011, 2: 1–17.
[19] ZHANG Dongmei, ZHOU Lizhi, SONG Yunwei. Effect of water level fluctuations on temporal-spatial patterns of foraging activities by the wintering Hooded Crane ()[J]. Avian Research, 2015, 6:16.
[20] LIU Jinzhen, XIAO Haixia, LEI Fumin, et alHighly pathogenic H5N1 influenza virus infection in migratory birds[J]. Science, 2005, 309: 1206.
[21] OLSEN B, MUNSTER V J, WALLENSTEN A, et alGlobal patterns of influenza a virus in wild birds[J].Science, 2006, 312(5772): 384–388.
[22] GAUTHIER-CLERC M, LEBARBENCHON C, THOMAS F. Recent expansion of highly pathogenic avian influenza H5N1: a critical review [J].Ibis, 2007, 149 (2): 202–214.
[23] DAGLEISH M P, RYAN P G, GIRLING S, et al.Clinical pathology of the critically endangered gough bunting ()[J]. Journal of Comparative Pathology, 2017, 156(2-3): 264–274.
[24] MOWLAVI G R, MASSOUD J, MOBEDI I, et alTetrameres (Tetrameres) grusi (Shumakovich, 1946) (Nematoda: Tetrameridae) in Eurasian cranes () in Central Iran[J]. Journal of Wildlife Diseases, 2006, 42: 397–401.
[25] NOVILLA M N, CARPENTER J W. Pathology and pathogenesis of disseminated visceral coccidiosis in cranes[J]. Avian Pathology, 2004, 33: 275–280.
[26] YANG Yuzhan, DENG Ye, CAO Lei. Characterising the interspecific variations and convergence of gut microbiota in Anseriformes herbivores at wintering areas[J]. Scientific Reports, 2016, 6: 32655.
[27] PIETERSE A, MALAN A P, ROSS J L. Nematodes that associate with terrestrial molluscs as definitive hosts, including(Rhabditida: Rhabditidae) and its development as a biological molluscicide[J]. Journal of Helminthology, 2017, 91(5): 517–527.
[28] 李博. 越冬白头鹤()肠道寄生线虫分子检测方法的建立[D]. 合肥. 安徽大学. 2015.
[29] PULLAN R L, BROOKER S. Ascaris lumbricoides and ascariasis: estimating numbers infected and burden of disease//Holland C. Ascaris the neglected parasite[J]. London: Academic Press, 2013.
[30] 许隆祺, 陈颖丹, 孙凤华, 等. 全国人体重要寄生虫病现状调查报告[J]. 中国寄生虫学与寄生虫病杂志, 2005, 23(5): 14–22.
[31] 尚煜, 汤林华. 儿童土源性线虫感染疾病负担的评价[J]. 中国妇幼保健, 2010, 25(34): 5149–5151.
[32] ECKBURG P, BIK E M, BERNSTEIN C N, et alDiversity of the human intestinal microbial flora[J]. Science, 2005, 308: 1635–1638.
[33] ESCH G, SHOSTAK A W, MARCOGLIESE D J, et alPatterns and processes in helminth parasite communities: an overview[J]. Springer Netherlands, 1990, 1–19.
[34] POULIN R, BLANAR C A, THIELTGES D, et alThe biogeography of parasitism in sticklebacks: distance, habitat differences and the similarity in parasite occurrence and abundance[J]. Ecography, 2011, 34: 540–551.
Intestinal parasitic nematode diversity in communities of Wintering Greater White-Fronted Geese () between Caizi Lake and Shengjin Lake in China
LI Qingyue, Gong Zhizhong, Feng Jiahui, LIU Gang*
School of Life Sciences, Anhui Medical University, Hefei 230032, China
Intestinal parasites are commonly reported in birds, which can spread to other animals including humans, causing serious zoonotic diseases. In this study, 60 fecal samples were collected fromoverwintering at Caizi Lake (CZ) and Shengjin Lake (SJ) in China. High-throughput sequencing was performed from intestinal parasitic nematodes in these samples. We analyzed the species, diversity and community composition of intestinal parasitic nematode infections of white-fronted geese in two lakes. In total, 3299430 valid reads were classified as belonging to intestinal parasitic nematode phyla, with 3249 intestinal parasitic nematode operational taxonomic units. Nearly all reads from the 60 fecal samples were assignable to 4 orders, 91 genera, and 191 species. The four orders were Rhabditida (62.12%), Tylenchida (32.20%), Araeolaimida (3.40%) and Monhysterida (2.27%), with the predominant order being Tylenchida. The Shannon-Wiener and Simpson indices showed that intestinal parasitic Nematode alpha diversity in the wintering greater white-fronted geese from CZ was not significantly higher than that of the geese from SJ (>0.05). Principle component analysis (PCA) showed that the intestinal parasitic nematode community compositions differed nonsignificantly between the guts of the greater white-fronted geese from both lakes. The phylogenetic trees showed that the samples were poorly matched with their lakes, and some samples were irregularly distributed. The intestinal parasitic nematode community composition and diversity among thediffered nonsignificantly between CZ and SJ, suggesting that the hosts were not the crucial factor in shaping the intestinal parasitic nematode structure. This is because CZ and SJ provide the geese with abundant and diverse food sources, similar diets and habitat environment.
intestinal parasitic nematodes;; diversity
10.14108/j.cnki.1008-8873.2022.06.024
Q341
A
1008-8873(2022)06-202-09
2020-10-26;
2020-11-20
国家自然科学基金项目(31702030); 安徽省高校自然科学基金重点项目(KJ2015A002, KJ2021A0246)
李清月(1994—), 女, 江苏连云港人, 硕士, 主要从事进化与分子遗传学研究, E-mail: 1051897431@qq.com
通信作者:刘刚, 男, 博士, 副教授, 主要从事进化与分子遗传学研究, E-mail: liugang8966@163.com
李清月, 龚治忠, 冯佳慧, 等. 升金湖和菜子湖越冬白额雁肠道寄生线虫多样性研究[J]. 生态科学, 2022, 41(6): 202–210.
LI Qingyue, Gong Zhizhong, Feng Jiahui, et al. Intestinal parasitic nematode diversity in communities of Wintering Greater White-Fronted Geese () between Caizi Lake and Shengjin Lake in China[J]. Ecological Science, 2022, 41(6): 202–210.
