电针对坐骨神经慢性压迫损伤大鼠脊髓GRK2及炎症因子表达的影响
2022-09-16吕瑛吴耀持孙懿君张峻峰郑明岳康学智
吕瑛,吴耀持,孙懿君,张峻峰,郑明岳,康学智
(1.上海中医药大学,上海 201203;2.上海交通大学附属第六人民医院,上海 200233;3.上海交通大学医学院附属同仁医院,上海 200336)
坐骨神经痛是临床常见病、多发病,是由多种原因引起的坐骨神经炎症、水肿从而产生沿坐骨神经通路及其所分布区域疼痛的临床症状群,全球患病率1.6%~43.0%[1]。常用的药物缓解方法包括单独口服阿片类药物或非甾体抗炎药物,或两者合用,然而药物治疗可引发不可忽视的副作用[2]。此外,还可以对腰椎间盘患者实施椎间盘切除减压术,但在单次或多次术后,仍有超过10%的人受到慢性顽固性疼痛困扰[3]。坐骨神经痛漫长的治疗过程会加重个人及家庭的多重压力。因此,寻找毒副作用小且有效的治疗方法极为重要,不但可以提高患者的生活质量,帮助其更好地投入生产工作,还可以减轻家庭和社会的经济负担。
电针可以有效缓解坐骨神经痛,经过长期实践,已在临床中形成一套行之有效的治疗方案,结合导气手法则缓解疼痛效果更强[4],但其作用机制尚待进一步明确。诸多与疼痛相关的递质都通过G蛋白偶联受体(G protein coupled receptors, GPCRs)发挥作用[5]。GPCRs的敏感性提高与痛觉超敏有密切关系[6]。G蛋白偶联受体激酶2(G protein coupled receptor kinase 2, GRK2)能够结合被激活的GPCRs,使GRCRs脱敏从而减少其介导的疼痛过程发生[7]。本动物实验研究采用坐骨神经慢性压迫损伤(chronic constriction injury, CCI)大鼠模型,通过检测各组大鼠不同时间点的机械缩足反射阈值(mechanic withdrawal threshold, MWT)及脊髓GRK2和炎症因子肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-1β(interleukin-1β, IL-1β)、白细胞介素-10(interleukin-10, IL-10)的水平,研究电针对CCI大鼠疼痛的影响及其相关作用机制。
1 材料与方法
1.1 实验动物与分组
健康雄性 SPF级 SD大鼠 25只,1月龄,体质量(220±20)g,购自上海市计划生育科学研究所实验动物经营部,许可证号为SCXK(沪)2018-0006。大鼠饲养于上海市第六人民医院动物实验室,室温(22~24)℃、相对湿度50%~70%、12 h循环照明,正常供水喂食。开展动物实验研究的实验条件及操作技术符合实验动物福利、伦理规范,伦理批件号为DWSY2020-0102。所有大鼠适应性饲养 1周后,随机分为对照组、模型 1组、模型2组、电针组及导气电针组,每组5只。
1.2 主要试剂及仪器
GRK2抗体(ABclonal生物科技有限公司,A4443)、TNF-α抗体(英国Abcam公司,Ab66579)、IL-10抗体(美国 SANTA CRUZ生物科技,SC-365858)、IL-1β抗体(Bioworld生物科技有限公司,BS6067)、β-Actin(美国ProteinTech集团有限公司,66009-1-Ig)、辣根过氧化物酶标记山羊抗兔 IgG(碧云天生物工程有限公司,A0208)、辣根过氧化物酶标记山羊抗小鼠IgG(H+L)(碧云天生物工程有限公司,A0216)、辣根过氧化物酶标记驴抗山羊 IgG(H+L)(碧云天生物工程有限公司,A0181)。Semmes-Weinstein vonFrey BW806型机械刺痛测试包(Stoelting公司,美国)、BW8061型动物测试笼(含支架和金属网)(Stoelting公司,美国)、G6805-1A低频电子脉冲治疗仪(上海华谊医用仪器有限公司,中国)。
1.3 模型制备
除对照组外,其余组大鼠均接受 CCI模型制备[8]。采用 3%的戊巴比妥钠溶液[40 mg/(kg·bw)]对大鼠行腹腔注射麻醉后取俯卧位捆绑。切开大鼠右后肢皮肤,分离肌肉,充分暴露右下肢坐骨神经主干,采用3道结扎法[9],作3个间距1 mm的轻度结扎,结扎强度以引起小腿肌肉轻度颤动为度,注意避免损伤,随后逐层缝合。对照组大鼠予以假手术,仅切开右后肢皮肤,分离肌肉,在找到坐骨神经干后即逐层缝合。术后待大鼠苏醒即放回笼中观察。术后连续3 d予腹腔注射青霉素,每日40万单位/只,防止伤口感染。
1.4 干预方法
造模后3 d导气电针组予以导气针刺法联合电针干预,采用0.25 mm×40 mm一次性无菌针灸针,选择大鼠患侧(右侧)L5~L6夹脊穴(平髂棘,L5~L6间脊椎旁开0.1寸)和环跳穴(俯卧固定,股骨大转子与尾骨、髂骨结合部连线上,外1/3与内2/3的交点)[10-11]进行治疗。进针后用拇、食指夹住针柄小幅度提插捻转,而后中指侧压针身使针身弯曲成弓弩状,将针体向上向前按压行导气针法1 min。后两穴接G6805-1A低频电子脉冲治疗仪,2 Hz,连续波,1 mA。出针前再行导气针法1 min。行针与留针总时长为 20 min,每日1次,连续治疗5 d后休息2 d,共干预14次。电针组进针后不行针,直接接电针留针20 min,电针参数及疗程同导气电针组。
1.5 样本采集
实验过程中无死亡大鼠,样本按照每组 5只采集分析。于干预4 d后处死模型1组,末次干预后处死其余4组。取大鼠L4~L6段脊髓,采用PBS缓冲液冲洗后,纵切平均分为2份,1份用于抽提RNA开展RT-PCR实验,1份用于抽提蛋白进行Western blot实验,均保存于-80 ℃冰箱。
1.6 观察指标
1.6.1 MWT
采用von Frey细丝刺激大鼠后腿,记录回缩时细丝的相应克数,采用 up-and-down法[12]计算大鼠MWT。检测时,用von Frey细丝穿过网格鼠架由下向上刺激大鼠右足中间部位,即L5神经根的足底支配区域,避开感觉迟钝的足垫区域,细丝弯曲略呈“S”状时维持时间6~8 s,使其提供相对恒定的机械力,这个过程视为1次刺激。刺激过程中,大鼠走动或一刺激就抬足被视为可疑阳性,此次结果不算在正常结果内,需等大鼠安静下来后再重新测量。相临两次刺激间隔时间≥6 s以避免前次刺激对本次痛阈测定结果产生影响。阳性结果记为○,阴性结果为记为×。检测以10.0 g细丝为起始测量值,大鼠若没有出现阳性反应,则继续取相邻一级更高强度细丝进行刺激,当在某一强度刺激过程中发生阳性反应时,则继续取相邻低一级的强度进行刺激。以这种方式重复进行,一直到第1次阳性、阴性反应交替出现时视为初始两次反应,出现后再使用相同强度重复测定4次。若检测力度大于60 g或小于2 g,该阈值则记为60 g或2 g。按照阳性反应、阴性反应顺序根据机械缩足痛阈值计算公式为 50%缩足痛阈(paw withdrawal threshold, PWT)=(10Xf+kδ)/10 000计算出阈值。以PWT评价大鼠MWT。
1.6.2 脊髓GRK2 mRNA水平检测
采用RT-PCR检测脊髓GRK2 mRNA水平。取适量脊髓组织,加入 1 mL Trizol溶液进行匀浆,冰上操作,提取RNA。按照37 ℃、60 min;95 ℃、5 min;4 ℃、60 min的反转录程序得到cDNA,加入80 μL无酶水稀释备用,-20 ℃保存。PCR扩增,每个样品做3个重复对照,最终结果使用 2-ΔΔCt相对定量法测定目的基因相对表达量。引物序列见表1。
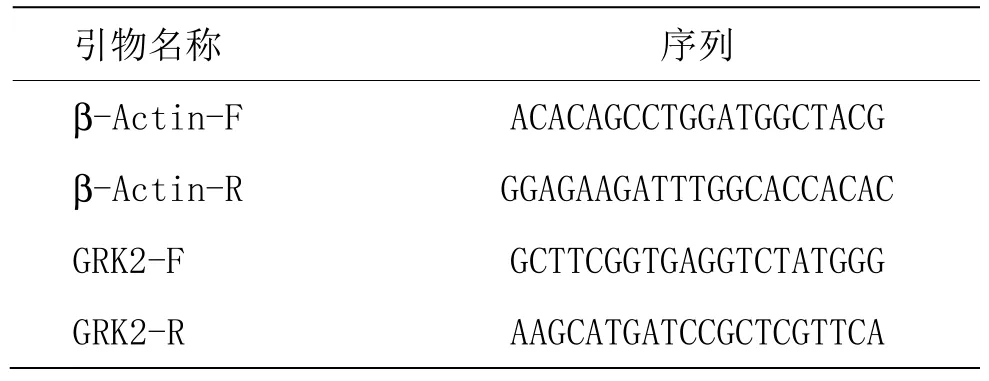
表1 各检测指标引物序列
1.6.3 脊髓GRK2及IL-1β、TNF-α、IL-10蛋白表达水平
采用Western blot法检测脊髓GRK2及IL-1β、TNF-α、IL-10蛋白表达水平。取适量脊髓组织,用冰PBS溶液洗涤3次。取适量RIPA裂解液,在使用前数分钟内加入PMSF溶液,比例为1:100。将组织吹打混匀,在4 ℃冰箱放置20 min左右。充分裂解后,11 000 rpm 4 ℃离心10 min,取上清液。进行蛋白质定量后,首先在80 V恒定电压下电泳至染料接近分离胶顶端。然后120 V恒定电压电泳至溴酚蓝刚出胶底部。350 mA转膜 2 h,以进行免疫检测。封闭时,将膜浸入到封闭液中,室温下振荡 1 h。加入稀释好的一抗抗体,GRK2抗体、IL-1β抗体、TNF-α抗体、IL-10抗体稀释比例均为1:1 000,β-Actin抗体稀释比例为1:10 000,4 ℃过夜。TBST溶液洗膜3次。加入稀释好的二抗抗体,1:1 000稀释,室温1 min振荡孵育。TBST溶液洗膜3次后取出 ECL发光试剂,取发光试剂和过氧化物溶液按1:1混合成发光液。将膜放入荧光化学发光成像仪中,滴加发光液进行曝光。
1.7 统计学分析
采用SPSS23.0软件对数据进行统计学处理。符合正态分布且方差齐的计量资料,用均数±标准差表示。多组间比较采用ANOVA分析,多时间点MWT采用重复测量方差分析。以P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠MWT比较
CCI造模前,各组间 MWT比较差异无统计学意义(P>0.05)。治疗前与对照组比较,模型1组、模型2组、导气电针组及电针组MWT显著下降,差异有统计学意义(P<0.01)。治疗前和治疗4 d后,模型1组与模型 2组 MWT比较差异无统计学意义(P>0.05)。治疗4 d后与对照组比较,模型1组、模型2组MWT显著下降,差异有统计学意义(P<0.05),与模型2组比较,导气电针组MWT显著上调,差异有统计学意义(P<0.05)。治疗 11 d后,与模型 2组比较,导气电针组、电针组MWT显著提高,差异有统计学意义(P<0.01)。末次治疗后,与模型2组比较,导气电针组、电针组MWT显著上调,差异有统计学意义(P<0.01),与电针组比较,导气电针组MWT显著上调,差异有统计学意义(P<0.01)。详见表2。
表2 各组大鼠MWT比较 (±s, g)
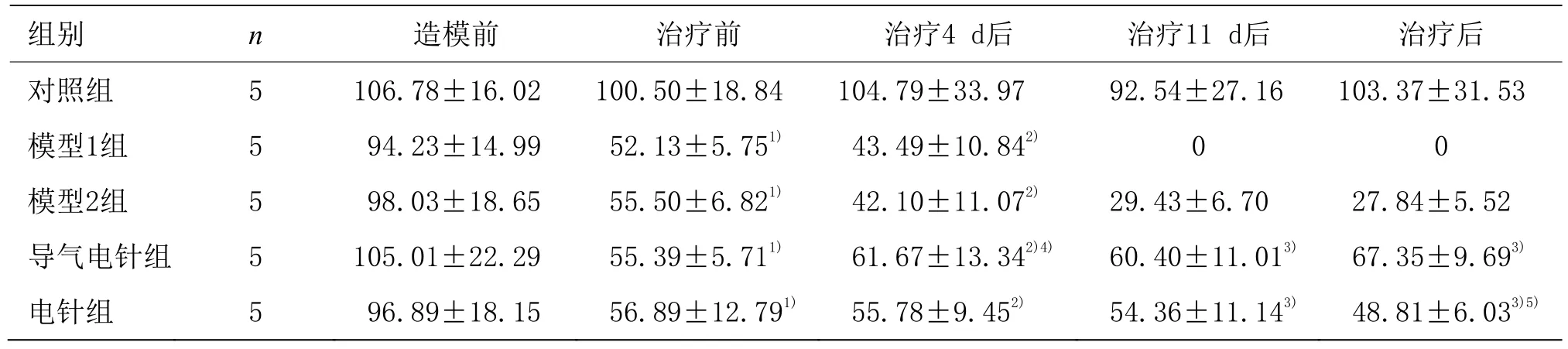
表2 各组大鼠MWT比较 (±s, g)
注:与对照组比较1)P<0.01,2)P<0.05;与模型2组比较3)P<0.01,4)P<0.05;与导气电针组比较5)P<0.01
组别 n 造模前 治疗前 治疗4 d后 治疗11 d后 治疗后对照组 5 106.78±16.02 100.50±18.84 104.79±33.97 92.54±27.16 103.37±31.53模型1组 5 94.23±14.99 52.13±5.751) 43.49±10.842) 0 0模型2组 5 98.03±18.65 55.50±6.821) 42.10±11.072) 29.43±6.70 27.84±5.52导气电针组 5 105.01±22.29 55.39±5.711) 61.67±13.342)4) 60.40±11.013) 67.35±9.693)电针组 5 96.89±18.15 56.89±12.791) 55.78±9.452) 54.36±11.143) 48.81±6.033)5)
2.2 各组大鼠脊髓组织中GRK2 mRNA和蛋白表达水平比较
与对照组比较,模型 1组及模型 2组脊髓GRK2 mRNA和蛋白均显著降低,差异有统计学意义(P<0.05);与模型 2组比较,导气电针组及电针组脊髓GRK2 mRNA和蛋白表达水平均显著上升,差异有统计学意义(P<0.05)。导气电针组与电针组比较差异无统计学意义(P>0.05)。详见图1至图3。

图1 各组大鼠脊髓组织中GRK2 mRNA水平比较

图2 各组大鼠脊髓组织GRK2蛋白条带图

图3 各组大鼠脊髓组织GRK2蛋白表达水平变化
2.3 各组大鼠脊髓组织 IL-1β、TNF-α、IL-10蛋白表达量比较
末次治疗后与对照组比较,模型1组及模型2组脊髓IL-1β、TNF-α蛋白表达显著上升(P<0.05);与模型2组比较,导气电针组及电针组脊髓TNF-α蛋白表达显著下降(P<0.01);与导气电针组比较,电针组脊髓TNF-α蛋白表达显著上升(P<0.01);与模型2组比较,导气电针组脊髓 IL-1β蛋白表达显著下降,差异有统计学意义(P<0.01);与导气电针组比较,电针组脊髓IL-1β蛋白显著上升,差异有统计学意义(P<0.05)。与对照组比较,模型1组及模型2组脊髓IL-10蛋白表达显著下降,差异有统计学意义(P<0.05);与模型 2组比较,导气电针组脊髓IL-10蛋白显著上升,差异有统计学意义(P<0.01);与导气电针组比较,电针组脊髓 IL-10蛋白表达显著降低,差异有统计学意义(P<0.05)。详见图4和图5。
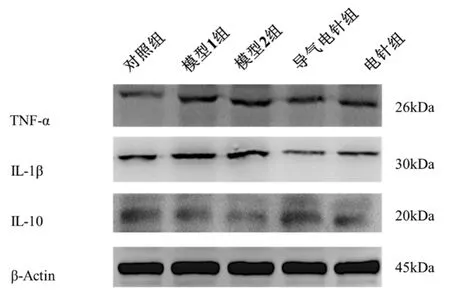
图4 各组大鼠脊髓组织TNF-α、IL-1β、IL-10蛋白条带图

图5 各组大鼠脊髓IL-1β、TNF-α、IL-10蛋白表达量比较
3 讨论
有研究证实在经典4道结扎法制备CCI模型基础上改用3道结扎法,也可以制备出满意的CCI模型,与4道法无显著差异[13],为了尽可能保证影响因素的单一性,本实验选择3道结扎法的CCI模型观察电针对坐骨神经痛的影响。CCI大鼠坐骨神经长时间受压,病情类似梨状肌综合征一类神经受压致痛疾病,辨证为血瘀气滞证,治以疏经通络、活血化瘀。取大鼠患侧平髂棘L5~L6水平的夹脊穴和环跳穴治疗。L5~L6夹脊穴位于腰部,用以缓解局部督脉和膀胱经气血不畅导致的疼痛症状,环跳穴可以疏风解痹、利腰脚痛,是治疗坐骨神经痛的要穴[14]。
导气针法是《内经》主要针法之一,《灵枢·五乱》中提及“徐入徐出,谓之导气”,其目的在于“同精导气”,即分辨逆乱的清浊营卫之气,引其归位,传导气感,扩散疗效。阴阳气机调顺归位则阴阳协同作用,乱气可除病可获愈[15]。本实验采用导气手法以针向行气法为主,欲气上行则针尖向上刺,欲气下行针尖向下刺,然后适度捻转、提插以催气。导气针法以求更快更强烈地“气至病所”,以达到“气速至则病速愈”。以导气针法联合电针治疗腰椎间盘突出症能明显缓解疼痛、麻木、酸胀等临床症状,并且可以使病变部位肌张力得到显著缓解,还能改善腰突症术后患者顽固性腰痛[16-17],对腰腿痛者徐徐导气有助于加快循经感传从而加速止痛[13],石向东等[18]发现导气针法有效缓解了腰突症下肢疼痛,童青等[19]发现在督脉穴位上施以导气针法可以起到温阳益肾、祛风通络、散寒止痛的效果,导气针法对腰腿痛治疗效果明显优于电针治疗。本实验中,行导气针法时观察到大鼠出现强烈的舔舐、转身、尖叫等反应,电针组大鼠此类反应则明显弱化。
以往机制研究发现电针可以影响局部神经性一氧化氮合酶、环氧合酶 2、p38丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)、JAK激酶 2-信号传导及转录激活因子 3(JAK kinase2-signal transduction and transcription activetor 3, JAK2-STAT3)信号通路[20-22]。上述部分炎症因子及信号通路受到上游GRK2调节,其机制是GRK2通过磷酸化胞内丝氨酸和苏氨酸残留致 G蛋白偶联受体(GPCR)与其 G蛋白失去偶联来调节一系列同源 GPCR脱敏[23],此过程促进 GPCR与抑制素结合而后内化[24],失去介导下游多条细胞因子释放通路,如MAPK信号通路、Jak-STAT信号通路,从而起到保护细胞免受过度刺激的作用。通过对模型1组和模型2组变化趋势的观察,发现CCI大鼠造模后3周时间里MWT、GRK2 mRNA和蛋白表达水平、细胞因子 IL-10水平均显著下降,而促炎因子IL-1β和TNF-α水平显著提高,提示炎症和痛敏状态持续,因此介入导气电针疗法是有意义的。TNF-α和 IL-1β是疼痛发生的机制之一[25-26],调节因子IL-10也参与疼痛产生的过程,其功能与IL-1β、TNF-α等拮抗,通过多种机制发挥减缓炎症、促进神经修复的作用[27]。实验结果显示,导气电针和电针治疗方法均可以显著上调大鼠脊髓组织GRK2蛋白表达水平;与电针法比较,导气电针法抑制炎症因子IL-1β、TNF-α水平和降低MWT的效果更好。电针法可以缓解CCI坐骨神经痛和炎症持续的趋势,其机制与电针调节脊髓组织GRK2蛋白表达水平并降低细胞因子 IL-1β、TNF-α水平和提高IL-10水平有关。
PATIAL S等[28]发现,在腹腔巨噬细胞GRK2减少95%的小鼠中,炎症细胞因子反应增强。电针可以治疗炎性疼痛,脊髓 GRK2可能是一个关键的分子靶点[29],靶向GRK2作为调节炎症性疼痛的策略可能是治疗临床疼痛的一种有前景的干预措施。导气电针组与电针组比较,GRK2蛋白水平变化未见显著差异,而炎症因子IL-1β和 TNF-α变化差异显著,提示导气针法还通过其他机制影响疼痛变化,有待进一步的研究。
