Li1.104Mn0.56Ni0.24O2富锂锰基材料Al3+掺杂研究
2022-09-13石仁吉余林玉邓浩杰谢涛雄任鹏文江剑兵
石仁吉 余林玉 邓浩杰 谢涛雄 任鹏文 江剑兵
湖南工业大学包装与材料工程学院 湖南 株洲 412007
1 研究背景
现有的锂离子电池正极材料容量偏低,如锰酸锂正极材料理论比容量只有148 mA·h/g[1],这远远无法满足新能源汽车高续航里程的需求,因此开发高容量、高循环次数[2-4]的锂离子电池正极材料成为研究重点之一。富锂锰基正极材料在高电压下能发挥出250 mA·h/g以上的放电比容量,其工作电压可达到4.5 V[5-7],并且具有热稳定性好、价格低廉、环保等优点,市场前景广阔。
富锂锰基正极材料的高容量归因于晶格氧的额外利用。较高的工作电压提高了晶格氧的活性,但是在活化过程中晶体结构中容易产生锂氧空位、过渡金属迁徙、边缘错位等问题,从而导致首次不可逆结构转变及循环过程中的电压衰减[8-11]。此外,富锂锰基正极材料在充放电时,受Jahn-Teller效应影响会导致结构破坏[12],严重制约其大规模应用。
理想情况下,锂离子电池充放电过程中的Li+占据3b位,过渡金属Ni、Co、Mn随机占据3a位[13-16],但由于离子半径相近,往往会互相占据对方的位置,形成阳离子混排,导致电池的电化学性能降低。研发人员发现,当正极材料中引入新的阳离子时,可以有效提升材料的稳定性,一定程度上减缓阳离子混排,降低正极材料阻抗,提升电子导电率,从而提高正极材料的循环性能及倍率性 能。Jin X.等[17]对 Li[Li0.2Ni0.13Co0.13Mn0.54]O2进行Mg掺杂,结果表明掺杂Mg后材料的电化学性能有所改善,在电流密度为40 mA/g时,其初始放电容量可达275.8 mA·h/g。Kang S. H.等[18]利用F掺杂得到了Li[Li0.2Ni0.15+0.5zCo0.10Mn0.55-0.5z]O2-zFz。经过F离子掺杂后,材料在首次循环过程中不可逆容量的损失得到明显改善,当z=0.05时,经过40次循环后,材料剩余的可逆容量依旧能达到311 mA·h/g,容量保持率几乎达到100%,而未掺杂的材料仅仅只有79%。
铝作为电化学惰性元素,其离子半径(5.35 nm)与 Mn4+半径(5.30 nm)较为接近,因此可以用Al3+掺杂替代部分Li+,来改善正极材料中阳离子混排现象。本研究采用共沉淀法制备前驱体Mn0.56Ni0.24(OH)2,并以Li2CO3作为锂源,Al3+作为掺杂离子,利用高温固相法进行掺杂改性研究。通过研究Al3+掺杂量对Li1.104Mn0.56Ni0.24O2材料结构、倍率性能及其他电化学性能的影响[19-20],为富锂锰基材料实现商业化提供参考依据。
2 实验部分
2.1 实验材料、设备与仪器
1)实验材料
碳酸锂(Li2CO3)、氧化铝(Al2O3)、无水乙醇(CH3CH2OH,),上海麦克林生化科技有限公司;一水硫酸锰(MnSO4·H2O)、六水合硫酸镍(NiSO4·6H2O),济南明启化工有限公司;氢氧化钠(NaOH)、氨水(NH3·H2O),上海阿拉丁生化科技股份有限公司;乙炔黑(C),西陇化工股份有限公司;聚偏氟乙烯(PVDF),国药控股北京有限公司;N-甲基吡络烷酮(NMP),郑州东润化工有限公司;金属锂片(Li),太原力之源科技有限公司;电解液(LiPF6,nEC:nDMC=1:1),国泰华荣化工新材料公司;泡沫镍(Ni),昆山富汇立电子有限公司;导电碳(Super-P),天津亿博瑞化工有限公司;去离子水,实验室自制。
2)实验设备与仪器
电 子 分 析 天 平,AS 220.R2 PLUS型,Radwag Wagi Elektroniczne公司;超声清洗机,SB-3200型,宁波新芝生物科技股份有限公司;鼓风干燥箱,101-0AB型,天津泰斯特仪器有限公司;电力搅拌机,LC-OES-60型,上海力辰仪器科技有限公司;封口机,MSK-110型,深圳科晶智达科技有限公司;电池测试系统,BTS-5V10mA型,深圳新威新能源技术有限公司;电化学工作站,CHI660E型,上海辰华仪器有限公司;马弗炉,SRJX-8-13型,上海力辰仪器科技有限公司;电感耦合等离子体光谱仪,Icp2060T型,深圳仁瑞电子科技有限公司;激光粒度仪,Mastersizer 2000型,英国马尔文仪器有限公司;振实密度测试仪,FZS4-4B型,宁波海曙瑞柯仪器有限公司;真空干燥箱,DZF-6090AB型,上海力辰仪器科技有限公司;全自动X射线衍射仪,Min flex型,日本理学株式会社;扫描电子显微镜,JSM-5600LV型,日本电子株式会社。
2.2 前驱体材料的制备
采用共沉淀法制备Mn0.56Ni0.24(OH)2前驱体材料。以浓度为 2 mol/L的NaOH溶液作为沉淀剂,2 mol/L的氨水溶液作为络合剂,MnSO4和NiSO4按浓度3:1配成浓度为2 mol/L的金属混合溶液,用计量泵将金属混合溶液、沉淀剂和络合剂匀速加入到反应釜中,反应过程温度控制在55 ℃,pH值控制在12.0±0.2,匀速搅拌速度为1500 r/min,保持反应釜为密封体系,通入氮气进行气体保护,以防止反应过程中产物的氧化。反应时间为12 h,将反应得到的沉淀清洗、过滤、最后将滤饼置于120 ℃恒温干燥箱内干燥24 h,得到Mn0.56Ni0.24(OH)2前驱体。
2.3 正极材料制备
将制备的Mn0.56Ni0.24(OH)2前驱体材料和适量的Al2O3、Li2CO3进行充分混合,研磨均匀后将混合物进行焙烧处理(950 ℃,24 h)。此过程中,Al2O3作为体相掺杂改性材料,通过调整Al2O3的用量,得到不同Al3+掺杂量的Li1.104-3xAlxMn0.56Ni0.24O2(x=0,0.0025, 0.005, 0.0075, 0.01),分别标记为LA-0、LA-1,LA-2,LA-3,LA-4。
2.4 表征与测试
利用X射线衍射仪对晶体结构进行分析,测试条件为: Cu Kα射线,扫描角度2θ范围10°~90°,步长0.02°;利用扫描电子显微镜对样品的微观形貌进行研究;在新威电池测试系统上对材料进行充放电测试,充电终止电压为4.8 V,放电终止电压为2.0 V;将充放电测试结束后的电池静置24 h,再采用电化学工作站进行电化学交流阻抗谱(EIS)测试,交流幅值的变化范围是5 mV,频率范围是10 mHz~100 kHz。
3 结果与讨论
3.1 SEM分析
图1为Mn0.56Ni0.24(OH)2前驱体的SEM图。由图可知,Mn0.56Ni0.24(OH)2前驱体是由一次细小颗粒经过团聚得到的二次类球形颗粒。
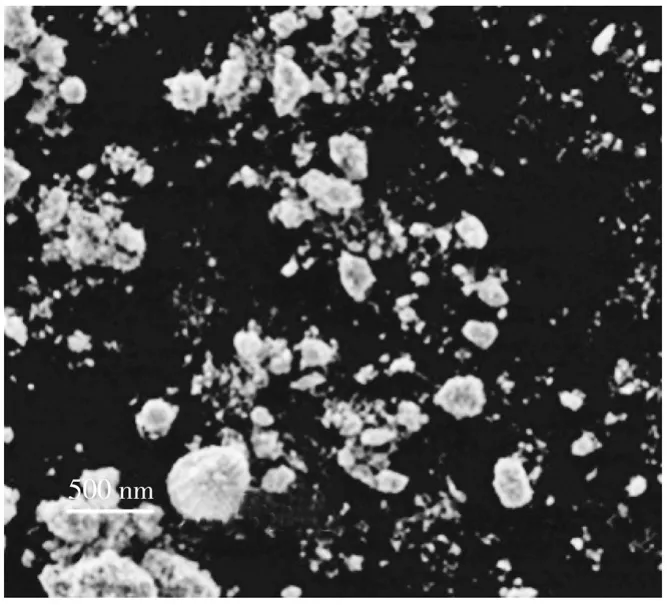
图1 前驱体Mn0.56Ni0.24(OH)2 SEM图Fig. 1 SEM images of Mn0.56Ni0.24(OH)2
图2为Li1.104-3xAlxMn0.56Ni0.24O2(x=0, 0.0025, 0.005,0.0075, 0.01)材料的SEM图。由图可以看出,所有LA样品的形貌和前驱体的类似,都是由一次颗粒团聚成二次颗粒的类球形颗粒。对比LA-0,发现掺杂Al3+后的LA-1~LA-4样品的二次颗粒形貌更加清晰、规则,离子表面更加光滑,可能是经过高温烧结后,Al3+掺杂使材料受热更加均匀,从而提高了材料颗粒的规整性。

图2 Li1.104-3xAlxMn0.56Ni0.24O2(x=0, 0.0025, 0.005, 0.0075, 0.01)的SEMFig. 2 SEM curves of Li1.104-3xAlxMn0.56Ni0.24O2(x=0, 0.0025, 0.005, 0.0075, 0.01)
3.2 XRD分析
图3是Li1.104-3xAlxMn0.56Ni0.24O2(x=0, 0.0025, 0.005,0.0075, 0.01)材料的XRD图谱。 由图可知,所有LA样品均具有层状结构,属于六方晶系的α-NaFeO2结构,属R-3m空间群[4],同时,谱图中没有其他杂质峰,表明Al代替部分Li进入富锂锰基正极材料晶格。富锂锰基正极材料的特征衍射峰强度比I(003)/I(104)表明该材料中阳离子混排程度,其值越大说明阳离子混排程度越低[12-14]。
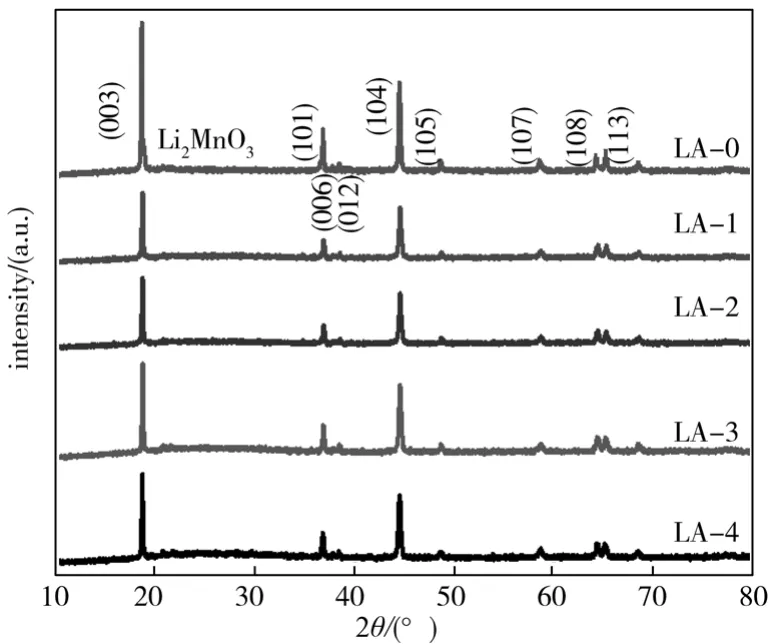
图3 Li1.104-3xAlxMn0.56Ni0.24O2(x=0, 0.002 5, 0.005, 0.0075, 0.01)的XRD图Fig. 3 XRD curves of Li1.104-3xAlxMn0.56Ni0.24O2(x=0, 0.0025, 0.005, 0.0075, 0.01)
表1列出了Li1.104-3xAlxMn0.56Ni0.24O2(x=0, 0.0025,0.005, 0.0075, 0.01)材料的晶胞参数和特征衍射峰强度比I(003)/I(104)。
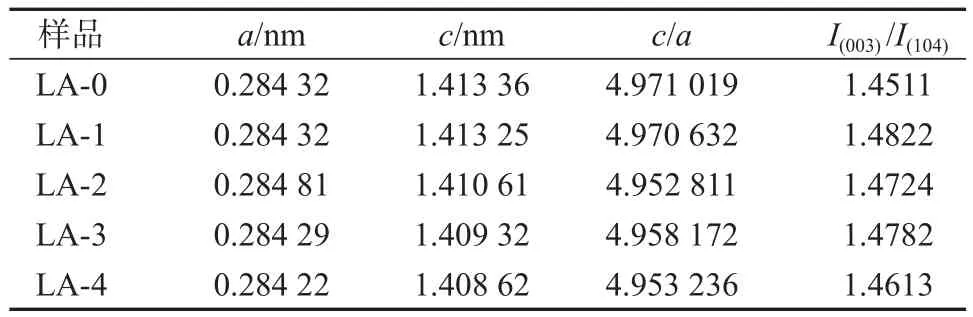
表1 Li1.104-3xAlxMn0.56Ni0.24O2(x=0, 0.0025, 0.005, 0.0075,0.01)晶格参数及特征峰强度比Table 1 Lattice and characteristic peak intensity ratios of Li1.104-3xAlxMn0.56Ni0.24O2(x=0, 0.0025, 0.005, 0.0075, 0.01)
由表1可知,随着Al3+掺杂量的增加,c逐渐减小,表明Al3+掺杂减小了材料的晶胞体积,同时所有LA样品中c/a值均大于密堆六方的理想值4.899;随着Al3+掺杂量的增加,LA样品的I(003)/I(104)值呈现先增大后减小的趋势,样品LA-1的I(003)/I(104)值最大,达到1.4822,表明Al3+掺杂有利于改善LA材料中阳离子混排现象,从而改善材料的电化学循环性能。
3.3 EDS分析
图4为样品LA-1的EDS图。由图可知,掺杂元素Al在LA-1材料内部均匀分布。结合样品LA-1的EDS图、XRD图与表1可知,经过高温烧结,掺杂元素Al成功代替部分Li元素均匀分布在晶格中。

图4 LA-1的EDS图Fig. 4 EDS curves of LA-1
3.4 电化学性能分析
图5为Li1.104-3xAlxMn0.56Ni0.24O2(x=0, 0.0025, 0.005,0.0075, 0.01)材料在0.1 C(25 mA/g)的电流密度下的首次充放电曲线。
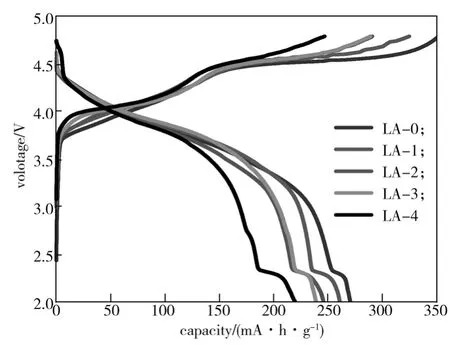
图5 Li1.104-3xAlxMn0.56Ni0.24O2(x=0, 0.0025,0.005, 0.0075, 0.01)的首次充放电曲线Fig. 5 Initial charge-discharge curves of Li1.104-3xAlxMn0.56Ni0.24O2(x=0, 0.0025,0.005, 0.0075, 0.01)

彩图
由图5可以看出,所有LA样品具有相似的电化学充放电曲线,均有两个明显的充电平台。样品LA-0、LA-1、LA-2、LA-3、LA-4的首次放电比容量分别为 270.52, 260.80, 245.84, 239.04, 219.84 mA·h/g,首次充电比容量分别为352.00, 324.74, 290.70, 289.07,246.89 mA·h/g,首次库伦效率分别约为76.85%、80.31%、84.57%、82.69%、89.04%。数据表明,随着Al3+掺杂量的增加,样品的首次放电比容量逐渐降低,而首次充放电效率有所提高,这是由于Al3+没有电化学活性,致使材料的首次放电比容量降低,但从XRD结果可知,Al稳定了材料的结构,改善了材料的阳离子混排,是提高材料首次库伦效率的主要原因。
图6为Li1.104-3xAlxMn0.56Ni0.24O2(x=0, 0.0025, 0.005,0.0075, 0.01)材料的倍率循环曲线。
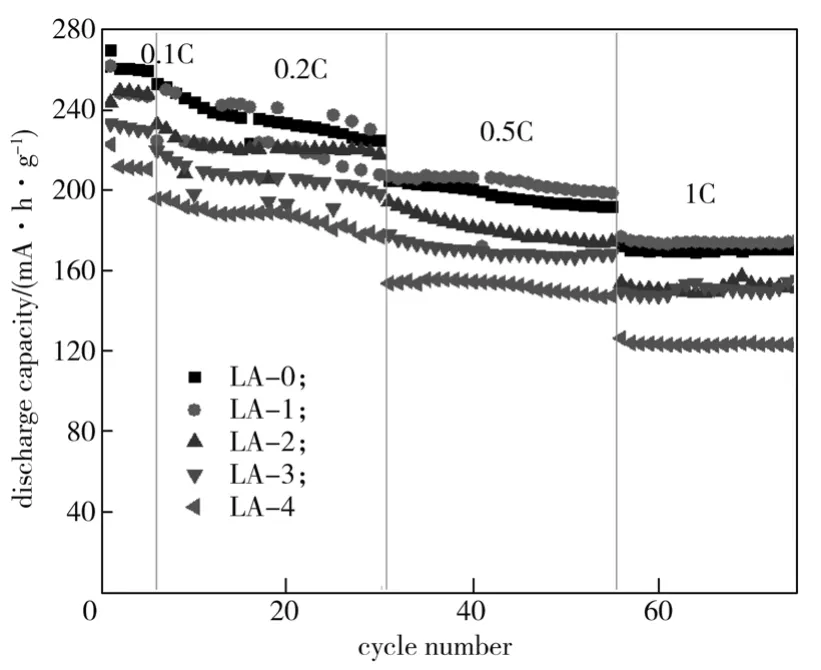
图6 Li1.104-3xAlxMn0.56Ni0.24O2(x=0, 0.0025,0.005, 0.0075, 0.01)的倍率性能曲线Fig. 6 Rate performance of Li1.104-3xAlxMn0.56Ni0.24O2(x=0, 0.0025, 0.005, 0.0075, 0.01)

彩图
由图6可以看出,随着倍率的增加,所有LA材料的放电比容量都降低。当倍率小于0.2 C时,随着Al3+掺杂量的增加,材料放电比容量逐渐降低;当电流密度增大到0.5 C、1 C时,LA-1材料的放电比容量明显提升,成为具有最高放电比容量的样品。这是由于随着铝离子掺杂量增加,晶体内部的锂层间距增大,这有利于锂离子嵌入和脱嵌,也有利于抑制锰离子迁入Li位而造成原材料向尖晶石相转变的不可逆相变[18],提高了Li+的导电性,让更多的Li+参与电化学反应,提高了材料的倍率性能,因此在较大的倍率下拥有较高的放电比容量[20]。但当Al3+掺杂量过大(LA-2~LA-4)时,可能会导致材料晶格畸变,使正极材料电化学性能降低。
图7为Li1.104-3xAlxMn0.56Ni0.24O2(x=0, 0.0025, 0.005,0.0075, 0.01)样品材料在0.2 C电流密度下的循环性能图。
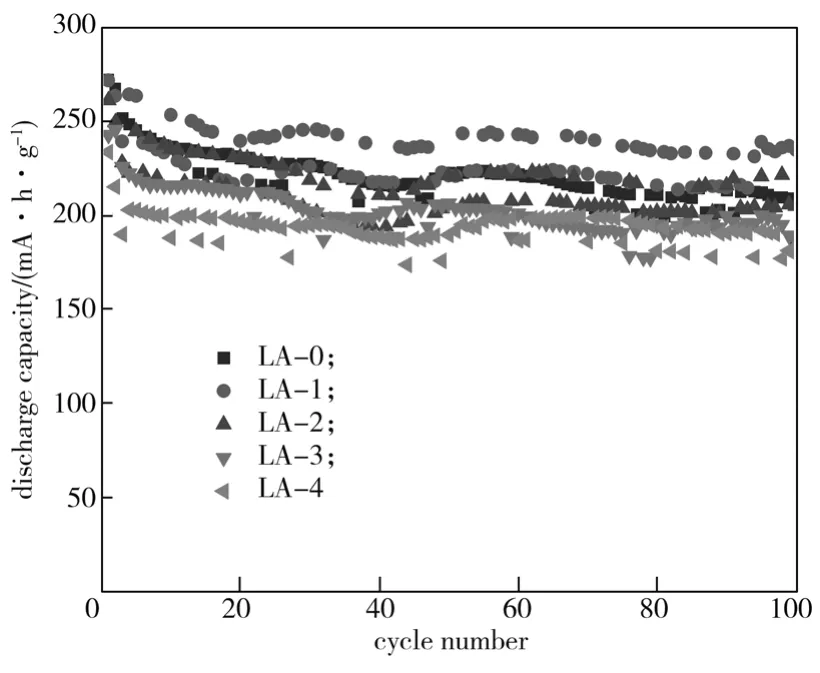
图7 Li1.104-3xAlxMn0.56Ni0.24O2(x=0, 0.0025,0.005, 0.0075, 0.01)的循环曲线Fig. 7 Cycling curves of Li1.104-3xAlxMn0.56Ni0.24O2(x=0, 0.0025,0.005, 0.0075, 0.01)

彩图
由图7可以看出,LA-0、LA-1、LA-2、LA-3、LA-4样品首次放电比容量分别为271.99, 271.56,260.84, 242.55, 233.31 mA·h/g,100次循环后,放电比容量分别为182.99, 234.42, 204.52, 186.47, 178.47 mA·h/g,对应的放电比容量保持率分别为67.27%、86.32%、78.41%、76.88%、76.49%。由此可以得出,Al3+掺杂可以有效改善材料的循环性能,特别是LA-1样品经过100次循环后,放电比容量保持率依然高达86.32%。这是由于Al3+掺杂减小了材料的晶胞体积,改善了材料中阳离子混排现象,稳定了材料在充放电过程中的结构,因此提高了材料的循环性能。LA-2~LA-4样品的容量保持率相比LA-1样品的有所降低,可能是由于A13+半径较大,过量A13+难以完全进入晶格。
图8为样品LA-0和LA-1在2.0~4.8 V电压范围,以0.5 mV/s扫描速率的第2~4次循环CV曲线(在0.1 C进行首次循环激活)。
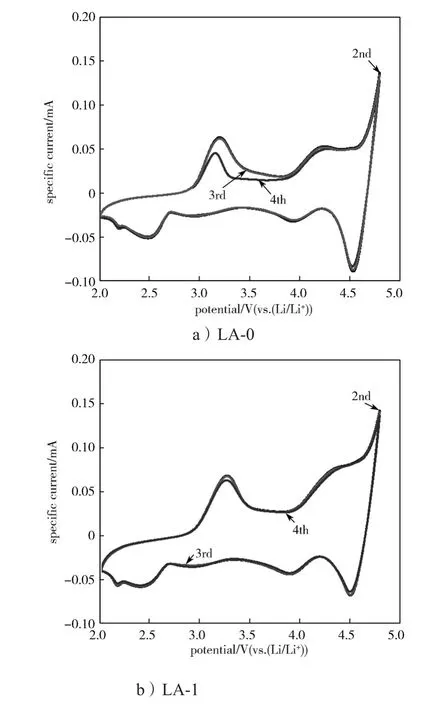
图8 样品LA-0与LA-1的循环伏安曲线Fig. 8 Cyclic voltammetry curves of sample LA-0 and LA-1

彩图
由LA-0样品的CV曲线可以看出, 未进行Al3+掺杂包覆的材料在第2次循环中,氧化峰在3.2 V左右,对应着Ni2+被氧化成Ni4+。 在还原过程中,2.7 V左右对应着Ni4+被还原,并且在之后的循环中,该还原峰逐渐变得明显,表明材料由层状结构向尖晶石状转变,产生相变,导致锂离子传输通道受阻,从而产生电压衰减,这是富锂锰基材料放电平台电压衰减的主要原因[20-22]。对比发现,LA-1样品第2~4次循环CV曲线中所有氧化还原峰基本重合在一起,这表明材料具有优良的循环性能,从而进一步验证了Al3+掺杂可以改善LA材料的循环性能。
图9为样品LA-0和LA-1进行100次循环后的电化学交流阻抗拟合图谱。在拟合所选择的等效电路中,Re1代表电路中的电阻,Rs对应高频区的半圆环,代表SEI膜的电阻,Rct对应中频区的半圆环,代表材料截面和电解液间的电荷转移电阻。Zw对应Warburg 阻抗[23]。
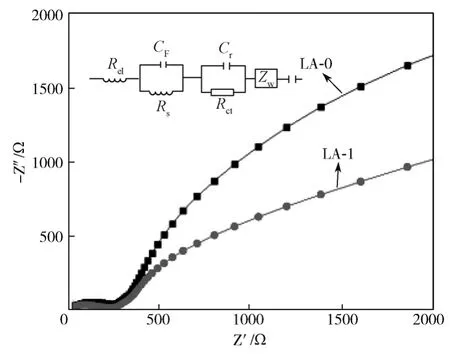
图9 样品LA-0与LA-1的交流阻抗图谱Fig. 9 AC impedance spectra of sample LA-0 and LA-1
由图9可以看出,两个样品的交流阻抗图谱都是由高频区的半圆环部分和低频区的直线部分组成,且LA-1样品的半圆环直径小于LA-0的。由此说明Al3+掺杂减小了材料的阻抗,提高了材料的电子电导率,阻抗的减小有利于克服电极过程中的离子扩散和电子转移的动力学限制,从而提高材料的比容量和改善材料的循环性能,进一步验证了Al3+掺杂可有效改善材料电化学循环。
4 结论
本研究采用高温固相法制备了不同Al3+掺杂量的Li1.104-3xAlxMn0.56Ni0.24O2(x=0, 0.0025, 0.005, 0.0075,0.01)富锂锰基正极材料,研究不同Al3+掺杂量对正极材料结构、倍率性能及电化学性能的影响,得到以下结论。
1)电化学测试结果表明,Al3+掺杂虽然降低了材料的放电比容量,但是提高了材料的首次充放电效率,改善了材料的循环性能。
2)当掺杂量x=0.0025时,材料的电化学性能最佳,0.2 C电流密度下,Li1.0965Al0.0025Mn0.56Ni0.24O2的首次放电比容量为271.56 mA·h/g,在循环100次后,放电比容量为234.42 mA·h/g,容量保持率高达86.32 %。
3)XRD结果表明,Al3+掺杂未改变材料层状结构属性,但是减小了材料的晶胞体积,改善了材料阳离子混排,从而稳定了材料的结构。
4)EIS结果表明,Al3+掺杂减小了材料的阻抗,提高了材料的电子电导率,从而提高材料的比容量,改善了材料的循环性能。
