玉露香梨采后病原菌分离鉴定及其生物学特性研究
2022-09-13侯亚茹高振峰杨志国陈恬张阳关军锋张立新张晓宇
侯亚茹,高振峰,杨志国,陈恬,张阳,关军锋,张立新,张晓宇,
(1.山西农业大学食品科学与工程学院,山西太原 030031;2.河北省农林科学院生物技术与食品科学研究所,河北石家庄 050051)
“玉露香”梨(‘Yuluxiang’)是以库尔勒香梨为母本,雪花梨为父本杂交育成的优质中熟梨新品种,富含多种糖类、矿物质及其它营养元素。但玉露香梨属于呼吸跃变型果实,水分含量高,采后贮运过程中易受到机械损伤,导致病原菌从伤口处侵入诱发病害。据统计,玉露香梨每年采后损失约20%~25%,而真菌侵染导致的腐烂是造成梨果采后损失重要因素之一。有研究表明,引起梨果采后腐烂的病原微生物主要有和等;牛佳佳等分离到酥梨贮藏期间病原菌主要有和,其中是生长最快和传染性较强的致病菌;对金刺梨黑斑病则主要是由真菌引起;而库尔勒香梨黑斑病则主要是由交链孢()和细极链隔孢()导致。关于玉露香梨贮藏期间病原菌的研究少有报道,因此,本研究对玉露香梨贮藏期间病原菌进行分离鉴定,并初步研究其生物学特性,旨在为玉露香梨贮藏过程中病害的侵染规律和防治提供理论依据。
1 材料与方法
1.1 材料与仪器
玉露香梨 在2020 年9 月份采于山西省临汾市隰县寨子乡,采后24 h 内运回实验室。挑选大小均一、无病虫害、无机械损伤的果实,存放于0±1 ℃贮藏库中备用;Tris 缓冲剂 北京索莱宝科技有限公司;葡糖糖 分析纯,天津市凯通化学试剂有限公司;琼脂粉 分析纯,北京奥博星生物技术有限责任公司;引物1、引物4 华大基因;PDA 培养基(马铃薯200 g,蒸馏水1 L,葡萄糖20 g,琼脂18 g);PDB 培养基(马铃薯200 g,蒸馏水1 L,葡萄糖20 g);查氏培养基(NaNO3 g,KHPO1 g,MgSO·7HO 0.5 g,KCI 0.5 g;FeSO·7HO 0.01 g;蔗糖30 g,琼脂15 g,蒸馏水1 L)。
SW-CJ-1FD 单人超净工作台 浙江苏净净化设备有限公司;DH 电热恒温箱 天津市通利信达仪器厂;DYY-6C 电泳仪 北京市六一仪器厂;WFH-202 紫外透射分析仪 上海精科实业有限公司。
1.2 实验方法
1.2.1 病原菌的分离鉴定
1.2.1.1 病原菌的分离纯化 取自然发病梨果感染组织病健交界处的小块组织(约 5 mm×5 mm)放入75%的酒精中浸泡30 s,用无菌水冲洗3 次,移入3%的次氯酸钠溶液浸泡3 min,再用无菌水清洗3 次,取出后用滤纸吸干组织块,接入PDA 平板中,28 ℃恒温培养。当培养出的菌落直径生长至1 cm时,挑取菌落边缘的菌丝转接入PDA 培养基平板中,28 ℃恒温培养;重复上述操作2~3 次得到纯化的病原菌,移入试管低温保存备用。
1.2.1.2 病原菌的致病性检测 根据柯赫氏法则,选取健康大小、成熟度一致的玉露香梨,75%的酒精表面消毒后用无菌水冲洗,晾干后进行接种处理:在果肩部切下约5 mm 深、5 mm 直径的圆形伤口,用打孔器取PDA 平板培养3~5 d 的5 mm 病原菌饼,接至伤口位置,28 ℃恒温培养,观察发病情况。以接PDA 培养基为对照,重复3 次。观察是否与自然发病的病原菌特征相一致。
1.2.1.3 病原菌的形态学观察 将纯化的病原菌培养5~7 d,观察菌落外观形态。待产孢后,挑取少量孢子或菌丝,在显微镜下观察菌株的组织结构:分生孢子及孢子梗的形状,有无分枝状态等。参照魏启超和葛启新等的方法,对病原菌进行初步鉴定。
1.2.1.4 病原菌的分子生物学鉴定 总DNA 的提取:将纯化的病原菌接种到100 mL PDA 培养基中,在室温下振荡培养7 d,然后对菌丝进行过滤和收集。液氮冷冻研磨成细粉,用CTAB 法提取纯化基因组DNA,将提取获得的DNA 样品放于−60 ℃保存备用。
病原菌rDNA-ITS 扩增与序列分析:按照上述方法提取真菌DNA 后,采用真菌通用引物(ITS1:5'-TCCGTAGGTGAACCTGCGG-3'和ITS4:5'-TCCTCCGCTTATTGATATGC-3')扩增rDNA-ITS区段。PCR 反应体系为(50 μL):模板DNA 4 μL,引物1、引物4 各2 μL,Premix Tap 25 μL,ddHO 17 μL。PCR 反应条件为:94 ℃预变性5 min;94 ℃变性55 s;50 ℃退火 50 s;72 ℃ 延伸 55 s;循环32 次;72 ℃延伸10 min;4 ℃保存。PCR 产物用 1%琼脂糖凝胶电泳检测,并送去北京六合华大基因科技有限公司进行测序。
将所得rDNA-ITS 区段序列在GenBank 数据库中进行BLAST 同源性检索,采用MEGA version 7.0.14 软件对同源序列与目的序列进行比对,以Neighbor-Joining 法构建系统发育树,分析亲缘关系。
1.2.2 生物学特性
1.2.2.1 最适温度的筛选 将直径5 mm 的菌饼接入PDA 培养基中央,分别置于5、10、15、20、25、30、35、40 ℃的恒温培养箱。培养5 d 后用十字交叉法测量菌落直径,10 d 后,用血球计数板测定产孢量,处理3 次重复。
1.2.2.2 最适pH 的筛选 用1 mol/L HCl 和1 mol/L NaOH 调配PDA 培养基,使其pH 分别为4、5、6、7、8、9、10、11,将菌饼接入不同pH 培养基中央,28 ℃恒温培养,培养5 d 后用十字交叉法测量菌落直径,10 d 后,用血球计数板测定产孢量,处理3 次重复。
1.2.2.3 最适碳源和氮源的筛选 以查氏培养基(Czapek)为基础培养基,按等量的碳源(麦芽糖、乳糖、葡萄糖、甘露醇、可溶性淀粉)替换Czapek 培养基中的蔗糖,以缺碳作对照,研究不同碳源对菌丝体生长和产孢量的影响。同样,按等量氮源(蛋白胨、牛肉膏、甘氨酸、尿素、硝酸铵、硫酸铵)替换Czapek 培养基中的硝酸钠,以缺氮作对照,28 ℃恒温培养,培养5 d 后用十字交叉法测量菌落直径。10 d 后,用血球计数板测定产孢量,处理3 次重复。
1.3 数据处理
利用Excel 2007 和SPSS 23.0 软件对试验数据进行统计分析和Origin2021 软件作图,并应用Duncan 氏新复极差法进行差异显著性检验。
2 结果与分析
2.1 病原菌的分离鉴定
2.1.1 病原菌的分离纯化 从玉露香梨病健交界处组织中共分离纯化出6 种形态、颜色和生长速度差异较为明显的纯培养物,命名为YL1~6。YL1 菌落初期为灰白色,后期为灰褐色;YL2 菌落初期为黄白色,后期为黄绿色;YL3 菌落初期为白色,后期长出许多灰蓝色孢子;YL4、YL5、YL6 菌落颜色略有一些差异,菌丝体形态极为接近,可能为同一种病原菌。
2.1.2 病原菌致病性 纯化后的病原菌接种到梨果伤口3 d 后,病斑从伤口处开始扩散,这表明所分离的菌株均具有致病性(图1),在玉露香梨果实上均表现出发病症状。YL1 发病症状:近圆形病斑,初为褐色,后渐变为灰褐色,表面稍凹陷,四周黑褐色;YL2 病果迅速软腐,贮藏时间长会流水,表面布满青绿色霉堆;YL3 病果病斑近圆形,淡褐色,软腐,略凹陷;YL4、YL5 和YL6 发病症状相近,伤口中央有菌丝附着,略凹陷,轻微软腐。其发病症状与自然发病症状一致。对照不发病。对回接后的病原菌再次进行分离培养,经鉴定仍为最初接种的菌株。

图1 病原菌回接发病症状Fig.1 Symptoms of natural and artificial inoculation
2.1.3 病原菌的形态学鉴定分析 纯化的病原菌从菌落特征和显微形态观察研究发现(图2),病原菌YL1 菌丝生长迅速、菌落均匀,有明显的基内菌丝,菌落逐渐从灰白色加深变为深灰色,菌丝绒状致密;显微镜观察分生孢子梗呈黄褐色,近椭圆形,具横隔,孢身中部的隔膜较粗,呈褐色;根据菌落、菌丝和孢子形态方面YL1 同较相似,与已报道的番莲果果腐病原菌和奉新猕猴桃黑斑病病原菌极为接近。

图2 病原菌在培养基的菌落形态及显微形态Fig.2 Colony morphology and micromorphology of pathogen in culture medium
YL2 菌落生长较快、结构疏松,呈黄绿色;显微镜下观察,菌丝体无色,分生孢子初为球形,后呈辐射型,无色;根据菌落、菌丝和孢子形态方面YL2 同较为相似。
YL3 菌落呈灰蓝色,密毡状,生长较为缓慢;显微镜下观察分生孢子链状着生,菌丝有分枝、分隔,有横膈膜;根据菌落、菌丝和孢子形态方面YL3 同较为相似,与已报道的柑橘采后腐烂病原菌较为相似。
YL4、YL5 和YL6 除PDA 平板菌落颜色略有一些不同之外,菌丝和孢子形态极为接近。菌落突起白色绒毛状,浅粉色,菌丝白色质密;显微镜下观察小型分生孢子着生于单生瓶梗上,大型分生孢子无色、多胞,镰刀形,两端细胞稍尖;根据菌落、菌丝和孢子形态方面YL4 同较为相似;YL4、YL5 和YL6 菌丝和孢子形态很接近,其形态特征与已报道的黄连根腐病镰刀菌()较为接近。
2.1.4 病原菌分子生物学鉴定结果 测序结果表明,菌株YL1、YL2、YL3、YL4、YL5、YL6 的PCR 扩增长度分别为500 bp 左右(图3),符合真菌ITS 区序列长度范围,表明ITS 区通用引物成功的扩增了玉露香梨采后腐烂病原菌的ITS 基因序列。构建系统发育树可知(图4~图7),YL1 的ITS 序列与的ITS 序列(登录号:MZ951051.1、MZ298823.1、OL514181.1、MW474904.1、OM0498 21.1)紧密地聚在同一分枝,同源性达100%,结合形态学特征综合分析,病原菌YL1 为;YL2 的ITS 序列与sp.的ITS 序列(登录号MT645617.1、MT645322.1、MT584825.1、MT497446.1、OK235450.1、OK217263.1、MW788 477.1、NR171607.1、NR171606.1 )同源性达100%,结合形态学特征综合分析,病原菌YL2 为sp.;YL3 的ITS 序列与的ITS 序列(登录号MF979522.1、MT158684.1、MG228408.1 )同源性达100%,结合形态学特征综合分析,病原菌YL3 为;YL4~6的ITS 序列与的ITS 序列(登录号:MT482502.1、LC500064.1、OM017211.1、MW791 922.1、MT463390.1、MK250655.1、MK407333.1、AB 470855.1、MK407347.1、MK407211.1、MW067648.1)同源性达99%,结合形态学特征综合分析,病原菌YL4~6 为sp.。
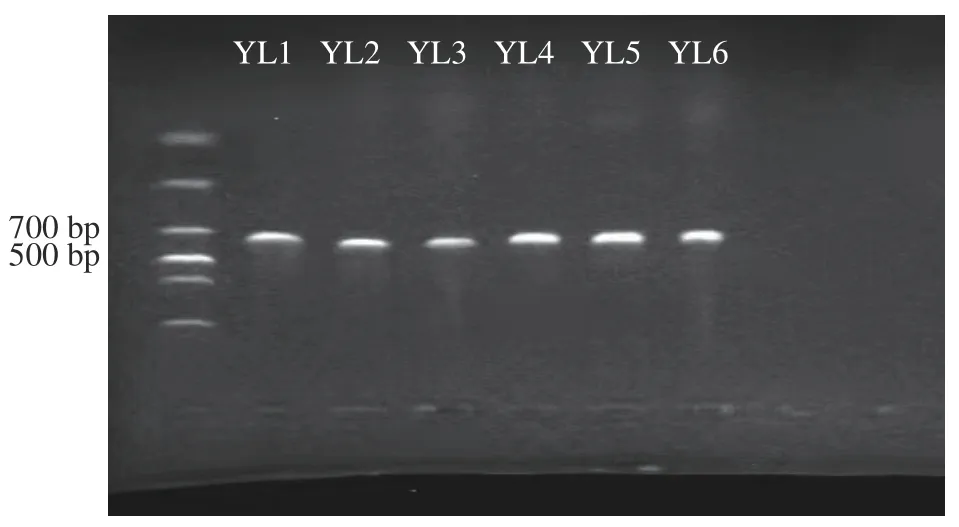
图3 病原菌 PCR 扩增产物凝胶电泳检测Fig.3 Detection of pathogenic fungi PCR amplification products by gel electrophor
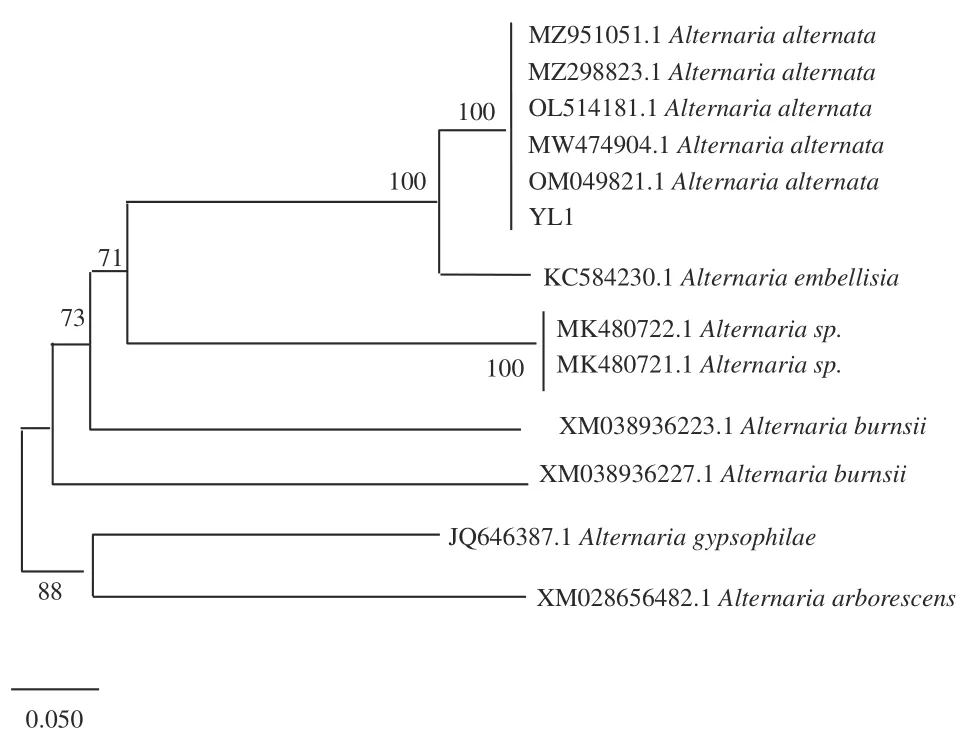
图4 基于ITS 基因序列构建的病原菌YL1 系统进化树Fig.4 Phylogenetic tree of pathogenic bacteria YL1 based on ITS gene sequences

图5 基于ITS 基因序列构建的病原菌YL2 系统进化树Fig.5 Phylogenetic tree of pathogenic bacteria YL2 based on ITS gene sequences

图6 基于ITS 基因序列构建的病原菌YL3 系统进化树Fig.6 Phylogenetic tree of pathogenic bacteria YL3 based on ITS gene sequences
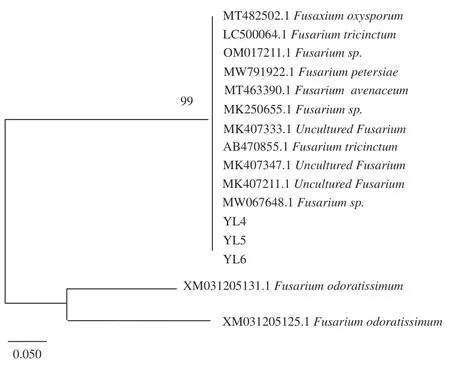
图7 基于ITS 基因序列构建的病原菌YL4~6 系统进化树Fig.7 Phylogenetic tree of pathogenic bacteria YL1~6 based on ITS gene sequences
2.2 生物学特性研究结果
2.2.1 最适温度 温度对病原菌、和菌丝体生长和产孢量有显著(<0.05)影响(图8)。该些菌株在10~35 ℃均可生长,不同温度下菌丝体生长和产孢量不同,不同病原菌的最适温度也不同。其中,和最适生长温度为25~30 ℃,在此温度下,菌落直径达5.9 和6.2 cm,产孢量达3.89 和3.21 lg(CFU/mL),菌落直径达6.2 和6.1 cm,产孢量达4.39和3.48 lg(CFU/mL),显著(<0.05)高于其余温度;最适温度为25~35 ℃,其菌落直径分别为5.23、6.11 和6.21 cm,产孢量达7.9、6.5 和6.8 lg(CFU/mL);最适生长温度为20 ℃~25 ℃,菌落直径达3.6 和2.7 cm,25 ℃时产孢量最高,可达8.4 lg(CFU/mL)。菌株、和培养5 和10 d 后,在5 ℃条件下不生长且不产孢,和在温度≥35 ℃下生长缓慢,说明菌株不耐高温。而和在40 ℃仍可生长,说明菌株耐高温。四株菌株均在25 ℃时产孢量最高。因此,推测玉露香梨采后病原菌的发生多在25 ℃左右,在这个温度对应的季节之前应做好该病害的防控工作。

图8 温度对病原菌菌丝体生长和产孢量的影响Fig.8 Effects of temperature on mycelial growth and sporulation of pathogenic bacteria
2.2.2 最适pH pH 对菌株的生长也有一定的影响(图9)。其中,最适生长pH 在6~10,其菌落直径达6、6.1、6.4、6.3 和5.7 cm,产孢量为5.3、4.8、4.5、4.3 和4.1 lg(CFU/mL);在pH 小于6 时生长缓慢,说明该菌株在偏碱性环境中均可生长;最适生长pH为7,菌落直径达7.2 cm,产孢量为7.8 lg(CFU/mL),在pH 大于7 时生长逐渐下降,说明该菌株在偏中性环境中生长较好;和最适生长范围在5~7,菌落直径分别为6.5、5.9 和6.7 cm、菌落直径为6.7、7 和7.4 cm,产孢量4.7、4.8 和4.7 lg(CFU/mL)。最适产孢量在7,产孢量为4.21 lg(CFU/mL),适合在偏酸中性环境中生长。
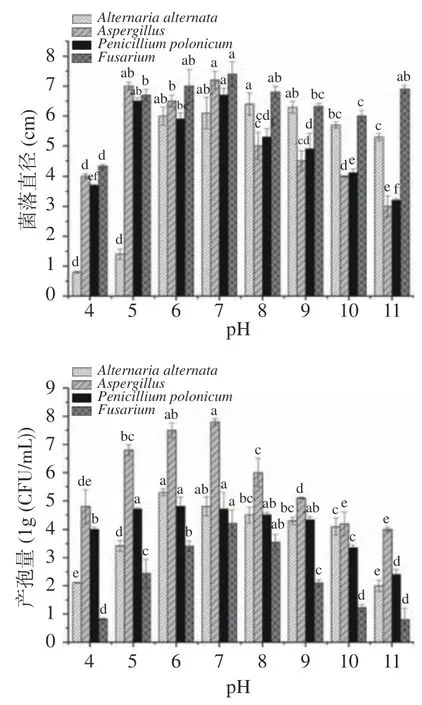
图9 pH 对病原菌菌丝体生长和产孢量的影响Fig.9 Effects of pH on mycelial growth and sporulation of pathogenic bacteria
2.2.3 最适碳源 病原菌、和可利用多种碳源(图10)其中,最适碳源为葡萄糖,菌落直径达6.5 cm、产孢量为5.42 lg(CFU/mL),显然葡萄糖对该菌株有促进生长的作用,碳源为果糖时生长较缓慢,菌落直径3.01 cm、产孢量为2.33 lg(CFU/mL);最适碳源为麦芽糖,直径达4.51 cm、产孢量4.2 lg(CFU/mL)。其次是甘露醇和乳糖,碳源为果糖和可溶性淀粉时生长较缓慢;最适碳源为甘露醇,直径达4.5 cm、产孢量为6.52 lg(CFU/mL),碳源为葡萄糖和可溶性淀粉时生长较为缓慢,可见该菌对葡萄糖和可溶性淀粉的适应能力较差;最适生长碳源为麦芽糖,直径6.75 cm,碳源是乳糖时产孢量最大,产孢量为4.31 lg(CFU/mL)。

图10 碳源对病原菌菌丝体生长和产孢量的影响Fig.10 Effects of carbon sources on mycelial growth and sporulation of pathogenic bacteria
2.2.4 最适氮源 病原菌、和在6 种供试氮源均可生长,同一菌株在不同氮源的生长不同,相同氮源培养基上各菌株生长和产孢也略有不同(图11),其中和最适生长氮源为牛肉膏,其菌落直径为6.8 和6.52 cm,产孢量最大氮源为蛋白胨,达4.7 lg(CFU/mL),最适生长氮源为蛋白胨,直径4.7 cm、产孢量4.75 lg(CFU/mL);最适生长氮源为牛肉膏,菌落直径达7.8 cm,其次是硝酸铵7.3 cm,氮源是甘氨酸时产孢量最大,可达3.8 lg(CFU/mL)。当氮源为硫酸铵时,菌株、和生长速度和产孢量明显低于CK值,由此可见,硫酸铵对该些病原菌有明显的抑制作用。根据这一研究结果可以考虑在玉露香梨种植过程中避免施加硝态类肥料,可适量施加硫酸铵以抑制病原菌生长,降低腐烂病的发生。

图11 氮源对病原菌菌丝体生长和产孢量的影响Fig.11 Effects of nitrogen sources on mycelial growth and sporulation of pathogenic bacteria
3 结论
本研究通过分离鉴定得到玉露香梨采后病原菌主要有、、和。对玉露香梨采后腐烂病原菌生长温度、pH 和最适碳氮源研究发现,最适生长温度为25~30 ℃,最适生长pH为6~10最适生长碳氮源分别为葡萄糖和牛肉膏;最适生长温度为25~35 ℃,最适生长pH 为6~10,最适生长碳氮源为麦芽糖和牛肉膏最适生长温度为20~25 ℃最适生长pH 为5~7,最适生长碳氮源为甘露醇和蛋白胨;最适生长温度为25~30 ℃,最适生长pH 为5~7,最适生长碳氮源为麦芽糖和牛肉膏。这一结论为探究玉露香梨贮期病原微生物多样性和采后贮藏特性提供理论基础。
