解毒凉血方含药血清调节TGFβ1/Smad信号通路对急性肝衰竭肝细胞凋亡的抑制作用*
2022-08-26刘慧敏李玉鑫高方媛王宪波江宇泳
急性肝衰竭(AHF)是指由多种因素引起肝细胞大量坏死、肝功能严重肝损害的一组临床综合征,主要表现为重度黄疸、凝血功能异常、肝性脑病以及严重的消化道症状等,严重者可进展为多器官功能衰竭甚至危及生命
。AHF起病急、病情进展快、并发症多,病死率极高,目前尚缺乏有效的治疗方法和预防措施。AHF发病机制复杂,至今尚未完全阐明。免疫功能紊乱、过度的炎症反应导致肝细胞凋亡、坏死是急性肝衰竭病理损伤的机制之一。AHF发病过程中,大量肝细胞凋亡坏死,同时伴随释放各种病理信号因子和细胞因子,其中转化生长因子β1(TGFβ1)被激活,进一步通过Smad2/3介导的线粒体依赖性凋亡通路加重肝损伤
。中医药在临床治疗AHF过程中发挥着重要作用,解毒凉血方是我们多年来应用于临床治疗AHF的经验方。前期研究结果显示,解毒凉血方能降低慢加急性肝衰竭患者的病死率、改善肝功能
,为进一步阐明该方治疗AHF的作用机制,本研究通过体外实验模拟肝细胞凋亡的病理过程,探讨解毒凉血方通过调节TGFβ1/Smad信号通路对AHF肝细胞凋亡的抑制作用。
1 材料与方法
1.1 材料 ①细胞:正常人肝细胞Chang liver及肿瘤细胞HepG2细胞由中国医学科学院肿瘤医院肿瘤研究所提供。②中药材:购买于北京同仁堂。③主要试剂:胎牛血清购自美国GIBCO公司;DMEM培养基、RIPA裂解液、BCA蛋白浓度测定试剂盒购自北京索莱宝生物技术有限公司;TGFβ1抗体、Smad3兔单克隆抗体、p-Smad2/3抗体、Smad7抗体购自Abcam公司;GAPDH抗体购自中山金桥,Annxin V-APC 凋亡检测试剂盒(IVY0201-100test)购自晶莱生物,CCK8试剂盒购自日本同仁化工。④主要仪器设备:生物倒置显微镜(IX51,日本OLYMPUS),CO
培养箱(XD-101,日本SANYO),酶标仪(RT-6000,深圳雷杜生命科学股份有限公司),电泳仪(DYY-7C,北京六一生物科技有限公司),4℃离心机(Neofuge 13R,Heal Force),化学发光成像仪(型号5200,Tanon),FACSCanto流式细胞仪(型号657338,Biosciences)。
1.2 解毒凉血方含药血清的制备 解毒凉血方由茵陈30 g,生地、黄芩、蒲公英、紫草、赤芍、生黄芪、党参、白术、茯苓各15 g,栀子12 g,升麻、大黄各9 g组成,共计195 g/剂,一日一剂用于60 kg成人剂量为3.3 g/kg,根据《实验动物学》中相关公式计算大鼠用药量为6.25×3.3 g/kg=20.63 g/kg。以上中药2付(共390 g),二次煎煮后浓缩至370 ml,浓度约1.05 g/ml。选用健康成年SD大鼠25只,体重(200±20)g,给药前4 h禁食不禁水,用已制备好的解毒凉血方煎剂按2 ml/200 g体重灌胃,每12 h 给药1次,共5次(连续3 d)。末次给药后1 h,乙醚麻醉后腹主动脉取血,无菌取血制备含药血清。各组血清均混匀,56℃灭活30 min,0.22 μm微孔滤膜滤过除菌,冻存管分装,-20℃保存备用。
若以NaOH形式衡量,以1800m3/h尾气计算,采用双脱吸收工艺改造后,每年将减少NaOH(固体碱,反应用掉的)用量约9.5t,但在实际运行中,由于要外排一部分,保持一定的pH和碱浓度,其用量远远不止,双塔吸收工艺将减少废碱渣和废水的排放,减少对污水处理的影响,有利于环保。
1.3 细胞培养 Chang liver、HepG2均应用RPMI-1640培养液(含10% FBS、100 U/ml青霉素和100 μl/ml链霉素)于37℃、5% CO
条件下培养,每2~3天换液1次,当细胞长至80%铺满时再消化传代。以上两种细胞分别按1.5×10
个/孔均匀种于96孔板,实验细胞分为正常组、模型组、空白血清组、15%含药血清组、10%含药血清组、5%含药血清组,每组设置5个复孔。15%含药血清组、10%含药血清组、5%含药血清组分别加入含15%、10%、5%解毒凉血方含药血清的细胞培养液预处理24 h后,除正常组外其余各组均加入100 μl凋亡诱导剂(含50 ng/ml TNFα与0.5 μg/ml ActD)刺激24 h以诱导细胞凋亡,同时在未接种细胞的空白孔中加入细胞培养液作为空白对照孔。
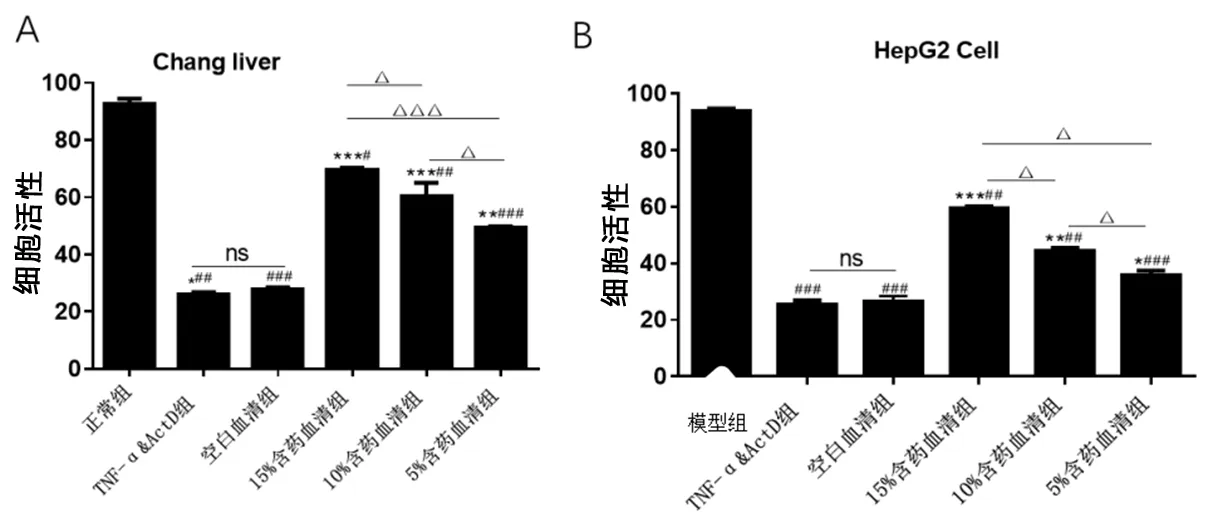
2.2 解毒凉血方含药血清对TNF-α联合ActD诱导肝细胞凋亡的保护作用 空白血清组及模型组细胞凋亡率显著高于空白对照组(
<0.01及
<0.001),15%含药血清组凋亡细胞率显著低于模型组及空白血清组(
<0.01)。见图2。
随着数字化校园理念的提出,高校越来越重视信息化管理的重要性,利用数字化、信息化等技术手段对高校固定资产进行动态管理,准确地掌握固定资产的使用现状,从而进行合理配置,避免固定资产大批量闲置,发挥固定资产最大效益,为高校实现自身资源的优化配置奠定基础。
1.6 免疫荧光方法检测凋亡肝细胞TGFβ1的表达及分布 细胞凋亡诱导完成后,4%多聚甲醛固定细胞15 min,封闭液封闭后滴加TGFβ1抗体,4℃孵育过夜,二抗避光孵育2 h,DAPI复染细胞核,PBS冲洗、吹干后滴加抗荧光猝灭剂封片,尽快采集图像。
1.5 流式细胞术检测细胞凋亡 细胞凋亡诱导完成后,收集各组细胞并转移至流式管内,PBS洗涤2次,用1×binding buffer重悬细胞,调整细胞浓度为2×10
/ml,加入2 μl Annexin V FITC染料和2 μl PI染料,4℃避光孵育15 min,流式细胞仪检测。
1.7 Western Blot方法检测TGFβ1、p-TβR Ⅱ、Smad7及p-Smad2/3的表达 细胞凋亡诱导完成后,收集细胞样本,加入适量RIPA裂解液提取细胞总蛋白,BCA法测定蛋白质浓度,蛋白质热变性后采用SDS-PAGE电泳法分离并转印到PVDF膜,5%脱脂牛奶/TBST混合液室温封闭PVDF膜2 h,TBST洗膜后分别加入TGFβ1、Smad2、Smad7及p-Smad2/3抗体4℃孵育过夜,洗膜后加入二抗,室温下振摇反应1.5 h,洗膜后滴加ECL发光液,置于X射线摄影暗匣中进行曝光并扫描图像。
式中:εs为初始学习率,rd表示衰退率,ec为当前训练的迭代次数,ed则是预设的超参数,可控制学习率衰退的快慢。衰退学习率会随着迭代次数的增加而减小,因此,在训练初期,学习率较大,模型可以快速地接近最优解;而在训练后期,学习率逐渐变小,模型的训练也趋于稳定,最终收敛于最优解附近。
随着国家对生态环境建设的重视,全社会有识之士都乐于进行生态环境建设项目开发。所以要集全社会力量,以保障资金到位。
2 结果
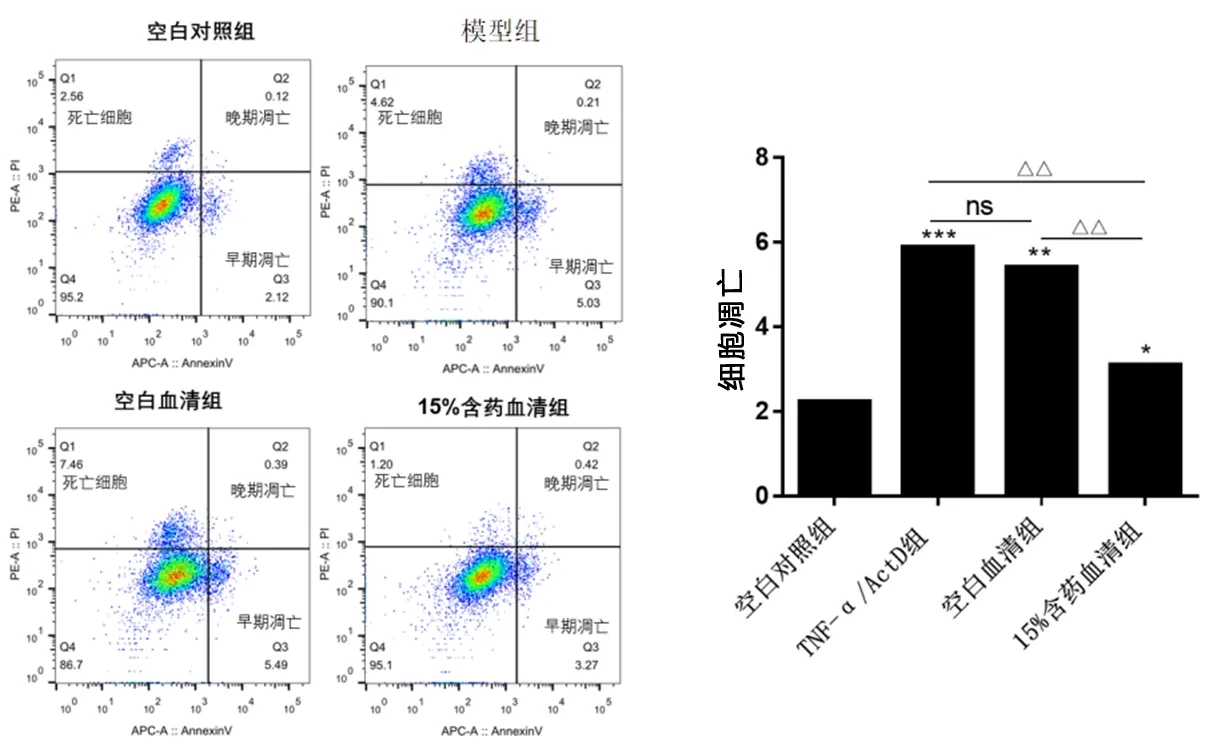
2.3 肝细胞凋亡后TGFβ1表达及解毒凉血方含药血清对TGFβ1表达的影响 免疫荧光结果显示,模型组及空白血清组细胞加入TNFα联合ActD处理24 h后细胞质中TGF-β1表达水平显著升高,15%含药血清组细胞质中TGFβ1表达低于模型组及空白血清组(
<0.001)。见图3。
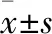
1.4 CCK-8法检测细胞活性 细胞凋亡诱导完成后,每孔细胞均加入10 μl CCK-8反应液,培养箱内孵育1~3 h,酶标仪测定450 nm处吸光度。
2.1 解毒凉血方含药血清抗细胞凋亡的有效干预浓度筛选 解毒凉血方含药血清对细胞具有保护作用,高浓度(15%)及中浓度组(10%)药物预处理后细胞活性显著高于未处理组和低剂量组(5%),组间比较有统计学差异(
<0.05),解毒凉血方疗效最佳的含药血清浓度为15%。见图1。
为了促进铁路运输企业全面预算责任主体落实的积极性,应该建立完善铁路运输企业绩效考核体系,重点是对铁路运输企业全面预算执行是否及时到位、预算实际绩效情况等进行系统全面的评价分析,进而准确地掌握铁路运输企业各预算责任主体的落实情况。同时,还应该将预算绩效考评与奖惩机制相挂钩,进一步强化全面预算管理的导向性,促进全面预算管理目标的顺利实现。
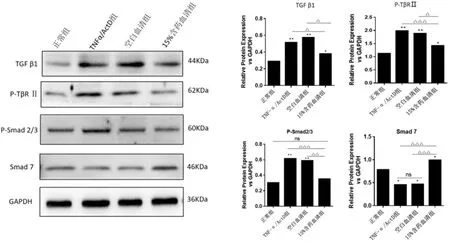
2.4 解毒凉血方含药血清对TGFβ1信号通路活化和Smad磷酸化的影响 模型组及空白血清组在诱导细胞凋亡后TGFβ1表达及TGFβⅡ型受体磷酸化(P-TβR Ⅱ)水平较正常组细胞显著升高(
<0.01),15%含药血清组TGFβ1及P-TβR Ⅱ水平显著低于模型组及空白血清组(
<0.05),提示解毒凉血方含药血清降低了TGFβ1表达及其Ⅱ型受体的磷酸化。15%含药血清组Smad2/3磷酸化(p-Smad2/3)水平低于模型组及空白血清组(
<0.01),Smad7表达水平高于模型组及空白血清组(
<0.001)。见图4。
3 讨论
AHF发病机制相当复杂,在现有的研究中,肝细胞凋亡和免疫损伤仍是肝衰竭的主要发病机制。各种致病因素诱导炎性细胞浸润肝脏,促进免疫细胞激活和炎性细胞因子释放,介导肝脏的免疫损伤过程,导致大量肝细胞凋亡坏死
。TNFα与肝细胞膜上的TNF-R1受体结合,启动凋亡级联信号通路,大量炎症因子分泌形成瀑布效应,形成内毒素血症
。内毒素既可直接介导肝细胞损伤,又可以间接通过诱导TNFα继发加重肝细胞凋亡。TNFα联合ActD诱导肝细胞损伤较好的模拟了肝细胞凋亡的过程,被广泛应用于细胞凋亡的研究中
。肝细胞炎症性凋亡、坏死是AHF的共同的病理特点
。因此,从抑制肝细胞凋亡、坏死入手,研制靶点明确、阻断病情进展的药物,是治疗该病的重要方向。
TGFβ1是一种多功能细胞因子,在细胞的增殖分化、创伤修复、免疫反应和炎症反应等过程中具有重要的调节作用。研究显示,TGFβ1与肝损伤、肝细胞凋亡密切相关,也是诱导肝纤维化发生的重要原因之一
。TGFβ1可促进凋亡蛋白表达从而诱导肝细胞凋亡
,抑制TGFβ1可抑制凋亡进程并促进肝细胞再生
。大量凋亡的肝细胞可以促进巨噬细胞分泌促炎因子参与免疫反应,又加重了肝脏的损伤和肝功能的恶化。研究显示,凋亡细胞释放的外泌体可促进巨噬细胞分泌TGFβ1
。Smads蛋白是TGFβ1信号通路中下游主要的效应分子,在TGFβ1信号转导过程中具有转录激活作用,是TGFβ1由膜受体到细胞核内基因信号转导途径中的关键环节
。TGFβ1通过活化配体依赖的活性丝氨酸/苏氨酸激酶异二聚体结合,使TGFβⅡ型受体(TβRⅡ)磷酸化,进而引起TβRⅠ受体(TβRI)磷酸化。Smad2/3可被活化的TβRⅠ受体直接磷酸化,磷酸化的Smads2/3与Smad4结合形成复合物,进入细胞核,并在核内与各种转录因子结合参与调控相关靶基因转录。Smad7在TGFβ1/Smad信号转导通路中起主要的负反馈作用,是细胞中TβRI丝氨酸/苏氨酸激酶的拮抗蛋白,与TβRI结合后使之无法将Smad2/3磷酸化而阻断信号转导过程。本研究结果显示,解毒凉血方含药血清有效降低了凋亡肝细胞TGFβ1表达及其TGFβⅡ型受体的磷酸化水平,与空白血清组及TNFα& ActD诱导凋亡组比较,15%含药血清干预组Smad2/3的磷酸化水平降低,提示解毒凉血方能阻抑TGFβ1/Smad信号通路的活化。此外,解毒凉血方含药血清组Smad7表达高于诱导模型组及空白血清组,提示解毒凉血方降低Smad2/3磷酸化可能是通过上调Smad7表达从而阻断TGFβ1/Smad信号通路的活化。
肝衰竭属中医“急黄”“瘟黄”“肝瘟”等范畴,本病多为疫毒、药毒、过量饮酒为患,其基本病机为湿热毒邪熏蒸肝胆导致肝胆失于疏泄,进而瘀阻脉络,在“湿热胶结”的基础上形成“毒瘀阻络”,临证以清热解毒、凉血化瘀为其基本治法。解毒凉血方是我们历经多年的研究和总结创立的治疗急性肝衰竭的有效方药。本方大剂量应用茵陈清利肝胆经之湿热,同时配伍蒲公英、栀子清热解毒,阻抑热毒所致的肝损害;“瘀”是病变之本,且“毒”与“瘀”互为因果、交结难解,阻滞脉络,以紫草、赤芍凉血化瘀,清解血分之热,同时改善肝脏的微循环,使气血通畅,促进肝功能的恢复,以达祛瘀生新之效。以升麻、白术、茯苓、黄芪健运中州、利湿醒脾、使气血得以生化,扶正以驱邪外出。综上,全方共奏清热解毒、凉血化瘀、利湿健脾之效。TGFβ1/Smad通路的激活和凋亡级联反应在急性肝衰竭的发生、发展过程中具有重要作用,本研究结果显示,清热解毒凉血法能降低肝细胞凋亡率、顿挫病势,从而阻止肝衰竭进展。解毒凉血方不仅降低TGFβ1的表达,而且降低了TGFβⅡ型受体的磷酸化及Smad2/3磷酸化,并上调了Smad7的表达,阻抑了TGFβ1/Smad介导的进一步肝损伤,表明该方在肝衰竭进展期可有效抑制肝细胞凋亡,从而阻断肝衰竭进展,这与该方在既往的临床研究中改善慢加急性(亚急性)肝衰竭早中期患者预后的结论相一致
。
综上,解毒凉血方对TNFα联合ActD诱导的肝细胞调亡具有阻抑作用,其机制可能与该方抑制TGFβ1/Smad信号通路活化有关。
[1] Sarin SK,Choudhury A,Sharma MK,
.Acute-on-chronic liver failure: consensus recommendations of the Asian Pacific association for the study of the liver (APASL): an update[J].Hepatol Int,2019,13(4): 353-390.
[2] Li M,Qin XY,Furutani Y,
.Prevention of acute liver injury by suppressing plasma kallikrein-dependent activation of latent TGF-beta[J].Biochem Biophys Res Commun,2018,504(4): 857-864.
[3] Niu L,Cui X,Qi Y,
.Involvement of TGF-beta1/Smad3 signaling in carbon tetrachloride-induced acute liver injury in mice[J].PLoS One,2016,11(5): e156090.
[4] 刘慧敏,王宪波,侯艺鑫,等.解毒凉血方加减治疗乙型肝炎慢加急性肝衰竭的随机对照临床研究[J].中国中西医结合杂志,2014,34(4): 412-417.
[5] 刘慧敏,王宪波,侯艺鑫,等.解毒凉血方联合西药治疗乙型肝炎慢加急性肝衰竭患者64例临床观察[J].中医杂志,2013,54(21):1829-1833.
[6] Triantafyllou E,Woollard KJ,Mcphail M,
.The role of monocytes and macrophages in acute and acute-on-chronic liver failu-re[J].Front Immunol,2018,9: 2948.
[7] Wang X,Ning Q.Immune mediated liver failure[J].Excli J,2014,13: 1131-1144.
[8] Wu Z,Han M,Chen T,
.Acute liver failure: mechanisms of immune-mediated liver injury[J].Liver Int,2010,30(6): 782-794.
[9] 时红波,时红林,张向颖,等.TNF-α/ActD协同内质网应激通过调控糖原合成酶激酶3β促进肝细胞凋亡[J].胃肠病学和肝病学杂志,2017,26(9):1006-1010.
[10] Dong V,Nanchal R,Karvellas CJ.Pathophysiology of acute liver failure[J].Nutr Clin Pract,2020,35(1): 24-29.
[11] Zhang Y,Guo J,Li Y,
.let-7a suppresses liver fibrosis via TGFbeta/SMAD signaling transduction pathway[J].Exp Ther Med,2019,17(5): 3935-3942.
[12] Vollmar J,Kim YO,Marquardt JU,
.Deletion of organic cation transporter Oct3 promotes hepatic fibrosis via upregulation of TGFbeta[J].Am J Physiol Gastrointest Liver Physiol,2019,317(2): G195-G202.
[13] Sakata K,Eda S,Lee ES,
.Neovessel formation promotes liver fibrosis via providing latent transforming growth factor-beta[J].Biochem Biophys Res Commun,2014,443(3): 950-956.
[14] Mcmillin M,Grant S,Frampton G,
.The TGF beta1 receptor antagonist GW788388 reduces JNK activation and protects against acetaminophen hepatotoxicity in mice[J].Toxicol Sci,2019,170(2):549-561.
[15] Chen H,Kasagi S,Chia C,
.Extracellular vesicles from apoptotic cells promote TGF beta production in macrophages and suppress experimental colitis[J].Sci Rep,2019,9(1): 5875.
[16] 刘慧敏,王宪波,王融冰.基于解毒凉血法的中西医结合方案治疗乙型肝炎慢加急性肝衰竭疗效分析[J].中西医结合肝病杂志,2011,21(4):197-200.
