江西省山药病原线虫种类鉴定及地理分布
2022-08-08吴彩云范琳娟徐雪亮刘子荣喻吉生康宏波胡平华涂年生彭德良姚英娟
吴彩云, 范琳娟, 徐雪亮, 刘子荣, 喻吉生, 康宏波,胡平华, 涂年生, 彭德良, 姚英娟*
(1. 江西省农业科学院农业应用微生物研究所, 南昌 330200; 2. 江西省吉安市农业科学研究所, 吉安 343119; 3. 江西省吉安市泰和县塘洲镇综合执法队, 吉安 343715; 4. 江西省吉安市永丰县蔬菜产业发展中心, 吉安 331500; 5. 中国农业科学院植物保护研究所, 北京 100193)
山药为薯蓣科Dioscoreaceae薯蓣属Dioscorea多年生草质藤本作物,是江西省重要的蔬菜作物,综合种植效益远高于其他经济作物,常年种植面积约1.3万 hm2。江西省山药品质优异,在国内外享有盛誉[1-2]。然而,长期以来由于受到土地资源和种植习惯等因素的影响,大多数山药田常年连作栽培,土壤环境逐渐恶化,山药线虫病发生日益加重,山药的产量和品质受到了极大影响,严重阻碍了江西省山药的可持续发展[3-4]。姚英娟等[5]报道了江西省山药线虫病的田间发病率一般为30%~80%,严重的甚至达到100%,减产20%~50%,已成为制约江西省山药产业的一大难题。目前,我国山药的病原线虫主要涉及2个属6个种,分别是根结线虫属Meloidogyne的爪哇根结线虫M.javanica[6]、南方根结线虫M.incognita和花生根结线虫M.arenaria[7],以及短体线虫属Pratylenchus的穿刺短体线虫P.penetrans[8]、薯蓣短体线虫P.dioscoreae[9]和咖啡短体线虫P.coffeae[10-11]。南方根结线虫和爪哇根结线虫主要分布在河南、山东等山药产地;穿刺短体线虫主要分布在山东省;咖啡短体线虫主要分布在江苏、山东、安徽、河南等山药产地[10]。然而,关于江西省山药病原线虫却鲜有报道,仅有贺哲等[12]报道了瑞昌山药短体线虫病的病原为咖啡短体线虫,江西省其他地区山药线虫病的病原种类和发生情况等均未见报道。
本研究于2019年-2020年对江西省山药主要种植区的线虫病进行采样调查并对病原进行形态和分子鉴定,明确江西省山药线虫病主要病原线虫种类及地理分布,为进一步研究山药线虫病的发生规律及科学防治奠定理论基础,为江西省山药产业线虫病综合防控和可持续发展提供科学依据。
1 材料与方法
1.1 材料
供试样品:2019年1月至2020年12月,在各山药种植地采用五点取样法随机采集江西省7市27县(市)的共计157份山药块茎样品,标记后带回实验室进行线虫分离。
主要试剂及仪器:10×PCR Buffer(Mg2+free)、蛋白酶K、PremixTaqTM、DNA凝胶回收试剂盒,日本TaKaRa公司;pEASY-T1 Cloning Kit,北京全式金公司。Bio-rad T100 PCR扩增仪(Bio-rad),SPX-250B-Z型生化培养箱(上海博讯);光学显微镜(Nikon);DYCP-31DN电泳仪(北京六一);Tanon 2500凝胶成像系统(Tanon)。
1.2 线虫分离与形态学观察
采用贝尔曼漏斗法分离线虫。将单层厨房用纸均匀铺于漏斗中,切取山药块茎约250 g置漏斗中,加入200 mL无菌水,25℃静置24 h后,接取线虫液约10 mL镜检。从线虫液中挑取单条病原线虫,60℃杀死分离到的线虫后,在显微镜下观察线虫的形态特征,依据刘维志[13]的《植物线虫志》和谢辉[14]的《植物线虫分类学》进行属的鉴定,分别统计各属线虫的数量。山药块茎样品的采集地点和地理信息见表1。
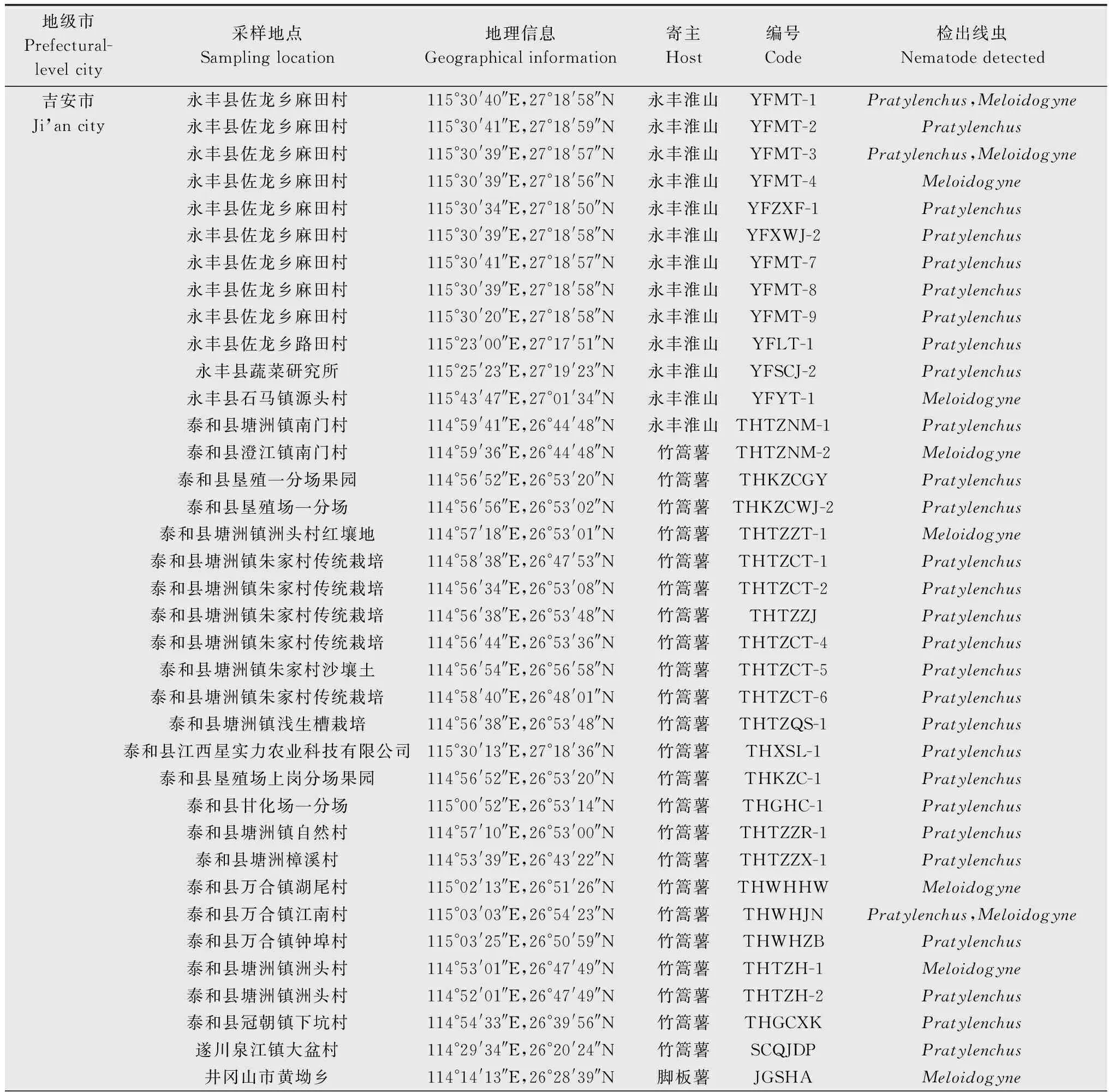
表1 江西省山药线虫样品的采集信息和形态学鉴定结果Table 1 Geographic information and genus identification of nematode populations collected from yam fields in Jiangxi province

续表1 Table 1(Continued)
1.3 线虫的分子鉴定
单条线虫的DNA提取方法参见王江岭等[15]。以单条线虫DNA为模板,采用引物对TW81(5′-GTTTCCGTAGGTGAACCTGC-3′)和AB28(5′-ATATGCTTAAGTTCAGCGGGT-3′)扩增rDNA-ITS区片段,退火温度为55℃[16]。采用引物对D2A(5′-ACAAGTACCGTGAGGGAAAGTTG-3′)和D3B(5′-TCGGAAGGAACCAGCTACTA-3′) 扩增rDNA 28S D2-D3区片段,退火温度为55℃[17]。对于根结线虫属种类的分子鉴定,同时采用引物对NAD5F2(5′-TATTTTTTGTTTGAGATATATTAG-3′)和NAD5R1(5′-CGTGAATCTTGATTTT-
CCATTTTT-3′)扩增mtDNA的Nad5基因片段,退火温度为45℃[18]。PCR反应体系:DNA模板为3 μL,10 μmol/L的上、下游引物各1 μL,2×PremixTaqTM12.5 μL,灭菌ddH2O补足至25 μL。扩增条件为:94℃预变性4 min;94℃变性30 s,55℃/45℃退火30 s,72℃延伸1 min(根据扩增产物大小确定),32个循环;72℃再延伸10 min。PCR产物经琼脂糖凝胶电泳检测后,使用DNA凝胶回收试剂盒进行纯化,用pEASY-T1 Cloning Kit克隆后送至生工生物工程(上海)股份有限公司进行测序。采用DNAstar软件进行序列拼接,对所测序列进行同源性分析,并提交GenBank获得序列号。
1.4 系统进化树的构建和地理分布分析
从GenBank下载相关线虫种类的rDNA-ITS和rDNA 28S D2-D3同源序列并进行序列的相似性分析。采用MEGAX软件构建系统发育树,以大豆孢囊线虫Heteroderaglycines作为外群。通过统计分析明确江西省各地区采集山药样品的线虫种类发生情况。
2 结果与分析
2.1 江西省山药线虫种类的形态鉴定结果
从江西省7市27县(市)共采集山药块茎样品157份,分别采自‘永丰淮山’‘竹篙薯’‘瑞昌山药’‘脚板薯’等山药品种,其中62份有线虫侵染,不同的山药种类均有不同程度的受害情况。山药块茎上分离到的线虫经镜检发现,病原线虫为短体线虫属Pratylenchus和根结线虫属Meloidogyne线虫。短体线虫侵染的块茎表面有近圆形或不规则稍凹陷的褐色病斑,感病严重的块茎病斑上有很多龟裂状的纵向裂纹。切开病茎,纵切面有深褐色或黄褐色的黏腐糊状病组织,严重时,块茎腐烂并散发腐臭气味。根结线虫侵染的块茎表面呈暗褐色,多数块茎畸形。在线虫侵入点附近肿胀,凸起,形成许多大小不一的根结,发病严重的块茎产生疙瘩,表皮腐烂。
2.2 分子鉴定结果
为进一步确定线虫的种类,从物种水平准确区分开,本研究对表1中发病率高的地区中共11份线虫样品进行了分子鉴定。种群编号为THTZCT-2、THTZH-2、YFZXF-1、THTZQS-1、THKZCWJ-2、YFMT-2、YFSCJ-2、YFXWJ-2、THTZZJ的病原线虫ITS序列扩增产物大小为1 035~1 041 bp,rDNA 28S D2-D3区序列扩增产物大小为759~782 bp。序列经克隆测序后,于NCBI中BLAST同源性检索为咖啡短体线虫P.coffea,GenBank登录号详见表2。编号为JJMHL-2的病原线虫ITS序列扩增产物为558 bp,rDNA 28S D2-D3区序列扩增产物大小为759 bp,BLAST同源性检索为南方根结线虫M.incognita。编号为RCFZ-1的病原线虫ITS序列扩增产物为557 bp,BLAST检索发现与埃塞俄比亚根结线虫M.ethiopic(KY882495)的序列相似性最高,为92.13%。rDNA 28S D2-D3区序列扩增产物大小为760 bp,BLAST检索与南方根结线虫M.incognita多个序列相似性高达99.21%。为了进一步确定该线虫种类,对该线虫的Nad5基因扩增并测序,BLAST检索为南方根结线虫。部分山药样品中病原线虫PCR检测结果见图1。

图1 山药样品中病原线虫PCR扩增产物电泳图Fig.1 Electrophoresis of PCR product from genes of pathogenic nematode in yam samples

表2 山药样品中线虫分子鉴定结果Table 2 Molecular identification results of nematodes in yam samples
2.3 病原线虫种群系统发育树分析
将测定的序列与不同地区的短体线虫和根结线虫种群的序列进行比对后构建系统进化树(图2),选择大豆孢囊线虫H.glycines作为外群。基于ITS序列构建的系统发育树结果显示,山药样品中分离的短体线虫属线虫(种群编号为THTZCT-2、THTZH-2、YFZXF-1、THTZQS-1、THKZCWJ-2、YFMT-2、YFSCJ-2、YFXWJ-2、THTZZJ)与咖啡短体线虫聚为1个分支,样品中分离的根结线虫属线虫(种群编号为RCFZ-1和JJMHL-2)与南方根结线虫聚为1个分支。此外,基于rDNA 28S D2-D3序列构建的系统发育树也得到一致的结果。

图2 基于rDNA-ITS序列和rDNA 28S D2-D3区序列的病原线虫系统发育树Fig.2 Phylogenetic tree of pathogenic nematodes based on rDNA-ITS sequences and rDNA 28S D2-D3 sequences
2.4 江西省山药线虫的种类和地理分布
对江西省157份山药块茎样品的线虫发生情况进行统计分析,吉安市、九江市、宜春市、赣州市和抚州市山药主产区均存在线虫危害情况,萍乡市和南昌市山药样品中未检测到病原线虫(表3)。在62份线虫侵染样品中,短体线虫属侵染样品有45份(含根结线虫属与短体线虫属复合侵染的山药样品8份),占总山药线虫侵染样品数的72.6%;根结线虫属侵染样品有27份(含两类线虫复合侵染的山药样品8份),占总山药线虫样品数的43.5%。在吉安市62份山药样品中,短体线虫属单一侵染样品有27份,根结线虫属单一侵染样品有7份,短体线虫属线虫和根结线虫属线虫复合侵染的山药样品有3份,咖啡短体线虫为优势种群。对吉安市的山药样品进一步分析,发现永丰县和泰和县的线虫发病率较高,其中永丰县的山药线虫侵染率为66.7%,泰和县的山药线虫侵染率高达88.9%,而在遂川县、吉水县、吉安县、万安县的山药样品中均未发现病原线虫。

表3 江西省采集山药样品线虫侵染的发生情况Table 3 The occurrence of nematode infection in yam collected in Jiangxi province
咖啡短体线虫是江西省山药主产区的优势种群,在吉安市、九江市、抚州市和赣州市等地均广泛分布,其中吉安市永丰县和泰和县两地危害最为严重。南方根结线虫虽不是优势种群,但在江西省大部分地区都有零星发生。此外,样品中也存在单一种群侵染和复合种群侵染的情况。
3 讨论
线虫病的危害是目前山药种植中的一个重要问题,严重制约山药产业的发展。而要实现对山药线虫病的治理,首先必须对其线虫种类进行鉴定,明确其在山药主产区的分布,才能有的放矢制定治理策略。
利用形态学特征及分子生物学鉴定相结合的方法对病原线虫种类鉴定是国内外研究者常采用的研究方法,其准确性和可靠性较高[19-20]。本文对江西省各地的山药种植区进行取样,共取得山药块茎样品157份,分别采自‘永丰淮山’‘竹篙薯’‘瑞昌山药’‘脚板薯’等山药品种。通过病原线虫分离,形态学观察共获得62份病原线虫侵染的样品,且不同的山药种类均有不同程度的受害情况。通过分子生物学技术对病原线虫进行种类鉴定,明确了病原线虫种类为咖啡短体线虫和南方根结线虫。将咖啡短体线虫的rDNA-ITS序列和28S序列进行同源性分析,发现同源性结果与采样地理来源之间没有明显关系。其中采自吉安市泰和县塘洲镇的短体线虫(编号为THTZQS-1),其rDNA-ITS序列和28S序列突变/插入率均比其他地区的线虫要高,采用高保真酶得到的序列也是如此。此现象产生原因是否与田间环境有关,需要进一步研究。
本研究通过对江西省山药主产区7市27县的山药进行取样,明确了病原线虫为咖啡短体线虫和南方根结线虫,咖啡短体线虫在江西大多地区都有广泛分布,为江西省山药主产区的优势种群。南方根结线虫主要在九江、宜春等地分布较多。值得注意的是,江西山药主产区中,以吉安市永丰县和泰和县两地的山药线虫危害最为严重,山药线虫侵染率分别为66.7%和88.9%,且线虫种类多为咖啡短体线虫。这可能与当地种植品种单一、种植年限长、种植习惯和山药的常年连作等有关。有研究表明,农户的一些错误种植习惯,如施肥不当,会引发土壤盐渍化和理化性状改变;连作导致土壤养分分布不均衡,土壤线虫和有害微生物增多且顽固,土壤微生物间的拮抗作用削弱,均会加重土传线虫病的发生[21-23]。
综上所述,本研究表明江西省山药病原线虫主要为咖啡短体线虫和南方根结线虫。咖啡短体线虫在江西省大部分地区都有广泛分布,是江西省山药主产区的优势种群,且以吉安市永丰县和泰和县两地的线虫危害最为严重。南方根结线虫明显较咖啡短体线虫少,虽不是优势种群,但是分布也比较广泛。本研究基本明确了江西省山药种植区引起线虫病的线虫种类和地理分布情况,为山药线虫病的防治提供了理论指导。
