梨立枯丝核菌果腐病菌生长条件及寄主范围测定*
2022-08-04吴屿硕阎维巍张鑫楠葛永红贾晓辉
吴屿硕,阎维巍,张鑫楠,葛永红,贾晓辉
(1 渤海大学食品科学与工程学院,辽宁锦州 121013)
(2 中国农业科学院果树研究所)
梨是我国主要果树树种,其栽培面积和产量均居世界第1 位。2018 年我国梨的栽培面积达94.34万hm2,占全国水果种植面积的7.94%;2018 年我国梨的产量达1 607.8 万t,占全国水果总产量的6.26%[1]。然而,近年来在我国梨贮藏企业中发现的新病害——立枯丝核菌果腐病(Rhizoctonia solani),对贮藏企业造成了潜在的威胁。
R.solani是丝核菌属中最复杂、最庞大的多核丝核菌[2]。其无性态属于无孢目丝核菌属,有性态为担子菌门瓜亡革菌[3]。一般在田间多为无性态,其寄主范围极广,至少可侵染263 种植物,包括水稻、玉米、大豆、马铃薯等[4-7]。据报道,该病原菌可引起草莓根腐病[8]、西瓜立枯病[9]、甜瓜果腐病[10]、烟草靶斑病[11]、马铃薯黑痣病[12]、水稻纹枯病[13]、玉米纹枯病[14]、甘蓝黑根病[15]、娃娃菜褐腐病[16]、荞麦立枯病[17]、棉花立枯病[18]等。迄今为止,关于立枯丝核菌果腐病菌生长条件尚未见系统研究,该病原菌是否能侵染其他树种果实也不明确。
因此,本研究以R.solani为对象,探讨离体条件下不同培养基、温度、pH 值、光照条件、碳源、氮源对其生长特性的影响,同时研究R.solani对不同寄主的致病力,以期为进一步研究立枯丝核菌果腐病发病机理及其合理有效防控提供理论依据。
1 材料与方法
1.1 试验材料
(1)供试菌株。从自然腐烂的梨果实病健交界处分离R.solani,纯化鉴定后低温保存于马铃薯葡萄糖琼脂培养基(Potato Dextrose Agar,PDA)上。使用前将保存的菌株从4 ℃左右的冰箱取出后,挑取少量菌丝接种至PDA 平板上,在25 ℃的恒温培养箱中培养,待菌落直径达平皿的2/3 时,用直径为5 mm 的打孔器打取菌饼,接种至用酒精消毒后的黄冠梨表面,置于25 ℃的恒温培养箱中。培养第5 d,采用常规组织分离法分离病原菌,并进行纯化,获得复壮菌株,备用。
(2)供试培养基。PDA、马铃薯蔗糖琼脂培养基(Potato Saccharose Agar,PSA)、平板计数琼脂培养基(Plate Count Agar,PCA)、燕麦粉培养基(Oatmeal Agar,OA)、察氏培养基(Czapek-Dox Medium)、梨汁培养基(马铃薯粉20 g,琼脂粉18 g,过滤黄冠梨纯梨汁1 000 mL)。
1.2 试验方法
1.2.1 不同培养基对菌丝生长和菌核形成的影响
将供试培养基高温灭菌后,各取10 mL,倒入直径为90 mm 的培养皿内,冷却备用。用内径为5 mm 的打孔器打取同一菌龄的菌饼,转接至不同培养基平板上,置于25 ℃恒温培养箱中全光照培养。每天观察菌落生长情况,3 d 后采用十字交叉法测量菌落直径,每个处理重复5 次,每个重复3 个平板。计算不同培养基中R.solani菌丝生长速率,并在培养20 d 后观察菌核形成情况。
1.2.2 不同温度对菌丝生长和菌核形成的影响
用打孔器打取直径为5 mm 的菌饼接种至PDA培养基平板中央位置,分别置于5、10、15、20、25、30、35 ℃恒温培养箱中,采用全光照模式,培养3 d 后采用十字交叉法测量菌落直径,每个处理重复5 次,每个重复3 个平板。观察菌丝生长情况,并计算不同温度下R.solani菌丝生长速率,并在培养20 d 后观察菌核形成情况。
1.2.3 不同pH 值对菌丝生长和菌核形成的影响
用1 mol/L 稀盐酸或1 mol/L NaOH 溶液将PDA培养基调至所需pH 值(4.0、5.0、6.0、7.0、8.0、9.0、10.0),灭菌后取10 mL 倒入培养皿中,用打孔器打取直径5 mm 的菌饼接种至PDA 培养基平板中央,用封口膜密封后在25 ℃恒温培养箱中全光照培养,每天观察菌落生长情况,培养3 d 后用十字交叉法测量菌落直径,每个处理重复5 次,每个重复3 个平板。计算不同pH 值条件下R.solani菌丝生长速率,并在培养20 d 后观察菌核形成情况。
1.2.4 不同光照对菌丝生长和菌核形成的影响
用打孔器打取直径为5 mm 的菌饼接种至PDA培养基平板中央位置,用封口膜密封后在25 ℃恒温培养箱中培养,分别置于全光照(光照∶黑暗=24 h∶0 h)、全黑暗(光照∶黑暗=0 h∶24 h)、光暗交替(光照∶黑暗=12 h∶12 h)环境中,隔天观察菌落生长情况,培养3 d 后采用十字交叉法测量菌落直径,每个处理重复5 次,每个重复3 个平板。计算不同光照中R.solani菌丝生长速率,并在培养20 d 后观察菌核形成情况。
1.2.5 不同碳源对菌丝生长和菌核形成的影响
用打孔器打取直径为5 mm 的菌饼接种至以果糖、葡萄糖、半乳糖、乳糖、淀粉、麦芽糖和木糖为碳源的PDA 培养基平板中央位置,用封口膜密封后在25 ℃恒温培养箱中全光照培养,培养3 d 后采用十字交叉法测量菌落直径,每个处理重复5 次,每个重复3 个平板。计算不同碳源中R.solani菌丝生长速率,并在培养20 d 后观察菌核形成情况。
1.2.6 不同氮源对菌丝生长和菌核形成的影响
用打孔器打取直径为5 mm 的菌饼接种至以0.5%的氯化铵、硫酸铵、甘氨酸、磷酸二氢铵、硝酸铵、硝酸钾和谷氨酸为氮源的PDA 培养基平板中央位置,用封口膜密封后在25 ℃恒温培养箱中全光照培养,培养3 d 后采用十字交叉法测量菌落直径,每个处理重复5 次,每个重复3 个平板。计算不同氮源中R.solani菌丝生长速率,并在培养20 d后观察菌核形成情况。
1.2.7 寄主范围测定
按照柯赫氏法则,采用有伤接种方式进行离体果实致病性测定。选取大小一致、无机械伤、病虫害的梨、苹果、香蕉、蓝莓、葡萄、橙、猕猴桃、桃、李、枣共10 个树种的12 个品种果实各30 个,经70%的酒精表面消毒后用无菌水冲洗,自然晾干后备用。取在PDA 上培养5 d 的菌饼,菌丝面向下直接接种至果实胴部位置;以PDA 圆饼直接接种至果实胴部位置作为对照。将处理好的果实放在密封塑料袋中,然后将其置于25 ℃的恒温培养箱中培养,每天观察病斑扩展情况,第10 d 测定病斑直径。将发病部位进行常规组织分离,通过形态学鉴定是否为接种菌种。
1.3 数据处理
试验数据采用Microsoft Excel 2010 软件进行统计分析,使用SPSS 26.0 统计分析软件对试验数据进行方差分析。
2 结果与分析
2.1 病原菌离体生长条件
2.1.1 不同培养基对菌丝生长和菌核形成的影响
由表1 可知,R.solani在6 种培养基中均能生长,其中在察氏培养基上生长速率最快,培养3 d时生长速率为24.70 mm/d,且浓密;在PCA 培养基上菌丝生长也较快,但与察氏培养基上相比较稀疏;在梨汁培养基上菌丝生长较慢。可见在6 种培养基中,察氏培养基为R.solani生长的最适培养基。
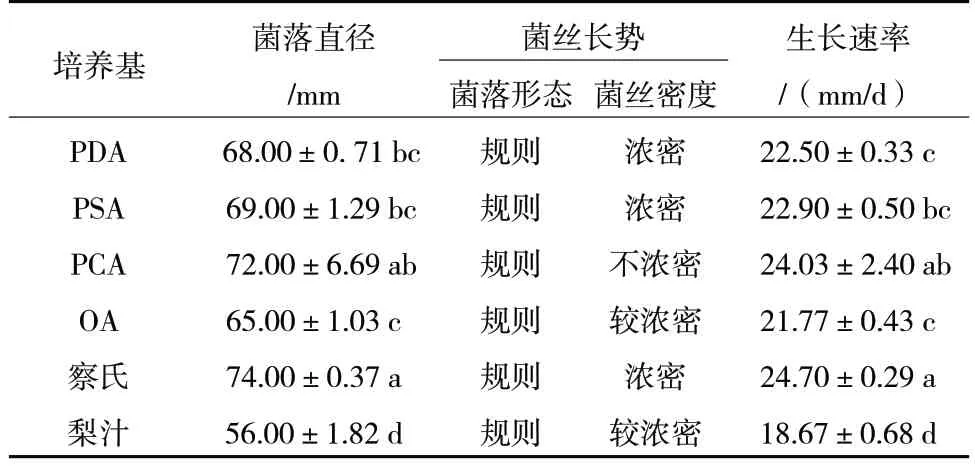
表1 不同培养基对R.solani 菌丝生长的影响
由图1 可知,R.solani菌核在6 种培养基中均能形成,在PDA 培养基上形成菌核数量最多,其次是OA 培养基,而PSA 培养基和PCA 培养基不利于菌核的形成。因此,适合R.solani菌核生长的培养基顺序是PDA 培养基>OA 培养基>察氏培养基>梨汁培养基>PCA 培养基>PSA 培养基。

图1 不同培养基对R.solani 菌核的影响
2.1.2 不同温度对菌丝生长和菌核形成的影响
由表2 可知,R.solani菌丝在5~10 ℃条件下不生长;在15~35 ℃条件下均能生长,各温度之间均存在显著性差异,生长速率依次为25 ℃>30 ℃>20 ℃>15 ℃>35 ℃,25 ℃时菌丝浓密。因此,R.solani生长最适温度为25 ℃。
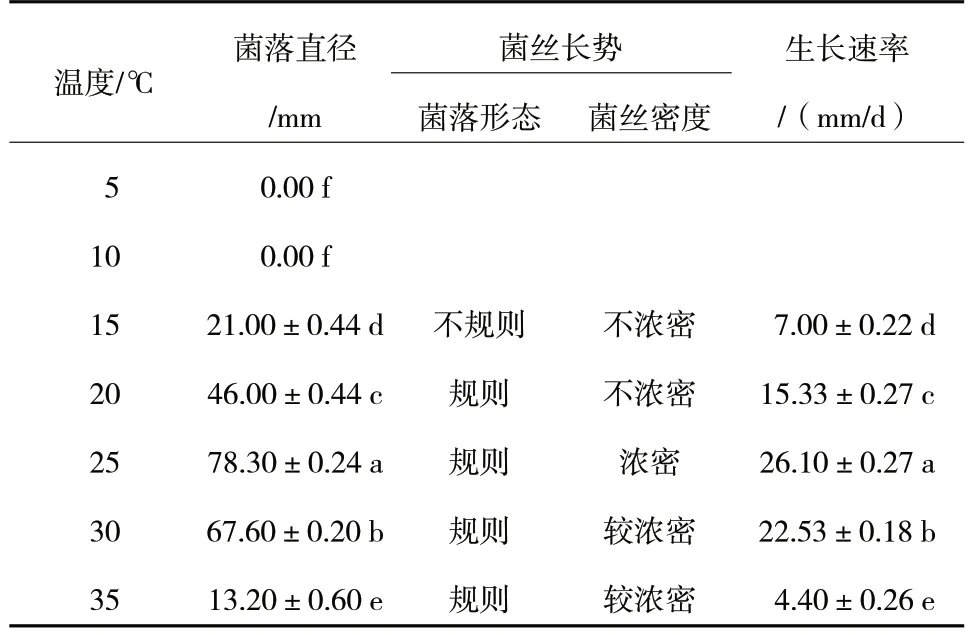
表2 不同温度对R.solani 菌丝生长的影响
从图2 可以看出,温度对R.solani菌核形成有一定的影响,在15~35 ℃条件下均可形成菌核,并随着温度的升高,菌核形成数量增加,但35 ℃时菌核明显减少。因此,25~30 ℃培养有利于R.solani形成菌核且数量较多。

图2 不同温度对R.solani 菌核的影响
2.1.3 不同pH 值对菌丝生长和菌核形成的影响
由表3 可知,在pH 值4.0~10.0 范围内R.solani菌丝均能生长,在培养3 d 时,pH 值5.0~6.0 培养基中菌落直径显著高于其他pH 值条件,且菌丝浓密。当pH 值小于5.0 时,菌落直径随pH 值的降低而减小。当pH 值大于6.0 时,菌落直径随pH 值的增大而减小。因此,R.solani生长的最适宜pH 值为5.0~6.0。
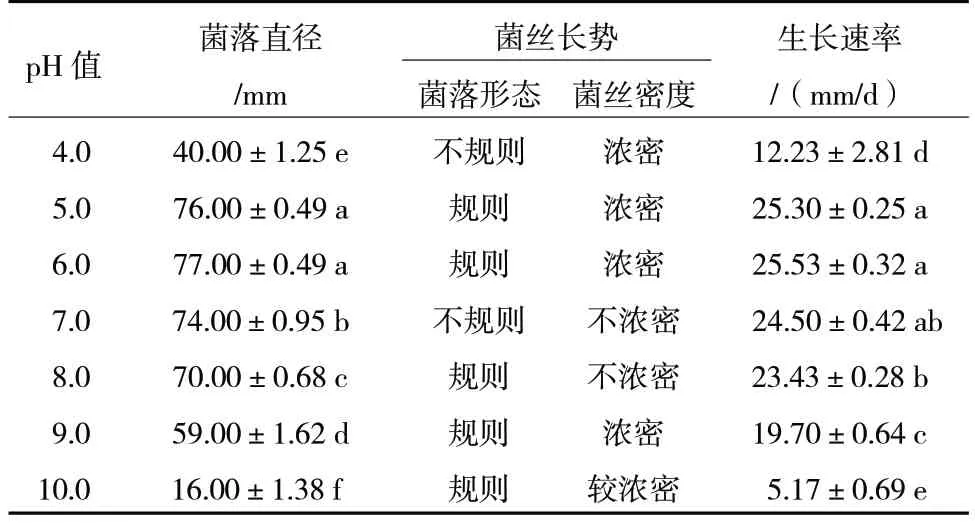
表3 不同pH 值对R.solani 菌丝生长的影响
从图3 可以看出,R.solani菌核在pH 值4.0~10.0 范围内均能形成,并且在pH 值5.0~7.0 条件下随着pH 值升高菌核数量逐渐增加,但pH 值达到8.0 时菌核数量明显减少。因此,pH 值为5.0~7.0 时利于R.solani形成菌核且数量较多。

图3 不同pH 值对R.solani 菌核的影响
2.1.4 不同光照对菌丝生长和菌核形成的影响
由表4 可知,R.solani菌丝在3 种光照条件下均能生长,其中全光照条件最适宜病原菌生长。在培养3 d 时,菌落直径可达70.00 mm,显著高于光暗交替和全黑暗条件,菌丝生长快且浓密。因此,R.solani菌丝生长最适光照条件为全光照。

表4 不同光照对R.solani 菌丝生长的影响
如图4 所示,R.solani在不同光照条件下均可形成菌核,在全光照条件下产生的菌核数量最多,并且颜色较深;其次是全黑暗条件;而在12 h 光照/12 h 黑暗条件下产生的菌核数量较少,且生长较分散。因此,全光照可以促进R.solani菌核的形成。

图4 不同光照对R.solani 菌核的影响
2.1.5 不同碳源对菌丝生长和菌核形成的影响
由表5 可知,R.solani在含有不同碳源的7 种培养基中均能生长,但生长速率不同,在麦芽糖作为碳源的培养基上生长最快,培养3 d 时菌落直径为78.00 mm;在淀粉作为碳源的培养基上生长较快,菌落直径为77.00 mm;在含有不同碳源的7 种培养基中,相对不利于病原菌生长的碳源是乳糖,菌落直径为40.00 mm。因此,R.solani生长的最适碳源为麦芽糖。
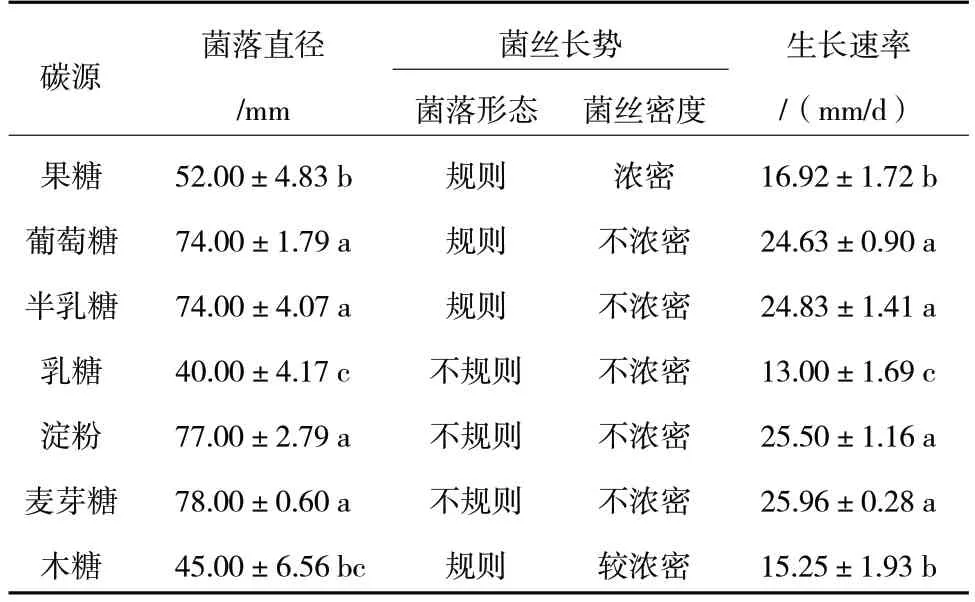
表5 不同碳源对R.solani 菌丝生长的影响
由图5 可知,以果糖、葡萄糖、半乳糖、乳糖、淀粉、麦芽糖作为碳源,菌核均在中央形成,但数量未见明显差异;木糖作为碳源,菌核在距离中心较远处形成。由此说明,R.solani菌核形成与碳源的关系不密切。

图5 不同碳源对R.solani 菌核的影响
2.1.6 不同氮源对菌丝生长和菌核形成的影响
由表6 可以看出,R.solani在含有不同氮源的7种培养基中均能生长,在甘氨酸作为氮源的培养基上生长较快,生长速率为19.83 mm/d,培养3 d 时菌落直径为59.50 mm;在含有不同氮源的7 种培养基中,相对不利于病原菌菌丝生长的氮源是氯化铵,培养3 d 时菌落直径仅10.90 mm。因此,R.solani生长的最适氮源为甘氨酸。
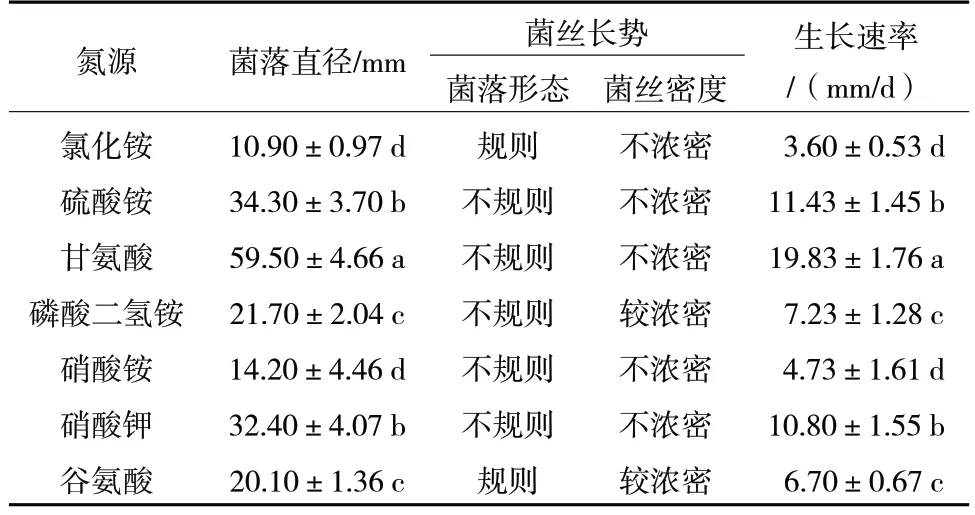
表6 不同氮源对R.solani 菌丝生长的影响
由图6 可知,不同氮源与R.solani菌核形成量有一定关系。氯化铵作为氮源时,菌核形成较多;谷氨酸作为氮源时,无明显菌核形成。因此,适合R.solani菌核形成的氮源依次为氯化铵>硝酸铵>硫酸铵>硝酸钾>甘氨酸>磷酸二氢铵>谷氨酸。

图6 不同氮源对R.solani 菌核的影响
2.2 寄主范围测定
由表7 可知,R.solani除了可侵染梨果实外,还可侵染苹果、香蕉、桃、李、枣等果实,但不侵染蓝莓、葡萄、橙和猕猴桃果实。R.solani对梨的侵染能力最强,接种到梨上的病斑直径基本显著高于其他树种,并且对不同梨品种的侵染能力差异显著,其中,早酥和黄冠梨接种后病斑直径显著高于三季梨;对不同苹果品种的侵染能力同样差异显著,秋香苹果接种后病斑直径显著高于富士苹果。
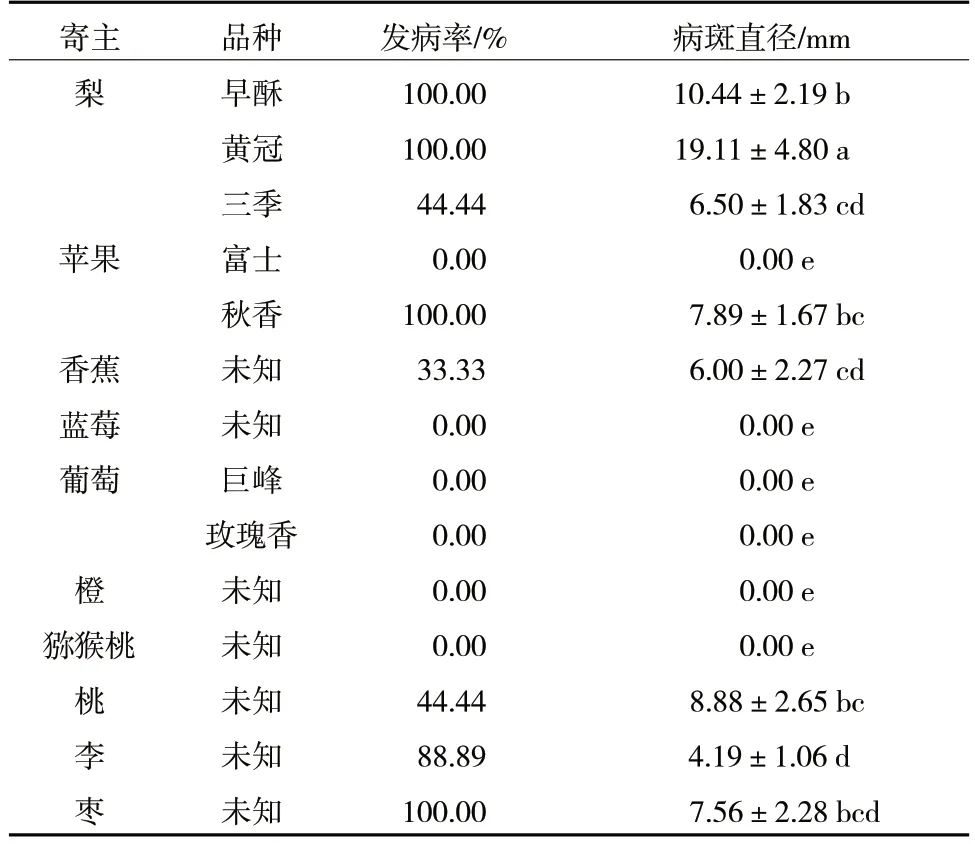
表7 R.solani 寄主范围测定
将发病部位进行常规组织分离,培养物通过形态学鉴定与供试菌株特性一致,证实发病部位是由R.solani侵染所导致。
3 讨论与结论
已有研究认为,立枯丝核菌(R.solani)是最具破坏力的植物病原菌之一[19]。其引起的根腐病于1904 年最早在美国烟草植株上报道[20]。目前,进一步明确其寄主范围广、危害大,主要危害禾本科、茄科、豆科和十字花科等43 科260 多种植物[21]。本研究表明,R.solani除可侵染梨果实外,还可侵染苹果、香蕉、桃、李、枣等果实。本研究采用无伤接种方式进行致病性试验,可见,R.solani对上述果实具有较强的侵染能力。而对不同苹果、梨品种间的致病力仍存在较大差异,在黄冠梨及秋香苹果果实上致病力较强,说明选择抗病品种是防控该病害发生的有效途径。
本研究表明,R.solani菌丝生长最适培养基为察氏培养基。这与洪恺等[22]研究发现辽宁花生R.solani引起的基腐病结果不一致。可能是由于该病原菌的寄主不同导致的结果不同,并且与PDA 培养基中来自马铃薯的氮源不同的是本研究中察氏培养基的氮源为硝酸盐。根据上述研究结果可知,R.solani菌丝在硝酸盐作为氮源的条件下,生长较好;R.solani菌核形成最适培养基为PDA 培养基,可能是由于PDA 培养基的碳源为葡萄糖,而察氏培养基中的碳源为果糖。R.solani菌丝在15~30 ℃温度范围内均可快速生长,并且大豆根腐病中的R.solani在15~30 ℃温度范围内生长较快[23];R.solani在15~30 ℃温度范围内均可形成菌核,小麦纹枯病中的R.solani在15~30 ℃温度范围内有菌核形成,并且温度在25~30 ℃条件下最有利于形成菌核且数量较多、个体较大[24]。R.solani菌丝在pH 值为5.0~6.0 范围内生长良好,pH 值为6.0 时菌丝生长速度最快且菌核形成较多。R.solani菌丝在PDA 培养基上于25 ℃、全光照培养条件下平均生长速率为22.50 mm/d,属于已有真菌中生长速度较快的病原菌。R.solani生长速度快的特性意味着该病原菌具有较好的适应能力,加大了梨果腐病病害的防控难度。全光照培养的R.solani菌丝生长最快,这与王文慧等[24]研究发现马铃薯R.solani引起的黑痣病结果不一致,马铃薯黑痣病中的R.solani属于AG-3,可能是由于梨果腐病中该病原菌的菌丝融合群与马铃薯黑痣病的菌丝融合群不同导致;且在全光照条件下菌核形成数量较多,小麦纹枯病中的R.solani在全光照条件下产生的菌核数量最多[25]。在不同碳源、氮源培养基上,该病原菌的生长有所差异。以麦芽糖为碳源的培养基最适合病菌生长和菌核形成;以甘氨酸为氮源的培养基病菌生长最快,且菌核形成数量较多,对于烟草靶斑病中的R.solani菌丝生长及菌核形成,甘氨酸是较好的氮源[26]。R.solani病原菌在自然界中存在一定的遗传多样性,是否存在致病性分化,还有待于进一步研究。
