PET微塑料对污泥和厨余垃圾共消化的影响
2022-08-01郭雨文任连海
郭雨文,曾 蓓,高 星,王 攀*,任连海**
(北京工商大学生态环境学院,国家环境保护食品链污染防治重点实验室,北京 100048)
0 前言
我国污水处理厂的剩余污泥产量巨大,2019 年污泥产量(80 %含水率)已达到6 000 万吨[1]。作为污水处理的副产物,剩余污泥中含有多种污染物质,如重金属、难降解物质、微塑料以及抗生素抗性基因等[2]。同时剩余污泥中也含有丰富的有机质,通常采用厌氧消化得到燃料(如沼气、氢气等)的方式来处理[3]。厨余垃圾富含有机物,极易腐败酸化。一旦处置不当,会引起病原菌的传播,从而对人体健康构成威胁。在目前的处置方式(填埋、堆肥、焚烧、厌氧消化)中,厌氧消化是最常用的解决方案。有学者提出将剩余污泥和厨余垃圾混合进行厌氧共消化,可以增加有机物的消耗和产气量,稳定厌氧消化的连续运行[4]。然而,研究表明污水处理工艺段中剩余污泥会积累99%的微塑料,其微塑料浓度范围为1.5×103~2.4×104颗/kg TS[5]。微塑料是粒径小于5 mm的聚合物颗粒。除了大塑料破碎形成的微塑料外,还有大量微塑料是人工制造的,例如用于个人护理和化妆品[6]。微塑料的研究最初集中在河流、湖泊、河口、海岸线和海洋生态系统[7]。目前关于微塑料的毒性来源于各种添加剂的浸出,如聚氯乙烯(PVC)通过浸出双酚A(BPA)抑制厌氧体系内的微生物活性,并增加氧化应激[8];而聚对苯二甲酸乙二醇酯(PET)微塑料通过浸出有毒邻苯二甲酸二丁酯(DBP)抑制废弃活性污泥碱性厌氧消化中的水解、酸化和乙酸生成[9]。剩余污泥中,PET 微塑料普遍存在,且含量较高,因此研究其对于厌氧共消化的影响至关重要[10]。
然而,目前还没有关于PET 微塑料对剩余污泥和厨余垃圾厌氧共消化影响的研究,并且微塑料粒径对厌氧共消化的影响尚不清楚。本研究旨在探究PET微塑料(30 μm 和250 μm)在0、0.45、1.44、2.88 mg/g TS的添加量下对共消化反应器中甲烷产量和性能及厌氧共消化体系中微生物群落结构的影响。
1 实验部分
1.1 主要原料
剩余污泥,北京污水处理厂;
厨余垃圾,北京工商大学食堂的果蔬残渣;
接种污泥,山东省某厂污水处理的厌氧工段;
PET微塑料,粒径为250 μm和30 μm,北京半夏科技发展有限公司;
氢氧化钠(NaOH)、盐酸(HCl)、硫酸(H2SO4)、酒石酸钾钠、纳氏试剂、石油醚,分析纯,国药集团化学试剂有限公司;
邻苯二甲酸氢钾、氯化铵(NH4Cl),优级纯,国药集团化学试剂有限公司;
乙酸、丙酸、正丁酸、异丁酸,优级纯,上海麦克林生化科技有限公司;
Fast DNA®土壤DNA 提取试剂盒,MP 生物医疗有限责任公司;
材料的TS、挥发性固体(VS)、碳氮比、氢离子浓度指数(pH值)、脂肪和蛋白质含量等基本特性见表1。

表1 实验底物的理化参数Tab.1 Physical and chemical characteristics of the substrate
1.2 主要设备及仪器
电子天平,ME104E/02,梅特勒托利多科技(中国)有限公司;
马弗炉,SX-G07123,天津中环电炉股份有限公司;
智能高速冷冻离心机,3H20RI,湖南赫西仪器装备有限公司;
紫外分光光度计,UV754N,上海佑科仪器仪表有限公司;
电热鼓风干烘箱,DHG-9070,上海一恒科学仪器有限公司;
数显水浴恒温振荡器,SHA-C,常州荣华仪器制造有限公司;
可调速旋涡混合器,VORTEX-GENIE2,美国Scientific Industries公司;
快速消解仪,5B-1F,连华科技股份有限公司;
凯氏定氮仪,KDN-2c,上海纤检仪器有限公司;
元素分析仪,Vario EL/micro cube,德国Elementar公司;
气相色谱仪,GC-7900,上海天美科学仪器有限公司;
气相色谱仪,GC-2014C,岛津企业管理(中国)有限公司。
1.3 样品制备
剩余污泥和厨余垃圾作为消化底物,底物和接种物按照干物质质量比2∶1,碳氮比为8,总质量为300 g(用水调节TS=7.05 %、VS=5.83 %)。pH 值使用6 mol 的NaOH 进行调整。用氮气(99.9%)冲洗反应器120 s并用橡皮塞密封保持厌氧,置于37 ℃恒温摇床(120 r/min)中,直到累积甲烷产量稳定后停止厌氧消化实验。剩余污泥中微塑料的粒径大致分布在25~500 μm[9-10],所以选择粒径为250、30 μm的PET微塑料为添加物,实验设置3 个水平(0.48、1.44、2.88 mg/g TS,换算成质量为0.016 3、0.048 8、0.097 5 g)和一个空白对照组。微塑料的添加量主要参考了剩余污泥中PET 微塑料的含量(28~12 000 μg/g TS)[11]。在厌氧消化过程中,每隔2 天测量产气量并检测沼气组分,并从反应器中取2 g混合物样品,然后以8 000 r/min的转速离心12 min。经0.45 μm滤膜过滤后,上清液用于分析溶解性化学需氧量(SCOD)、氨氮和挥发性脂肪酸(VFAs)。
1.4 性能测试与结构表征
TS采用105 ℃干燥重量法测定;
VS采用马弗炉灼烧重量法测定;
SCOD采用快速消解法(HJ/T 399—2007)测定;
氨氮采用纳氏试剂分光光度法(HJ 535—2009)测定;
粗脂肪采用索氏提取法(GB/T 14772—2008)测定;
粗蛋白采用凯氏定氮法(GB 5009.5—2016)测定;
沼气量采用排水法测定;
沼气组分采用气相色谱法(热导检测器),进样口温度为150 ℃、检测器温度为150 ℃、柱温为80 ℃、电流为50 mA;采用高纯氮气作为载气,进气量为1 mL;
VFAs(乙酸、丙酸、丁酸)采用气相色谱法,采用火焰离子化检测仪(FID),FFAP 色谱柱,进样口温度为250 ℃、检测器温度为250 ℃,采用高纯氮气作为载气,进样量为1 μL[12];
微生物群落分析用Fast DNA®土壤DNA 提取试剂盒提取样品DNA,DNA的纯度和浓度通过琼脂糖凝胶电泳检测。使用Tru Seq®DNA PCR-Free Sample Preparation Kit 建库试剂盒进行文库构建,然后使用Nova Seq6000进行上机测序;
通过SPSS 25 软件进行单因素方差分析以检查显着性,p<0.05被认为具有统计学意义。
2 实验部分
2.1 微塑料对厌氧共消化系统产甲烷性能的影响
图1 为不同粒径PET 微塑料对剩余污泥和厨余垃圾中温厌氧共消化的影响。添加了PET微塑料的反应器中累积甲烷产量显著低于对照组(p<0.05)。在投加量为2.88 mg/g TS 时,30 μm 组和250 μm 组反应器中的累积甲烷产量与对照组相比,分别降低了54.49 %和49.58 %。在厌氧消化反应第10 天,对照组的累积甲烷产量为(301.88±11.63)mL/(g·VS)。在PET 微塑料的添加量为0.48、1.44、2.88 mg/g TS时,如图1(a)所示,30 μm组甲烷产量下降至(200.38±12.43)、(165.05±9.90)、(137.39±11.80)mL/(g·VS)。而如图1(b)所示,250μm组的甲烷产量下降到(231.49±12.03)、(168.40±11.80)、(152.19±11.37)mL/(g·VS)。说明微塑料会抑制共消化系统中的甲烷产生。
如图1(c)、(d)所示,所有组的每日甲烷产量在第2 天出现峰值。对照组在第2 天的每日甲烷产量为(93.06±0.44)mL/(g·VS);而添加了250 μm 微塑料的反应器中,3 个添加量的每日甲烷产量分别为(49.25±0.06)、(38.220±0.63)、(36.11±0.56)mL/(g·VS)。其中,PET 添加量为2.88 mg/g TS 时,日产甲烷产量低于对照组61.20 %。30 μm 组3 个投加量的日产甲烷量分别为(38.96±0.74)、(34.65±0.45)、(29.34±0.63)mL/(g·VS);PET添加量为2.88 mg/gTS 时,每日甲烷产量与对照组相比降低了68.48 %。先前的研究表明,产甲烷菌的丰度和辅酶F420的活性受到微塑料的抑制,最终阻碍了甲烷的产生[8,13]。张等[13]从添加了PET 微塑料的反应器中检测出DBP,并用PET 的浸出物DBP 代替PET 微塑料进行厌氧消化,发现甲烷产量呈现相似的抑制情况,验证了微塑料的毒性是由于浸出DBP。

图1 不同粒径PET微塑料对剩余污泥和厨余垃圾厌氧共消化中累计甲烷产量和每日甲烷产量的影响Fig.1 The effect of different PET microplastics on cumulative methane production and daily methane production of anaerobic codigestion of sewage sludge and food wastes
2.2 微塑料对厌氧共消化性能的影响
在剩余污泥和厨余垃圾厌氧共消化过程中,反应器内SCOD 的变化如图2(a)、(b)所示。而各组SCOD反应开始时约为15 g/L,前5 天逐渐升高,随之开始下降。对照组在第5 天时SCOD 的浓度达到最大,为(39.98±1.55)g/L。而添加了微塑料的反应器中SCOD 均略高于对照组。随着微塑料浓度的增加,反应器中SCOD 有所下降。这与魏等[13]的结果相似,说明微塑料的添加会增加底物的溶解。但30 μm和250 μm的微塑料对SCOD 影响不同,添加30 μm 的微塑料,在添加量为1.44、2.88 mg/g TS 时,SCOD 浓度的最高值出现在第6 天,说明小粒径的PET 微塑料在高浓度下,会延后有机质的水解,延长消化周期。
微塑料对厌氧消化过程中氨氮的影响见图2(c)、(d)。底物中的蛋白质经过水解会转化为氨基酸,进一步转化为氨氮[14]。但当氨氮浓度高于2 000 mg/L 时,会产生氨抑制,抑制产甲烷菌的活性[15]。氨氮浓度在1~5天逐渐增高,但随着共消化的进行,第5 天之后,氨氮浓度又开始下降。对照组中,氨氮浓度在第5 天为2.29 g/L。而添加了微塑料的反应器中,氨氮浓度基本高于对照组。30 μm 组中添加量为0.48、1.44、2.88 mg/g TS 时,最大氨氮浓度分别为(2.77±0.120)、(2.35±0.072)、(2.34±0.098)g/L。而250 μm组中0.48、1.44、2.88 mg/g TS 3个水平的最大氨氮浓度分别为(2.63±0.112)、(2.21±0.074)、(2.36±0.001)g/L。说明微塑料的添加均会增加氨氮产量,小粒径微塑料更容易造成氨抑制现象,从而抑制产甲烷。
厌氧消化过程中,复杂的有机质大分子经过水解和酸化,产生多种VFAs。VFAs浓度过高会抑制产甲烷菌的活性[16]。图2(e)、(f)为添加不同量的30 μm 和250 μm PET 微塑料的厌氧消化过程中VFAs 的浓度变化。随着厌氧消化的进行,VFAs 浓度先快速增加,然后趋于平稳。这说明系统中水解酸化速率>产甲烷速率。对照组的VFAs在第8天达到最大值,为(23.89±0.70)g/L。而添加了微塑料的实验组,VFAs最大值出现的时间都被推迟,大多在第10 天。同时微塑料的添加增加了VFAs 的积累。30 μm 组中0.48、1.44、2.88 mg/g TS 3 个水平的最大VFAs 浓度分别为(25.58±0.46)、(26.69±0.64)、(25.51±0.64)g/L。而250 μm 组中0.48、1.44、2.88 mg/g TS 3 个水平的最大VFAs 浓度分别为(23.44±0.58)、(25.33±0.57)、(27.02±0.63)g/L。张等[17]认为影响酸化过程的原因可能是微塑料释放出渗滤液对微生物有毒害作用。与产酸菌相比,产甲烷菌对外界环境较为敏感[18]。因此,微塑料的添加对产甲烷菌的影响更大,大量的VFAs 无法被充分利用而积累。

图2 PET微塑料对SCOD、氨氮和VFAs浓度的影响Fig.2 Effects of PET microplastics on SCOD,ammonia nitrogen and VFAs concentration.
2.3 微塑料对剩余污泥和厨余垃圾共消化中细菌群落的影响
2.3.1 微生物群落多样性和丰富度分析
采用16s rRNA高通量测序技术对厌氧共消化混合物中微生物群落进行分析,研究了添加30 μm和250 μm PET 微塑料(2.88 mg/g TS)的厌氧共消化系统在第1、2、10天以及原始混合样品的微生物群落。厌氧消化结束时获得的所有样品共检测到514 117 条高质量序列,每个样品的序列范围在45 124~103 124 之间。原始反应器中的物种数目为642。稀疏曲线越接近饱和,说明可以分析厌氧消化样品中的大部分细菌群落。细菌Alpha多样性结果如表2所示。物种数目数值越高,说明样品内微生物种群丰富度越高。随着厌氧消化的进行,反应器内的微生物多样性下降。此外,大粒径(250 μm)的微塑料在厌氧系统中的微生物多样性低于小粒径(30 μm)的微塑料。香农指数越高,说明微生物群落丰富度越高,多样性越高,物种分布越均匀。在厌氧共消化初期,对照组的香农指数最低,为3.877;而添加了微塑料的体系中,其香农指数分别为4.257(250 μm)和5.176(30 μm),说明添加微塑料系统中微生物分布更均匀。Chao 指数是用chao1 算法估计样品中所含操作分类单元(OTUs)数目;Ace 指数用于评估群落中OTU数目。

表2 细菌Alpha的多样性指数Tab.2 Diversity index of bacterial Alpha
2.3.2 细菌群落结构门水平分析
图3 显示了不同厌氧消化阶段反应器中微生物群落的门水平分布。所有反应器中Bacteroidota、Firmicutes、Spirochaetota、Euryarchaeota 是最丰富的4 个门,占80%以上。这四类门中的许多微生物都参与水解过程,可以将蛋白质、碳水化合物等有机化合物降解为乙醇、醋酸等挥发性有机酸等小分子物质[8,19]。Euryarchaeota 包含了古菌中的大多数种类,其中主要为各种产甲烷菌。随着厌氧消化的进行,对照组在第2天时,Bacteroidetes(34.05%)相对丰度比原始混合样多了76.05 %。而Firmicutes 和Spirochaetota 的相对丰度都减少了,分别从42.08%、4.16%减少到33.63%和0.3%。在厌氧消化第10天,Bacteroidetes的相对丰度减少到43.6 %,而Firmicutes、Spirochaetota 和Euryarchaeota 的相对丰度又增加到了34.99 %、4.61 %和8.44%。

图3 细菌门水平相对丰度Fig.3 Relative abundance of bacterial at phylum level
相比之下,添加了微塑料的反应器中,其微生物群落结构存在显著差异。在含有微塑料的反应器中,大多数细菌的相对丰度低于对照组。在厌氧消化反应第2天,250 μm组反应器中Bacteroidetes和Spirochaetota相对丰度分别为28.39 %和0.04 %。在30 μm 组中,Bacteroidetes 和Spirochaetota 的相对丰度分别为32.64%和1.1%。研究表明,Bacteroidetes在厌氧消化产乙酸阶段发挥重要作用[20-21]。Bacteroidetes的富集解释了厌氧消化初期乙酸的大量积累。Firmicutes可以分泌细胞外酶,如纤维素酶、脂肪酶和蛋白酶,并且可以在恶劣的环境条件下存活[22]。因此,在第2天,250 μm组和30 μm反应器中,Firmicutes的相对丰度增加到53.98%、51.96%,与对照组相比分别增加了60.51%、54.51%;在第10天,250 μm 反应器中,Firmicutes的相对丰度与对照组相比增加了8.32%。含有微塑料的反应器中Chloroflexi的相对丰度也低于对照组(第10 天)。先前的文献报道Chloroflexi 可以分解各种有机物质,例如多糖和蛋白质[23]。有研究发现,微塑料会积聚在厌氧颗粒污泥的表面,影响反应体系中细菌的生长[24]。
2.3.3 细菌群落结构属水平分析
图4 显示了微塑料对厌氧共消化系统中细菌属水平群落的影响。原始样品中的优势菌为Cateniphilum(16.67 %)、Proteiniphilum(15.50 %)、Anaerofustis(8.72 %)、Prevotella(4.84 %)、Christensenellaceae(3.68 %)、Treponema(3.48 %)、Candidatus_Saccharimonas(2.88 %)。随着厌氧共消化的进行,对照组在第2 天,Prevotella和Clostridium快速富集,增加到50.18 %和22.51 %。Prevotella是一种产酸细菌,其主要的发酵产物是乙酸和琥珀酸以及少量的异丁酸和乳酸[25]。Clostridium相对丰度的增加得益于它在不良环境条件下具有极强的抵抗力。Clostridium可以利用蛋白质和氨基酸,在该属中的一些菌可以分解碳水化合物产生各种有机酸(乙酸、丙酸、丁酸)和醇类物质(乙醇、异丙醇、丁醇)[26]。而在添加了30 μm 和250 μm的微塑料后Prevotella相对丰度减半,说明微塑料的添加会抑制产酸菌的作用。而Proteiniphilum作为有效的兼性纤维素降解细菌,可以直接将木质纤维素降解为二氧化碳、甲酸盐和醋酸盐[27],其在第2 天的丰度分别为2.17 %(250 μm)、5.21 %(30 μm),明显低于对照组(8.08 %)。这些产酸细菌丰度的减少证明PET微塑料降低了有机物转化为VFAs 的效率。Rikenellaceae作为产酸菌,其丰度与丁酸呈正相关[28]。厌氧消化结束时Rikenellaceae的丰度分别为3.56 %(30 μm组)和3.42%(250 μm 组),高于对照组(3.10%)。这解释了在厌氧消化后期,大量的丁酸在反应器中积累的原因。但从图2(e)、(f)可知,对照组的VFAs累积量低于微塑料添加组。这或许与产甲烷菌和产酸菌对于微塑料的敏感程度有关。有研究指出微塑料的添加对产甲烷菌的影响更大,会使VFAs 无法被充分利用而积累[18]。

图4 细菌属水平相对丰度Fig.4 Relative abundance of bacteria at the genus level
2.4 微塑料对剩余污泥和厨余垃圾共消化中古菌群落的影响
2.4.1 古菌微生物群落多样性和丰富度分析
表3 显示了原始混合样品和添加不同水平的微塑料反应器在第2 天和第10 天的古细菌的Alpha多样性指数。原始反应器中的物种数目为93。随着反应的进行,对照组中反应器中古菌的香农指数、辛普森多样性指数、Chao指数第2天均大于第10天。同时,添加了微塑料的反应器中古菌的多样性低于同时期对照组。说明微塑料的添加会降低厌氧系统中古菌的多样性。

表3 古菌Alpha的多样性指数Tab.3 Archaea Alpha diversity index
2.4.2 古菌群落结构属水平分析
图5 为不同厌氧共消化时期的古菌群落分布。Methanobacterium和Methanosaeta是整个厌氧阶段相对丰度最高的2个古菌属。对照组中Methanobacterium(48.7 %)、Methanosaeta(42.95 %)、Methanospirillum(4.67 %)和Candidatus Methanofastidiosum(2.78 %)为优势菌。Methanobacterium和Methanospirillum是氢营养型产甲烷古菌,主要利用电子供体(氢气、甲酸)还原CO2来产生甲烷[29]。而Methanosaeta属是通过裂解乙酸,还原甲基碳,来产生甲烷,属于乙酸营养型产甲烷菌[30]。Candidatus methanofastidisum则利用乙酸、丙酸和甲基化合物来产生甲烷[31]。
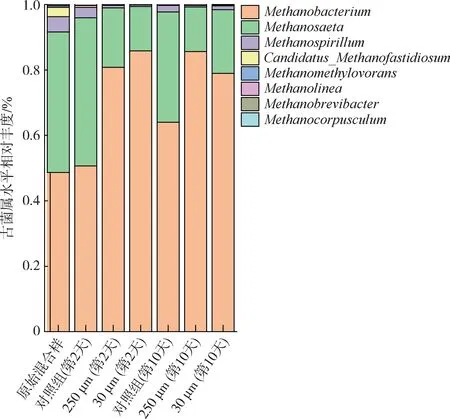
图5 古菌属水平相对丰度Fig.5 The relative abundance of archaea at the genus level
随着厌氧消化的运行,对照组中Methanobacterium的相对丰度逐渐增加,在第2 天为50.65 %,而第10 天为64.04 %。而Methanosaeta则逐渐减少,在第2 天和第10 天分别为64.04 %和33.68 %。Methanospirill的相对丰度也有所下降。添加了微塑料的厌氧体系中,以Methanobacterium和Methanosaeta主导的古菌微生物发挥产甲烷作用。添加了不同粒径微塑料的实验组都呈现出Methanobacterium相对丰度增加,而Methanosaeta相对丰度呈降低的趋势。这说明微塑料主要是依靠影响Methanosaeta的丰度来抑制乙酸产甲烷途径,从而降低甲烷产量。但不同粒径的微塑料对于产甲烷菌丰度影响程度有所不同。其中小粒径微塑料对Methanosaeta的伤害可能更大。添加了250 μm 的微塑料组,在第2 天的古菌群落中,Methanosaeta的相对丰度虽与空白组第1 天的相对丰度相比大幅度减少,但与同时期添加了30 μm 微塑料的厌氧体系相比多了33.54 %。同时,30 μm 组反应器内有机质未完全水解,VFAs 累积浓度明显低于对照组[图2(e)、(f)]。说明微塑料的添加滞后了有机质的水解酸化周期,也抑制了相应的关键水解酸化细菌的丰度,同时也抑制了Methanosaeta乙酸产甲烷的途径。综上可知,微塑料通过减少VFAs 积累量和降低Methanosaeta丰度的方式来削弱厌氧消化产甲烷的过程。
对添加了微塑料之后厌氧共消化系统中微生物群落演替进行了分析,结合厌氧共消化性能评价,探讨了微塑料影响厌氧消化的微生物机理(图6),蓝色为未添加微塑料的实验组,红色为添加了微塑料的实验组。如图6 可知,添加微塑料使Bacteroidota、Firmicutes 两个门的微生物总体相对丰度增加,其中包含了大量的水解酸化菌,促使厨余垃圾和剩余污泥中的有机质水解为多糖、氨基酸。同时在微塑料的刺激下,厌氧共消化体系中的产酸菌Prevotella、Proteiniphilum丰度降低,抑制了水解产物转化为乙酸、丁酸等挥发性脂肪酸。挥发性脂肪酸在产氢产乙酸菌的作用下分解为乙酸、H2和CO2,同型产乙酸菌Clostridium可以将H2和CO2还原为乙酸。乙酸型产甲烷菌(如Methanosaeta)通过分解乙酸生产甲烷,而氢营养型产甲烷菌(如Methanobacterium)通过合成H2和CO2生产甲烷。微塑料的添加大大降低了Methanosaeta的相对丰度,抑制了乙酸型产甲烷途径;Methanobacterium相对丰度较对照组未有明显增加,因此,微塑料通过降低Methanosaeta的相对丰度限制了甲烷的产生。

图6 微塑料对厌氧消化的微生物机理Fig.6 Microbial mechanism of microplastics on anaerobic digestion
2.5 相关性分析
微塑料粒径、甲烷产量、共消化天数、共消化系统中挥发性脂肪酸VFAs、SCOD、氨氮等中间代谢物与细菌、古菌之间有密切联系。采用Spearman相关性分析,结果如图7 所示。微塑料的粒径与Euryarchaetota呈显著正相关(r=0.945、p<0.01),说明粒径越小,产甲烷菌丰度越小,对产甲烷菌影响越大。在古菌属水平中,微塑料的添加与Methanosaeta(r=-0.794、p<0.05)、Methanospirillum(r=-0.869、p<0.05)呈负相关。但微塑料对于其他水解酸化菌并无显著影响。而Firmicutes与中间代谢产物氨氮(r=-0.857、p<0.05)、VFAs(r=-0.786、p<0.05)呈现显著负相关。说明相比于其他微生物,产甲烷菌更容易受到微塑料的影响。

图7 微塑料、环境因子、甲烷产量与微生物之间的相关性热图Fig.7 Heatmap of correlations between microplastics,environmental factors,methane production and microorganisms
3 结论
(1)微塑料的存在会抑制厌氧共消化系统中甲烷产量;微塑料粒径越小,抑制效果愈明显。在2.88 mg/g TS 水平下,甲烷产量分别下降了54.49 %(30 μm)和49.58%(250 μm);
(2)小粒径的微塑料更容易造成氨抑制,延长有机质水解周期,使大量的VFAs无法被充分利用而积累;
(3)在共消化过程,微塑料抑制了Prevotella、Proteiniphilum产酸菌的丰度,同时也抑制了古菌Methanosaeta的丰度,减弱了乙酸产甲烷的途径;
(4)微塑料的粒径与Euryarchaetota呈显著正相关(r=0.945、p<0.01);微塑料粒径越小,对产甲烷菌丰度抑制越明显,与其他细菌相比,产甲烷菌对微塑料更为敏感。
