酶法体外高效制备信号分子(pp)pGpp
2022-08-01陈传玉谭樊杰殷平张德林
陈传玉,谭樊杰,殷平,张德林
作物遗传改良全国重点实验室/湖北洪山实验室/华中农业大学生命科学技术学院,武汉 430070
植物和细菌处于营养胁迫时,会产生一种由核苷酸代谢产物(pp)pGpp诱导的严谨反应[1],即氨基酸饥饿时发生蛋白合成及相关基因表达停滞的反应[2-3]。信使分子(pp)pGpp,也被称为警报素分子,是细菌和植物生存所必需的。信使分子(pp)pGpp主要分为3种:鸟苷五磷酸(pppGpp,G5P)、鸟苷四磷酸(ppGpp,G4P)和鸟苷三磷酸(pGpp,G3P)。(pp)pGpp与GTP结构非常相似,在五碳糖的5′依次递减一个磷酸基团,五碳糖的3′焦磷酸基团被一个羟基取代。
(pp)pGpp作为常用的信号传递分子[4],对许多病原菌(例如大肠杆菌、沙门氏菌、金黄色葡萄球菌)的黏附[5]、侵入[6]、免疫逃避、传播、生物膜形成[7]和慢性感染[7]起着重要作用。鞭毛是大多数细菌黏附宿主细胞的关键。(pp)pGpp能够通过抑制病原体鞭毛基因的表达,从而影响病原体入侵。(pp)Gpp通过产生毒素和调节生物膜形成在免疫逃避和细菌传播中发挥作用[8]。由于信使分子(pp)pGpp对细菌和病原体的毒性、致病性的特殊作用,使其可能成为一种潜在的新型的抗菌药物[9-11]。
在细菌中,主要由3种信使分子合成酶(RelA、GppA、YvcI)负责催化合成(pp)pGpp[12]。细菌中(pp)pGpp的合成和水解主要由双功能RSH代谢酶(例如RelA)决定,RSH合成酶活性过高,(pp)pGpp水平升高,激活应激反应,抑制细胞生长和基因表达。RSH水解酶使(pp)pGpp水平过低,细胞不能对营养胁迫产生适当的反应。而RSH酶特有的严谨反应不存在哺乳细胞中,因此,利用(pp)pGpp类似物抑制细菌生长为开发新的抗菌药物提供了可能。尽管(pp)pGpp被发现已有近50年的历史,但是(pp)pGpp的代谢和信号传递过程仍是关注的重点。近年来,蓝细菌中的(pp)pGpp代谢机制逐渐被人们发现,可能与现有的代谢调控有所差异。由于蓝细菌是具有叶绿体的放氧光合性细菌,其类似的RSH活性调控机制为日益严重的蓝藻水华治理提供了可能。
现有的研究中,(pp)pGpp主要来源于植物和细菌的内源提取以及酶生物合成[13-14],具有操作复杂、成本高昂、使用有毒试剂的弊端,无法满足快速获得大量的(pp)pGpp的需求。因此,本研究以体外酶合成(pp)pGpp的方法为基础,建立和优化新的生物合成(pp)pGpp体系,以期为相关生化和微生物学研究高效提供物质保障。
1 材料与方法
1.1 菌 株
所需菌株为大肠杆菌BL21(λDE3)和DH5α,枯草芽孢杆菌168 strain。其中,信使分子(pp)pGpp合成酶的基因(relA、gppA)序列来源于大肠杆菌BL21(λDE3),yvcI来源于枯草芽孢杆菌168 strain。蛋白表达纯化使用大肠杆菌BL21(λDE3),质粒扩繁使用大肠杆菌DH5α。
1.2 主要试剂和仪器
1)分子克隆。引物合成和测序由武汉擎科生物有限公司完成,dNTP购买于New England Biolabs公司,Pfu和Taq酶由华中农业大学作物遗传改良全国重点实验室Yin Lab提供。普通DNA产物回收试剂盒(DP204-02)和普通质粒小提试剂盒(DP103-02)购自天根生化科技(北京)有限公司。
2)蛋白纯化试剂。丙烯酰胺和甲叉双丙烯酰胺(B546018)、Tris SDS pH 6.8(B546022)、Tris SDS pH 8.8(C526033)购自生工生物工程股份有限公司、Tris(V900866)、NaCl(V900058)、咪唑(V900153)购买于Sigma公司。
3)信使分子合成试剂。ATP(A600020)和GTP(A620250)购于生工生物工程股份有限公司,Tris、MgCl2、NaCl试剂均购买于Sigma公司。
4)主要仪器。蛋白纯化仪(ÄKTA™pure 25,GE Healthcare)、制冷型台式真空离心浓缩仪(北京中科科尔仪器有限公司)。
1.3 质粒构建
负责合成(pp)pGpp的3种酶基因来源于大肠杆菌BL21(λDE3)和枯草芽孢杆菌(168 strain)。将大肠杆菌 BL21(λDE3)和枯草芽孢杆菌(168 strain)菌株分别涂布无抗生素的LB平板,培养6~8 h;随后挑取多菌落于50 μL超纯水,100℃煮5 min破碎细胞壁,12 000 r/min离心5 min后,取5 μL的上清作为模板进行PCR反应,获得DNA片段;将DNA片段装载于pET15D或pET21b,进行菌落PCR反应,选取阳性克隆测序,确定基因序列,进行质粒提取。
1.4 大肠杆菌培养
将构建好的质粒转入大肠杆菌BL21(λDE3)感受态细胞中,接入10 mL含有相应抗性的LB培养基中,于37℃、200 r/min摇床培养12 h。再按照1∶100的比例将其接入1 L LB培养基中,200 r/min、37℃培养4~5 h至OD600达到1.0左右;将温度降至16℃诱导14~16 h。
1.5 蛋白纯化
使用高压破碎的方式破碎细菌,使细菌细胞壁和细胞膜破碎,释放胞质中的蛋白。破碎好的菌液,14 000 r/min 4℃冷冻离心1 h,离心后取上清。因pET15D载体的N端融合6×His纯化标签或pET21b载体C端融合8×His纯化标签,通常使用Ni柱亲和层析获得目的蛋白,随后进一步使用Source Q 10-100进行纯化,获得高纯度的信使分子(pp)pGpp合成酶。
1.6 酶活反应
以ATP和GTP为原料,通过RelA催化合成G5P,再由焦磷酸激酶GppA水解G5P生成G4P,最后磷酸水解酶YvcI水解G5P或G4P生成G3P。
1)RelA的催化反应。RelA以ATP和GTP为原料,将底物ATP-5′端的焦磷酸转移到GTP的3′端上,取代羟基的位置,合成产物AMP和pppGpp。
2)GppA的催化反应。GppA以pppGpp为底物,降解其5′端的γ-磷酸基团,催化生成产物ppGpp。
3)YvcI的催化反应。YvcI以pppGpp和ppGpp为底物,降解5′端的γ和β-磷酸基团,催化生成产物pGpp。
RelA1-400以ATP和GTP为底物,于37℃反应30 min后使用Source Q 10-100进行分离纯化,获得G5P。随后GppA以G5P为底物催化生成G4P。经验证YvcI以G5P和G4P作为底物,催化合成G3P。
1.7 终止反应
于95℃终止反应,避免使用苯酚等试剂危害人体,同时将蛋白酶变性形成沉淀,除去蛋白等杂质,为进一步提纯信使分子做准备。
1.8 信使分子(pp)pGpp分离提纯
与传统信使分子提取分离不同,不需要使用有机试剂萃取,采取更为环保安全的方式进行纯化。根据底物和产物所带电荷不同,利用Source Q 10-100对信使分子进一步分离提纯,其中A buffer:25 mmol/L Tris pH 8.0,B buffer:25 mmol/L Tris pH 8.0,1 mol/L NaCl。
1.9 冻 干
利用脱盐柱将纯化后的信使分子置换到需要的超纯水中,随后使用制冷型真空离心浓缩仪,将信使分子浓缩冷冻成干粉,可于-80℃长期保存。
1.10 浓度测定
2 结果与分析
2.1 酶的体外表达纯化
将负责合成(pp)pGpp的3种酶基因relA、gppA、yvcI,从E.coliBL21(λDE3)和Bacillus subtilis168 strain基因组中克隆到pET15b或pET21D载体上,进行蛋白表达和纯化。如图1所示,经镍柱亲和层析和离子交换层析,3种信使分子合成酶蛋白纯度高、性质稳定,可用于信使分子的体外合成。
2.2 信使分子合成酶活性测定
RelA以ATP和GTP为原料,催化ATP的5′端β位磷酸基团断裂,转移到GTP的3′端取代羟基,合成信使分子G5P(图2A)。GppA催化G5P的5′端γ位磷酸断裂合成G4P(图2B),YvcI以G5P或G4P为底物,催化合成产物G3P(图2B)。
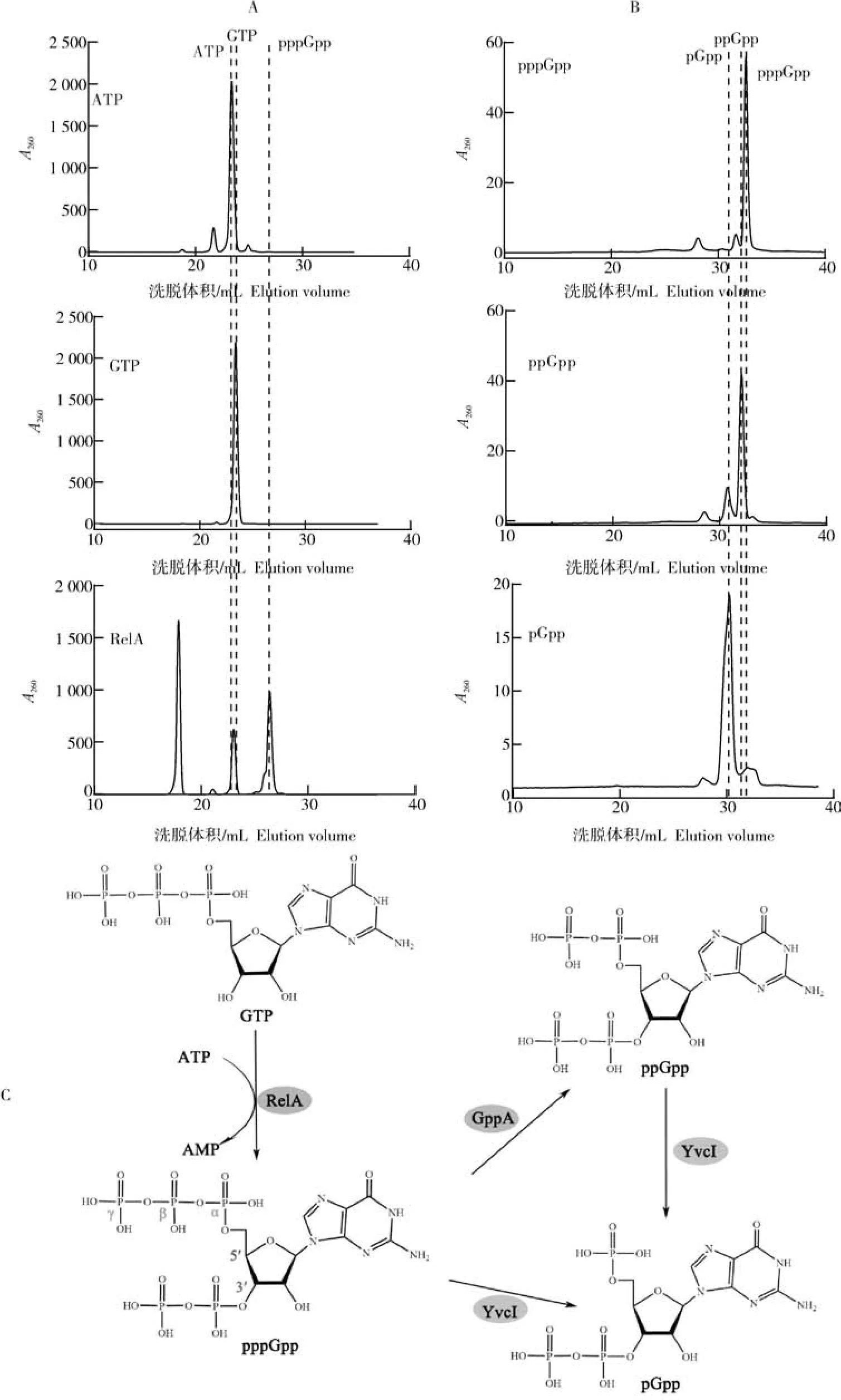
图2 信使分子合成酶活性测定Fig.2 Messenger molecular synthase activity assay
2.3 不同条件对产物得率的影响
1)pH对信使分子G5P合成的影响。反应体系中的pH依次为Bis-tris pH 6.0,Tris-HCl pH 7.0、8.0、9.0,Glycine pH 10.0,RelA1-400用不同的pH稀释100倍,浓度为1 μmol/L。如图3所示,G5P合成量随pH升高逐渐升高,pH=9时G5P产量最高,RelA1-400的活性最强,pH=10时G5P产量反而降低,RelA1-400的活性降低。

图3 pH对信使分子G5P合成的影响Fig.3 The effect of pH on the synthesis of the messenger molecule G5P
2)金属离子对信使分子G5P合成的影响。如图4所示,在 Tris-HCl pH 9.0、RelA1-400浓度为 1 μmol/L的反应体系中,探索金属离子Ca2+、Ba2+、Zn2+、Mn2+、Mg2+对信使分子G5P合成的影响。结果显示,RelA1-400在含有Ca2+、Ba2+、Zn2+的反应体系中,无催化活性,不合成G5P;RelA1-400在Mg2+存在下,合成效率最高,G5P的产量最高。
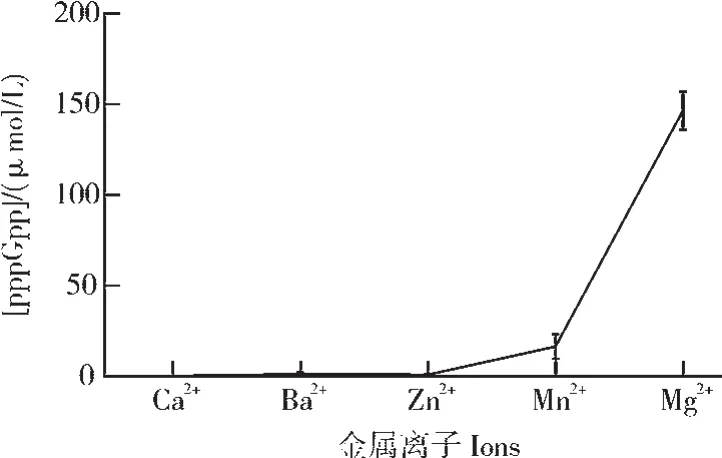
图4 金属离子对信使分子G5P合成的影响Fig.4 Effects of metal ions on the synthesis|of messenger G5P
3)反应时间对信使分子G5P合成的影响。如图5所示,在Tris-HCl pH 9.0、添加Mg2+、RelA1-400浓度为1 μmol/L的反应体系中,在5~120 min随时间延长G5P的产量逐渐增加。为缩短反应时间,提高合成效率,下文探索G5P合成酶的浓度。

图5 反应时间对信使分子G5P合成的影响Fig.5 The effect of reaction time on the synthesis of messenger molecule G5P
4)酶浓度对信使分子G5P合成的影响。在Tris-HCl pH 9.0、添加Mg2+、反应时间为10 min的反应体系中,探索 1、2、4、6、8 μmol/L 酶浓度对信使分子G5P合成的影响(图6)。结果显示,酶浓度在2、4、6 μmol/L时RelA1-400的活性最高,G5P的合成量最高;随着酶浓度升高,G5P的产量反而降低。为提高反应效率,减少反应体系中的蛋白酶,提高信使分子的纯度,选择2 μmol/L的RelA1-400作为最佳反应酶浓度。

图6 酶浓度对信使分子G5P合成的影响Fig.6 The effect of enzyme concentration on the synthesis of the messenger molecule G5P
5)反应时间对信使分子G4P合成的影响。为提高合成效率,在RelA催化合成反应10 min后,直接加入GppA或YvcI继续反应合成G4P或G3P。这样,只需一步纯化就可以获得目标产物,避免了二次纯化的损失。因此,本研究在RelA1-400合成G5P的基础上,探索优化合成信使分子G4P、G3P的方法。在Tris-HCl pH 9.0、添加Mg2+、2 μmol/L RelA1-400反应10 min后,继续添加1 μmol/L GppA参与反应,探索反应时间对信使分子G4P合成的影响(图7)。结果显示,随时间延长,信使分子G4P的产量逐渐升高。为提高合成效率,选取反应时间20 min,继续优化GppA酶浓度。

图7 反应时间对信使分子G4P合成的影响Fig.7 The effect of reaction time on the synthesis of messenger molecule G4P
6)酶浓度对信使分子G4P合成的影响。在Tris-HCl pH 9.0、添加 Mg2+、2 μmol/L RelA1-400反应 10 min后,继续添加GppA参与反应20 min,探索了不同的酶浓度对信使分子G4P合成的影响(图8)。结果显示,随GppA的浓度升高,信使分子G4P的产量逐渐升高,添加6 μmol/L GppA反应20 min,信使分子G4P的产量最高。
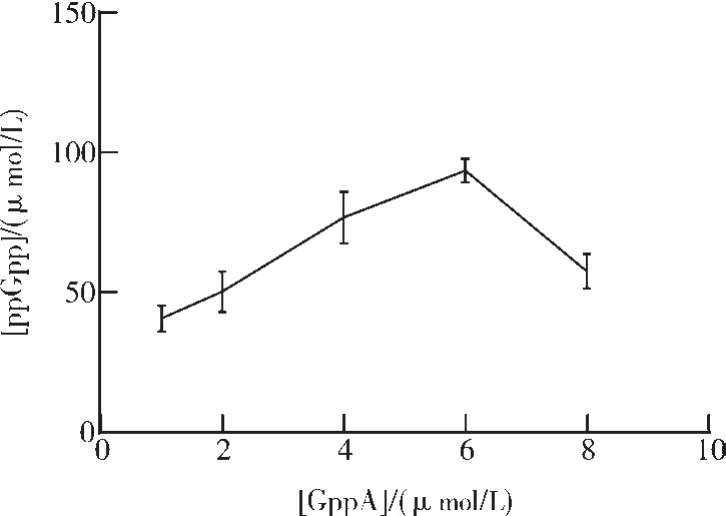
图8 酶浓度对信使分子G4P合成的影响Fig.8 The effect of enzyme concentration on the synthesis of messenger G4P
7)反应时间对信使分子G3P合成的影响。在Tris-HCl pH 9.0、添加Mg2+、2 μmol/L RelA1-400反应10 min后,继续添加 1 μmol/L YvcI参与反应,探索不同反应时间对信使分子G3P合成的影响(图9)。结果显示,随反应时间延长,信使分子G3P的产量逐渐升高。添加1 μmol/L YvcI反应20 min后,底物基本消耗完。

图9 反应时间对信使分子G3P合成的影响Fig.9 The effect of reaction time on the synthesis of messenger molecule G3P
8)酶浓度对信使分子G3P合成的影响。如图10所示,在Tris-HCl pH 9.0、添加 Mg2+、2 μmol/L RelA1-400反应10 min后,继续添加YvcI参与反应20 min,探索不同酶浓度对信使分子G4P合成的影响。结果显示,随YvcI的浓度升高,信使分子G3P的产量逐渐升高,添加4 μmol/L YvcI反应20 min后,信使分子G3P的产量最高。

图10 酶浓度对信使分子G3P合成的影响Fig.10 The effect of enzyme concentration on the synthesis of messenger G3P
2.4 制备小分子的适用范围测定
(pp)pGpp信使分子参与嘌呤合成通路,与嘌呤合成蛋白结合(Gmk)并抑制其功能。蛋白样品中不能存在DTT,所以纯化蛋白全程不添加DTT,并且分子筛纯化时,补加10 mmol/L MgCl2(即25 mmol/L Tris-HCl pH 8.0,150 mmol/L NaCl,10 mmol/L MgCl2),与此同时冻干的信使分子也溶解于此试剂。采用信使分子滴定嘌呤合成蛋白的方法(20∶1)进行ITC(isothermal titration calorimetry)实验。ITC验证了嘌呤合成蛋白(Gmk)与信使分子(pp)pGpp发生了强烈互作(图11),说明信使分子(pp)pGpp可以应用于生化分析。
2.5 合成通路的优化
如图12所示,与传统的合成方法相比,新的合成方法只需要将反应产物经离子交换柱进行分离纯化,除去多余的底物和产物,随后将得到的信使分子置换到超纯水中,冻成干粉即可。此方法简单快速,不需要任何有毒试剂,安全环保。

图11 信使分子(pp)pGpp与Gmk的互作验证Fig.11 Interaction verification of messenger molecule(pp)pGpp and Gmk

图12 合成通路优化Fig.12 Synthetic pathway optimization
2.6 成本对比分析
合成信使分子成本对比分析结果(表2)显示,与商业化购买的信使分子相比,合成信使分子(pp)pGpp的成本降低了96%。
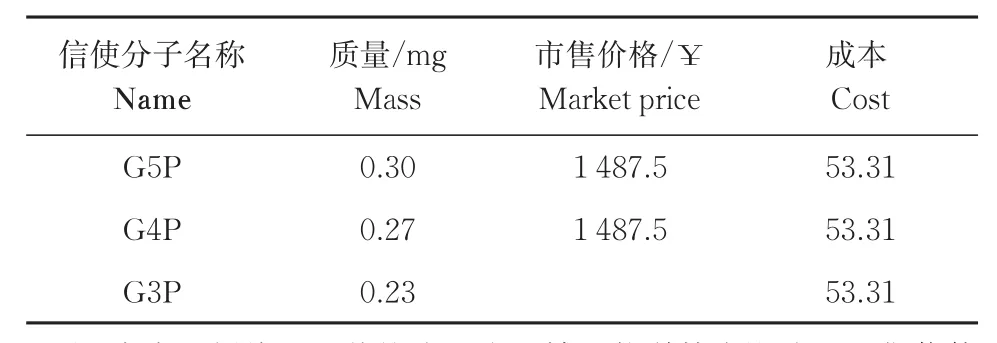
表2 合成信使分子成本对比分析Table 2 Comparative analysis of the cost of synthetic messenger molecules
3 讨论
选择合适的pH和金属离子是信使分子合成酶发挥功能的关键,但其他因素也是影响信使分子体外合成的重要因素。体外合成信使分子容易出现蛋白杂质,因此,本方法在终止反应时,为使蛋白变性而不引入其他有机试剂,防止其他杂质对信使分子纯度的影响。另外,本研究体外合成的信使分子经验证,可以运用到ITC分析。Takahashi等[13]从拟南芥中提取信使分子,采用甲酸、甲醇等具有强腐蚀性和毒性的试剂进行信使分子的萃取,进一步进行HPLC纯化获得信使分子。与其相比,本研究建立的体外合成方法,具有以下优势:一是方法简单,不需要特殊的有毒试剂;二是原料简单,常用的ATP、GTP即可参与反应;三是无需任何冰上或者4℃操作,室温操作即可;四是反应时间大大缩短。
