‘赤霞珠’与‘西拉’杂交群体内种子单宁的遗传趋势分析
2022-07-26刘敖一孙琪董志刚刘镇海段长青潘秋红
刘敖一,孙琪,董志刚,刘镇海,段长青,潘秋红
(1. 中国农业大学食品科学与营养工程学院/农业农村部葡萄酒加工重点实验室,北京 100083;2. 山西农业大学果树研究所/山西省葡萄与葡萄酒工程技术研究中心,山西太谷 030031)
葡萄酒的质量很大程度上取决于葡萄果实的质量,葡萄果实的风味物质指纹与品种、气候、土壤和栽培等因素密切相关[1]。缩合单宁(Condensed tannins)又称原花色素(Proanthocyanidins),由黄烷-3-醇单体聚合而成,是构成红葡萄酒口感和风味的特征成分之一,在葡萄酒中具有沉淀蛋白、提高结构感、稳定色素、抗氧化、抗自由基和抗菌等作用[2]。黄烷-3-醇类物质的抗氧化能力受到其结构的影响。类黄酮的C6-C3-C6骨架结构分别对应A-C-B环,其中B环发挥着重要作用,C环起次要作用,而A环的抗氧化能力最弱,并且不同羟基所在位置不同,清除自由基的能力也会不同[3],随酚羟基数目增多,结合蛋白的能力逐渐增加。因此,开展优良酿酒葡萄新品种的选育,筛选出含高质量黄烷-3-醇类物质的酿酒葡萄品种具有重要的实际意义。
一般认为,单宁的溶解度随聚合度的增大而降低。丙酮水溶液是目前使用最普遍的提取溶剂,根据单宁在丙酮中的溶解度,可将它们分成可溶性单宁和非可溶性单宁[4]。非可溶性单宁代表了聚合度较高的单宁,根据目前的研究可知,从梨中提取的mDP值为28的高聚合度单宁仍能被浸渍至模拟酒体中[5],并且高聚合度的单宁容易与唾液蛋白结合增加口腔的摩擦而提供涩感[6];可溶性单宁代表了聚合度较低的单宁(mDP<8),容易进入酒体中[7],主要提供了苦味。葡萄酒的涩感强度和苦味与单宁含量呈强正相关[8-9],在低聚合度情况下,随单宁的聚合度增加葡萄酒的涩感强度增大,而酒中苦味的最大强度和持续时间下降[10]。因此,研究葡萄中可溶性单宁和非可溶性单宁,有助于指导葡萄和葡萄酒的生产以及品质的控制。
单宁主要存在于葡萄的果皮、种子和果梗中,其中种子中的单宁含量最高。尽管在葡萄酒酿造过程中,种子单宁的浸出率只有6%,而果皮中单宁的浸出率为大约30%,但种子中的单宁仍是葡萄酒中单宁的主要来源,是贡献葡萄酒感官品质、陈酿潜力和抗氧化性的重要指标之一[11]。已有研究初步表明,酿酒葡萄单宁为多基因控制的遗传性状[11],并且种子单宁的遗传符合数量遗传特征[12]。在酿酒葡萄杂交F1代中,不同部位的单宁有不同的遗传趋向,其中果皮单宁趋向于低亲遗传,而果肉单宁趋向于高亲遗传[13]。但以往关于单宁含量测定,主要采用Folin-Ciocalteu法,其结果并不能反映可溶性单宁和非可溶性单宁的含量。本文以欧亚种酿酒葡萄品种‘赤霞珠’和‘西拉’及其杂交F1代的种子为试材,分析可溶性单宁和非可溶性单宁在群体内的含量分布,探究其遗传趋势,为以改善种子单宁为目标的葡萄育种提供依据,同时筛选目标优株,为单宁缩合机理的理论研究提供材料。
1 材料和方法
1.1 试验材料
酿酒葡萄‘赤霞珠’和‘西拉’杂交群体的亲本和F1代的种子采自山西省农业科学院果树研究所,该群体于2013年杂交,2018年大量结果。本研究所用的子代均是通过多重测序方法检验,证实为真实杂交子代,于2019年8—9月,从90株结果的杂交子代中,逐株采集可溶性固形物含量21%左右的果实,每株采集40~50粒,共90份。可溶性固形物采用数字手持糖量计(PAL-1,Atago,Japan)测定。采集后立即用液氮速冻,低温速运至实验室,置于﹣80 ℃超低温冰箱中备用。葡萄果实破碎后取种子,在液氮下研磨成粉末,用于可溶性和非可溶性单宁的提取和测定。
1.2 试验方法
1.2.1 可溶性单宁的提取与测定
基本上参照Yu等[14]进行,稍作修改。
取100 mg种子样品粉末于2 mL离心管中,向样品中加入1 mL单宁提取缓冲液(70 %丙酮,0.1 %乙酸,Vol),在冰水中超声30 min,4 ℃下12000 r·min-1离心10 min,取上清,沉淀按照上述步骤再提取两次,合并3次上清液,即为可溶性单宁的粗提液。沉淀用于非可溶性单宁的测定。
将上清液与等体积氯仿混合充分,4 ℃下4054 r·min-1离心5 min,弃下层有机相,重复3次;接着,在上层溶液中加入等体积正己烷,涡旋混合,4 ℃下9730 r·min-1离心5 min,保留下层溶液,重复3次。对所得下层溶液氮吹,直至液面基本不变,液氮速冻,置于﹣20 ℃下冷冻干燥后,用600 μL 50%色谱级50%(Vol)甲醇/水溶液复溶,即得到可溶性单宁提取液。每个样品提取3份,分别用于以下测定。
取2 μL各样品可溶性单宁提取液以及各2 μL的0、0.75、1、1.5、3 mg·mL-1(-)-表儿茶素标准溶液于96板各孔中,随后向各孔中加入100 μL 4-二甲基氨基肉桂醛(4-dimethyl-amino-cinnamaldehyde,DMACA)反应液(0.2%DMACA(w/v)溶于1∶1甲醇/3N盐酸)。将96孔板放入Spectramax190酶标仪(美国Molecular Devices)中,室温下轻轻震荡5 min后,在640 nm下测量各孔的吸光值。种子可溶性单宁含量用(-)-表儿茶素浓度对吸光值制作的标准曲线进行定量,单位为mg·g-1。
1.2.2 非可溶性单宁的提取与测定
将上述提取单宁时得到的沉淀冻干,向干燥粉末中加入500 μL丁醇/浓盐酸(95∶5,Vol)溶液,涡旋震荡使沉淀重悬,置于冰水混合物超声处理30 min,4 ℃下12000 r·min-1离心10 min,取上清液,即得到非可溶性单宁提取液。
将非可溶性单宁提取液以及终浓度分别为0、0.05、0.1、0.15、0.2、0.4 mg·mL-1单宁二聚体PB1 [(-)-表儿茶素-(4β→8)-(+)-儿茶素] 标准品的丁醇盐酸溶液,分别加入到离心管中,共同在95 ℃下孵育1 h。冷却到室温后,用丁醇浓盐酸将样品稀释5倍,取各样品100 μL依次加入到96孔板中,在550 nm下测量各个样品孔的吸光值,非可溶性单宁的含量用PB1的浓度对相应吸光值绘制的标准曲线进行半定量,单位为mg·g-1。
1.3 数据统计分析
数据分析主要采用EXCEL、SPSS 20软件分析,绘图软件为Origin 2018。在遗传趋势分析中广义遗传力(the broad sense heritability,H2)、变异系数(variation coefficient,CV)、超中优势率(ratio of middle advantage rate,H)、超高亲率(ratio of higher than high parent, HH)及超低亲率(ratio of lower than low parent, LL)结果计算方法[15-17]如下所列:
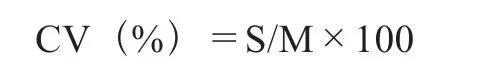
式中:S为标准差,M为后代性状平均值

式中:M为后代性状平均值,P—为亲中值

式中:VP为表现型方差,VE为环境方差

式中:VE为环境方差,VP1为母本的表型方差,VP2为父本的表型方差。

式中:nhp为子代群体中表型值超过高亲的个数;nlp为子代群体中表型值超过高亲的个数,n为群体个数。
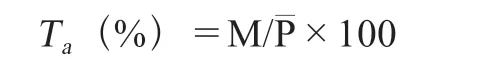
式中:Ta为遗传传递力,M为后代性状平均值,P—为亲中值
2 结果与分析
2.1 亲本及其子代种子可溶性和非可溶性单宁含量分布
亲本及杂交子代的种子可溶性及非可溶性单宁含量如图1。两亲本中,‘赤霞珠’总单宁含量为69.99 mg·g-1,其中可溶性单宁的含量为65.47 mg·g-1, 非可溶性单宁含量为4.52 mg·g-1;‘西拉’总单宁含量为57.37 mg·g-1,包括53.52 mg·g-1的可溶性单宁和3.85 mg·g-1非可溶性单宁。杂交子代总单宁的含量范围在41.15~80.63 mg·g-1,变化较大且近似连续变化,符合数量遗传的特征。因此,在子代总单宁含量接近的情况下,可溶性单宁与非可溶性单宁的比例存在较大差异。

图1 ‘赤霞珠’与‘西拉’杂交群体种子可溶性与非可溶性单宁含量Figure 1 Contents of soluble and insoluble tannins in the seeds of hybrid population of 'Cabernet Sauvignon' and 'Syrah'
如图2(A~D)频数分布图所示,对杂交群体的可溶性单宁、非可溶性单宁、总单宁含量及非可溶性单宁在总单宁中的占比进行了分析,进一步探究子代中单宁的组成,其中非可溶性单宁在总单宁中的占比可以反映单宁向不可溶性单宁转变的趋势。
由图2可知,F1代果实采收期时,种子可溶性单宁含量主要在40.00~58.00 mg·g-1,占所有F1代种子的65.56%;非可溶性单宁含量分布在3.00~8.00 mg·g-1,占所有F1代种子的73.33%;单宁总含量主要集中在45.00~60.00 mg·g-1,占所有种子的61.11%;非可溶性单宁含量占总单宁的百分比主要分布在6.00%~14.00%,占所有F1代种子的73.33%。‘赤霞珠’与‘西拉’杂交群体种子单宁含量相关的性状基本符合正态分布,说明杂交群体内可溶性和非可溶性单宁含量性状符合数量遗传的特征。
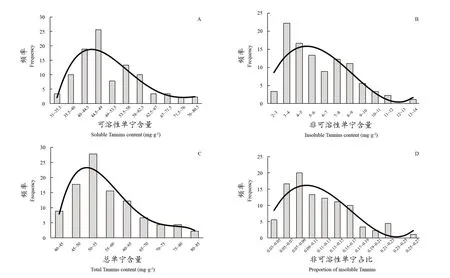
图2 ‘赤霞珠’与‘西拉’杂交群体种子各状态单宁及其非可溶性单宁占比分布图Figure 2 Frequency distribution of contents of soluble Tannins (A), insoluble Tannins (B) and total Tannins (C) as well as percentage of insoluble Tannins in total Tannins (D) in the seeds of hybrid population of 'Cabernet Sauvignon' and 'Syrah'
2.2 可溶性和非可溶性单宁的遗传趋势分析
根据‘赤霞珠’和‘西拉’亲本及其F1代的非可溶性单宁、可溶性单宁、总单宁含量、非可溶单宁占总单宁百分比,进行遗传特征分析,结果如表1所示。

表1 ‘赤霞珠’与‘西拉’杂交群体F1代种子单宁的遗传指标Table 1 Genetic parameters of seed tannins in the seeds of F1 hybrid population of 'Cabernet Sauvignon' and 'Syrah'
由表1可知,‘赤霞珠’与‘西拉’杂交F1代种子的可溶性单宁和总单宁含量超低亲比率分别为65.56%和64.44%,遗传传递力分别为84.41%和88.36%,偏向低值遗传。而种子的非可溶性单宁含量和非可溶性单宁占总单宁比例均高于亲本平均值,并且超高亲比率分别达到63.33%和81.11%,遗传传递力分别达到144.54%和169.00%,偏向高值遗传。子代可溶性单宁含量、非可溶性单宁含量和非可溶性单宁占比的变异系数分别为20.13%、38.97%和44.42%,说明在杂交群体中这3个性状都有较大的选择潜力。上述4个单宁指标性状的广义遗传力均很高,在84.94%~95.41%之间,说明酿酒葡萄杂交子代的种子单宁含量的变异中主要是遗传效应起作用,环境的影响很小。
2.3 子代中种子非可溶性单宁的极端最高及最低含量
从图1中分别筛选出‘赤霞珠’与‘西拉’杂交F1代中种子非可溶性单宁含量最高的3个子代H1、H2和H3,最低的3个子代L1、L2和L3。非可溶性单宁含量范围在2.94~2.63 mg·g-1,平均值为2.79 mg·g-1;非可溶性单宁含量最高的3个子代的含量范围在13.03~11.13 mg·g-1,平均值为11.84 mg·g-1,是最低的4.24倍。利用单因素分析检验,这6个株系之间总缩合单宁含量在0.05的水平上没有显著性差异。从非可溶性单宁的占比,可以清楚地看到,高低子代的占比相差5.00~4.00倍(图3),表明非可溶性缩合单宁含量高的子代具有更强的缩合单宁聚合能力。
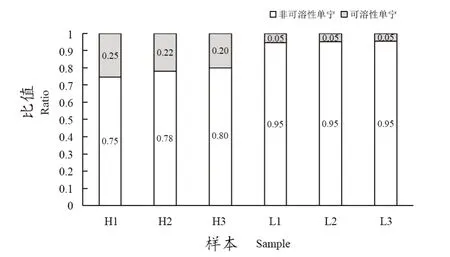
图3 杂交子代中非可溶性单宁含量最高和最低的占比Figure 3 The highest and lowest percentages of insoluble tannin in the hybrid progeny
3 讨论
在葡萄育种中,杂交育种是葡萄品种改良的常用方法,能有效提高葡萄品质、抗性和产量等[18]。对于葡萄酒而言,单宁含量直接影响葡萄酒的口感,因此,控制酿酒原料中单宁含量对提升葡萄酒的品质有重要意义[19]。单宁分为水解单宁和缩合单宁,水解单宁对葡萄酒涩感和苦感的影响远小于缩合单宁[2]。已有报道采用乙醇提取葡萄种子缩合单宁,Folin-Ciocalteu法测定总单宁含量,发现‘黑比诺’与‘马瑟兰’杂交F1代种子的单宁含量表现出超高亲遗传的特征,说明可以通过杂交手段筛选出单宁含量高的品种[22]。在本研究中,利用单宁在丙酮-水溶液中的溶解性,将高聚合度和低聚合度的单宁区分开,研究种子可溶性和非可溶性单宁的遗传倾向,发现可溶性与非可溶性单宁都具有较高的遗传力,可以稳定遗传,这与前人的研究结果相似[20]。但从本试验中发现,可溶性单宁偏向于低值遗传,而非可溶性单宁倾向于高值遗传,表明可以通过杂交育种手段使葡萄种子中可溶性单宁逐渐减少,而非可溶性单宁增加。
由于一定聚合度的单宁对葡萄酒有更多的正面作用,因此在育种中可以筛选出有较高单宁聚合能力强的个体。在本研究中通过检测高聚合度单宁含量的个体差异,筛选出拥有更强的单宁聚合能力的个体。这些个体不仅可以为酿酒葡萄单宁聚合能力的相关研究提供实验材料,也可以在实际生产中推广应用。
本研究仅对‘赤霞珠’与‘西拉’两个酿酒葡萄品种杂交得到的F1代个体的种子缩合单宁的遗传特征进行了初步分析,具体的遗传机制和规律尚待进一步的研究探索。
