山东省动物源多重高抗大肠杆菌的抗药基因和毒力基因分析
2022-07-15刘玲红胡明刘玉庆
刘玲红 胡明 刘玉庆









摘 要:为了解和掌握山东省动物源大肠杆菌的多重抗药现象,并分析多重高抗菌株中抗药基因和毒力基因的分布和共存情况,从山东省兽医抗药性监测网(Veterinary antibiotic monitoring resistance system,Varms)菌种库中选取动物源大肠杆菌,用琼脂稀释法进行10种抗菌药物的药敏试验,对5重以上的多重抗药性菌株进行抗药谱分析,并选择多重高抗菌株进行MLST分型,采用PCR方法对常见的21种抗药基因和15种毒力基因进行分析。结果显示,5重以上抗药菌株占20%左右,9~10重抗药且最小抑菌浓度(minimum inhibitory concentration,MIC)远远高于R值的多重高抗菌株32株中,均检测到含有7~13个抗药基因和0~6个毒力基因共存,其中高检出率的β-内酰胺类、喹诺酮类和氯霉素类的抗药基因均为质粒介导;毒力基因以fimC、sitA、iucD和hlyF为主要毒力因子,检出率为40%~90%。兼具抗药性和毒力的菌株造成严重的公共卫生威胁和巨大的食品安全潜在危害。
关键词:大肠杆菌;多重抗药性;抗药基因;毒力基因
中图分类号:S852.61+2 文献标识码:B 文章编号:1673-1085(2022)06-0004-12
随着养殖业集约化发展,养殖动物处于高营养、高密度的饲养环境中,自身免疫力低下,各種应激反应和疫苗保护不完全,极易发生感染[1]。大肠杆菌(Escherichia coli)作为常在菌群容易成为条件致病菌,是现代养殖业中最常见和最难防治的重要疾病之一[2]。 兽医临床上使用抗菌药物是防治大肠杆菌病的首要方法,但不规范使用导致大肠杆菌产生抗药性,造成抗药率不断上升,抗药谱迅速增宽,药物压力下加速了抗药性基因元件在不同物种间的传播,不仅形成多重抗药性,而且抗药程度也在逐渐加深[3]。同时,大肠杆菌的致病力往往与其所携带的毒力基因密切相关,对感染的发生和发展起着决定作用[4]。因此,了解动物源大肠杆菌的抗药表型、所携带抗药基因和毒力基因以及分布,对把握其动态发展有重要的实际意义。
山东省兽医抗药性监测网(Verterinary antibiotic resistance system,Varms)是由山东省农业科学院畜牧兽医研究所联合山东省规模化养殖集团以及兽药生产企业共同创建的兽医抗药性实体监测网(http://www.varms.cn/#/),运用智能化药敏检测仪、快速药敏检测盒,监测养殖场临床病料、粪样和环境样本的细菌抗药性,线上通过Varms实时将检测结果上传到Varms数据库,自动汇总,便于集团公司和行业公共查询,直接指导临床用药。本研究以Varms近年收集动物源大肠杆菌菌株为研究对象,通过分析药敏数据选择多重高抗菌株,对抗药基因和毒力基因进行检测和相关性分析,关注多重高抗大肠杆菌潜在的传播和危害,为山东地区大肠杆菌病的防控提供了理论参考和借鉴。
1 材料与方法
1.1 试验材料
菌株:药物敏感性试验质控菌株ATCC 25922由山东省农业科学院畜牧兽医研究所公共卫生实验室保存;近年收集动物源大肠杆菌563株,由Varms菌种库收集与保藏,包括禽源(鸡和鸭)和猪源。
试剂与药品:MHA琼脂和MH肉汤培养基购自北京陆桥技术有限责任公司;分析纯抗菌药物庆大霉素、多西环素、氟苯尼考、氨苄西林、头孢曲松、头孢噻呋、头孢噻肟、恩诺沙星、环丙沙星和左氧氟沙星,购自北京普博欣生物科技有限责任公司; PCR buffer、dNTP、Taq DNA聚合酶和DNA Marker等,购于天根生化科技( 北京) 有限公司。
1.2 试验方法
1.2.1 药敏试验 根据美国临床和实验室标准协会(Clinical and Laboratory Standards Institute, CLSI)制定的标准药敏测定方法[5],采用山东省农业科学院畜牧兽医研究公共卫生研究室自主研发的智能化药敏检测仪[6,7],对动物源大肠杆菌进行10种药物的敏感性测定,根据MIC值和CLSI标准的S(敏感)、I(中介)、R(抗性)值,计算抗药率,分析抗药谱型和MIC频率分布。
1.2.2 大肠杆菌多位点序列分型(MLST) 根据PubMLST(http://pubmlst.org)和NCBI上公布的基因片段设计大肠杆菌七个管家基因adK、fumC、gyrB、icd、mdh、purA、recA的引物序列,由青岛擎科梓熙生物技术有限公司合成,大肠杆菌7个管家基因引物序列见表1。
采用水煮法提取大肠杆菌总DNA,MLST的PCR反应体系为50 µL:1×Taq mix 25 µL,上游(F)
和下游引物(R)各1 µL,模板DNA 2 µL,ddH2O 22 µL。PCR扩增程序为95 ℃预变性5 min,95 ℃变性45 s,54~60 ℃退火45 s,72 ℃延伸1 min,30个循环,72 ℃延伸10 min。
PCR产物经凝胶电泳回收后由青岛华大基因科技有限公司进行测序。用DNA Star软件根据Pub MLST的要求对测序结果进行修正,使7个管家基因均符合国际上关于大肠杆菌多位点序列分型的序列要求,与Pub MLST数据库中序列进行比对分析,分别获取7个管家基因位点的等位基因数值,形成相应的等位基因谱判断其序列型。
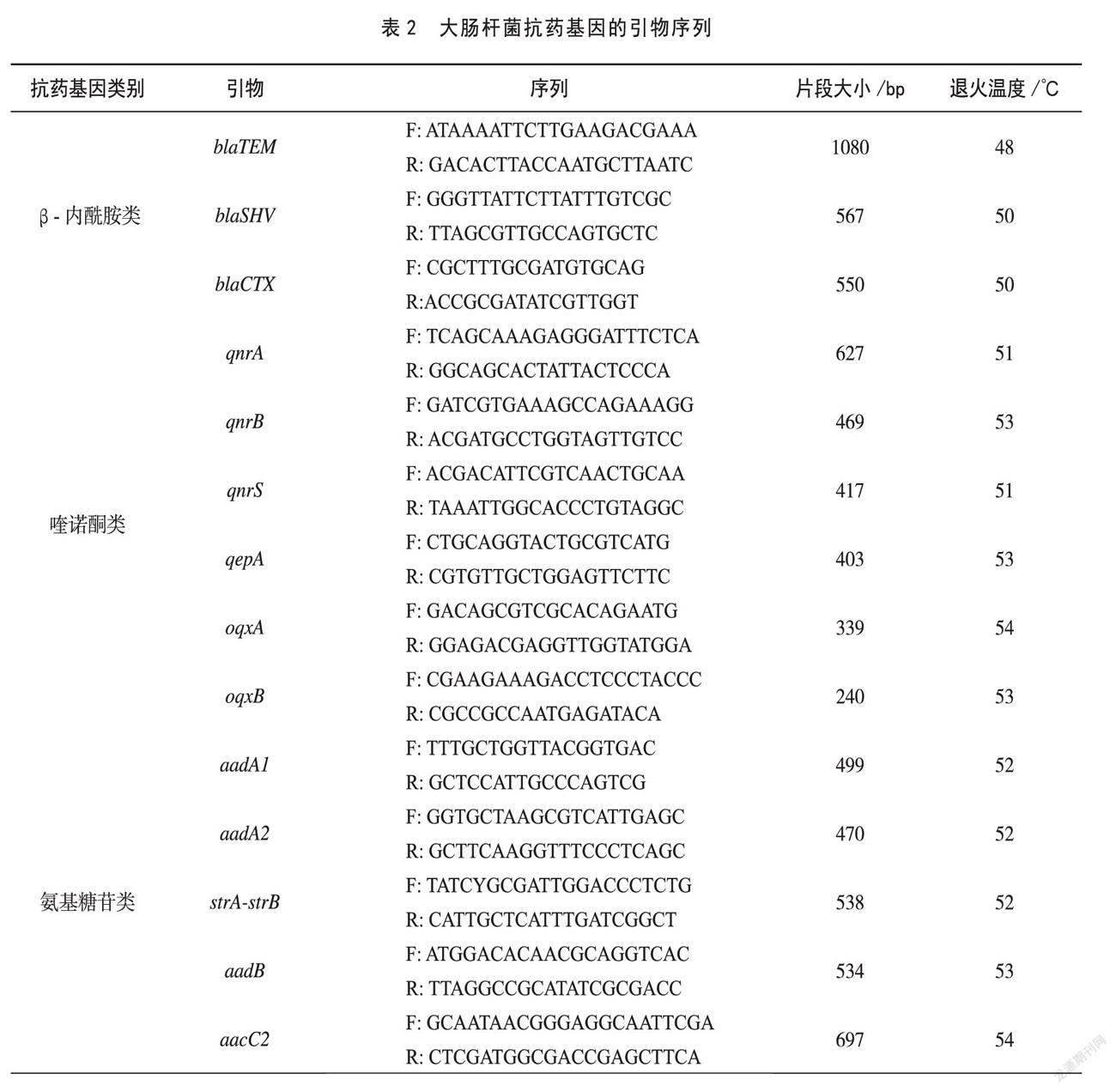
1.2.3 抗药基因和毒力基因的检测 检测大肠杆菌的抗药基因包括:β-内酰胺类:blaCTX-M,blaSHV,blaTEM;喹诺酮类:qnrA,qnrB,qnrS,qepA,oqxA,oqxB;氨基糖苷类:aadA1,aadA2,strA-strB,aadB,aacC2,aac(3')-IV,aph(3')-Ia,aph(3')-IIa;四环素类:tetA,tetB,tetC;氯霉素类:floR。根据GenBank和参考文献[8-12]设计合成大肠杆菌抗药基因的序列,如表2所示。
PCR反应体系为20 µL:1×Taq mix 10 µL,上游(F)和下游引物(R)各1 µL,模板DNA 2 µL,
ddH2O 6 µL。PCR扩增程序为95 ℃预变性5 min,
95 ℃变性45 s,52~60 ℃退火45 s,72 ℃延伸1 min,
30个循环,72 ℃延伸10 min。
检测大肠杆菌毒力基因包括:肠毒素astA,大肠杆菌素免疫蛋白基因cva/cvi,非菌毛黏附素eaeA,I型菌毛亚基fimC,耶尔森菌强毒力岛核心区的fyuA,溶血素hlyF,血清抗性蛋白iss,铁离子摄取相关基因irp2,气杆菌素家族的iucD,P菌毛编码基因papC,铁结合蛋白基因sitA,产志贺毒素stx1和stx2,温度敏感血凝素tsh,转运丝氨酸蛋白酶毒素vat。根据GenBank 和参考文献[13-18]设计合成大肠杆菌毒力基因的序列见表3。
PCR反应体系为20 µL:1×Taq mix 10 µL,上游(F)和下游引物(R)各1 µL,模板DNA 2 µL,ddH2O 6 µL。PCR扩增程序为95 ℃预变性5 min,95 ℃变性45 s,54~60 ℃退火45 s,72 ℃延伸1 min,30个循环,72 ℃延伸10 min。
2 结果与分析
2.1 大肠杆菌的药敏试验和多重抗药分析
通过山东省兽医抗药性监测网Varms采集各种动物来源的大肠杆菌,根据CLSI标准药敏测定方法,采用山东省农业科学院畜牧兽医研究公共卫生研究室自主研发的智能化药敏检测仪,测定MIC值,统计分析结果显示,5重以上的多重抗药性菌株106株,占20%左右,其中养殖环节多重抗药菌株的比例(86%,91/106)高于其他环节,如粪便和病料来源的大肠杆菌抗药程度远远高于鸡胚和鸭胚来源的大肠杆菌。此部分多重抗药菌株的抗药率如图1所示,对氟苯尼考和氨苄西林的抗药率达95%以上,恩诺沙星、多西环素、头孢噻呋、头孢噻肟和头孢曲松抗药率达80%左右,其余药物抗药率在70%左右。
多重抗药性大肠杆菌为5~10重抗药,抗药种类和谱型见表4,其中10重抗药所占的比例最大,达到37.27%。在10种药物中,青霉素类的氨苄西林、氨基糖苷类的庆大霉素、四环素类的多西环素、氯霉素类的氟苯尼考、头孢菌素类的头孢噻呋和喹诺酮类的恩诺沙星,为动物临床常用药物;头孢噻肟和头孢曲松、环丙沙星和左氧氟沙星为人医用抗菌药物,动物临床禁止使用;但从抗药率的结果看,大肠杆菌对同类药物都具有很高的抗药性,抗CEF/CRO/CTX的菌株占72.6%,抗LVX/CIP/ENR的菌株占64.2%,说明可能存在交叉抗药性。
2.2 多重高抗大肠杆菌的MIC分布
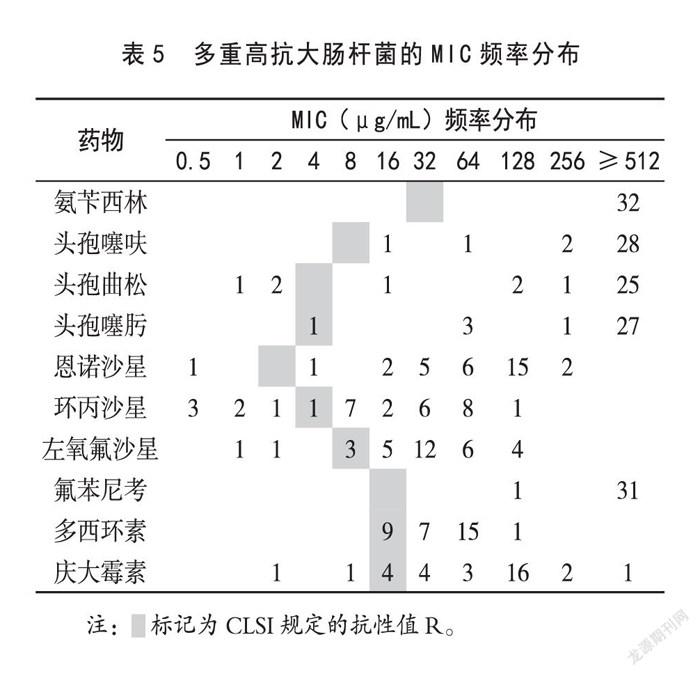
从上述多重抗药性大肠杆菌中选择9~10重抗药大肠杆菌32株,对氨苄西林、头孢噻肟、头孢噻呋、多西环素、氟苯尼考的抗药率为100%;对恩诺沙星、头孢曲松和庆大霉素,分别各有1株菌为敏感,抗药率高达96.7%。不但如此,菌株对各种药物的MIC很高,远远高于CLSI规定的R值,如氨苄西林和氟苯尼考,几乎所有菌株的MIC都大于等于512 µg/mL;对头孢类药物MIC大于等于512 μg/ml的菌株占80%以上;对恩诺沙星和庆大霉素,MIC高于128 µg/ml的菌株占50%以上。这些数据表明这些菌株为多重高抗菌株。具体MIC频率分布见表5。
2.3 多重高抗大肠杆菌的MLST分析
根据大肠杆菌7个管家基因测序结果形成相应的等位基因谱后判断其序列型,如表6所示,多重高抗大肠杆菌ST型高度分散,32株菌共计20種不同型别,其中6株为新型。
2.4 多重高抗大肠杆菌的抗药基因和毒力基因
抗药基因:每株动物源多重高抗大肠杆菌中均检测到含有7~13个抗药基因(表7)。β-内酰胺类blaCTX-M(100%)和blaTEM(90.6%)的检出率很高,而blaSHV检出率低于10%,说明前两个基因为主要流行抗药基因,与β-内酰胺类(青霉素类和头孢类)的高抗药表型一致;喹诺酮类oqxB和oqxA的检出率分别为96.9%和81.3%,是主要抗药基因,但qnrA、qnrB和qepA未检到,其中编号为32的菌株未检测到任何喹诺酮类抗药基因,其抗药表型也为敏感,二者具有一致性。氨基糖苷类共检测8个抗药基因,均有一定检出率,分布在34.4%~81.3%之间,组合检出率为100%,但依然有1株大肠杆菌的抗药表型是敏感的,说明基因型和表型之间存在一定程度的不一致性;四环素类抗药基因tetA和tetC未检测到,tetB的检出率为31.1%,与多西环素100%率不一致,抗药基因型和抗药表型并不吻合,表明还存在其它抗药性机制;氯霉素类floR(81.3%)流行率高达80%以上,与高抗药性表型一致。
毒力基因:除耶尔森菌强毒力岛核心片段fyuA、产志贺毒素stx1、肠毒素astA、温度敏感血凝素tsh和铁离子摄取相关基因irp2未检出外,共检测到10种毒力基因,见表8。I型菌毛亚基毒力基因fimC检出率最高,为90.6%;其次为铁结合蛋白sitA、气杆菌素家族的iucD和溶血素hlyF,分别为78.1%、59.4%和43.8%;血清抗性蛋白iss为21.9%,大肠杆菌素免疫蛋白cva/cvi为12.5%,非菌毛黏附素eaeA、产志贺毒素stx2、转运丝氨酸蛋白酶毒素vat和P菌毛编码基因papC均为6.3%。
抗药基因与毒力基因共存:多个抗药基因和多个毒力基因共存于同一株菌中是普遍现象,见表7和表9,32株多重高抗表型的大肠杆菌中同时含有8个以上抗药基因和3个以上毒力基因的菌株占87.5%,超过25%的菌株同时含有8~13个抗药基因和5~6个毒力基因,仅3株未检测的毒力基因。
3 讨论与结论
3.1 动物源大肠杆菌的抗药性
抗菌药物是控制细菌病感染的主要手段,随着在临床治疗中长期大量使用导致细菌抗药性的产生,从21世纪初期开始,动物源大肠杆菌出现多重抗药[19]。研究显示,大肠杆菌对第一线抗菌药物如头孢菌素、喹诺酮类等的抗性增强,并且由于同类抗菌药物存在相似的母体结构,显示出与医用抗菌药物的交叉抗药。质粒介导传播的新一代内酰胺酶是大肠杆菌对内酰胺类抗生素产生抗药性的重要原因[20],不同动物源大肠杆菌中也存在质粒介导的喹诺酮类耐药因子(plasmid-mediated-quinoloneresistance,PMQR)的细菌抗药[21],氟苯尼考抗药基因floR也为质粒介导[22]。本研究的多重高抗大肠杆菌三类检出率最高的抗药基因中,blaCTX-M和blaTEM基因的检出率为100%和90.6%,为大肠杆菌两类主要的ESBLs基因型;喹诺酮类耐药因子PMQR以oqxA、oqxB基因为主,均为80%以上;氟苯尼考抗药基因floR检出率超过80%。大肠杆菌中β-内酰胺类、喹诺酮类及氟苯尼考抗药基因floR共存的现象,均为质粒介导,势必加重耐药水平传播和引发多重耐药的风险[23]。
更加需要引起高度重视的是,本研究中某些大肠杆菌的MIC非常高,甚至高至512 μg/mL,远远高于CLSI规定的抗性值R,并且同时对多种药物都具有高抗药性,这样的菌株在临床并不罕见。此外,多重高抗大肠杆菌的MLST分型高度分散,新谱型较多,并且不同种动物源之间并无明显的种属特异性,菌株可能在不同物种间传播,增加了包括人在内的不同物种共患的可能性。山东兽医抗药性监测网Varms长期关注动物源细菌抗药性现状及动态变化,提供预警机制,采用高通量药物敏感性试验筛选较为敏感的抗菌药物进行治疗,尽量避免人畜抗药率高的抗菌药物,同时应严格控制抗菌药物用量和使用频率以避免抗药性的产生和广泛传播。
3.2 多重高抗大肠杆菌毒力基因的公共卫生意义
本研究的分离菌株大多为肠道共生菌群,与采样动物的健康状况有一定关系。然而,分离菌株携带大量的抗药基因和毒力基因的检测结果提示,动物可能作为抗药基因和毒力基因的储存库,兼具抗药性和毒力的菌株造成严重的公共卫生威胁和巨大的食品安全潜在危害。
大肠杆菌的致病性与其毒力因子有关,编码毒力因子的基因在动物源和人源致病性大肠杆菌有较高的检出率和同源性[24],推测某些人源致病性大肠杆菌和动物源致病性大肠杆菌有潜在的人畜共患风险,且动物是人源致病性大肠杆菌的储存器[25]。因此,从分子研究水平调查研究动物源大肠杆菌中抗药基因和毒力基因的携带、共存并探究抗药性和致病性之间的相关性,对公共卫生安全有重要的意义。
本研究中32株多重高抗大肠杆菌中,I型菌毛毒力基因fimC的检出率超高90%,大肠杆菌I型菌毛毒力因子广泛存在于大肠杆菌与绝大多数肠杆菌表面,能够介导细菌和宿主细胞之间的相互作用,是细菌感染性疾病成功建立的第一步。I型菌毛单独存在并不会导致很强的致病力,但这些菌株中较强的毒力因子如气杆菌素家族的iucD和溶血素hlyF也有较高的流行率,甚至如血清抗性蛋白基因iss和产志贺毒素基因stx2强毒力基因也有检出,志贺样毒素(Stx)是一种志贺毒素,具有细胞毒性、肠毒性、神经毒性作用,是毒性最强的细菌毒素之一,包括Stx1和Stx2两种亚型,Stx2较Stx1的毒力更强[26]。这样的强毒力基因与高抗药基因共存于菌株中,对动物养殖和公共卫生将是巨大的潜在威胁。对动物源大肠杆菌抗药基因和毒力因子传播的控制,抗药和致病机制的解析和抗菌药物替代品的研制是今后防控动物源多重高抗高治病大肠杆菌感染的研究方向。
参考文献:
[1] LAXMINARAYAN R, DUSE A, WATTAL C, et al. Antibiotic resistance - the need for global solutions [J]. Lancet Infect Dis, 2013, 13(12): 1057-1098.
[2] QUAIK S, EMBRANDIRI A, RABINDRAN B, et al. Veterinary antibiotics in animal manure and manure laden soil: Scenario and challenges in Asian countries [J]. J. King Saud Univ Sci, 2019,32(2):1300-1305.
[3] RU SH, LEE J H, PARK S H, et al. Antimicrobial resistance profiles among Escherichia coli strains isolated from commercial and cooked foods [J]. Int J Food Microbiol, 2012,159(3): 263-266.
[4] KAPER J B, NATARO J P, MOBLEY H L. Pathogenic Escherichia coli [J]. Nat Rev Microbiol, 2004, 2(2): 123- 140.
[5] CLSI. Performance Standards for Antimicrobial Disk Susceptibility Tests. 27th Edition. CLSI document M100 [S]. Wayne: Clinical and Laboratory Standards Institute, 2019.
[6] 胡明,李璐璐,赵敏,等. 96点阵琼脂稀释法与微量肉汤稀释法药敏试验结果的对比 [J].中國抗生素杂志,2018,43(6):729-733.
[7] 骆延波,胡明,张庆,等. 高通量药敏试验接种仪的初步应用 [J]. 中国家禽,2020,42(6): 52-57.
[8] 杨守深,曾雪花,林敏,等. 猪源大肠杆菌耐药性及超广谱β-内酰胺酶流行性分析 [J]. 中国人兽共患病学报. 2019,35(1):45-50.
[9] 陈朝喜,李宇涵,谭敏,等. 川西北高原牦牛和藏猪源大肠杆菌生物被膜表型、耐药基因、整合酶基因和毒力基因检测 [J]. 中国农业科学,2021,54(23):5144-5162.
[10] 冯世文,李军,李常挺. 广西规模化猪场猪源大肠杆菌耐药表型和耐药基因检测及相关性分析 [J]. 中国兽医学报,2020(6): 1170-1178.
[11] 汤景元,王红宁,张鹏举. 95个猪场大肠杆菌耐药表型及氨基糖苷类药物耐药基因型调查 [J]. 畜牧兽医学报,2008,39(4): 472-477.
[12] 陈朝喜,李宇涵,谭敏,等. 川西北高原牦牛和藏猪源大肠杆菌生物被膜表型、耐药基因、整合酶基因和毒力基因检测 [J]. 中国农业科学,2021,54(23):5144-5162.
[13] SMITH J L,FRATAMICO P M,GUNTHER N W. Extraintestinal pathogenic Escherichia coli [J]. Foodborne Pathog Dis, 2007, 4(2): 134-163.
[14] 刘璨颖,李建宏,梅启定,等. 禽源致病性大肠杆菌的耐药性和毒力基因研究 [J]. 中国家禽,2018,40(13):21-25.
[15] SCHIERACK P,WALK N, EWERS C, et al. ExPEC-typical virulence-associated genes correlate with successful colonization by intestinal E. coli in a small piglet group [J]. Environ Microbiol, 2008, 10(7): 1742-1751.
[16] LAY K K, KOOWATTANAUKUL C, CHANSONG N, et al. Antimicrobial resistance, virulence, and phylogenetic characteristics of Escherichia coli isolates from clinically healthy swine [J]. Foodborne Pathog Dis, 2012, 9(11): 992-1001.
[17] 楊立军,韩先干,尹会方,等. 福建省龙岩市禽致病性大肠杆菌的血清型、毒力因子及耐药性研究 [J]. 中国动物传染病学报,2016,24(6):24-29.
[18] KAWASE J, ETOH Y, IKEDA T, et al. An improved multiplex real-time SYBR green PCR assay for analysis of 24 target genes from 16 bacterial species in fecal DNA samples from patients with foodborne illnesses [J]. Jap J Infec Dis, 2016, 69: 191-201.
[19] 雷连成,郑丹,韩文瑜,等. 动物源性大肠杆菌药物敏感性检测及耐药性分析(英文) [J].中国兽医学报,2005,25(5): 470-473.
[20] 杨守深,曾雪花,林敏,等. 猪源大肠杆菌耐药性及超广谱β-内酰胺酶流行性分析 [J]. 中国人兽共患病学报,2019,35(1):45-50.
[21] 刘宁,胡龙华,张楠,等. 质粒介导的耐氟喹诺酮类药物基因的研究 [J]. 中国微生态学杂志,2013,25(8):925-927.
[22] 汤景元,王红宁,张鹏举. 95个猪场大肠杆菌耐药表型及氨基糖苷类药物耐药基因型调查 [J]. 畜牧兽医学报,2008,39(4):472-477.
[23] 蒋培余,潘劲草. 细菌遗传元件水平转移与抗生素抗性研究进展 [J]. 微生物学通报,2006,33(4):167-171.
[24] LEE G Y, JANG H I, HWANG I G, et al. Prevalence and classification of pathogenic Escherichia coli isolated from fresh beef, poultry, and pork in Korea [J]. Int J Food Microbiol, 2009, 134(3): 196-200.
[25] BELANGER L, GARENAUX A, HAREL J, et al. Escherichia coli from animal reservoirs as a potential source of human extraintestinal pathogenic E. coli [J]. FEMS Immunol Medical Microbiol, 2011, 62: 1-10.
[26] RIBERA F P, SOTELO E, MOTALES I, et al. Short communication: Detection of Shiga toxin-producing Escherichia coli (STEC) in healthy cattle and pigs in Lima, Peru [J]. J Dairy Sci, 2012,95(3): 1166-1169.
Analysis of antibiotic resistance genes and virulence genes of multiple high resistant Escherichia coli from animals in Shandong Province*
LIU Linghong1,2, HU Ming1,2**, LIU Yuqing1,2**
(1. Shandong Key Laboratory of Animal Disease Control and Breeding, Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences,Ji’nan 250101,China;
2.Key Laboratory of Livestock and Poultry Multi-omics of MARA, P.R.China, Ji’nan 250101,China)
Abstract: The multiple antibiotic resistance of E. coli from animals were detected in Shandong Province, and the antibiotic resistance genes and virulence genes were analyzed in multiple high antibacterial strains. E. coli strains from animals was selected from the strain bank of Shandong Veterinary antibiotic resistance monitoring system (Varms). The sensitivity test of 10 antibiotics was carried out by agar dilution method, and the resistance spectrum of more than 5 multiple drug resistant strains was analyzed. Multiple antibiotic resistance strains with high MICs were selected for MLST typing, and 21 common drug resistance genes and 15 virulence genes were detected by PCR. The results showed that about 20% of the strains were resistant to more than 5 drugs, 32 strains were resistant to 9~10 antibiotics and the MICs was much higher than the R value. The coexistence of 7~13 drug resistance genes and 0~6 virulence genes was detected in all 32 strains, in which the resistance genes with the highest detection rate of β-lactams, quinolones and chloramphenicols were mediated by plasmids; fimC, sitA, iucD and hlyF were the main factors of virulence genes, and the detection rate is 40% ~ 90%. E. coli strains with both resistance and virulence would pose a serious public health threat and huge potential harm to food safety.
Keywords: E. coli; Multiple antibiotic resistance; Antibiotic resistance genes; Virulence genes
*基金項目:山东省重大科技创新工程项目“针对超级细菌的兽用噬菌体新兽药和新添加剂研发应用”(2019JZZY010719);山东省现代农业产业体系“家禽创新团队环境控制岗位专家”(SDAIT-011-09);山东省农业科学院农业科技创新工程重大创新任务“临沂市农牧废弃物循环利用与公共卫生监测提升工程”(CXGC2022A27)。
作者简介:刘玲红( 1991—) ,女,硕士研究生,主要从事预防兽医学研究,E-mail: 1074150258@ qq.com。
**通信作者:胡明(1972—),女,副研究员,博士,主要从事畜牧业微生物研究,E-mail:may_lake@163.com;
并列通信作者:刘玉庆(1969—),男,研究员,主要从事农业畜牧业微生物研究,E-mail: liuiuqing@163.com。
