Th17和Treg细胞及其平衡对甲状腺相关眼病的影响
2022-07-12蒋敏敏王泽瑾高天雨燕树勋
王 萍,符 宇,蒋敏敏,王泽瑾,颜 焱,高天雨,王 颖,燕树勋
0 引言
甲状腺相关眼病(thyroid-associated ophthalmopathy,TAO)是一种器官特异性自身免疫性疾病,是Graves病(Graves’ disease,GD)最常见、最重要的甲状腺外器官损害[1],其发生率占GD的25%~50%[2]。TAO临床表现复杂,疾病的活动期主要为明显的炎症反应,眼部异常物质如糖胺聚糖(glycosamiboglycans,GAGs)大量沉积、淋巴细胞浸润和组织水肿引起的眼睑、结膜充血水肿、眼球突出等。静止期炎症活动减退,则出现眶内组织的纤维化和脂肪化,出现眼球运动障碍、斜视和复视等症状[3]。TAO导致的颅面畸形、视功能损伤等使患者总体的健康相关生活质量明显下降[4]。目前多用一般支持疗法、糖皮质激素治疗、免疫抑制剂治疗、球后放射治疗、手术等干预TAO[1],临床尚缺乏统一、成熟的治疗方案[5]。TAO的发病机制涉及免疫、遗传、环境等诸多方面,其中免疫因素与TAO关系密切[6]。越来越多的证据显示,辅助性T17(T-helper 17 lymphocyte,Th17)细胞、调节性T(regulatory T cell,Treg)细胞对TAO免疫平衡的影响至关重要[7]。本文就Th17、Treg细胞及其平衡对TAO的影响进行综述。
1 TAO的免疫学发病机制
TAO的具体发病机制尚不明确。多数学者认为其发病以甲状腺上皮细胞、眼眶成纤维细胞(orbital fibroblasts,OFs)等表达共同抗原所引起的细胞免疫异常为主。促甲状腺激素受体(thyrotropin receptor,TSH receptor,TSHR)是当前较为肯定的交叉抗原[8]。TSHR表达量的升高能直接参与TAO的发病,也能在TAO发生后进一步上升。胰岛素样生长因子1受体(insulin-like growth factor 1,IGF-1R)是TAO发病和进展的另一重要自身抗原[9]。
OFs作为TAO自身免疫反应的靶细胞[10],可发挥免疫调节功能,并有明显的异质性(细胞在生长过程中,经过多次分裂增殖,在完成其生命周期的同时呈现分子生物学或基因方面的改变,从而产生细胞状态或类型的多样性)。OFs能够在细胞因子和自身抗体的作用下分化成肌成纤维细胞和脂肪细胞[11]。活化的T淋巴细胞、B淋巴细胞、巨噬细胞等可通过CD40~CD154共刺激途径激活OFs,合成并释放大量的细胞因子、黏附分子和抗体到组织中,影响OFs的增殖和分化,诱导OFs合成并释放透明质酸(hyaluronic acid,HA)和其他GAGs,并表达免疫调节蛋白,引起眼眶局部炎症。GAGs堆积及脂肪形成最终导致眼外肌的增粗、水肿、变性、眼眶脂肪组织体积增大[3]和眼眶结缔组织纤维化[6]。同时,激活的OFs分泌大量的细胞因子、生长因子及趋化因子,将更多的免疫细胞进一步募集至眼眶中,导致TAO炎症反应的失控[12]。在TAO的发生发展中外周血纤维细胞也起到了很重要的作用。纤维细胞来源于骨髓,可表达CD45、CD34、趋化因子受体4(CXCR4)和TSHR等表面标志物。TAO患者外周血中CD34+纤维细胞的数量上升明显,能够浸润眼眶组织并分化成CD34+OF,与眼眶中原有的CD34-OF共同表达TSHR和IGF-1R,且相互调节[13]。Gillespie等[14]研究表明与健康组相比,TAO患者的外周血单核细胞(peripheral blood mononuclear cell,PBMC)中有更多的纤维细胞,TSHR表达增加。Smith等[3]认为组成性CD40和主要组织相容性复合体Ⅱ(major histocompatibility complex-Ⅱ,MHC-Ⅱ)在纤维细胞上的表达比OFs更有效,纤维细胞可有效地将抗原呈递给TAO中的T细胞。
2 Th17和Treg细胞及其功能概述
Th17作为主要的促炎细胞,其增殖、分化过程需要由胸腺基质淋巴细胞(TSLP)、IL-23、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、γ干扰素(interferon-γ,IFN-γ)、白细胞介素-1β(interleukin-1,IL-1β)、转化生长因子-β(transforming growth factor-β,TGF-β)、IL-4等共同介导,并需转录激活因子3(STAT3)活化和特异性转录因子维甲酸相关孤儿受体γt(RORγt)mRNA的表达[15-16]。其中IL-6在促进Th17细胞的分化的同时能够抑制Treg细胞的分化[17]。Th17细胞主要分泌IL-17(IL-17A)、IL-21、IL-22等细胞因子,表达IL-23受体(IL-23R)及趋化因子受体6(CCR6)。其中IL-17的改变能够代表Th17细胞水平的改变和疾病的发生。IL-17能够促进免疫细胞活化,使靶细胞高表达IL-6、IL-8等细胞因子,从而进一步召集和活化中性粒细胞,导致更多的炎症因子分泌,最终加重局部炎症反应及组织损伤。IL-21能够和STAT3相互作用,上调IL-23、RORγt的表达,扩展Th17细胞的分化状态[18]。IL-23作为Th17细胞启动后进一步拓展和存活的依赖性因子,能促进并维持Th17细胞的分化成熟和生理功能的反馈[19]。
Treg细胞有低反应性及免疫抑制性的特点。叉头状转录因子P3(fork head boxP3,Foxp3)是Treg细胞的标志性分子[20]。Treg细胞通过分泌细胞因子、细胞间接触、由Foxp3在转录水平调控效应性T细胞的活化过程、延长细胞增值周期、促进细胞死亡、清除活化免疫细胞[21]等多种方式发挥对效应性T细胞及抗原提呈细胞(antigen-presenting cells,APC)的负调节作用,还能由改变APC的状态来抑制B细胞的过度活化[22]。Treg细胞主要分泌TGF-β、IL-10等细胞因子,表达细胞毒性T淋巴细胞相关蛋白4(CTLA-4)分子,传递抑制信号。高浓度TGF-β在没有炎性因子介导的情况下,通过信号转导磷酸化激活转录因子Smad2和Smad3刺激FoxP3表达,促使CD4+T细胞分化为Treg细胞[23]。IL-10作为功能强大的抑炎因子,与TGF-β共同诱导Treg细胞分化,同时抑制Th17细胞的反应[24]。
Th17与Treg细胞是CD4+T细胞分化的不同方向,二者共享TGF-β介导的信号通路。TGF-β单独作用时,活化的初始T细胞分化成Treg细胞。当机体免疫系统被激活,IL-6和TGF-β协同作用则诱导RORγt mRNA产生,使T细胞向Th17细胞分化,同时抑制Treg的表达。Th17和Treg细胞在机体的免疫反应中既独立又统一,共同维持机体免疫微环境的平衡,一旦这种平衡被打破,多种免疫相关疾病便会随之发生[25]。
3 Th17细胞在TAO发生发展中的作用
Th17细胞在TAO患者眼眶组织的炎症反应和纤维化中起重要作用[26]。Th17细胞能够激活免疫细胞和OFs,促进细胞外基质的生成和眼眶组织的炎性改变,引起组织损伤和重塑[27]。IL-17A作为Th17细胞最主要的效应因子,在诱发炎症反应中发挥关键作用。众多研究已证实TAO患者的眼眶细胞及甲状腺细胞中有IL-17A的增加[28]。有研究显示,TAO患者外周血中Th17细胞数量增加、活性提高[29-30]。伴随着TAO的缓解,Th17细胞数量逐渐下降[28]。TAO患者OFs及外周血中IL-17A、IL-21、RORγt mRNA表达和IL-6、IL-23、IL-1β数量明显增高[31],并与促甲状腺素受体抗体(thyrotropin receptor antibody,TRAb)水平[28]、TAO临床活动性评分(clinical activity score,CAS)正相关[32-33]。此外,CD44作为HA的主要受体,可趋化T细胞黏附于OFs,而Th17细胞表面高表达CD44,可作为招募其浸润眼眶组织的重要信号分子。
3.1IL-17A促进TAO的炎症反应IL-17A不仅具有强大的致炎作用,还具有调节炎症反应的作用。IL-17A可在全身和眼眶局部组织等多个层面调控TAO的炎症反应[10,28]。TAO患者中IL-17A可诱导OFs表达促炎基因和蛋白,这种诱导作用具有时间依赖性及剂量依赖性,且能被IL-17A中和抗体完全阻断[18]。IL-17A通过激活NF-κB通路及MAP激酶(MAPK)刺激纤维细胞和OFs中的IL-6、TNF-α、IL-1β、趋化因子(如MCP-1、CXCL1、CXCL2、CXCL9、CXCL10、CCL7、CCL20)、粒细胞-巨噬细胞刺激因子(GM-CSF)、细胞间黏附分子(ICAM)、前列腺素E2(PGE2)、一氧化氮合成酶、共刺激分子(CD40和MHC Ⅱ)等的表达,招募炎症细胞并促进其增殖,并将炎症细胞募集到靶细胞的黏膜表面。同时和其它炎性细胞因子(如TNF-a、IFN-γ)协同增强炎症反应[6,30,34-35]。IL-17A与IL-17A受体的结合还可促进B细胞分化为浆细胞而产生TRAb。细胞因子中的IL-6可通过正反馈进一步促进Th17的分化和IL-17A的分泌,激活急性期反应与补体,不断放大细胞的免疫反应。方思捷等[36]研究表明在IL-17A处理的OFs中,p38 MAPK通路的活化有利于OFs合成和分泌促炎细胞因子。而纤维细胞和OFs可通过PGE2受体EP2或EP4介导的环磷酸腺苷(cAMP)途径促进Th17表型[26,33]。Leskela等[37]发现TAO患者外周血中T细胞免疫球蛋白黏蛋白-3(TIM-3)及半乳糖凝集素-9(Galectin-9)的表达减少,而TIM-3和Galectin-9表达降低与Th17细胞增加有关。魏洪发[38]推测miR-146a通过减弱对其靶基因白细胞介素-1受体相关激酶1(IRAK1)的抑制作用而提高IL-17A水平,参与TAO的发病,且IL-17A的水平能够反映疾病的严重程度。除此之外,IL-17A的单核苷酸多态性(single nucleotide polymorphism,SNP)与TAO的易感性有一定联系[39]。Th17细胞还可与Th1细胞协同介导TAO的眼眶炎症反应。李琳娜[40]研究表明甲强龙能够抑制活动期TAO患者PBMC中Th17细胞的增殖及IL-17A表达,糖皮质激素对Th17细胞的调节作用是其临床治疗TAO的机制之一。
除了眼眶结缔组织外,泪腺腺泡细胞也可表达TSHR,是TAO的靶器官之一。TAO患者泪腺的炎症会引起不同程度的干眼症状,影像学可表现为泪腺体积增大[41]。TAO患者泪腺的大小与泪液中IL-17A等炎性因子的水平正相关[42]。
3.2IL-17A推动TAO眼眶结缔组织的纤维化IL-17A能刺激多种细胞外基质(extracellular matrix,ECM)的基因及蛋白表达水平上调[26]。ECM的增加不但是推动TAO纤维化病变的重要因素,还是TAO的重要病理特征。α-平滑肌肌动蛋白(α-SMA)是成纤维细胞分化成肌成纤维细胞的重要标志,IL-17A在激活成纤维细胞的同时能够提高TAO患者OFs中α-SMA基因及蛋白的表达。IL-17A还可通过JNK-c-Jun信号通路与TGF-β协同促进TAO患者来源的CD90+OF细胞分化为肌成纤维细胞并合成ECM[26]。需要说明的是,以往的研究多认为TGF-β能抑制大部分T细胞的反应,促进抗炎的Treg细胞产生,然而新近的实验表明TGF-β可以诱导未致敏的T细胞表达RORγt,促进小鼠原始T细胞分化成Th17细胞。TGF-β有双重作用,能够诱导原始T细胞分化为Treg细胞或Th17细胞。在无其他细胞因子参与时可抑制Th17细胞分化,但在细胞因子IL-6、IL-23、IL-1、TNF-α等参与时促进Th17细胞的分化,且帮助Th17细胞抵抗Treg细胞的抑制作用[43]。
OFs对IL-17A反应的异质性使IL-17A对OFs在纤维化和脂肪化的平衡中更趋向于发生纤维化改变。在TAO的整个病程中,无论球后脂肪组织增生的多少,患者的眼眶结缔组织最终都会发生不同程度的纤维化变性。
3.3IL-17A抑制TAO眼眶结缔组织的成脂分化TAO中被激活的T细胞能够产生促进脂肪生成的前列腺素,刺激前脂肪细胞分化为成熟脂肪细胞,扩大眼眶组织体积。然而IL-17A可通过GSK-3β-CEBP/α通路抑制TAO的成脂分化过程。IL-17A有利于CD90-OF中脂肪的降解,在成脂分化的早期阶段加速脂肪相关蛋白的分解代谢,在中后期阶段能对过氧化物酶体增殖物激活受体γ(PPAR-γ)激动剂介导的眼眶脂肪细胞的分化产生直接干扰作用[29]。而IL-6、IL-4、IL-10等能够提高眼眶组织中TSHR的表达,促进脂肪转化。上述证据表明,IL-17A可在一定程度上抑制TAO眼眶结缔组织的成脂分化。
3.4Th17细胞其他细胞因子对TAO的影响IL-21、IL-23虽然不是Th17细胞所特有的,但它们能够维持Th17细胞的表型及功能。体外实验表明,IL-21单独作用能够引起少量Th17细胞的产生,和TGF-β协同刺激后能够促进Th17细胞大幅增殖,上调IL-23R和RORγt的表达[44]。IL-21还可诱导IL-6缺失的T细胞分化为Th17细胞,提示IL-21可能作用在IL-6下游,能在一定程度上取代IL-6。IL-21结合IL-21受体能通过JAK/STAT信号通路促进T细胞增殖,使免疫细胞活化。TAO患者外周血中IL-21水平增加[27]。
IL-23可诱导Th17细胞分泌更多的IL-17A,同时分泌IL-22,稳定和扩增Th17细胞的表型[44]。未致敏的T淋巴细胞分化成Th17细胞的同时生成有抗炎作用的IL-10,可抑制Th17细胞的致炎能力,然而IL-23能够降低IL-10的表达,提高IL-17A的表达及致病效应。IL-23与其受体的结合能够激活Janus激酶(Jak2和Tyk2),形成STAT的对接位点,STAT的磷酸化可激活IL-17A和IFN-γ的转录。有研究提示IL-23R SNP变异也与TAO的易感性有关。李红林等[45]报道了IL-23在TAO患者外周血中表达升高。
4 Treg细胞在TAO发生发展中的作用
Treg细胞膜受体和MHC Ⅱ类分子相互作用,递呈促甲状腺素受体肽,参与TAO的发病过程。Treg细胞的减少使机体对TSHR的免疫耐受降低,导致甲状腺自身抗体的产生和活化,尤其是TRAb的活化[46]。研究表明,Treg细胞在TAO患者PBMC中所占的比例较GD组、健康组下降[47]。TAO患者Foxp3 mRNA的表达显著降低[29]。临床研究发现,通过利妥昔单抗(Rituximab)治疗后的重度TAO患者,其体内Treg细胞的水平得到明显提升。
4.1PD-1增强Treg细胞的免疫耐受功能延缓TAO进展活化的Treg细胞表面可表达程序性死亡受体1(PD-1)。PD-1是负性共刺激分子,它通过与其配体PD-L1、PD-L2的结合,增强Treg的免疫耐受功能[48]。TAO患者外周血PD-1及PD-L1阳性的Treg细胞数少于GD患者及健康人,PD-1/PD-L1低于GD患者。TAO患者经糖皮质激素冲击治疗后外周血CD4+T细胞表面PD-1表达率上调,同时TRAb滴度、CAS评分改善。糖皮质激素能够刺激Treg细胞分泌TGF-β、IL-10等细胞因子。增加Treg细胞因子分泌、上调T细胞表面PD-1表达率可能是糖皮质激素抑制TAO自身免疫反应的机制之一[49]。Shi等[50]发现Treg细胞表面的PD-1可向树突状细胞(DC)传递负向信号,减少DC表面CD40、CD80、CD86的表达,引发DC的成熟障碍,抑制DC的抗原递呈功能。
4.2雌激素增强Treg细胞数目延缓TAO进展Treg的功能受雌二醇(E2)的正性调控,是E2发挥免疫抑制、抗炎及增加免疫耐受等作用的中介因子。体内及体外实验均证实E2可以增加Treg细胞数目,使Treg表达Foxp3增多,TGF-β、IL-10分泌增加[51],从而加强Treg细胞的免疫抑制作用。伴随雌激素水平的改变,Treg的数量及功能也发生改变[52]。因雌激素受体(ERα)基因多态性的影响,不同个体E2的生物学效应不同,这可能是造成TAO患者疗效差异较大的原因之一。研究表明TAO患者ERa基因Xba I位点AA基因携带者的ER含量的降低能够直接影响E2对Treg的作用,造成Treg数目或功能的下降,这可能是女性TAO发生的机制之一[53]。
4.3差异研究探讨尽管多数研究认为TAO患者体内Treg细胞减少,免疫抑制作用下降。但也有一些研究出现了不同的结果。有研究显示TAO患者外周血中Treg细胞较健康者增多,但其抑制作用明显下降[54]。也有研究显示TAO患者外周血Treg细胞数目和健康者无差异。造成这些差异的原因可能是:(1)炎症部位的大量炎症因子能够引起负反馈调节而提高Treg的数量。甲状腺自身免疫性疾病患者外周血Treg细胞数目的增加是一种代偿反应,且与TAO发病相关的主要是Treg细胞功能的衰退[55];(2)不同研究对Treg细胞的界定不一。对Treg细胞的定义有CD4+CD25+T细胞、CD4+Foxp3+T细胞、CD4+CD25+Foxp3+T细胞的不同。激活的CD4+T细胞同样表达CD25,把CD4+CD25+作为Treg细胞的标志可造成结果偏高;而CD4+Foxp3+T细胞根据是否表达CD45RA、Foxp3和CD25又可分为3个亚群,只标记Foxp3会造成结果偏低。目前多数研究认为用CD4+CD25+Foxp3+T细胞界定Treg细胞较为合适[56];(3)忽视了性别对免疫系统的影响。雌激素是一种免疫调节剂,能够调节Treg细胞的表型[52];(4)TAO发展的不同阶段和CAS的差异会影响眼眶结缔组织的免疫炎症进程;(5)不同检测方法对检测结果也会产生影响。
5 Th17/Treg细胞失衡促进TAO发展
多种自身免疫性疾病中均存在Th17/Treg稳态的破坏[43]。国内外研究发现Th17/Treg失衡同样参与了TAO的发生发展,并在一定程度上反映TAO的严重程度[56]。Li等[7]发现TAO患者Th17/Treg比值升高。Th17细胞和Treg细胞的诱导分化可相互排斥,两者调节作用相反。有学者认为Treg细胞不仅参与了Th17细胞的分化,其本身也能够向Th17细胞转化[57]。部分研究认为,TAO激素治疗后症状的缓解伴随着其免疫系统重新进入一种免疫稳态[58]。自身免疫性甲状腺疾病患者发病和缓解两个阶段的T细胞表面受体(T cell receptor,TCR)免疫组库的多样性、克隆迁移、克隆扩增和分布都没有大的变化,已缓解的TAO患者外周血中还存在针对TSHR的自身反应性T细胞,但其Th17/Treg细胞降低,Th17/Treg平衡在一定程度上得到恢复[59]。有学者对多发性硬化症患者和强直性脊柱炎患者接受造血干细胞移植后的免疫状态进行动态监测,结果显示尽管经历了大剂量化疗和造血干细胞移植,患者体内依然存在大量致病性T细胞[60]。这也说明自身免疫性疾病的缓解不是通过消除反应性克隆,而是通过重建免疫平衡来实现的。这在一定程度上也佐证了Th17/Treg细胞失衡对自身免疫性疾病的重要作用。Th17/Treg细胞平衡的不稳定性可能是TAO容易复发的原因之一[61]。Th17、Treg细胞影响TAO自身免疫反应的机制见图1。
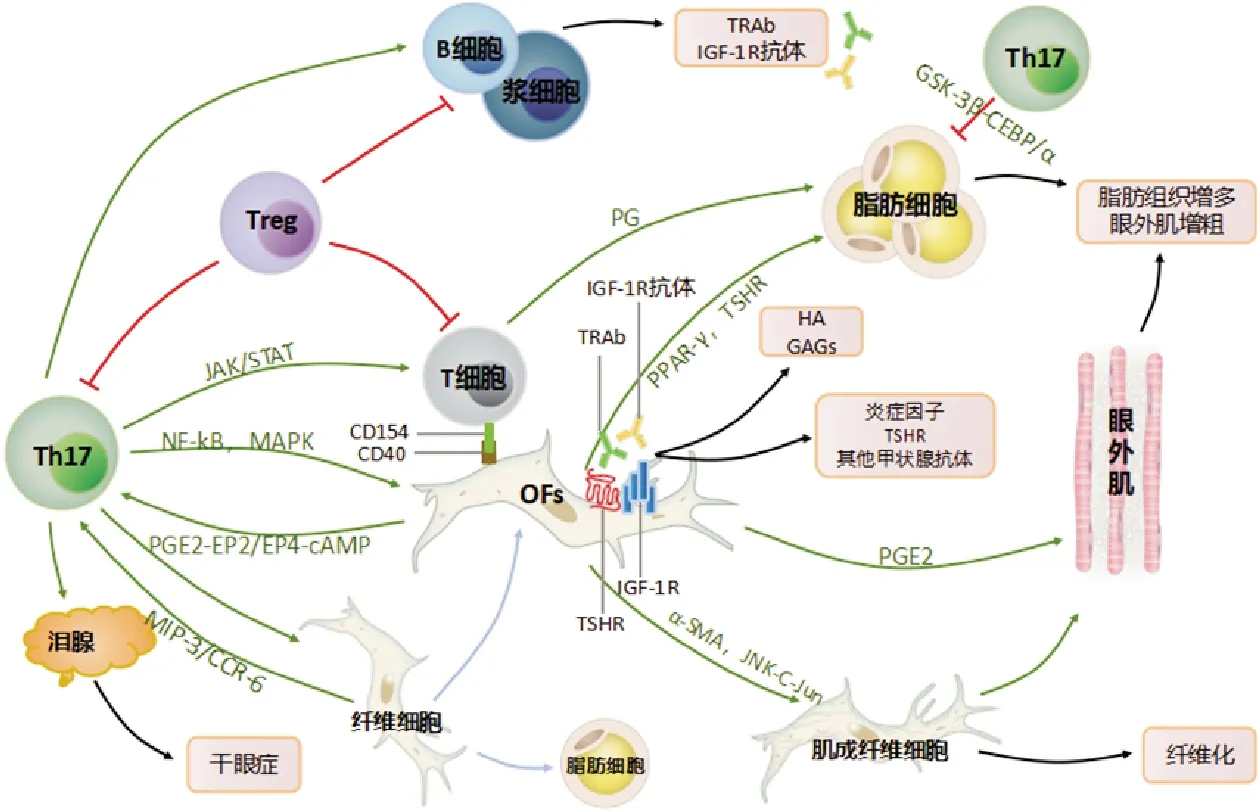
图1 Th17、Treg细胞对TAO自身免疫反应的影响模式图 Th17:Th17细胞;Treg:Treg细胞;TRAb:促甲状腺素受体抗体;TSHR:促甲状腺激素受体;IGF-1R:胰岛素样生长因子1受体;HA:透明质酸;GAGs:糖胺聚糖;PG:前列腺素。绿色箭头:促进或刺激;蓝色箭头:分化;黑色箭头:引起症状或免疫指标异常;红色抑制符:抑制或下调。
6 总结和展望
综上,Th17细胞可促进TAO的炎症反应及眼眶结缔组织的纤维化,抑制TAO眼眶结缔组织的成脂分化。Treg细胞可抑制TAO的免疫反应,维持免疫耐受。TAO的发生发展和Th17/Treg细胞免疫失衡密切相关。但目前关于Th17、Treg细胞及其下游靶基因等作用于TAO的具体机制尚不完全明了,有待进一步研究。目前虽已有针对IL-17A的多种单抗抑制剂被成功开发,但尚未在临床大范围应用于对TAO的治疗。继续研究Th17、Treg细胞对TAO影响的机制、研发调节Th17/Treg失衡的单抗治疗药物或中和异常表达细胞因子的制剂,可为TAO的防治提供新的思路和方法。
