生物素对动物糖、脂代谢的影响及其作用机制
2022-07-11晁碧辉宋万明李瑶兰杨竹青
晁碧辉 宋万明 李瑶兰 杨竹青
(江西农业大学动物科学技术学院,南昌 330045)
生物素(biotin)是动物维持正常生理机能不可或缺的维生素之一。它在动物碳水化合物、脂肪、蛋白质等养分代谢中起着重要作用,是动物生长、发育、繁殖等生命活动的必要营养因子[1]。过去认为哺乳动物可以通过饲粮、肠道微生物合成等途径获得生物素。但是,近年来研究表明,饲料原料中的和肠道微生物合成的生物素不能满足集约化生产和快速生长动物的需要,尤其是在疾病和应激情况下,必须通过在饲粮中添加生物素来提高动物的生产性能[2-5]。此外,在饲粮中添加一定量的生物素可显著改善动物的平均日增重、饲料利用率、胴体瘦肉率、肉质等生产性能指标,并可提高繁殖性能和降低腐蹄病等[2-5]。因此,本文就生物素对动物糖、脂代谢及脂肪沉积的影响及其作用机制进行了归纳总结,以期对畜禽集约化生产提供一定的指导。
1 生物素的理化性质及其代谢
生物素属于水溶性B族维生素,又称为维生素H、维生素B7、辅酶R,分子式为C10H16O3N2S,是由含2个五元杂环的双环化合物和含5个碳原子的含硫羧酸环组成(图1)。天然存在的生物素在全羧化酶合成酶(holocarboxylase synthetase,HCS)的催化下,其侧链上的羧基可与体内无活性羧化酶的赖氨酸ε-残基共价结合,形成有活性的羧化全酶[6],从而以全羧化酶形式参与体内羧化、脱羧和脱氢反应,具有转移羧基和固定二氧化碳的作用,并在动物碳水化合物、脂肪、蛋白质等代谢过程中起着关键作用;此外,生物素侧链上的羧基也可与组蛋白和热应激蛋白(HSP)等蛋白质的赖氨酸ε-残基共价结合,发生生物素酰化,从而来影响蛋白质和染色质结构,并调控基因表达[6-9]。生物素为无色针状结晶,易溶于水和乙醇,但不溶于有机溶剂,通常情况下相当稳定,只有遇到强酸、强碱、甲醛和紫外线等时才会被破坏。

图1 生物素的分子结构
生物素广泛存在于动、植物等饲料原料中,可能有8种不同的异构体,但只有D-生物素具有生物活性。饲料原料中生物素含量差异很大(变化范围为20~2 600 μg/kg),且很多饲料原料的生物素利用率不到50%[10]。饲料原料中的生物素常以多肽赖氨酸ε-残基共价结合形式存在,不能被动物直接吸收利用,必须在胃肠道的蛋白酶或肽酶的作用下,降解成生物胞素(ε-N-生物素酰-L-赖氨酸)和含生物素的小肽,然后在生物素酰胺酶作用下释放出游离的生物素,才能被动物吸收[11]。生物素的吸收主要是通过动物小肠1/3~1/2段处和结肠(猪)的肠细胞顶膜区的多维生素转运体(SMVT)跨膜转运至血液和各组织细胞,该吸收过程受Ca2+与钙调蛋白和蛋白激酶A(PKA)介导的信号通路调控[12]。超出机体需要的生物素经尿排出,而饲粮中未被吸收的生物素经粪排出,过量生物素对动物几乎无毒副作用。
2 生物素对动物糖、脂代谢的影响及作用机制
生物素作为乙酰辅酶A羧化酶1(ACC1)、乙酰辅酶AA羧化酶2(ACC2)、丙酮酸羧化酶(PC)、丙酰辅酶A羧化酶(PCC)和13-甲基丁烯酰辅酶A羧化酶(MCC)5种羧化酶的辅酶,具有全面而独特的调节体内糖、脂代谢的作用[13-16]。大量研究表明,生物素对基因表达有重要影响,但其作用的分子机制目前尚不清楚。至今为止,最为广泛接受的分子调节机制是环鸟苷酸(cGMP)/蛋白激酶G(PKG)信号通路和组蛋白生物素酰化。
2.1 生物素对动物糖代谢的影响及作用机制
2.1.1 生物素对动物糖代谢的影响
生物素是葡萄糖激酶(GK)、磷酸烯醇丙酮酸羧激酶(PEPCK)、磷酸果糖激酶(PFK)、丙酮酸激酶(PK)等关键酶的激活因子,是三羧酸循环的必需成分,参与糖酵解和糖原异生作用,并诱导胰岛素分泌来维持血糖稳定[13,17-19]。生物素主要通过2条途径来调控动物血糖水平:一是GK途径。一方面,生物素通过提高糖酵解过程的关键酶——GK的活性和表达来促进糖酵解,将葡萄糖转化为丙酮酸,从而达到降低血糖水平目的[17,20]。研究表明,生物素缺乏小鼠的葡萄糖耐受能力、肝脏葡萄糖磷酸化作用和糖原贮存量明显升高,但肝胰脏中GK活性和基因表达水平均降低了40%~50%,而补充生物素后该酶的活性及其在肝胰脏等组织中的基因和蛋白质表达水平均提高[17,20]。另一方面,高剂量的生物素能大大抑制糖异生过程不可或缺的限速酶——磷酸烯醇式丙酮酸羧激酶(PEPCK)和葡萄糖-6-磷酸酶(G6P)的活性和表达[13,20],同时也抑制了叉头框蛋白O1(FoxO1)和肝细胞核因子4α(HNF4α)等转录因子的表达[21],造成葡萄糖合成受阻,导致PC催化生成的草酰乙酸只能进入三羧酸循环,产生大量的ATP,随着ATP、ADP能量状态的改变,激活细胞能量压力感受器5′-AMP和蛋白激酶,从而通过调控固醇调节元件结合蛋白-1c(SREBP-1c)、碳水化合物反应元件结合蛋白(ChREBP)、烟酰胺磷酸核糖基转移酶(NAMPT)、过氧化物酶体增殖物激活受体γ辅激活因子-1α(PGC-1α)和哺乳动物雷帕霉素靶蛋白复合物1(mTORCl)等转录因子的表达来降低血糖水平,达到改善高血糖症的目的[14,21]。二是PC途径。在动物处于碳水化合物不足或饥饿时,生物素作为糖异生作用中关键限速酶——PC的辅酶,通过糖异生作来维持血糖稳定。研究表明,生物素缺乏,PC活性降低,导致丙酮酸不能异生为葡萄糖[22],而补充生物素后PC活性提高,促进糖异生作用,从而维持正常的血糖水平[15,23]。因此,当饲粮生物素供应不足,再加上各种应激和疾病等造成采食量不足时,将直接导致这两大生化反应受阻,降低葡萄糖的利用率,导致体内糖原快速减少或耗尽,出现低血糖甚至死亡现象。
生物素对胰岛功能、胰岛素分泌和基因表达等均有正面作用[24-25]。高剂量生物素能通过降低维持胰岛结构稳定的黏附蛋白基因[神经细胞黏附分子1(Ncam1)]表达和提高调控胰岛素分泌基因[叉头框蛋白A2(FoXA2)、胰十二指肠同源盒(Pdx1)和肝细胞核因子4α(HNF4α)等]表达来扩大胰岛体积,增加胰岛β细胞的比例及其转录水平,并促进胰岛素的分泌和表达[24];此外,生物素可以通过提高胰岛素受体的表达和蛋白质合成,来促进胰岛素受体转导蛋白-1(IRS-1)磷酸化,生物素也可以通过提高胰岛素受体和胰岛素分泌来降低高血糖症患者的血糖水平[25]。但是,生物素对动物糖代谢相关酶、胰岛素受体和胰岛素分泌的影响以及改善血糖的作用,并不是所有试验动物都取得了一致的结果,其可能原因与动物品种、饲喂方式、使用剂量以及动物生理状态等不同有关[1]。
2.1.2 生物素通过cGMP/PKG信号通路调控动物糖代谢的作用机制
在组织匀浆、初级培养液、体外细胞培养和体内试验中均发现,生物素是通过cGMP/PKG信号通路来调控基因的表达[26-28]。早在1982年就有研究人员发现1 mmol/L生物素或生物素-P-硝基苯基酯可将小鼠肝脏、心脏、肾脏、小脑和盲肠等匀浆组织中鸟苷酸环化酶(cGMPase)活性提高2~3倍[27],后来研究人员发现拉札生物素、双诺拉札生物素、碳生物素、异氮生物素等生物素类似物也可提高组织中cGMPase活性[29]。通过人类肝细胞阻断剂和抑制剂试验也发现,1 mmol/L生物素通过cGMP/PKG信号通路调控生物素依赖性羧化酶、HCS、SMVT的转录[26,30],以及去唾液酸糖蛋白和胰岛素受体的转录[25]。在小鼠分离培养的胰岛细胞中,生物素也可通过cGMPase和PKG信号诱导GK基因表达[28]。体内试验也表明,饲粮添加97.7 mg/kg生物素可以提高肝脏和脂肪组织的cGMP水平和腺苷酸活化蛋白激酶(AMPK)活性[14,16]。因此cGMP/PKG信号通路是目前最为接受的生物素调控基因表达的分子机制,但生物素是通过何种途径激活cGMP/PKG信号的目前还不是很清楚[1]。生物素可能通过HCS催化的中间产物——生物素酰腺苷酸(Bionyl-AMP)来活化cGMPase[26],cGMPase的活化使cGMP含量增加,从而刺激PKG产生信号传导,并激活AMPK等蛋白质磷酸化,使编码HCS、生物素依赖性羧化酶等基因转录活性增强[14,16,30]。也有研究提出,生物素可能通过一氧化氮合成酶(NOS)合成的一氧化氮(NO)来激活cGMP/PKG信号[31]。关于生物素诱导的cGMP/PKG信号又是通过何种途径来调控下游基因表达的尚不清楚。生物素可能通过激活cGMP/PKG信号来提高ATP水平,高水平的ATP通过ATP-敏感K+通路诱导胰岛素分泌,胰岛素再以自分泌方式通过磷脂酰肌醇-3-激酶(PI3K)/丝/苏氨酸蛋白激酶(AKT)信号通路激活胰岛素受体,导致GK活性和基因表达上调(图2)[1,28]。
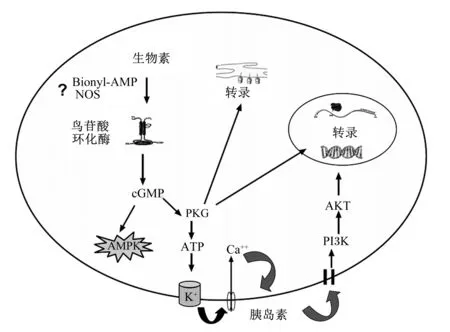
Bionyl-AMP:生物素酰腺苷酸 bionyl adenosine acid;NOS:一氧化氮合成酶 nitric oxide synthase;cGMP:环鸟苷酸 cyclic guanosine monophosphate;PKG:蛋白激酶G protein kinase G;AMPK:腺苷酸活化蛋白激酶 AMP activated protein kinase;ATP:三磷酸腺苷 adenosine triphosphate;PI3K:磷脂酰肌醇-3-激酶 phosphatidylinositol-3-kinase;AKT:丝/苏氨酸蛋白激酶 serine/threonine protein kinase;?:其作用途径不清楚 the pathway of action is unclear。
2.2 生物素对动物脂代谢的影响及作用机制
2.2.1 生物素对动物脂代谢的影响
生物素作为ACC1和ACC2的辅酶,将活性二氧化碳提供给乙酰辅酶A,催化乙酰辅酶A羧化为丙二酰辅酶A,而丙二酰辅酶A作为二碳单位,供给机体参与长链脂肪酸合成。因此,生物素是脂肪酸合成起始和脂肪酸碳链延长所必需的物质。生物素作为PCC的辅酶,是奇数碳脂肪酸和胆固醇侧链β-氧化的必需物质。生物素也是长链不饱和脂肪酸合成,尤其是必需脂肪酸合成的必需因子,并与乙酰胆碱和胆固醇合成有关。
大量研究表明生物素与机体脂质代谢相关。糖尿病患者添加生物素降低了血液葡萄糖和甘油三酯(TG)水平,提高了高密度脂蛋白胆固醇(HDL-C)水平[32]。药物剂量(2~15 mg/d)的生物素可以改善正常人的血脂水平,也可以降低高甘油三酯血症Ⅱ型糖尿病患者的血清TG和极低密度脂蛋白(VLDL)水平[33],降低高胆固醇Ⅱ型糖尿病患者的血清TG水平和低密度脂蛋白胆固醇(LDL-C)/HDL-C比例[34],降低Ⅰ型糖尿病患者的血清TG、总胆固醇(TC)和VLDL水平[35]。饲粮添加药物剂量的生物素降低了小鼠血清TG[18]和非酯化脂肪酸(NEFA)水平[16],同时也降低了肝脏TG和cGMP水平[14],但提高了脂肪组织的cGMP水平[16]。生物素也可以降低高果糖诱导代谢综合征小鼠的血清TG、NEFA和LDL-C水平,以及肝脏脂质水平,并能提高血糖和胰岛素耐受性[36]。
2.2.2 生物素调控动物脂代谢的作用机制
生物素主要通过降低肝脏和脂肪组织中脂肪生成相关基因的表达来调控机体的脂质代谢。在肝脏中,生物素通过降低SREBP1-c、葡萄糖转运蛋白2(GLUT2)、磷酸果糖激酶1(PFK1)、PK、乙酰辅酶A羧化酶(ACC)和脂肪酸合成酶(FAS)基因的表达,以及提高葡萄糖-6-磷酸脱氢酶(G-6-PD)等脂质代谢相关基因的表达来改善血液和肝脏脂质水平;在脂肪细胞中,生物素通过降低SREBP1-c、ACC1、FAS、G-6-PD、PFK1和过氧化物酶体增殖物激活受体γ(PPARγ)等脂肪生成相关基因的表达来降低脂肪含量[21]。生物素也降低了调控脂肪合成相关基因(如SREBP-1c、FAS和ACC1等)在链脲霉素诱导的糖尿病小鼠肝脏中的表达水平[21]。Aguilera-Méndez等[14]研究也发现,在肝脏和脂肪细胞中生物素通过提高cGMP水平和AMPK活性(磷酸化水平升高)来减少脂肪合成,从而导致ACC1失活(磷酸化水平升高),SREBP-1c和FAS基因表达下调。另外,生物素还可能通过提高脂肪细胞ACC2磷酸化水平来加速脂肪酸氧化,但在附睾脂肪中并没有发现生物素的脂解作用[16]。也有研究表明,生物素可通过提高胰腺β细胞功能、周边胰岛素敏感性以及下丘脑ACC2的表达来抑制食欲和肥胖发生[37]。
2.3 生物素通过蛋白质生物素酰化调控基因表达的作用机制
在很多细胞中生物素可与组蛋白和HSP等蛋白质的赖氨酸ε-残基共价结合,发生蛋白质生物素酰化,从而以表观遗传形式参与DNA甲基化、组蛋白甲基化和去乙酰化等过程,并对基因表达、细胞信号通路及染色质结构等起着独特的调控作用[6-9]。组蛋白生物素酰化水平很低(<0.001%),主要发生在组蛋白H3的K4、K9和K18以及组蛋白H4的K8和K12位点,也可发生在组蛋白H2A的K9、K13、K125、K127和K129位点[6-8]。最近,通过人胚肾细胞蛋白质组质谱分析发现了108个新的生物素酰化位点,其中最显著的是HSP家族成员,且50%左右的生物素酰化蛋白呈现蛋氨酸氧化,生物素酰化HSP的蛋氨酸硫氧化比例达到100%[9]。蛋白质结构分析表明,蛋氨酸硫氧化紧临于生物素酰化蛋白表面的赖氨酸残基,且当临近的赖氨酸残基生物素酰化后,蛋氨酸硫氧化的概率提升[9]。许多蛋白家族生物素酰化后,其体积远远超过原有体积,其主要原因是酰化过程携带了HSP家族成员和编码烯醇化酶1(ENO1)基因家族成员,这些HSP家族成员(如HSP60和HSP72)具有氧化还原和免疫功能[9,38],生物素酰化的2个ENO1基因产物[c-Myc启动子结合蛋白-1(MBP-1)和ENO1]具有糖酵解和抑制肿瘤作用[39]。HSP60基因敲除和生物素缺乏试验也表明生物素酰化赖氨酸残基和蛋氨酸硫氧化可协同抵御活性氧[9]。近年来在染色体着丝粒周围和基因转座子区域发现组蛋白H4的K8和K12生物素酰化修饰,和组蛋白H3的K9和K18生物素酰化修饰,这些组蛋白生物素酰化修饰能够抑制基因转录、修复DNA和沉默转座子等,从而维持基因组结构稳定[7-8]。生物素缺乏时,基因转座子的组蛋白生物素酰化水平下降,转座子的活性提高,导致基因组结构不稳定;生物素缺乏还可导致组蛋白的甲基化水平下降,磷酸化和乙酰化水平升高,且组蛋白甲基化、磷酸化和乙酰化水平的改变可阻碍组蛋白与DNA互作[40]。此外,组蛋白生物素酰化还依赖于DNA甲基化,DNA甲基化水平下降,导致组蛋白的生物素酰化水平提高[7],但组蛋白的生物素酰化水平提高是否会导致DNA甲基化水平改变,及其在糖、脂代谢中的作用,目前未见相关报道。
3 生物素对动物生长性能及脂肪沉积影响的研究进展
3.1 生物素对畜禽生长性能及脂肪沉积的影响
家禽生物素缺乏时,生物素依赖性羧化酶(如ACC1、ACC2、PC、PCC和MCC等)的活性降低,导致糖原异生作用和胴体脂肪合成能力下降,蛋白质合成受阻,抑制肝脏利用多不饱和脂肪酸(如亚油酸转化为花生四烯酸),导致胴体亚油酸过度沉积[41]。由于肝脏亚油酸转化为花生四烯酸能力受阻,导致肝脏、心脏和肌肉等器官的前列腺素前体物质缺乏,进而影响这些器官的正常生理功能[41]。由于集约化养殖的迅猛发展,家禽对生物素等营养素的需要量不断增高。NRC(2012)饲养标准中,对多种家禽的生物素建议添加量为0.15~0.30 mg/kg。
猪生物素缺乏时,脂肪组织中饱和脂肪酸(如棕檩酸和硬脂酸)比例下降而单不饱和脂肪酸(棕檩油酸)比例增高,造成质地柔软的油性背膘产生,严重影响猪的生长速度、肉品质和饲料转化效率[2],甚至出现掉毛、皮炎、口腔溃烂、痉挛、蹄角横裂及母猪繁殖问题等临床症状。为了充分发挥生长肥育猪的生长性能,生物素的添加量可达880 μg/kg以上[3]。生物素在猪的生长后期(体重42.4~96.6 kg,家畜大量蓄积体脂时)作用最大,饲粮添加55~500 μg/kg生物素能提高能量底物——多不饱和脂肪酸如亚油酸的利用率,促进猪脂肪代谢,从而提高饲料转化效率和增重率,并影响脂肪组织中饱和脂肪酸含量和胴体的脂肪组成[2]。Kopinski等[42]和Martelli等[3]研究也发现,饲粮添加100~300 μg/kg生物素可以提高大猪(体重160 kg)肝脏和皮下脂肪中豆蔻酸和棕榈酸等脂肪酸的含量,导致饱和脂肪酸含量升高,不饱和脂肪酸含量及其碘值下降。生物素可能通过提高乙酰辅酶A羧化酶活性,催化乙酰辅酶A羧化为丙二酰辅酶A,丙二酰辅酶A作为二碳单位合成饱和脂肪酸,从而增加了猪皮下脂肪的硬度[3]。此外,生物素还可改善育肥猪的肉色和肌肉嫩度,减少背膘厚,提高瘦肉率、胴体长、大腿重和胴体等级等[2-3,42]。
生物素参与反刍动物糖异生、丙酸代谢及脂肪酸合成等生化过程。泌乳期奶牛补饲20 mg/d生物素,可以提高母牛的产奶量[43],提高血浆和初乳中生物素含量,并改善奶牛的糖代谢和胰岛素敏感性[5]。饲粮添加生物素提高了奶牛的血糖水平,降低了血清NEFA和TG水平[4],还降低了产后奶牛肝脏TG水平[44]。血清代谢组学分析表明,生物素提高了奶牛血清肌苷和鸟苷等氨基酸代谢水平,降低了亚油酸和油酸等脂肪酸代谢水平[4],从而很好地改善早期泌乳奶牛的胰岛素敏感性和应激反应[5]。
3.2 生物素对水产动物生长性能的影响
鱼类生物素缺乏,将导致肝细胞空泡、变性、肿胀;心脏肌纤维溶解、断裂,肌间间隙变宽;肌肉肌纤维萎缩、断裂,且肌横纹模糊不清或消失;肠道黏膜上皮细胞变性、坏死、脱落;后肾肾小管细胞变性、肿胀;鳃丝粗短、排列不整齐、充血,且鳃小片粘连、坏死、脱落等现象[45]。由于肝脏、肾脏、肠道、鳃等是鱼类重要的消化免疫器官,因此这些器官的损坏将严重影响鱼类的生长性能、糖代谢、脂代谢和免疫功能等。饲粮添加0.5 mg/kg生物素可使喀拉鲃幼鱼的增重率、蛋白质保持效率、饲料转化率最大,适宜添加量为0.41~0.87 mg/kg[23]。饲粮添加0.210~0.238 mg/kg生物素可使草鱼[(117.11±0.48) g]增重率和免疫力最佳[46]。研究表明,饲粮生物素与碳水化合物存在互作,其通过激活PI3K/AKT信号通路来提高葡萄糖转运、糖酵解和糖原合成,从而促进大鳞鲆生长[47]。但生物素对鱼类糖、脂代谢影响的分子机制还不清楚。
4 小 结
综上所述,生物素是动物机体代谢必不可少的维生素之一,其在动物血糖稳定,胰岛素敏感性及糖、脂代谢等过程中具有重要的调节作用,能够提高动物的生长性能和免疫功能等。但生物素对动物糖代谢、脂代谢、脂肪沉积及肉质等影响及其调控机理研究甚少,部分动物的生物学最佳需要量尚不明确。虽然最近有研究表明,添加1.0 mg/L生物素可以提高植物厌氧氨氧化菌活性,从而提高总氮去除率、胞外聚合物分泌量和血红素产量[48],但生物素对动物肠道菌群的影响及其作用机制目前不清楚。因此,有必要进一步研究生物素对动物肠道菌群的影响及其对动物生长性能以及糖、脂代谢等的调控机理,探讨生物素改善肉质(肌间脂肪含量、肌肉嫩度、多汁性和肉色)的可能性,确定提高动物生产性能的最佳添加量。在此基础上,进一步揭示生物素在动物生产实践中的应用潜力,为改善养殖动物生长性能、脂肪沉积和肌肉品质开辟新的营养调控途径。
