HK-2外泌体提取及体外细胞靶向性的研究
2022-07-02谭小宁李勇敏马荣丽罗吉吕元
谭小宁 李勇敏 马荣丽 罗吉 吕元

〔摘要〕 目的 比较HK-2外泌体分离方法对粒径分布的影响,探索体外细胞摄取外泌体模式对外泌体细胞靶向性的参考价值。方法 采用超速离心法和3种试剂盒分离HK-2外泌体,测定其粒径分布;用PKH67标记HK-2外泌体,体外观察HFL1、hFOB1.19、Kupffer、HCT116 4种细胞吸收HK-2外泌体,以及HCT116吸收HCT116、HK-2、HFL1、Kupffer 4种细胞的外泌体情况。结果 不同的分离方法得到外泌体的粒径分析结果显示,超速离心法得到外膜囊泡的粒径比较均一,集中在100 nm左右。体外细胞吸收外泌体试验结果显示:(1)在体外,HK-2外泌体均能被HFL1、hFOB1.19、 Kupffer、HCT116细胞吸收;(2)HCT116能吸收HCT116、HK-2、HFL1、Kupffer细胞的外泌体。结论 超速离心法和试剂盒都能分离得到HK-2外泌体,超速离心法得到外泌体粒径大小分布较均一;试剂盒操作比较便捷,但是大囊泡和杂蛋白居多。在体外,同种外泌体能被多种细胞摄取吸收,同种细胞能吸收不同种细胞外泌体,表明外泌体在体外没有特别好的靶向性。
〔關键词〕 外泌体;超速离心法;粒径分布;体外细胞;靶向吸收
〔中图分类号〕R2 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.06.009
Extraction of HK-2 exosomes and cell targeting in vitro
TAN Xiaoning1, LI Yongmin1*, MA Rongli2, LUO Ji1, LV Yuan1
(1. Hunan Academy of Traditional Chinese Medicine Affiliated Hospital, Changsha, Hunan 410006, China;
2. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China)
〔Abstract〕 Objective To compare the effect of HK-2 exosomes separation method on particle size distribution, and to explore the reference value of model of exosome uptake by cells in vitro for exosome targeting. Methods HK-2 exosomes were separated by supercentrifugation and three kits, and its particle size distribution was determined. HK-2 exosomes were labeled with PKH67 to observe the absorption by HFL1, hFOB1.19, Kupffer and HCT116 cells, and exosomes of HCT116, HK-2, HFL1 and Kupffer cells were absorbed by HCT116. Results The particle size analysis of exosomes obtained by different separation methods showed that the particle size of outer membrane vesicles obtained by supercentrifugation was relatively uniform, concentrated at about 100 nm. The results of in vitro cell absorption of exosomes showed that: (1) HFL1, hFOB1.19, Kupffer and HCT116 cells could absorb HK-2 exosomes in vitro. (2) HCT116 can absorb exosomes of HCT116, HK-2, HFL1 and Kupffer cells. Conclusion HK-2 exosomes can be isolated by supercentrifugation and kit. The particle size distribution of the exosomes obtained by supercentrifugation method is relatively uniform. The kit is relatively easy to operate, but large vesicles and miscellaneous proteins are in the majority. In vitro, the same exosomes can be absorbed by multiple cells, and the same cells can absorb different kinds of exosomes, indicating that there is no particularly good targeting.
〔Keywords〕 exosome; supercentrifugation; size distribution; in vitro cells; targeted absorptionF80849DF-0E0D-4572-BCF0-165EECEBDB69
外泌体(exosome, Exo)是一类直径30~120 nm的有被囊性小泡,成杯状或球形结构,表面富含胆固醇、神经鞘磷脂、神经酰胺等脂类物质[1-2]。外泌体在形成过程中选择性地包裹细胞质中的一些蛋白质、核酸等信息物质,参与细胞通信、细胞迁移、血管新生和肿瘤细胞生长等过程,在生物信息交流中起关键作用[3-5]。本课题组一直关注外泌体与脏腑相关理论之联系,以细胞外泌体的特性来探索肾与骨之间的通信交流[6-7]。外泌体的研究越来越多,但是外泌体的分离纯化方法以及靶向细胞的寻找,一直困扰着研究者。本文比较超速离心法和3种常用的商业化试剂盒分离对人肾近曲小管上皮细胞HK-2外泌体的粒径分布的影响,并通过比较同种外泌体被多种细胞摄取吸收,同种细胞吸收不同种细胞外泌体的情况,获得体外细胞摄取外泌体方式对外泌体寻找靶向细胞的评估价值,望能促进外泌体的研究。
1 材料
1.1 细胞
人肾近曲小管上皮细胞(HK-2)(目录号SCSP-511)、人SV40转染成骨细胞(hFOB1.19)(目录号GNHu14)、人结肠癌细胞(HCT116)(目录号TCHu 99),均购自中国科学院细胞库;肝脏巨噬细胞(Kupffer)(武汉普诺赛生命科技有限公司,货号:CP-R132);人肺成纤维细胞(HFL1)由中南大学生命科学院赠送。
1.2 主要试剂
DMEM/F-12粉末(批号:1881051)、ES级胎牛血清(批号:1809582)均购自美国Gibco公司;无外泌体胎牛血清(上海素尔生物有限公司,批号:SUER050QY);exoEasy Maxi外泌体分离纯化试剂盒(德国QIAGEN公司,货号:76064);ExoQuick-TCTM外泌体快速抽提试剂盒(美国SBI公司,货号:EXOTC10A-1);GETTM外泌体分离纯化试剂盒(北京捷腾生物科技有限公司,货号:GET300-2);一抗稀释液(货号:P0023A)、封闭液(货号:P0252)、超敏发光液(货号:P0018)、DAPI染色液(货号:C1002)均购自上海碧云天公司;PKH67荧光试剂盒(美国Sigma公司,批号:MKBZ0604V);F-Actin染色试剂盒(美国Abnova公司,批号:1631293)。
1.3 主要仪器
超速离心机(美国Bechman公司,型号:L-100XP);纳米颗粒跟踪分析仪(德国Particle Metrix公司,型号:ZetaView);电泳仪(美国Hoefer公司,型号:SE300);正置荧光显微镜(型号:DM4000型)、激光共聚焦显微镜(型号:TCS-SPS)均购自德国Leica公司;超高分辨率成像系统(美国Applied Precision公司,型号:DeltaVision OMX Blaze)。
2 方法
2.1 细胞培养及上清液收集
人肾近曲小管上皮细胞(HK-2)培养于10% FBS的DMEM/F-12完全培养基中,37 ℃,5% CO2,饱和湿度培养箱中培养。汇合率达80%左右时,0.25%胰酶消化細胞成单个细胞悬液,1∶2进行传代培养。于提取外泌体之前更换成含10%无外泌体的FBS的DMEM/F-12培养基培养。48 h后,收集上清液,300×g离心10 min去除残留的细胞,2000×g离心10 min去除死细胞,10 000×g离心30 min去除大的囊泡和凋亡小体,得到比较纯的HK-2上清液。用超滤管对HK-2上清液进行浓缩,4000×g离心25 min,大约浓缩10倍。
2.2 分离纯化HK-2外泌体
2.2.1 超速离心法提取HK-2外泌体 超速离心管灭菌,每支装约20 mL的预处理浓缩后的HK-2上清液,于超高速离心机100 000×g离心70 min,小心吸出上清液,留1 mL液体;再加19 mL PBS洗外泌体,100 000×g离心70 min去掉杂蛋白,吸出上清液,用适量的PBS重悬。
2.2.2 exoEasy Maxi外泌体分离纯化试剂盒提取HK-2外泌体 预处理浓缩后的HK-2细胞培养上清液8 mL,加入与上清液等体积的缓冲液Buffer XBP,混匀加到离心柱里,500×g离心1 min,去掉膜下面的液体,把膜亲和离心柱转移到新的收集管中。用10 mL缓冲液Buffer XWP清洗离心柱上结合的外泌体,5000×g离心5 min去除残留的缓冲液。将离心柱转移到新的收集管中,加入400 μL的缓冲液Buffer XE和膜孵育1 min,500×g离心5 min进行洗脱,收集洗脱液。再把洗脱液加到离心柱的膜上,孵育1 min,5000×g离心5 min,收集洗脱液。
2.2.3 ExoQuick-TCTM外泌体快速抽提试剂盒分离纯化HK-2外泌体 沉淀溶液和样品的比例为1∶5,在5 mL预处理浓缩后的HK-2上清液中加入1 mL沉淀溶液混匀,4 ℃冰箱内放置过夜,1500×g离心30 min,吸出上清液,加入100~500 μL PBS重悬即可。
2.2.4 GETTM外泌体分离纯化试剂盒分离纯化HK-2外泌体 滤器预处理:把GETTM过滤器安装在50 mL的离心管上,在膜上均匀加500 μL的预处理液,抽真空使液体完全通过滤器。再均匀地加200 μL平衡液至滤膜上,抽真空使完全通过滤器。上样:加50 mL HK-2上清液(未浓缩),抽真空使上清液完全通过滤膜,可一次性处理250 mL。洗涤:均匀地加100 μL 洗涤液至滤膜上,抽真空使液体完全通过滤器。收集外泌体:把GETTM过滤器转移到新的50 mL的离心管上,在滤膜上加400 μL收集液,与滤膜孵育2 min,使液体完全通过滤膜,收集管中的外泌体悬液。F80849DF-0E0D-4572-BCF0-165EECEBDB69
2.3 粒径分析
将4种方法分离得到的外泌体每个取10 μL稀释500倍,用纳米颗粒跟踪分析仪测定外泌体的粒径分布及浓度。
2.4 HK-2外泌体体外靶向成骨细胞(hFOB1.19)检测
通过HK-2外泌体提取方法的比较,4种方法中选择超速离心法制备外泌体进行后续靶向实验研究。PKH67标记外泌体后加入hFOB1.19中:取外泌体悬液200 μL,加入1 mL 稀释液;另取离心管,加入1 mL稀释液,再加入4 μL PKH67染料溶液混合均匀;把外泌体悬液加到染料中,室温孵育2 min;加入2 mL无外泌体血清孵育1 min终止染色;100 000×g离心70 min收集外泌体,用PBS洗涤,再超速离心,用200 μL PBS悬浮避光保存。hFOB1.19汇合率达到80%时,用胰酶消化,细胞计数。在6孔板里预先加入盖玻片,将hFOB1.19以每孔2×105/mL的浓度接种在玻片上,置于33.5 ℃、5% CO2饱和湿度培养箱中培养。待细胞贴壁后,加入PKH67标记的外泌体,每孔加50 μL,培养3 h。
2.4.1 激光共聚焦显微镜观察 将加入外泌体孵育3 h的6孔板移出培养箱,吸除上清液,用PBS洗一遍,加入1 mL 4%多聚甲醛固定20 min,吸出固定液,用PBS洗3遍。加入1 μg/mL的DAPI染色液1 mL,避光孵育20 min,吸出染色液,用PBS洗去多余的染料。在载玻片上滴一滴甘油,把盖玻片从6孔板里拿出放在载玻片上,放4 ℃冰箱内避光保存,采用激光共聚焦显微镜观察并拍照。
2.4.2 超高分辨率成像系统观察 按照“2.4.1”操作,制备DAPI染色细胞爬片,用肌动蛋白染色试剂盒标记细胞骨架。取1 μL染料加到1 mL的缓冲液Labeling Buffer中稀释,取500 μL加入激光共聚焦小皿中,室温避光孵育30 min,用PBS洗去多余的染料,用超高分辨率成像系统观察并拍照。
2.5 HK-2外泌体体外摄取情况观察
选择HFL1、Kupffer、HCT116、hFOB1.19细胞(这些细胞来源于肺、肝、肠、骨等不同组織,且为本实验室保存)为观察对象。同“2.4”操作,培养细胞,制备好细胞爬片,分四象限排放于培养皿中,加入PKH67标记的HK-2外泌体200 μL,室温避光孵育3 h,用PBS洗去多余的染料,用荧光显微镜观察并拍照。
2.6 HCT116体外摄取多种细胞外泌体观察
按照“2.4”操作,分别制备HCT116、HK-2、HFL1、Kupffer细胞外泌体并用PKH67标记,分别加入HCT116细胞中,用荧光显微镜观察并拍照。
3 结果
3.1 HK-2外泌体不同提取方法对粒径分布的影响
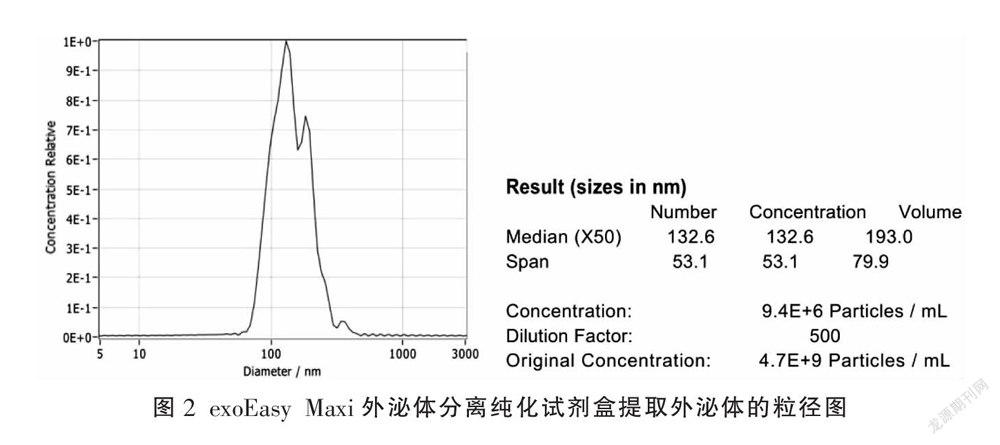
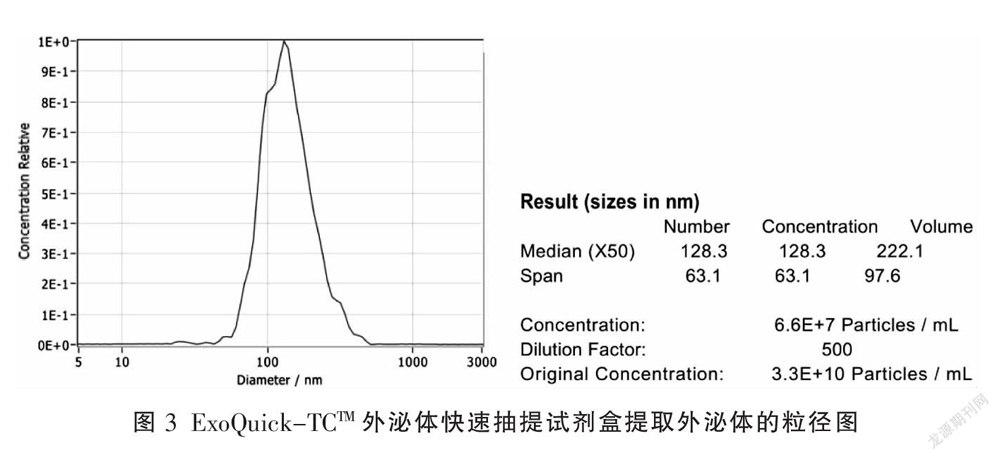
超速离心HK-2上清液得到外泌体,粒径集中在100 nm左右,表明外泌体粒径均一,纯度较高,1 mL HK-2上清液可以分离得到1.2×108个外囊泡(图1);exoEasy Maxi外泌体分离纯化试剂盒、ExoQuick-TCTM外泌体快速抽提试剂盒、GETTM外泌体分离纯化试剂盒提取HK-2上清液的外泌体大部分粒径集中在100~500 nm,大囊泡居多。exoEasy Maxi外泌体分离纯化试剂盒、ExoQuick-TCTM外泌体快速抽提试剂盒、GETTM外泌体分离纯化试剂盒提取的外泌体浓度分别为9.4×106/mL(图2)、6.6×107/mL(图3)、8.7×107/mL(图4)。
3.2 激光共聚焦显微镜观察HK-2外泌体体外靶向成骨细胞(hFOB1.19)
激光共聚焦显微镜观察如图5,可见HK-2 外泌体被hFOB1.19摄取并分布在核周围。
3.3 超高分辨率成像系统观察HK-2外泌体体外靶向hFOB1.19
图6A为超高分辨率成像系统下F-Actin红色荧光标记细胞骨架、DAPI蓝色荧光标记细胞核的hFOB1.19细胞。图6B可以清晰地观察到PKH67标记的HK-2外泌体已进入hFOB1.19细胞,分布在细胞核周围。将图6B视野旋转90°后为图6C所示,旋转180°为图6D所示,从不同角度可见,在hFOB1.19细胞核中间可见绿色的HK-2外泌体颗粒,确定HK-2外泌体已被hFOB1.19摄入细胞中。
3.4 荧光显微镜观察HK-2外泌体体外被多种细胞摄取情况
HK-2外泌体加入HFL1、hFOB1.19、Kupffer、HCT116细胞中检测,如图7所示,可见细胞内有PKH67标记的绿色外泌体,说明HK-2外泌体能被HFL1、hFOB1.19、Kupffer、HCT116细胞摄取。本研究中PKH67标记的HK-2外泌体的荧光信号容易淬灭,且细胞周围的HK-2外泌体荧光信号聚集过多,难以区别细胞对外泌体摄取量的差异。
3.5 荧光显微镜下观察HCT116体外摄取多种细胞外泌体情况
HFL1、HK-2、Kupffer、HCT116的外泌体加入HCT116细胞中,荧光显微镜下能看到HCT116细胞内出现PKH67标记的外泌体,如图8,说明HFL1、HK-2、Kupffer、HCT116的外泌体在体外均能被HCT116所摄取。
4 讨论
外泌体具有源细胞特征、器官靶向性与生物功能性三大特性,从外泌体角度对脏腑相关理论进行阐释,视外泌体为脏腑之间的一个靶向信使,由各脏腑细胞分泌,沿着脏腑相关的路线,靶向目标,调控靶器官功能,且运用脏腑相关理论有可能预测外泌体的靶向运动和生物功能。这对于中医基础理论的研究具有重要意义。F80849DF-0E0D-4572-BCF0-165EECEBDB69
细胞在胞外环境的刺激下会发生内吞、出芽,形成内囊泡,同时选择性地包裹细胞质中的蛋白质、核酸等,与细胞膜融合后形成外泌体被释放到胞外[8]。外泌体提取分离的常用方法是超速离心法,但其耗时比较长,极高的转速可能破坏囊泡的结构。试剂盒操作简便、耗时短,但聚合物沉淀引入过多杂蛋白,导致外泌体蛋白定量不准确。另外,在提取外泌体的过程中,一些化学试剂的加入破坏了囊泡的生物功能,导致外泌体功能研究难以进行[9-10]。本研究用超速离心法和3种常用的试剂盒分别提取HK-2外泌体,发现超速离心法提取外泌体粒径分布集中在100 nm左右,均一性好,质量好。试剂盒提取外泌体的共性是100 nm以上的囊泡居多,exoEasy Maxi外泌体分离提取试剂盒提取的外泌体浓度低,粒径分布集中,质量较好,ExoQuick-TCTM、GETTM提取的外泌体粒径分布有2个峰,均一性较差。
研究中还有一些其他的提取外泌体的方法,凝胶尺寸排阻色谱是依靠细胞外囊泡的直径与其他成分进行区分,但是在一些样品(如血浆)中存在大量与囊泡尺寸相似的粒子(如脂蛋白)等,因此分离效果不是很理想;免疫亲和纯化是仅选择一种外泌体亚型通过外泌体表面蛋白的亲和方式来捕获外泌体,该方法受限于抗体的特异性等问题,样品也会存在很多杂质。在研究中可以用两种方法同时用于外泌体的分离,SHARMA等[11]使用离心、浮力密度和超滤方法组合的手段从细胞条件培养基和生物流体中分离外泌体。近年来已经开发出一些用于快速分离和分析外泌体的装置,如微流控芯片、交流电动力学微阵列芯片装置主要用于血液中外泌体的分析,不需要预处理或稀释样品,也不需要使用捕获抗体或其他亲和技术,可以在30 min内对靶标进行特异性鉴定和定量,实现无缝的“样本到答案”的液体活检筛查[12]。
细胞外泌体分离纯化至关重要,最新的研究发现不同尺寸的外泌体的发生机制和功能作用不同[13],ZHANG等[14]用不对称流场分离技术对细胞释放的纳米级颗粒进行分类,证实了外泌体亚类的存在,把直径为90~120 nm的外泌体囊泡称为大外泌体囊泡,60~80 nm的称为小外泌体囊泡,把直径大约35 nm的称为“外泌颗粒”,深入分析之后发现这3种纳米颗粒显示出不同的蛋白质组、脂质、RNA和DNA分布以及N-糖基化模式,表明它们可能来源于不同的生物发生机制。因此,对外泌体的分离方法的优化仍是需要继续研究的课题。
细胞外泌体属纳米级,无色透明,即使超高分辨率显微镜(目前的STED技术分辨率可达30 nm)[15]也难以清楚分辨。因囊泡膜标记较方便,绿色荧光染料PKH67及橙红色荧光染料PKH26、Di1等标记技术成熟[16-17],因此,观察细胞外泌体以荧光标记囊泡膜为主。然而这种膜标记荧光信号弱,难以在活体动物上清晰捕捉。近期,RIDDER等[18]用逆转录病毒载体转染小鼠肿瘤细胞TU2449,使其表达Cre重组酶,该肿瘤细胞的外泌體携带Cre-mRNA,将肿瘤细胞或其外囊泡注入含有Rosa26-stop-Rep报告基因的克隆小鼠中,当外泌体被靶细胞吸收,释放Cre- mRNA,剪断stop编码,Rep基因显性呈红色,表明外泌体到达该细胞组织,形成良好的外泌体体内运行可视系统。在此基础上,BITTEL等[19]利用Cre-LoxP系统报告,在Rosa26-tdTomato-reporter背景下,发现大肠埃希菌外膜囊泡在体内的转移路线,cre-OMV转移到肠上皮细胞,包括肠干细胞和巨噬细胞,此外,心脏、肝脏、肾脏、脾脏和大脑也有出现。细胞和细菌外囊泡体内转移信息可视化系统的研制,大大促进了囊泡生物信息科学的研究进程。
细胞外泌体靶向性或选择性是囊泡研究的另一焦点。本课题组发现,在体外,HK-2外泌体能被不同细胞摄取,同时,人结肠癌细胞HCT116可吸收不同细胞的外泌体,用荧光显微镜甚至激光共聚焦观察难以判断其靶向性或选择性。TENG等[20]用PKH26标记植物来源的外泌体,与多种细胞体外共培养,再用流式细胞仪测定红色荧光强弱,以此判断外泌体对细胞的选择性;然后采用Dil标记外泌体,观察其在体内的分布,结合体外实验判断植物来源的外泌体对体内细胞的选择性,既简单又有很好的准确性,值得借鉴。
本研究探讨了外泌体被体外细胞摄取的情况,对于外泌体在体内的实际分布与靶向性情况如何,有待进一步研究。
参考文献
[1] BROWN T J, JAMES V. The role of extracellular vesicles in the development of a cancer stem cell microenvironment niche and potential therapeutic targets: A systematic review[J]. Cancers, 2021, 13(10): 2435.
[2] REYES-RUIZ J M, OSUNA-RAMOS J F, DE JES[U][']S-GONZ?LEZ L A, et al. The regulation of Flavivirus infection by hijacking exosome-mediated cell-cell communication: New insights on virus-host interactions[J]. Viruses, 2020, 12(7): E765.
[3] DENG Y, SUN Z, WANG L, et al. Biosensor-based assay of exosome biomarker for early diagnosis of cancer[J]. Frontiers of Medicine, 2022, 16(2):157-175.F80849DF-0E0D-4572-BCF0-165EECEBDB69
[4] GONZ?LEZ-SARR?AS A, IGLESIAS-AGUIRRE C E, CORT?S-MARTíN A, et al. Milk-derived exosomes as nanocarriers to deliver curcumin and resveratrol in breast tissue and enhance their anticancer activity[J]. International Journal of Molecular Sciences, 2022, 23(5): 2860.
[5] 付佳琪,蔡治國,于漫亚,等.基于网络药理学及全转录组测序对当归四逆汤干预外泌体抑制多发性骨髓瘤血管新生的机制研究[J]. 湖南中医药大学学报,2022,42(1):120-128.
[6] 李勇敏,谭小宁,马荣丽,等.中医脏腑相关理论新释:外泌体与脏腑相关理论之联系探微[J].湖南中医杂志,2017,33(2):1-4.
[7] 马荣丽,李勇敏,谭小宁,等.肾细胞外泌体的研究进展[J].湖南中医药大学学报,2017,37(11):1291-1294.
[8] KALLURI R, LEBLEU V S. The biology, function, and biomedical applications of exosomes[J]. Science, 2020, 367(6478): 1-15.
[9] DU K L, SUN X D, TANG X H, et al. Effects of storage temperature and time on quality of plasma exosomes extracted by ExoQuickTM and Umibio kits[J]. Chinese Journal of Cellular and Molecular Immunology, 2020, 36(4): 330-336.
[10] LUO D, LI C L, WU L, et al. Advances of exosomes extraction and its mechanism in early diagnosis of lung cancer[J]. Chinese Journal of Lung Cancer, 2020, 23(11): 999-1006.
[11] SHARMA S, SCHOLZ-ROMERO K, RICE G E, et al. Methods to enrich exosomes from conditioned media and biological fluids[J]. Methods in Molecular Biology, 2018, 1710: 103-115.
[12] LEWIS J M, VYAS A D, QIU Y Q, et al. Integrated analysis of exosomal protein biomarkers on alternating current electrokinetic chips enables rapid detection of pancreatic cancer in patient blood[J]. ACS Nano, 2018, 12(4): 3311-3320.
[13] CHEN J C, LI P L, ZHANG T Y, et al. Review on strategies and technologies for exosome isolation and purification[J]. Frontiers in Bioengineering and Biotechnology, 2021(9):1-18.
[14] ZHANG H, FREITAS D, KIM H S, et al. Identification of distinct nanoparticles and subsets of extracellular vesicles by asymmetric flow field-flow fractionation[J]. Nature Cell Biology, 2018, 20(3): 332-343.
[15] SZATANEK R, BAJ-KRZYWORZEKA M, ZIMOCH J, et al. The methods of choice for extracellular vesicles (EVs) characterization[J]. International Journal of Molecular Sciences, 2017, 18(6): 1153.
[16] LI B Z, XU H X, HAN H Y, et al. Exosome-mediated transfer of lncRUNX2-AS1 from multiple myeloma cells to MSCs contributes to osteogenesis[J]. Oncogene, 2018, 37(41): 5508-5519.
[17] SHAN Y, YOU B, SHI S, et al. Hypoxia-induced matrix metalloproteinase-13 expression in exosomes from nasopharyngeal carcinoma enhances metastases[J]. Cell Death & Disease, 2018, 9(3): 382.
[18] RIDDER K, SEVKO A, HEIDE J, et al. Extracellular vesicle-mediated transfer of functional RNA in the tumor microenvironment[J]. Oncoimmunology, 2015, 4(6): e1008371.
[19] BITTEL M, REICHERT P, SARFATI I, et al. Visualizing transfer of microbial biomolecules by outer membrane vesicles in microbe-host-communication in vivo[J]. Journal of Extracellular Vesicles, 2021, 10(12): e12159.
[20] TENG Y, REN Y, SAYED M, et al. Plant-derived exosomal microRNAs shape the gut microbiota[J]. Cell Host & Microbe, 2018, 24(5): 637-652.F80849DF-0E0D-4572-BCF0-165EECEBDB69
