香茅草总黄酮的提取及抗氧化活性
2022-06-15李琳李影黄瑜王微
李琳 李影 黄瑜 王微






摘 要:為提高香茅草(Cymbopogon citratus)的经济价值,并为香茅草中其他活性成分提取提供理论依据,选择乙醇作为微波辐射提取溶剂,氧化锌和乙醇作为吸附剂和洗脱剂,应用微波辅助-分散固相提取技术对香茅草中黄酮类化合物进行提取纯化,对乙醇体积分数、液料比、微波功率、微波时间和微波温度进行单因素试验,根据试验结果进行响应面优化,采用DPPH(1,1-二苯基-2-三硝基苯肼)和FRAP(Ferric ion reducing antioxidant power)法测定香茅草总黄酮对DPPH自由基的清除效果和总抗氧化活性。结果表明,香茅草中黄酮类化合物最佳提取工艺为乙醇体积分数80%、液料比50∶1(mL/g)、微波功率580 W、微波时间14 min、微波温度55 ℃,该条件下总黄酮得率为3.320 1%,其相对标准偏差(Relative Standard Deviation,RSD)为1.80%。当香茅草总黄酮提取物质量浓度为1.0 mg/mL时,其自由基清除率达73.38%,黄酮总抗氧化能力(FRAP)值为1.913 mmol/L,香茅草总黄酮具有较好的自由基清除能力和总抗氧化能力,微波辅助-分散固相提取技术提取香茅草总黄酮稳定性好,工艺精简可靠、重复性强,具有较好的抗氧化活性。
关键词:香茅草;微波辅助提取;响应面法;氧化锌;分散固相提取;抗氧化
中图分类号:S718.3 文献标识码:A 文章编号:1006-8023(2022)03-0106-09
Extraction and Antioxidant Activity of Total Flavonoids from Cymbopogon citratus
LI Lin, LI Ying, HUANG Yu, WANG Wei*
(College of Chemistry, Chemical Engineering and Resource Utilization, Northeast Forestry University, Harbin 150040, China)
Abstract:The purpose of this study is to improve the economic value of Cymbopogon citratus and provide a theoretical basis for the extraction of other active components from Cymbopogon citratus, the flavonoids from Cymbopogon citratus were extracted and purified by microwave-assisted-dispersed solid phase extraction method and the ethanol was selected as the solvent for microwave radiation extraction, zinc oxide and ethanol were used as adsorbents and eluents. Single factor experiments were carried out on ethanol concentration, ratio of liquid to material, microwave power, microwave time and microwave temperature. Response surface optimization was carried out according to the results of single factor experiments. DPPH(1,1-diphengl-2-trinitrophenylhydrazine) and FRAP(Ferric ion reducing antioxidant power) methods were used to determine the scavenging effect and total antioxidant activity of total flavonoids of Cymbopogon citratus on DPPH free radicals. The experimental results showed that the optimum extraction process was as follows: ethanol concentration volume fraction is 80%, liquid-to-material ratio is 50∶1(mL/g), microwave power is 580 W, microwave time is 15 min, microwave temperature is 55 ℃. Under this condition, the total flavonoid yield was 3.320 1%, and the RSD (Relative Standard Deviation) was 1.80%. When the mass concentration of total flavonoids of Cymbopogon citratus was 1.0 mg/mL, the free radical scavenging rate was 73.38%, and the FRAP value was 1.913 mmol/L, the total flavonoids of Cymbopogon citratus had better free radical scavenging ability and total antioxidant capacity. The microwave-assisted-dispersive solid phase extraction of total flavonoids of Cymbopogon citratus has good stability, concise and reliable process, strong repeatability, and has great antioxidant activity.
Keywords:Cymbopogon citratus; microwave-assisted extraction; response surface method; zinc oxide; dispersive solid-phase extraction; antioxidant
0 引言
香茅草(Cymbopogon citratus),别名苞茅、柠檬草,为禾本科(Gramineae)香茅属(Cymbopogon)多年生草本植物,原产于非洲、印尼和印度等热带地区,我国主要分布在广东、台湾、海南、福建、广西、四川、贵州和云南等省(区),常见品种有西印度柠檬香茅(Cymbopogon citratus (DC. ex Nees) Stapf)、东印度柠檬香茅(Cymbopogon flexuosus)等。香茅草是一种具有柠檬香气的香料植物,可用来制作香水、肥皂等;其性温味辛,具有疏风解表、祛瘀通络的功效,可治疗感冒头痛、胃痛、泄泻、风湿痹痛和跌打损伤等;此外,香茅草的柠檬香气能够增添料理的风味层次,也是非常好的烹饪香料[1]。可见,作为一种药食两用资源,香茅草具有广阔的开发前景。
对于药食植物来说,如何快速、有效地将有效活性成分提取出来并对提取物进一步分离纯化是其开发利用的基础。传统上常采用有机溶剂提取法、超声辅助提取法(Ultrasonics-Assisted Extraction,UAE)、热回流提取法(Heat Reflux Extraction,HRE)和酶提取法等提取植物有效活性成分,但这些方法存在诸多缺点:①大量使用有机溶剂,产生的废液废渣严重污染环境,且不可避免的溶剂残留会影响产物的质量和稳定性;②提取效率低、步骤多、选择性差,较难实现自动化或联用;③提取温度高、时间长、能耗大,且易造成热敏性成分分解和挥发性成分损失。因此,发展快速、高效、尽量不用或少用有害试剂、将环境污染减至最低限度的绿色样品处理技术已成为该领域科学工作者追求的目标。
微波辅助提取法(Microwave-Assisted Extraction,MAE)是新近发展起来的一种从植物等组织中提取化学成分的新型提取方法,与传统提取方法相比,MAE具有如下优点:①微波具有很强穿透力,可使反应物内外部分同时均匀、 迅速加热,提取时间短、效率高;②选择性好,基于结构不同的物质吸收微波能力不同的性质,可实现待测组分的选择性加热,进而与基体分离;③可利用在非极性溶剂中加适量极性溶剂的方法控制微波吸收能力大小进而控制温度;④密封操作可保证溶剂不损失,对环境友好;⑤可同时提取多个样品[2]。香茅草的主要化学成分包括黄酮类、酚类、萜类和挥发油等,具有抗氧化、抗炎和抗菌等活性[3],目前,对香茅草的化学成分研究多集中在挥发油提取和利用方面,关于其黄酮类成分的研究鲜见报道。
分散固相提取(Dispersive Solid-Phase Extraction,DSPE)是一种全新的样品前处理技术,其首先利用吸附剂吸附样品溶液中的目标分子,然后采用合适的洗脱剂解吸,进而得到目标化合物,具有简单高效、重复性好、富集效率高和溶剂消耗低等优点[4]。目前,在DSPE中用作吸附剂的材料包括多壁碳纳米管、介孔二氧化硅纳米颗粒、硅基吸附剂和活性炭纤维等[5-6]。氧化锌(ZnO)是一种常用的化学吸附剂,具有带隙宽、化学和热稳定性好、吸附效率高等特点,在化学提取领域得到广泛应用,如Ji等[7]利用氧化锌提取方便面中的醛,Wang等[8]利用氧化锌提取饮料中的黄酮类化合物,但鲜见将其作为吸附剂用于DSPE提取天然產物的研究。
鉴于此,本研究选择乙醇作为微波辐射提取溶剂,氧化锌和乙醇作为吸附剂和洗脱剂,应用微波辅助-分散固相提取技术对香茅草中黄酮类化合物进行提取纯化,对乙醇体积分数、液料比、微波功率、微波时间和微波温度进行单因素试验,根据试验结果进行响应面优化,采用DPPH(1,1-二苯基-2-三硝基苯肼)和FRAP(Ferric ion reducing antioxidant power)法测定香茅草总黄酮对DPPH自由基的清除效果和总抗氧化活性,旨在提高香茅草的经济价值,为香茅草中其他活性成分提取提供理论依据。
1 材料与方法
1.1 试验材料
香茅草叶片购自哈尔滨三棵树中药材专业市场并经专家鉴定;芦丁标准品购自上海古朵生物科技有限公司;L-抗坏血酸、DPPH购自美国Sigma 公司;碳酸钠(分析纯)、亚硝酸钠(分析纯)、硝酸铝(分析纯)、氢氧化钠(分析纯)、乙醇(分析纯)、氧化锌购自天津市致远化学试剂有限公司;去离子水为实验室自制。
1.2 仪器与设备
S0116总抗氧化能力检测试剂盒,碧云天生物技术公司; Infinite 200 PRO Nano Quant酶标仪,上海安景科技有限公司;KQ-300DB型超声波清洗器,昆山市超声仪器有限公司;MAS-Ⅱ型微波提取仪,上海新仪科技有限公司;C-RE-52A型旋转蒸发仪,力辰科技有限公司;GL-16G台式离心机,上海安亭科学仪器厂制造,HX-200A型粉碎机,永康市溪岸五金药具厂;AB-104型电子天平,郑州紫拓仪器设备有限公司。
1.3 试验方法
1.3.1 样品溶液制备
称取1 mg粉碎后样品(过80目筛)于三角瓶中,料液比为1∶40 (g/mL)加入70%乙醇水溶液,温度55 ℃,40 kHz功率下超声提取35 min,离心得上清液,4 ℃保存备用。
1.3.2 芦丁标准曲线绘制
采用NaNO2-Al(NO3)3-NaOH 比色法[9],并稍作修改。准确称取1 mg芦丁标准品,用乙醇配制成0.2 mg/mL芦丁母液。精确量取芦丁标准溶液0.1、0.2、0.3、0.4、0.5、0.6 mL于5 mL容量瓶中,分别加入无水乙醇使溶液总体积为0.6 mL,摇匀。依次加入0.1 mL 5%亚硝酸钠溶液摇匀静置 6 min,0.1 mL 10%硝酸铝溶液摇匀静置6 min,1.5 mL 10%氢氧化钠溶液摇匀,加蒸馏水定容至2.5 mL。另一组试剂作为空白对照。每组取5个样品200 μL滴于96孔板,在510 nm波长处采用酶标仪测定吸光度,横坐标为芦丁质量浓度,纵坐标为吸光度,绘制标准曲线[10](y=2.096 8x-2.007 3,R2=0.999 3,线性范围0.008 0~0.048 0 mg/mL),相关性良好。
1.3.3 样品中总黄酮含量测定
精确移取0.1 mL样品溶液滴于96孔板中,按上述标准曲线绘制方法采用酶标仪测定吸光度,根据回归方程计算总黄酮得率
总黄酮得率=C×V×nM×100%。
式中:C为提取液质量浓度,mg/mL;V为提取液原始体积,mL;M为香茅草粉末质量,g;n为稀释倍数。
1.3.4 提取方法筛选
微波辅助提取(MAE):准确称量1 g样品粉末于微波反应器中,加入70%乙醇40 mL混匀,微波温度65 ℃,微波时间15 min,微波功率600 W。离心得上清液,测定总黄酮含量。
超声辅助提取(UAE):准确称量1 g样品粉末于100 mL锥形烧瓶中,加入70%乙醇40 mL混匀,将烧瓶置于超声清洗器中,超声温度55 ℃,超声时间35 min,超声频率40 kHz。离心得上清液,测定总黄酮含量。
热回流提取(HRE):准确称量1 g样品粉末于100 mL圆底烧瓶中,加入70%乙醇40 mL混匀,将烧瓶置于带有回流装置的水浴中,回流温度60 ℃,回流时间35 min。冷卻后称量提取液,加入乙醇弥补减重,离心得上清液,测定总黄酮含量[3]。
1.3.5 香茅草总黄酮纯化
微波辅助提取后,应用分散固相提取技术对香茅草总黄酮进行纯化。工艺条件为:取提取液的上清3 mL于50 mL离心管中,加入2 mg氧化锌,混匀后在超声清洗器中浸泡120 s,使黄酮类化合物完全被氧化锌吸附。混合溶液通过0.22 μm注射器过滤后用500 μL乙醇洗脱滤渣中的黄酮类化合物,收集洗脱液,12 000 r/min离心10 min,测定离心后上清液中总黄酮含量。
1.3.6 单因素试验
选择微波辅助提取方法,以液料比40∶1(mL/g)、提取时间10 min、提取温度60 ℃、提取功率500 W、乙醇体积分数70%为单因素试验基础条件,以分散固相提取纯化后总黄酮得率为指标,考察5个因素对香茅草总黄酮提取量的影响。其中,液料比设置为30∶1、40∶1、50∶1、60∶1、70∶1(mL/g),提取时间设置为5、10、15、20、25 min,提取温度设置为30、40、50、60、70 ℃,微波提取功率设置为450、500、550、600、650 W,乙醇浓度(体积分数,下同)设置为60%、70%、80%、90%、100%。
1.3.7 响应面优化试验
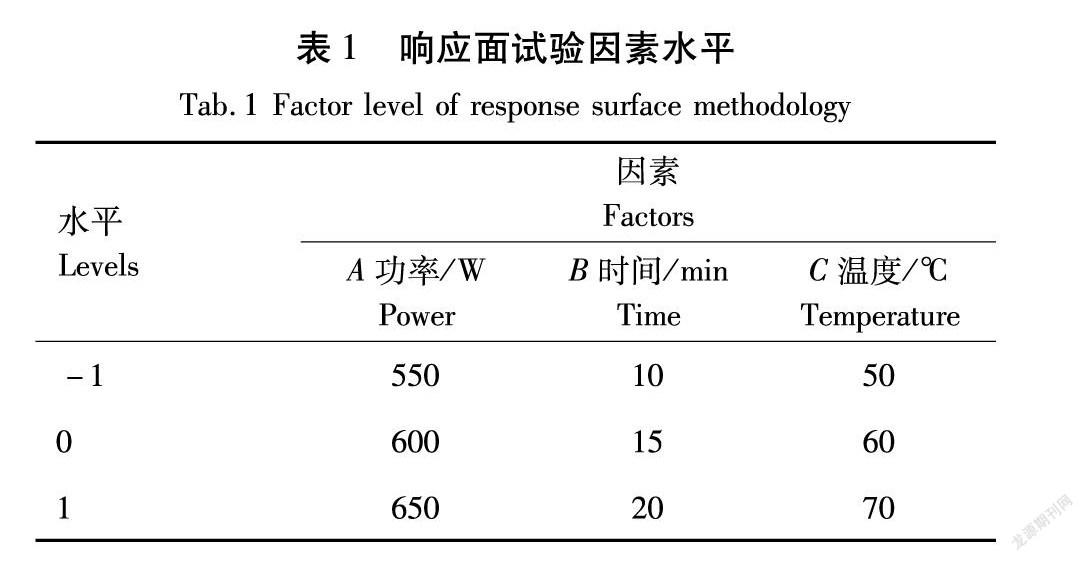
在单因素试验基础上,利用Design-Expert.10软件设计三因素三水平响应面优化试验,以分散固相提取纯化后总黄酮得率为指标,微波温度、微波功率、微波时间为自变量,确定最佳提取工艺。响应面试验因素水平见表1[10]。
1.3.8 香茅草总黄酮抗氧化活性
采用DPPH自由基清除能力试剂盒检测DPPH自由基清除能力,FRAP检测试剂盒检测总抗氧化能力,以L-抗坏血酸为对照。
(1)清除DPPH自由基能力测定。参考米智等[11]对DPPH自由基清除率的测定方法,计算公式如下
清除率=1-A1A0×100%。
式中:A1为样品溶液的吸光度;A0为初始吸光度。
(2)FRAP法总抗氧化能力测定。参考 Amamcharla 等[12]对总抗氧化活性的测定方法并适当修改。将各种溶液充分混匀后37 ℃下放置5 min,酶标仪593 nm波长测定吸光度;按照相同步骤,于96孔板检测孔中滴入不同浓度FeSO4溶液测定吸光度,以吸光度(A)为纵坐标,FeSO4浓度(mmol/L)为横坐标,绘制FeSO4标准曲线(y = 0.088 5x + 0.050 9,R2 = 0.999 4),计算总抗氧化能力。
1.4 数据处理
所有试验重复3次,使用GraphPad Prism 5和Design Expert 10软件进行数据统计与处理。
2 结果与分析
2.1 提取方法筛选
微波辅助提取、超声辅助提取和热回流提取对香茅草总黄酮得率的影响如图1所示。微波辅助提取的总黄酮得率为3.39%,高于热回流提取(2.56%)和超声辅助提取(2.88%),这是因为微波反应过程中,高频电磁波透射进植物细胞内部吸收能量产生大量的热,使物料和溶剂快速升温,胞内游离水吸热气化产生的压力可将细胞膜和细胞壁冲破形成微小孔洞,进一步加热,细胞内部和细胞壁水分减少,细胞收缩,表面出现裂纹,孔洞和裂纹的存在使细胞外液体易于进入细胞内,溶解并释放细胞内产物[13]。故后续试验采用微波辅助提取方法。
所得数据为3次试验的平均值,*为与微波辅助提取法相比P<0.05,**为与微波辅助提取法相比P<0.01。
The data obtained are the average value of three tests. * is compared with microwave-assisted extraction P<0.05, ** is compared with microwave-assisted extraction P<0.01.
2.2 单因素试验结果分析
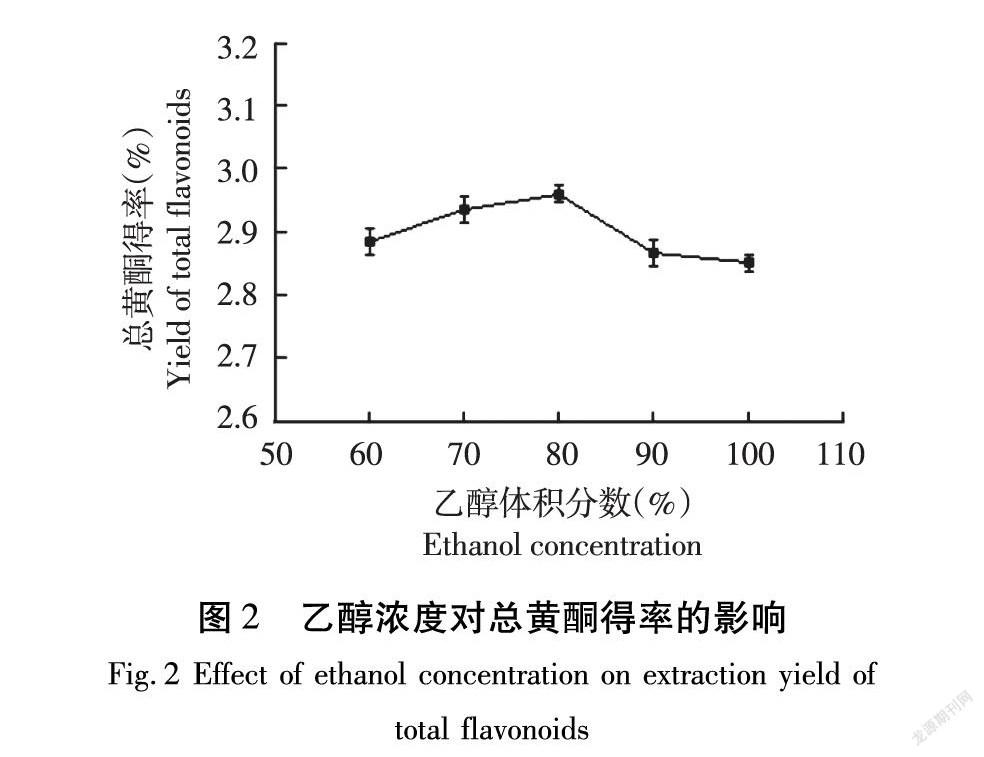
2.2.1 乙醇浓度对总黄酮得率的影响
由图2可知,总黄酮得率随乙醇浓度增加而增大,乙醇浓度80%时达最大值,超过80%总黄酮得率呈下降趋势,这是因为随着乙醇浓度增加,其他醇溶性物质如香茅草中挥发油类析出,导致黄酮类化合物溶解度下降,得率随之降低[14]。因此,乙醇浓度选择80%。
2.2.2 液料比对总黄酮得率的影响
由图3可知,总黄酮得率随液料比增加呈先增大后减小的趋势,这是因为随着溶剂量增加,香茅草粉末与溶剂接触更充分,黄酮类物质逐渐析出,液料比超过50∶1(mL/g)后,溶液质量浓度随液料比增加而变小,黄酮类物质析出受抑制,导致得率不增反降。考虑到经济效益和环保因素,液料比不宜过大[9],因此,液料比选择50∶1(mL/g)。
2.2.3 微波温度对总黄酮得率的影响
由图4可知,总黄酮得率受微波温度影响较大,适当升温,分子浸出速率加快,总黄酮得率在30~50 ℃时明显升高,温度50 ℃时达到峰值,后总黄酮得率开始缓慢下降,这是因为温度过高,提取出的黄酮被氧化或导致其活性物质分解,总黄酮含量减少,黄酮得率降低[10]。因此,微波温度选择50 ℃。
2.2.4 微波功率对总黄酮得率的影响
由图5可知,总黄酮得率随微波功率增加明显增大,微波功率600 W时达到峰值3.237%,后总黄酮得率开始缓慢下降,这是因为微波功率过大,体系温度升高,乙醇挥发速度加快,高温下总黄酮结构发生变化,得率下降[10]。因此,微波功率选择600 W。
2.2.5 微波时间对总黄酮得率的影响
由图6可知,微波时间5~20 min黄酮不断从香茅草体内析出,得率逐渐增大,微波时间20 min达到最大值,后总黄酮得率缓慢下降,这是因为微波时间过长,香茅草内黄酮物质被氧化或分解且杂质溶出度增加,黄酮得率下降[15]。因此,微波时间选择20 min。
2.2.6 响应面法优化提取工艺
利用Design expert 10軟件,对总黄酮提取试验中影响比较显著的微波功率、微波时间、微波温度进行模拟拟合与条件预测,分析得到试验方案及结果见表2。
以香茅草总黄酮得率为响应值,对表2中数据进行回归拟合,可得回归方程如下
总黄酮得率=3.30+0.056A+8.750×10-3B+
0.018C-2.500×10-3AB-5.000×10-3AC-5.000×10-3BC-0.041A2-0.036B2-0.084C2。
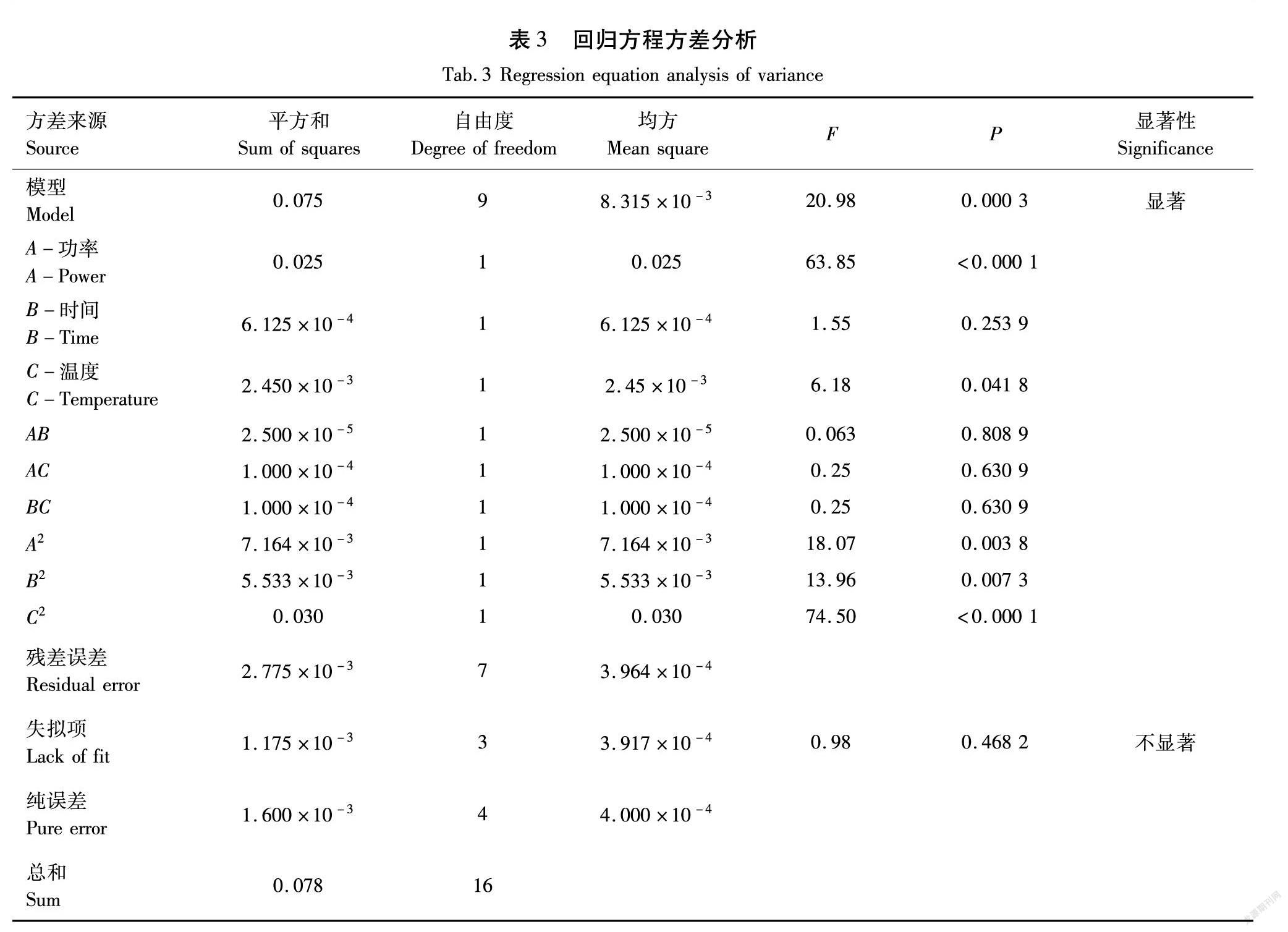
对回归方程进行方差分析,结果见表3。
由方差分析结果可知,模型P为0.000 3,模型差异显著;失拟项为0.468 2(不显著),模型拟合度好;R2=0.978 8,模型能充分拟合试验数据[16]。这表明建立的模型为有效模型,可通过该模型确定香茅草总黄酮最佳提取工艺。一次项检验中,A影响极显著、C影响显著、B影响不显著,各因素交互项均不显著;二次项检验均达极显著。同时一次项检验F表明,各因素对香茅草总黄酮提取的影响程度由大到小为:微波功率、微波温度、微波时间[17]。
各因素交互作用对香茅草总黄酮得率的影响如图7所示,响应面坡度越陡,说明对总黄酮得率的影响越大,由等高线图可得到其极值的相关条件在圆心[16]。分析图7(a)、图7(c)、图7(e)的坡度可知,时间与功率、温度与功率交互作用对总黄酮得率的影响均较大,温度与时间交互作用对总黄酮得率的影响相对缓和。温度与功率交互作用的坡度最陡,且图7(d)等高线趋于椭圆,说明对总黄酮得率影响最为显著;时间与功率交互作用的坡度较陡,且图7(b)等高线趋于圆形,说明对总黄酮得率具有较显著影响,但弱于温度与功率交互作用[18],这与F大小比较结果相符。
2.3 优化提取参数和验证试验
使用Design expert 10软件优化试验条件,得到最佳提取工艺参数为微波功率584.246 W、微波时间14.381 3 min、微波温度53.043 1℃,结合单因素试验确定的乙醇体积分数80%、液料比50∶1(mL/g),该条件下的理论得率为3.222%;考虑到实际操作,最佳提取工艺条件确定为乙醇体积分数80%、液料比50∶1 (mL/g)、微波功率580 W、微波时间14 min、微波温度55 ℃。
称取5份香茅草粉末,采用优化提取工艺条件进行3次平行试验,总黄酮得率平均值为3.320 1%,其相对标准偏差(Relative Standard Deviation,RSD)为1.80%,模型拟合试验条件与实际操作拟合程度较好,响应面法建立了具有很大可靠性的回归模型[19]。
2.4 香茅草总黄酮抗氧化活性
2.4.1 对DPPH自由基的清除效果
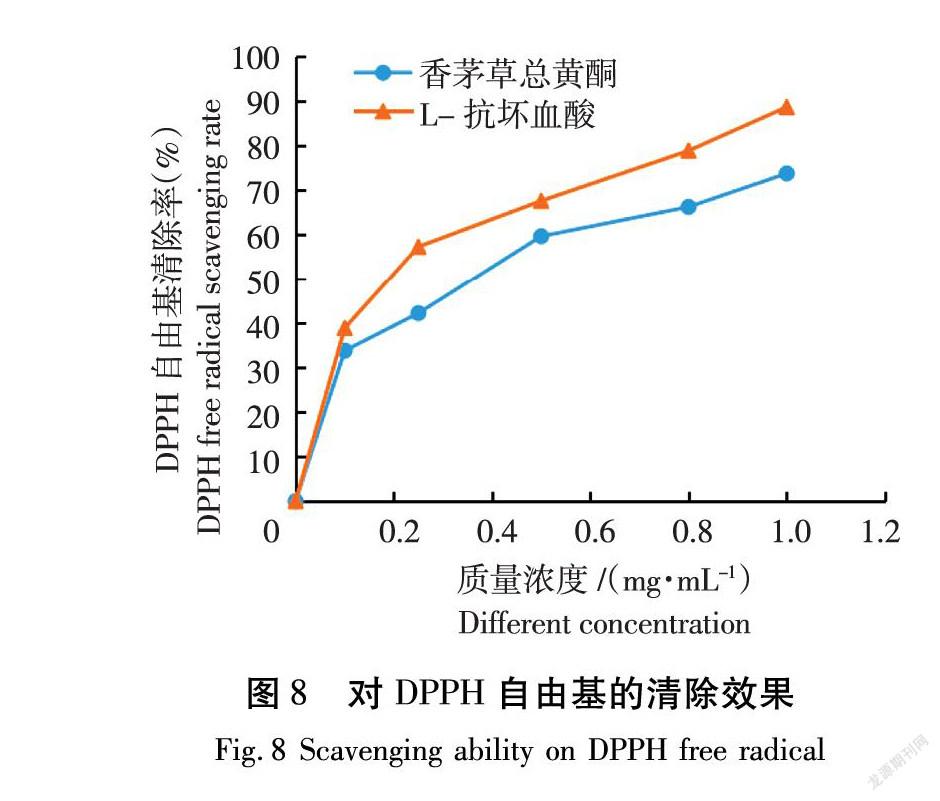
香茅草总黄酮及对照L-抗坏血酸对DPPH自由基的清除效果如图8所示。
香茅草总黄酮对DPPH自由基具有明显清除作用,黄酮提取物抗氧化性较好[20-21],且在0~1.0 mg/mL样品液体浓度范围内,DPPH自由基清除率稳定上升,浓度越高,清除率越大,当香茅草总黄酮提取物质量浓度为1.0 mg/mL时,其自由基清除率达73.38%。
2.4.2 FRAP法总抗氧化能力
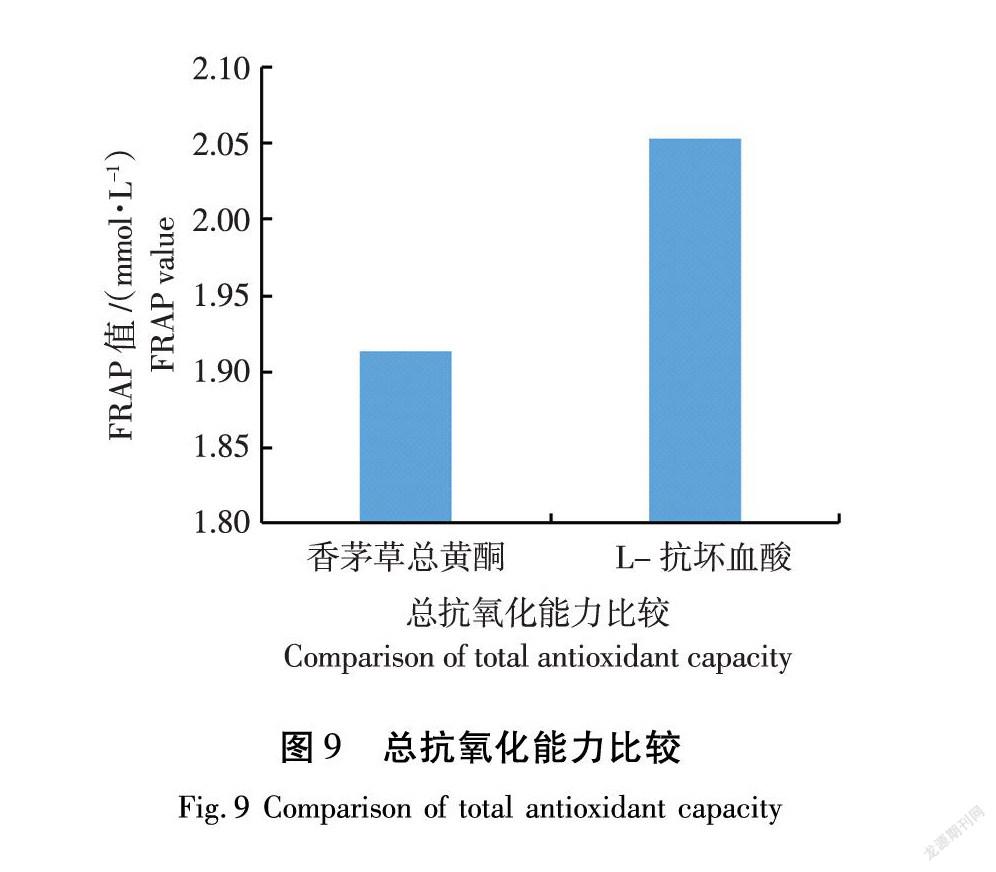
由图9可知,香茅草总黄酮提取液在593 nm波长下3次重复试验测得的吸光度平均值为0.388,与1.913 mmol/L FeSO4溶液吸光度相同,说明香茅草总黄酮总抗氧化能力(FRAP值)为1.913 mmol/L,具有较好的总抗氧化能力,但不及L-抗坏血酸[21]。
3 结论
微波辅助提取、超声辅助提取与热回流提取方法比较发现,微波辅助提取的总黄酮得率(3.39%)高于热回流提取(2.56%)和超声辅助提取(2.88%),微波反应过程中,高频电磁波透射进植物细胞内部吸收能量产生大量的热,使物料和溶剂快速升温,胞内游离水吸热汽化产生的压力可将细胞膜和细胞壁冲破形成微小孔洞,进一步加热,细胞内部和细胞壁水分减少,细胞收缩,表面出现裂纹,孔洞和裂纹的存在使细胞外液体易于进入细胞内,溶解并释放细胞内产物,加快胞内外物质发生置换从而提高总黄酮得率。本研究采用微波辅助提取法,以乙醇为溶剂提取香茅草黄酮类化合物,随机将总黄酮类化合物进行分散固相提取,得到纯度更高的总黄酮提取物,并通过响应面优化试验进一步得到纯度更高的黄酮提取物,为后续抗氧化试验做准备。试验确定最佳提取工艺为乙醇浓度80%、液料比50∶1(mL/g)、微波功率580 W、微波时间14 min、微波温度55 ℃,该条件下香茅草总黄酮得率为3.320 1%,重复性试验检测,RSD为1.80%,说明模型拟合试验条件与实际操作拟合程度较好。对香茅草中黄酮类化合物进行DPPH自由基清除能力、FRAP法总抗氧化能力检测,以L-抗坏血酸为对照,结果表明,当香茅草总黄酮提取物浓度为1.0 mg/mL时,其自由基清除率达73.38%,FRAP值为1.913 mmol/L,香茅草总黄酮具有较好的自由基清除能力和总抗氧化能力。微波辅助-分散固相提取技术提取香茅草总黄酮稳定性好、工艺精简可靠、重复性强,香茅草中黄酮类化合物具有较好的抗氧化活性。
【参 考 文 献】
[1]张雪梅,胡志宇.我国香茅属植物研究进展[J].中国民族民间医药,2009,18(5):14-15.
ZHANG X M, HU Z Y. Research progress of Cymbopogon in China[J]. Chinese Journal of Ethnomedicine and Ethnopharmacy, 2009, 18(5): 14-15.
[2]YIN L J, ZHENG X, WANG G, et al. Microwave irradiation followed by zinc oxide based dispersive solid-phase extraction coupled with HPLC for simultaneous extraction and determination of flavonoids in Veronicastrum latifolium(Hemsl.) Yamazaki[J]. Analytical and Bioanalytical Chemistry, 2019, 411(5): 1029-1040.
[3]项佳媚,郑希龙,魏建和,等.香茅草及香茅草茶的研究进展[J].世界科学技术-中医药现代化,2017,19(5):874-879.
XIANG J M, ZHENG X L, WEI J H, et al. Research progress in Cymbopogon citratus(DC.) Stapf and lemongrass tea[J]. World Science and Technology-Modernization of Traditional Chinese Medicine, 2017, 19(5): 874-879.
[4]DONG S Y, LOU Q, HUANG G Q, et al. Dispersive solid-phase extraction based on MoS2/carbon dot composite combined with HPLC to determine brominated flame retardants in water[J]. Analytical and Bioanalytical Chemistry, 2018, 410(28): 7337-7346.
[5]MARTINEZ PEREZ-CEJUELA H, TEN-DOMENECH I, EL HASKOURI J, et al. Solid-phase extraction of phospholipids using mesoporous silica nanoparticles: application to human milk samples[J]. Analytical and Bioanalytical Chemistry, 2018, 410(20): 4847-4854.
[6]CAO J, PENG L Q, DU L J, et al. Ultrasound-assisted ionic liquid-based micellar extraction combined with microcrystalline cellulose as sorbent in dispersive microextraction for the determination of phenolic compounds in Propolis[J]. Analytica Chimica Acta, 2017, 963: 24-32.
[7]JI J J, LIU H H, CHEN J M, et al. ZnO nanorod coating for solid phase microextraction and its applications for the analysis of aldehydes in instant noodle samples[J]. Journal of Chromatography A, 2012, 1246: 22-27.
[8]WANG L C, SHANGGUAN Y N, HOU X D, et al. Zinc oxide crystal whiskers as a novel sorbent for solid-phase extraction of flavonoids[J]. Journal of Chromatography B, 2017, 1060: 91-96.
[9]邹维娜,王微,徐启江,等.香茶子叶片总酚、总黄酮提取及抗氧化性研究[J].食品工业科技,2017,38(2):266-272.
ZOU W N, WANG W, XU Q J, et al. Extraction of total phenolics and flavonoids from the leaf of Ribes odoratum Wendl. and its antioxidant activity[J]. Science and Technology of Food Industry, 2017, 38(2): 266-272.
[10]唐森,石佳香,覃逸明,等.微波提取五指毛桃總黄酮工艺研究[J].中国饲料,2021(15):37-42,47.
TANG S, SHI J X, QIN Y M, et al. Study on microwave extraction of total flavonoids from Ficus hirta Vah[J]. China Feed, 2021(15): 37-42, 47.
[11]米智,刘荔贞,李慧.等.响应面法优化胡麻籽饼粕黄酮提取工艺及抗氧化活性的研究[J].中国粮油学报,2022(4):6-11.
MI Z, LIU L Z, LI H, et al. Optimization of extraction process and antioxidant activity of flavonoids from flaxseed meal by response surface methodology[J]. Journal of the Chinese Cereals and Oils Association, 2022(4): 6-11.
[12]AMAMCHARLA J K, METZGER L E. Modification of the ferric reducing antioxidant power(FRAP) assay to determine the susceptibility of raw milk to oxidation[J]. International Dairy Journal, 2014, 34(2): 177-179.
[13]吴龙琴,李克.微波萃取原理及其在中草药有效成分提取中的应用[J].中国药业,2012,21(12):110-112.
WU L Q, LI K. Microwave extraction and its application in extraction of active components from Chinese herbal medicine[J]. China Pharmaceuticals, 2012, 21(12): 110-112.
[14]卢赛赛,许凤,王鸿飞,等.杨梅叶中总黄酮提取及其抗氧化能力研究[J].果树学报,2015,32(3):460-468.
LU S S, XU F, WANG H F, et al. Extraction and antioxidant activities of total flavonoids from Myrica rubra leaves[J]. Journal of Fruit Science, 2015, 32(3): 460-468.
[15]吴进东,董欣华,朱旺生,等.霍山石斛花总黄酮微波辅助提取工艺的优化[J].中成药,2021,43(7):1704-1707.
WU J D, DONG X H, ZHU W S, et al. Optimization of microwave-assisted extraction process for total flavonoids from Dendrobidium huoshanense flowers[J]. Chinese Traditional Patent Medicine, 2021, 43(7): 1704-1707.
[16]谢洋,李鹏,隋新,等.响应面优化细叶杜香提取工艺及抗氧化活性研究[J].天然产物研究与开发,2019,31(3):475-481.
XIE Y, LI P, SUI X, et al. Study on optimization of extraction conditions of Ledum palustre L. by response surface methodology and its antioxidant activities[J]. Natural Product Research and Development, 2019, 31(3): 475-481.
[17]刘冰雪,王玲玲,张晓雪,等.万寿菊中叶黄素的超高压提取工艺优化[J].森林工程,2021,37(4):71-78.
LIU B X, WANG L L, ZHANG X X, et al. Optimization of ultra-high pressure extraction process for lutein from marigold[J]. Forest Engineering, 2021, 37(4): 71-78.
[18]李占君,张厚良,徐宜彬,等.模型优化塔拉籽油的超临界制备工艺[J].森林工程,2021,37(4):79-86.
LI Z J, ZHANG H L, XU Y B, et al. Model optimization of supercritical preparation process of Tara seed oil[J]. Forest Engineering, 2021, 37(4): 79-86.
[19]DIMINS F, AUGSPOLE I. Total phenolic, antioxidant activities and flavonoid contents of herbal syrups[J]. Key Engineering Materials, 2019, 800: 60-64.
[20]曹乃馨,罗阳兰,解修超,等.夹竹桃花不同溶剂提取物的GC-MS分析及其抗氧化、抑菌活性[J].中成药,2021,43(12):3512-3517.
CAO N X, LUO Y L, XIE X C, et al. GC-MS analysis of different solvent extracts from oleander flower and their antioxidant and antibacterial activities[J]. Chinese Traditional Patent Medicine, 2021, 43(12): 3512-3517.
[21]徐圆圆,周思维,陈仲,等. 无患子不同器官中的总皂苷和总黄酮含量[J]. 南京林业大学学报(自然科學版), 2021, 45(4): 83-89.
XU YY, ZHOU S W, CHEN Z et al. Contents of the total saponins and total flavonoids in different organs of Sapindus mukorossi[J].Journal of Nanjing Forestry University (Natural Science Edition), 2021, 45(4): 83-89.
[22]邢宇航,郑烨宇,薛璐,等.不同品种芒果核中多酚类化合物的鉴定及抗氧化活性分析[J].食品工业科技,2022,43(9):1-8.
XING Y H, ZHENG Y Y, XUE L, et al. Identification and antioxidant activity analysis of polyphenols in different mango cultivars[J]. Science and Technology of Food Industry, 2022, 43(9): 1-8.
