盐胁迫对大豆种子萌发过程中子叶超微结构的影响
2022-06-10廖珍凤王剑宋西娇陈光沈梦梦苗瑞祥徐盛春
廖珍凤, 王剑, 宋西娇, 陈光, 沈梦梦, 苗瑞祥, 徐盛春
(浙江省农业科学院 公共实验室,浙江 杭州 310021)
大豆含有丰富的蛋白质和油脂,是重要的粮食、经济作物[1-2],也是异黄酮、维生素、纤维和矿物质的重要来源[3]。目前,全球对大豆的需求正在持续增加,但是大豆品质和产量受温度、水分、盐碱化等非生物胁迫的影响日益显著[4]。盐胁迫是长期制约作物生长的主要逆境之一。全球超过6 000万 hm2的耕地遭受不同程度盐碱化的威胁,约占世界灌溉土地总面积的20%[3]。盐胁迫易引起作物组织渗透失衡、过度离子毒害,抑制细胞分裂和增殖,甚至导致植物死亡[3,5]。
目前,国内外对盐胁迫下大豆生长形态、生理生化、产量和品质等各方面进行了大量研究。大豆、苦豆萌芽期经盐胁迫处理后,胚根的抗氧化酶含量和活性均发生变化。幼苗期出现发黄和萎蔫、根系生长状况差等现象,当盐处理浓度达到0.9%时,幼苗甚至出现干枯死亡的情况[6]。此外,在不同类型盐碱胁迫下,大豆单株荚数、单株粒数、百粒重等多个性状均呈下降趋势,直接造成大豆产量的减少[7]。种子萌发是植物成苗的关键时期,亦是植物生命周期中对盐胁迫最敏感的时期。研究[8-10]表明,盐胁迫处理显著降低水稻、油菜、玉米等种子发芽率和活力。种子萌发所需蛋白质、脂质等能量物质主要集中在子叶细胞中的蛋白质贮藏液泡、油体中[11-12],但相关研究较少。细胞内研究主要集中在叶绿体、线粒体等细胞器受盐胁迫的影响,且多集中在幼苗或成熟植株时期。高浓度盐胁迫下,野大麦、玉米的叶肉细胞超微结构发生严重病理变化,叶绿体的基粒类囊体片层结构消失,线粒体肿胀,细胞器膜都受到不同程度的破坏[13-14]。
目前,盐胁迫对大豆种子萌发期影响的研究多集中在生理生化水平,而对大豆萌发过程中盐胁迫影响子叶细胞超微结构的研究甚少。鉴于此,本研究利用电镜技术,结合有关生理指标的测定,研究盐溶液胁迫下,大豆萌发过程中子叶细胞的超微结构和形态的动态变化,简析蛋白质贮藏液泡、油体、质体及其他细胞器的降解转化过程。
1 材料与方法
1.1 材料
供试大豆品种为浙农6号,由浙江省农业科学院蔬菜研究所提供。
1.2 方法
1.2.1 大豆萌发期盐胁迫试验
挑选籽粒饱满、种皮无破损、无病斑的大豆种子(浙农6号),用无菌水冲洗数次后用于萌发试验。用不同浓度盐溶液润湿的双层长方形滤纸(20 cm×30 cm)垫底,将种子置于滤纸距离上下边缘3 cm处,每排为9粒种子,按间隔1.5 cm依次平铺在滤纸上,放置两排,再将一层润湿滤纸覆盖于铺好的种子上,从左至右将夹有种子的3层滤纸卷起,放入带盖水桶中(20 cm×20 cm),桶内加少量不同浓度盐溶液保持湿润,设3组重复。将准备萌发的大豆种子置于培养箱中,培养条件:25 ℃/25 ℃(昼/夜),相对湿度70%,分为对照组(蒸馏水),50、100和150 mmol·L-1NaCl进行萌发实验,每24 h更换1次相应浓度的盐溶液。
1.2.2 大豆萌发相关性状指标测定
大豆种子分别用NaCl处理,设50、100和150 mmol·L-13个浓度梯度,以蒸馏水为对照,设3组重复,每组重复18粒大豆种子。试验期间每天记录发芽数,以萌发大豆胚根长1 cm为萌发临界点统计发芽率。统计一直持续8 d,并每天测定下胚轴与根的长度。统计大豆种子在不同浓度NaCl溶液处理后的发芽率、发芽势、下胚轴与根的长度以及侧根数量。计算发芽率、发芽势。
1.2.3 透射电子显微镜样品制备
在大豆萌发0 h、12 h、2 d、5 d、8 d时,对处理组和对照组进行透射电镜样品取样。以大豆胚轴为中心点,取去掉种皮的子叶中间部位切下1 mm×1 mm×2 mm小条,每个处理组取相同部位,重复取样3次。样品放入3.5%戊二醛溶液中固定,并且真空抽沉,将固定的样品用1%锇酸二次固定,乙醇梯度脱水,spurr树脂渗透、包埋。制好的包埋块用Leica UC6型超薄切片机进行超薄切片,醋酸双氧铀和柠檬酸铅双重染色,Hitachi H7650型透射电子显微镜观察、拍照。
1.2.4 扫描电子显微镜样品观察
在大豆种子萌发5 d、8 d时进行扫描电镜样品取样。以种脐为中心点,用双面刀片将子叶切成2 mm的薄片,每个处理组取相同部位,重复取样3次。样品放入3.5%戊二醛溶液中固定,并且真空抽沉,将固定的样品用1%锇酸二次固定,乙醇梯度脱水,乙酸异戊酯过渡,经Quorum K850临界点干燥仪干燥,离子溅射仪喷金,用日立Hitachi Regulus 8100扫描电镜观察,拍照。
2 结果与分析
2.1 盐胁迫对大豆萌发的影响
用50、100和150 mmol·L-1NaCl 3个盐浓度处理萌发大豆后,发现随着盐浓度的增加,大豆种子发芽率、发芽势、根长、侧根数量等均呈下降趋势(图1、图2、表1)。对照组的发芽率在4 d后与最终发芽率一致,盐处理组的种子萌发持续时间随盐浓度升高而延长,并且随盐浓度的升高,大豆的发芽率、发芽势均降低(图1、图2)。50 mmol·L-1和100 mmol·L-1NaCl溶液处理时,发芽率、发芽势与对照相比差异不显著,说明低盐溶液对大豆种子萌发抑制作用较低。150 mmol·L-1NaCl胁迫下,大豆种子发芽率、发芽势显著低于对照组,说明高浓度的盐胁迫显著抑制种子萌发(图1、图2)。与发芽率相比,胚根、下胚轴及侧根的生长对盐胁迫更加敏感,生长受抑制较为严重。50、100和150 mmol·L-1NaCl溶液处理时,胚根、下胚轴长度以及侧根数均显著小于对照组。当盐浓度达到150 mmol·L-1时,胚根基本无侧根生长(表1)。

相同萌发时间不同处理间无相同小写字母者表示组间差异达显著水平(P<0.05)。图2同。图1 不同浓度NaCl处理对种子发芽率的影响

图2 不同浓度NaCl处理对种子发芽势的影响

表1 NaCl胁迫对大豆胚根和下胚轴生长的影响
2.2 透射电镜观察盐处理对萌发子叶细胞超微结构的影响
为观察不同盐浓度处理下,大豆种子萌发过程中子叶细胞超微结构的变化,本试验对不同萌发时间的大豆子叶进行透射电镜观察。结果显示,未萌发的大豆种子子叶细胞中分布着大量大小、形状不一的蛋白质贮藏液泡和油体。细胞内仅含1~2个质体,极少细胞器存在(图3)。

PSV,蛋白质贮藏液泡;OB,油体;SG,淀粉粒;P,质体;CW,细胞壁;图a-1为图a的局部放大图,字母-1为相应字母的局部放大图,图4~6同。图3 未萌发大豆子叶细胞超微结构的透射电镜照片
种子萌发12 h时,对照组质体内淀粉颗粒增多,周围已形成少量的粗面内质网(图4中a、a1),而盐溶液处理组尚未观察到内质网或其他细胞器(图4中b~d1)。盐溶液处理组子叶细胞基质电子密度加深,油体数量较对照组增多,并且与蛋白质贮藏液泡膜接触的油体直径小于远离液泡膜的油体(图4中b1、c1、d1)。种子萌发2 d时,对照组大豆子叶细胞内,蛋白质贮藏液泡聚集融合成大的电子密度较浅的贮藏液泡,质体数量增加,尚未形成片层结构(图4中e、e1)。盐溶液处理组,子叶细胞内蛋白质贮藏液泡体积均小于对照组,而油体数量较萌发12 h时减少,并被挤到细胞壁边缘(图4中f~h1)。50 mmol·L-1NaCl溶液处理时,油体数量与对照组相差不大,当盐浓度达到100和150 mmol·L-1时,大量油体密集分布在胞质中,细胞质基质电子密度也明显加深(图4中g1、h1)。150 mmol·L-1NaCl溶液处理下,发现细胞质壁出现轻微分离(图4中h1),基质中分布大量小的空泡化结构,蛋白质贮藏液泡和质体的膜结构也遭到破坏(图4中h1)。
种子萌发5 d时,对照组子叶细胞内的蛋白质贮藏液泡融合形成大液泡,极少量的油体颗粒分布在细胞壁周围。质体数量增多,基质中出现稀疏的片层结构,线粒体结构还比较简单,没有形成嵴膜(图5中a、a1)。盐溶液处理组,子叶细胞内蛋白质贮藏液泡聚集在一起,形成大小、形状不规则的大液泡,而油体的数量,随盐浓度的升高而增加。这表明种子萌发过程中,蛋白质和脂质降解转化速度受到盐胁迫的影响而延缓。细胞内质体的数量随着盐浓度增加而减少,基质均为无定形基质,无片层结构,淀粉粒几乎充满整个质体(图5中b~d1)。种子萌发8 d时,对照组子叶细胞内的蛋白质贮藏液泡与油体都已消耗殆尽,形成中央大液泡。质体内形成基粒类囊体片层结构,发育转化为叶绿体,基质内的淀粉粒并未增加反而减少。线粒体和内质网大量分布在胞质中,线粒体的基质区逐渐变小,嵴膜逐渐密集(图5中e、e1)。50 mmol·L-1NaCl溶液处理组,质体内基粒片层结构稀疏,少量线粒体、内质网分布在胞质中(图5中f、f1)。随着NaCl浓度的升高,100 mmol·L-1NaCl溶液处理时,胞质中分布着大量未完全降解转化的油体颗粒,液泡内含大量絮状蛋白质。2个处理组均未形成完整的叶绿体,且盐浓度越高,质体转化成叶绿体的程度越低,线粒体内也只有连成片的网状膜和较大的基质区。当NaCl溶液浓度达到150 mmol·L-1时,胞质中含大量形状不规则的油体颗粒,质体膜结构受损,基质内出现空泡化结构,未观察到线粒体及内质网(图5中g~h1)。
2.3 扫描电镜观察盐处理对萌发子叶细胞超微结构的影响
种子萌发5 d时,对照组子叶细胞内含大量质体内的淀粉颗粒,未观察到蛋白质贮藏液泡与油体(图6中a、a1)。而盐溶液处理组,子叶细胞内分布着大量蛋白质贮藏液泡,表明蛋白质和脂质降解转化速度延缓(图6中b~d1)。萌发8 d时,盐处理组细胞内的淀粉颗粒随NaCl浓度增加而减少(图6中e~h1),这与透射电镜观察结果一致。

图a~d1,大豆萌发12 h;a、b、c、d分别为对照组(蒸馏水)、50、100和150 mmol·L-1 NaCl处理组。图e~h1,大豆萌发2 d;e、f、g、h分别为对照组(蒸馏水)、50、100和150 mmol·L-1 NaCl处理组。白色箭头指示质体,黄色箭头指示质壁分离处。PSV,蛋白质贮藏液泡;OB,油体;SG,淀粉粒;P,质体,CW,细胞壁;M,线粒体;ER,内质网。图4 萌发12 h和2 d时大豆子叶细胞超微结构的透射电镜照片
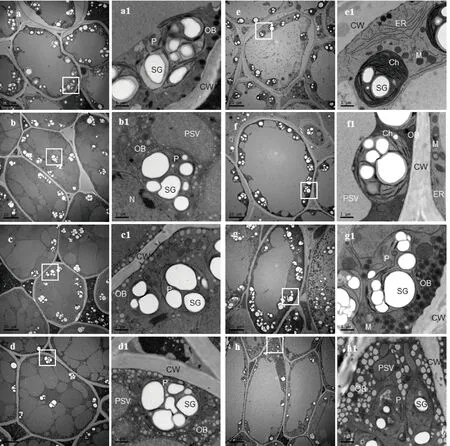
图a~d1,大豆萌发5 d;a、b、c、d分别为对照组(蒸馏水)、50、100和150 mmol·L-1 NaCl处理组。图e~h1,大豆萌发8 d;e、f、g、h分别为对照组(蒸馏水)、50、100和150 mmol·L-1 NaCl处理组。PSV,蛋白质贮存液泡;OB,油体;SG,淀粉粒;P,质体;CW,细胞壁;Ch,叶绿体;M,线粒体;ER,内质网;N,细胞核。图5 萌发5 d和8 d时大豆子叶细胞超微结构的透射电镜照片
3 讨论
随着全球土壤盐碱化面积的逐年增加,盐胁迫已经成为限制作物产量的主要非生物胁迫之一[15]。作物在种子萌发期和幼苗期对盐分最敏感,盐胁迫引起的渗透胁迫和过度离子毒害,造成作物发育迟缓,抑制组织的分化和生长[5]。种子萌发期间,子叶内各种酶被激活,促进贮藏物质降解成小分子,保证自身的呼吸作用,并转运到胚根或胚芽等生长点,促进下胚轴和胚根的生长发育[16-17]。本研究结果表明,NaCl处理组的种子萌发持续时间随NaCl浓度升高而延长,发芽率、发芽势随盐浓度升高而降低。NaCl浓度为50、100 mmol·L-1时,大豆种子的发芽率、发芽势与对照组差异不显著,直至NaCl浓度达到150 mmol·L-1时,大豆种子的发芽率、发芽势均显著低于对照组。说明低盐浓度对大豆种子萌发没有明显的抑制作用,高盐浓度的胁迫强烈抑制种子活力,降低种子的萌发率,这与前人的研究结果一致[18-19]。种子萌发受抑制程度随盐浓度增加而加剧,这种现象应该是钠离子和氯离子对萌发种子的毒性作用可以随盐处理浓度的升高得到积累[20],另一方面,高盐离子产生的渗透压也可以阻止水分的吸收,从而影响种子的萌发[21]。根系是植物吸收土壤中营养物质的主要器官,盐胁迫下水稻、油菜种子萌发主根长和侧根数等生长性状均受到显著抑制[22-23]。这与本试验中,盐溶液处理组的胚根、下胚轴长度以及侧根数量均显著小于对照组的结果一致。
子叶是种子重要的贮存器官,细胞中的蛋白质和脂质分别贮存于蛋白质贮藏液泡和油体内。豆类的蛋白质贮藏液泡是由磷脂双分子层包裹的囊泡,囊泡内主要含大豆球蛋白[11],而油体是由单层磷脂分子和镶嵌于其中的油体膜蛋白组成,核心是三酰甘油[24]。大豆萌发时,大豆蛋白酶C1诱导子叶贮藏蛋白液泡内的蛋白水解产生游离氨基酸,为生长提供重要的氮源、碳源和硫源[25],油体则在脂肪氧化酶、脂肪分解酶等作用下,被分解为甘油、脂肪酸并生成碳水化合物,参与到体内物质转化和能量代谢过程中[26-27]。目前,盐胁迫对大豆种子萌发时期子叶营养成分变化的研究多集中在生理生化水平,而对大豆种子萌发过程中盐胁迫影响子叶细胞超微结构的研究甚少。多数研究表明,大豆种子发芽过程中,蛋白质、脂质含量会明显减少,游离氨基酸含量显著增加[28-29]。本研究通过透射电镜和扫描电镜观察可知,正常萌发大豆,随着发芽天数延长,蛋白质贮藏液泡逐渐聚合增大,变成电子密度较浅的大液泡,油体的数目也随发芽天数的延长逐渐减少。说明贮藏蛋白质被酶解成小分子肽运送出细胞,三酰甘油也逐渐被消耗提供能量,支持胚根、胚芽的生长,这与王慧等[11,28-29]的研究结果一致。通过比较对照组和盐处理组,发现种子萌发5 d时,对照组子叶细胞内的蛋白质贮藏液泡融合形成大液泡,仅剩极少量的油体颗粒分布在细胞壁周围。盐溶液处理组,子叶细胞内还存有大量未降解转化的蛋白质贮藏液泡和油体。萌发8 d时,对照组子叶细胞内蛋白质贮藏液泡与油体都已消耗殆尽,而盐处理组液泡内含大量絮状蛋白质,油体颗粒也未完全降解。这说明盐溶液处理下,大豆种子蛋白质贮藏液泡和油体水解转化速度要比对照组缓慢,并且随着盐浓度的增加,延缓效应越明显。这种现象可能是盐离子对细胞代谢产生毒性,破坏了蛋白酶、肽酶、脂肪氧化酶等相关水解酶的活性和功能,抑制了子叶细胞内蛋白质贮藏液泡和油体降解成小分子参与到合成其他物质的过程,导致根长、下胚轴长以及侧根数量等生长性状受到不同程度的影响,最终抑制大豆的发芽率。盐胁迫可以通过破坏丝氨酸蛋白酶活性延缓腰果萌发时子叶中蛋白质的水解和转运,限制游离氨基酸的释放,破坏其与组织生长过程中物质供给之间的平衡关系,抑制种子的萌发[30-31]。在玉米和向日葵种子萌发过程中,盐胁迫还会延缓子叶内油脂的分解,从而降低种子的发芽率[32-33]。已有的研究表明,乙醛酸途径在大多数油料作物种子萌发过程中,将储存的脂质转化为可溶性糖时起着至关重要的作用。然而,盐胁迫会抑制乙醛酸循环中一些重要酶的活性,如过氧化氢酶、苹果酸合酶和异柠檬酸裂解酶[34]。大豆萌发12 h和2 d时,透射电镜观察还发现盐处理组子叶细胞质基质电子密度明显加深。盐浓度达到150 mmol·L-1时,萌发2 d的子叶细胞出现轻微的质壁分离,基质中分布大量小的空泡化结构,蛋白质贮藏液泡的膜结构也遭到破坏。这可能是高浓度钠离子一方面引起细胞渗透失衡,产生渗透压阻止水分的吸收,另一方面破坏生物膜表面膜蛋白导致膜系统紊乱等。本研究中150 mmol·L-1盐溶液处理组,最终无法形成叶绿体、线粒体、内质网等细胞器,这应该是高盐胁迫下一系列生理反应的累积,包括酶活性受到抑制、膜系统紊乱、活性氧产生等[5,35]。

图a~d1,大豆萌发5 d;a、b、c、d分别为对照组(蒸馏水)、50、100和150 mmol·L-1 NaCl处理组。图e~h1,大豆萌发8 d;e、f、g、h分别为对照组(蒸馏水)、50、100和150 mmol·L-1 NaCl处理组。PSV,蛋白质贮存液泡;SG,淀粉粒;CW,细胞壁。图6 萌发5 d和8 d时大豆子叶细胞超微结构的扫描电镜照片
综上所述,NaCl处理对大豆的发芽率、发芽势、根长、下胚轴长以及侧根数量等性状的抑制作用随着浓度的增加而升高。不同盐浓度处理下,蛋白质贮藏液泡和油体降解转化速度都明显延缓,叶绿体、液泡、内质网、线粒体等细胞器形成速度也随盐浓度增加而变慢。但本试验仅是模拟盐胁迫条件,探讨了一种盐分对大豆种子萌发的影响。实际盐土都是复合盐碱成分,试验光照、气温等与田间环境也存在差异。因此,实际生产中的盐碱胁迫对大豆萌发的影响机制还有待进一步研究探讨。
