哺乳期补饲开食料对牦牛犊牛生长性能、瘤胃发育和微生物区系的影响
2022-06-10郭文杰郝文君崔占鸿刘书杰
王 音 郭文杰 郝文君 崔占鸿 刘书杰
(青海大学畜牧兽医科学院,青海省牦牛工程技术研究中心,青海省高原放牧家畜动物营养与饲料科学重点实验室,西宁810016)
反刍动物幼畜的饲养方式、饲粮营养水平和乳源生长因子都会影响其消化道的发育[1],犊牛的早期培育又是牦牛养殖中重要的环节。研究表明,通过补饲有利于犊牛胃肠道消化功能的快速建立[2],实现牦牛犊牛适时断奶培育,有效促进母牦牛早期发情和配种,进而提高牦牛养殖的生产效益,加快草畜生产高质量发展。营养丰富的开食料不仅易消化吸收,还能显著提高犊牛的采食量,促进其生长发育[3-5]。反刍动物通过瘤胃微生物将膳食纤维转化为糖原以供微生物发酵并为机体细胞提供能量[6-7],开食料中70%~85%的粗纤维和其他可消化物质都能够被反刍动物瘤胃消化利用[8],因此在宿主的生长发育和免疫中,瘤胃微生物的群落结构尤为重要[9-10]。本实验室前期研究表明,早期断奶和补饲开食料有利于提高牦牛犊牛的生长性能和消化道发育[11],但对哺乳期补饲开食料如何调控牦牛犊牛瘤胃发育的机制研究还不够深入。因此,本研究利用16S扩增子测序技术,在牦牛犊牛采食苜蓿干草的基础上,进行补饲开食料,探究早期补饲开食料对哺乳期牦牛犊牛生长性能、瘤胃形态及功能发育的影响,为牦牛犊牛断奶后的代乳培育技术研究提供重要参考。
1 材料与方法
1.1 试验设计
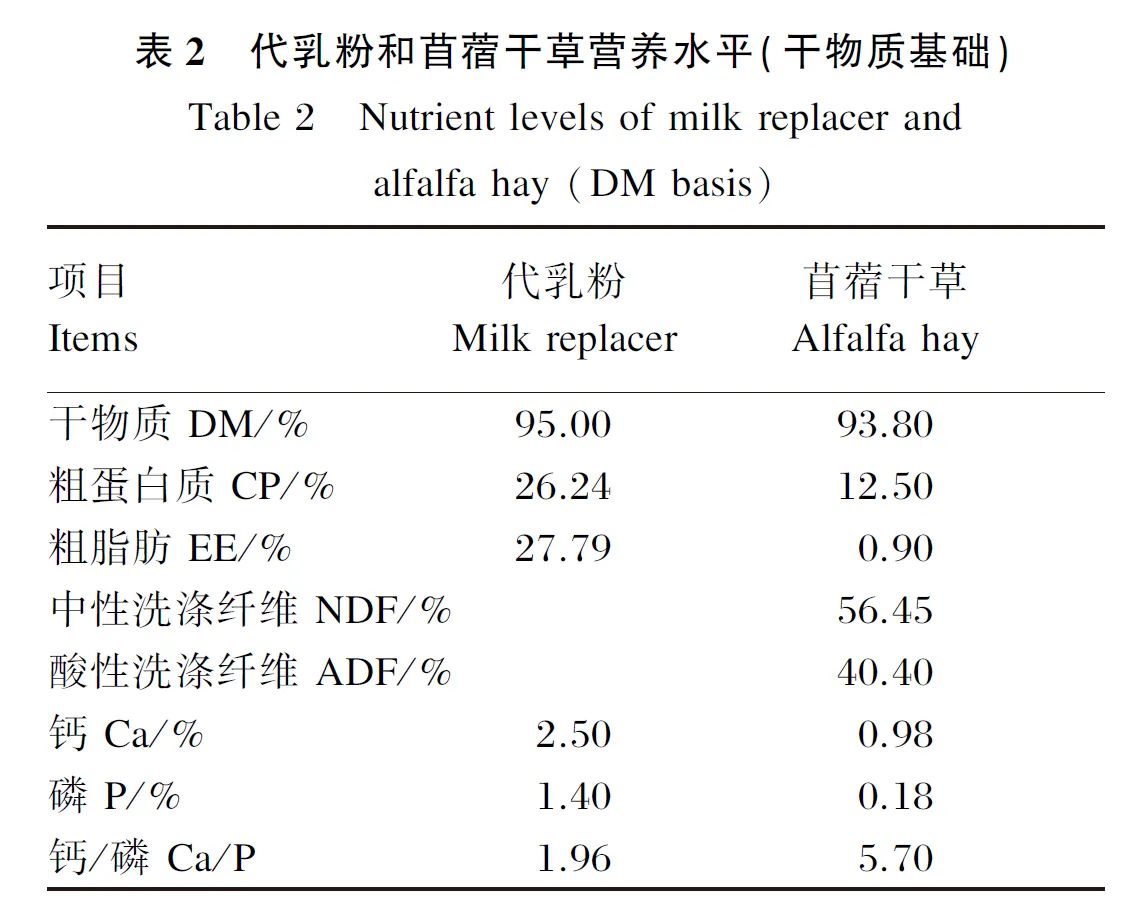
本试验于2020年7月至11月在青海省海北藏族自治州海晏县开展,试验采用单因素设计,选取体重相近、体况良好的20头30日龄牦牛公犊牛作为试验对象,单栏饲养,并饲喂一定比例的代乳粉(代乳粉∶温水=1∶5)。经过1周适应期后随机分为对照组(RA组)和试验组(RAS组),每组各10头。在饲喂代乳粉的基础上,RA组饲喂苜蓿干草(代乳粉+苜蓿草),RAS组按照苜蓿干草∶开食料=1∶1的模式进行饲喂(代乳粉+苜蓿草+开食料),自由饮水。开食料组成及营养水平见表1。代乳粉、苜蓿干草营养水平见表2。试验期间定期对圈舍进行消毒和清洁工作。预试期14 d,正试期120 d。试验结束后,每组随机选取5头进行屠宰取样。
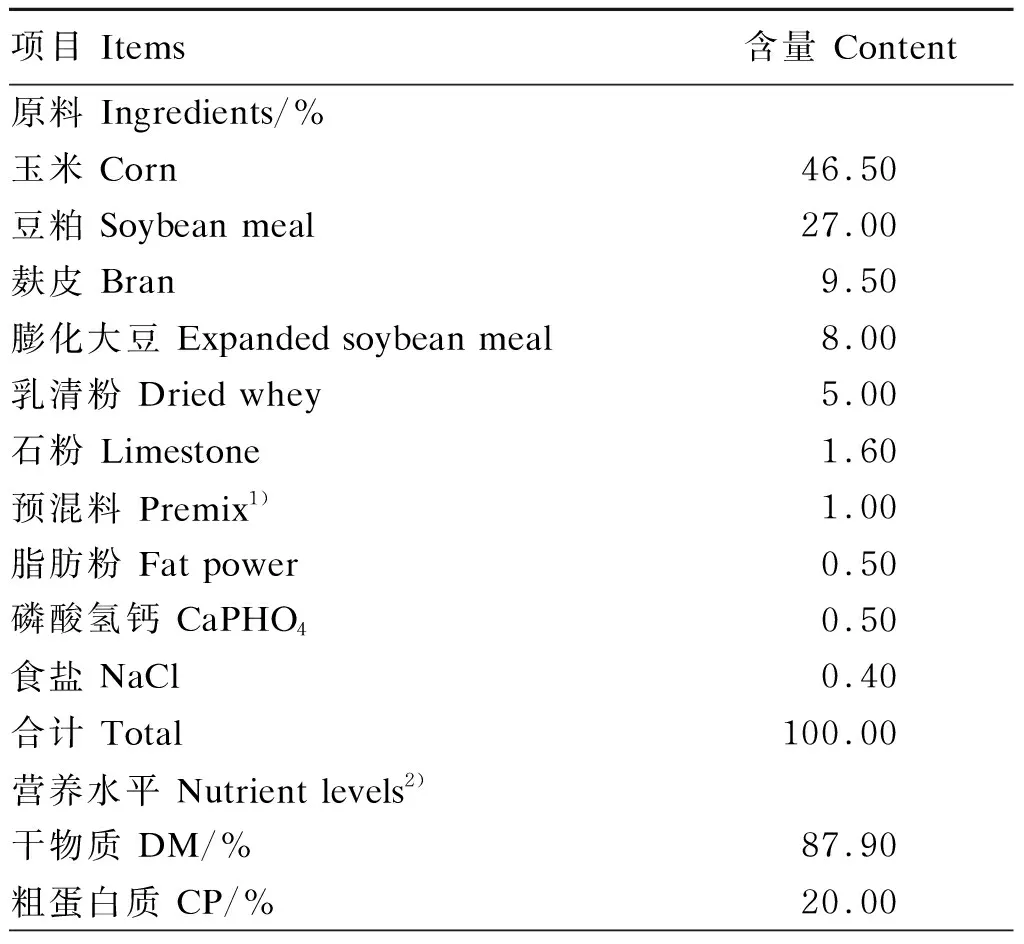
表1 开食料组成及营养水平(干物质基础)

续表1项目 Items含量 Content粗脂肪 EE/%4.70中性洗涤纤维 NDF/%10.90酸性洗涤纤维 ADF/% 4.10钙 Ca/%0.80磷 P/%0.45钙/磷 Ca/P1.78
1.2 样品采集与预处理
犊牛屠宰后,取瘤胃内容物经4层纱布过滤,采集瘤胃液立即测定pH。另采集约50 mL瘤胃液分装后经液氮运输回实验室保存,用于DNA的提取和后续分析以及挥发性脂肪酸(VFA)、氨态氮(NH3-N)浓度和微生物蛋白(MCP)含量的测定。取大小为2 cm×2 cm的瘤胃组织保存于4%多聚甲醛溶液中,用于固定组织和石蜡切片的制作。
1.3 测定指标与方法
1.3.1 干物质采食量、体重增重
试验期间,每日称量并饲喂草和料,记录投喂量,第2天饲喂前分别清理剩料并记录称重。试验开始和结束前,早晨对犊牛进行称量空腹体重。试验结束后计算犊牛干物质采食量(DMI)、平均日增重(ADG)和料重比。
1.3.2 瘤胃发酵参数
瘤胃液样品在测定当天进行解冻并离心,离心后取上清液,待测样品放在4 ℃冰箱内保存。瘤胃液pH使用UB-7型(梅特勒-托利多,美国)酸度计进行测定。瘤胃NH3-N浓度采用冯宗慈等[12]改进的比色法进行测定。MCP含量采用南京建成生物工程研究所提供的试剂盒进行测定。使用岛津GC-2014气相色谱仪测定瘤胃液VFA的浓度[13],气相色谱的条件如下:载气为N2,分流比40∶1,进样量为1 μL,进样孔温度、辅助箱温度和气化室温度均为250 ℃;FID检测器温度:250 ℃。恒流模式下的流量为2.1 mL/min,平均线速度38 cm/s,柱压11.3 psi(0.1 MPa),柱温箱设定为程序升温,90 ℃下1 min,120 ℃下1 min,150 ℃下运行3 min。
1.3.3 瘤胃组织形态观察
在操作台上将瘤胃组织从固定液中取出,用刀片对组织进行修整后放入脱水盒内并编号,经梯度酒精脱水、浸蜡,浸蜡后的组织置于包埋机内进行包埋,蜡块修整后进行切片、展片、烤片。染色采用苏木精-伊红染色法。切片在Olympus BX53电子显微镜下观察,进行数据采集。
1.3.4 瘤胃微生物区系检测
将5 mL的瘤胃液样品经干冰运输至北京诺和致源生物技术公司的Illumina MiSeq平台上对细菌扩增子进行测序,引物序列341F(5′-CCTAYGGGRBGCASCAG-3′)和806R(5′-GGACTACNNGGGTATCTAAT-3′)。文库构建使用的是TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒。
1.4 数据处理与统计分析
采用Excel 2016对数据进行整理,用SPSS 22.0软件进行数据独立性方差齐性检验,采用one-way ANOVA程序进行单因素方差分析。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 补饲开食料对牦牛犊牛生长性能的影响
由表3可知,补饲开食料后,RAS组犊牛在试验期末体重极显著高于RA组(P<0.01),RA组和RAS组分别增重39.62和45.70 kg。RA组干物质采食量为678.71 g/d,显著低于RAS组(P<0.05)。
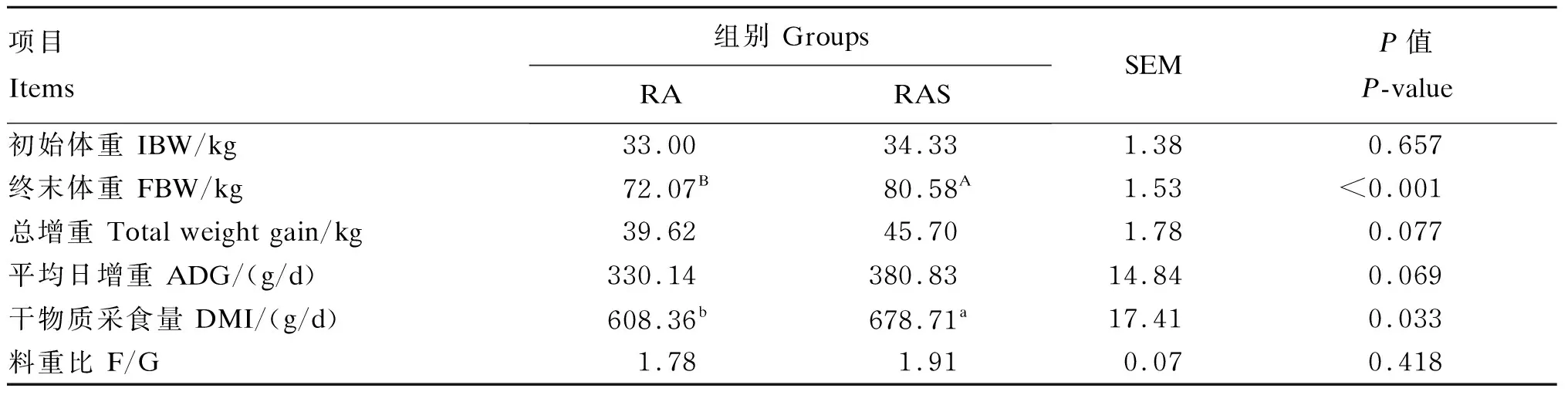
表3 补饲开食料对牦牛犊牛干物质采食量和增重的影响
2.2 补饲开食料对牦牛犊牛瘤胃发酵参数的影响
由表4可知,RAS组犊牛早期采食开食料后,瘤胃NH3-N浓度极显著提高了33.74%(P<0.01),RAS组瘤胃MCP含量显著提高了31.30%(P<0.05);RA组犊牛瘤胃液乙酸浓度显著高于RAS组(P<0.05);RAS组戊酸浓度显著高于RA组(P<0.05)。
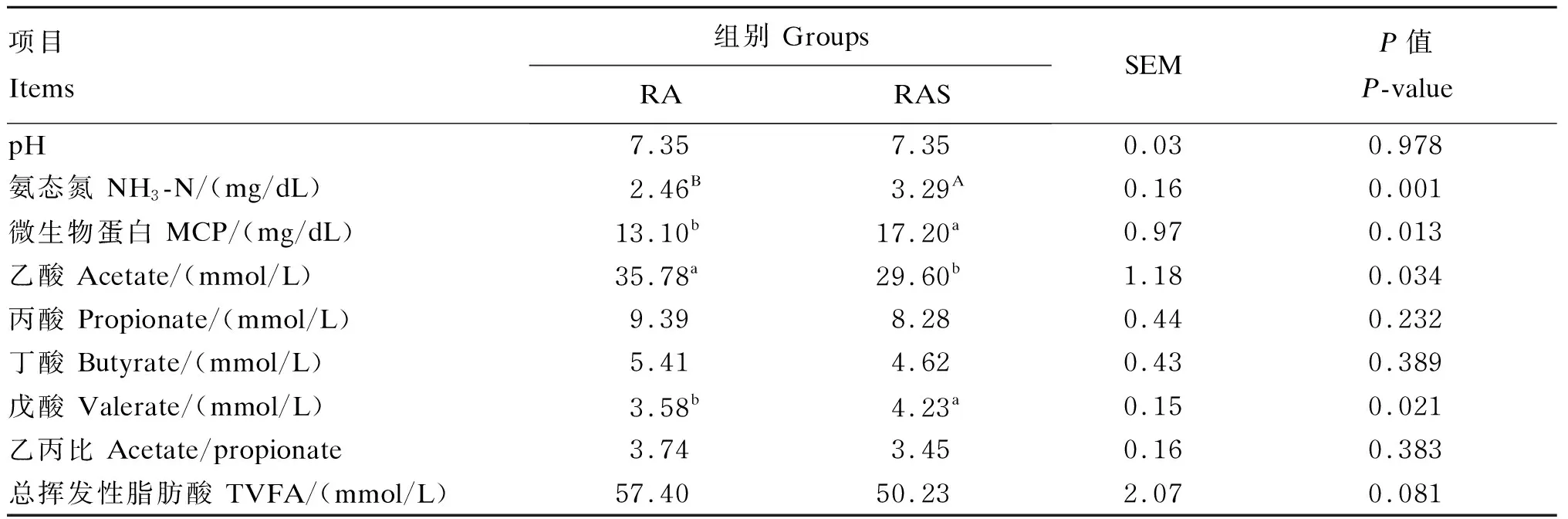
表4 补饲开食料对牦牛犊牛瘤胃发酵参数的影响
2.3 补饲开食料对牦牛犊牛瘤胃上皮形态发育的影响
瘤胃组织发育形态观察如图1所示,RAS组犊牛瘤胃颜色加深,乳头分布密集。图2为瘤胃上皮组织切片在倒置电子显微镜下成像图。统计结果如表5所示,RAS组犊牛瘤胃乳头的长度极显著高于RA组(P<0.01),瘤胃乳头宽度和肌肉层厚度组间无显著差异(P>0.05)。
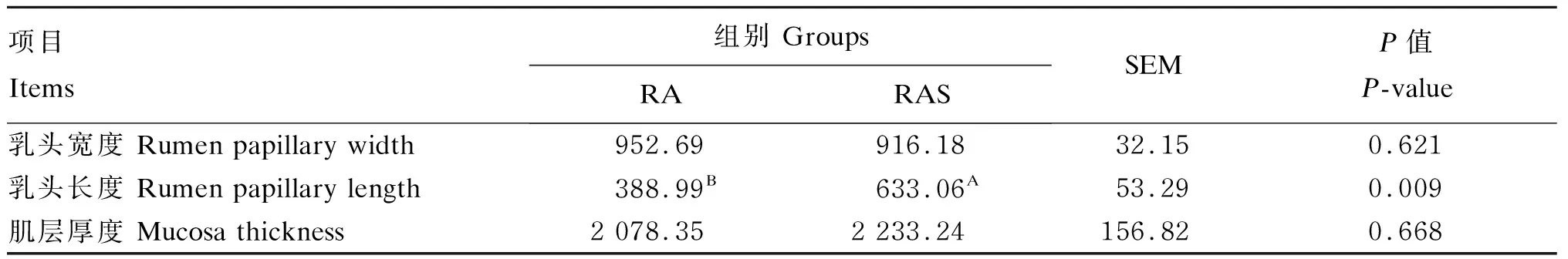
表5 补饲开食料对牦牛犊牛瘤胃上皮形态发育的影响
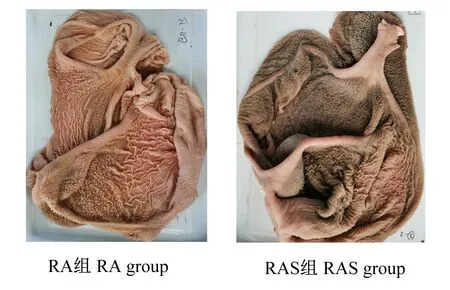
图1 牦牛犊牛瘤胃上皮外观形态观察
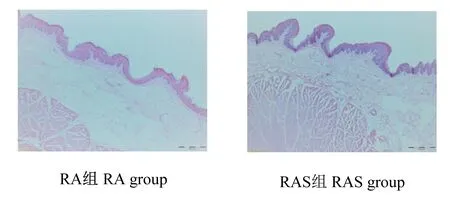
图2 牦牛犊牛瘤胃上皮组织切片
2.4 补饲开食料对牦牛犊牛瘤胃微生物区系的影响
2.4.1 瘤胃微生物群落操作分类单元(OTU)聚类和Alpha多样性分析
根据16S rRNA基因测序所得数据,绘制出的犊牛瘤胃液微生物样本的稀释曲线如图3,稀疏曲线具有97%的相似度,说明样品有足够的测序覆盖率,能够代表每个样本中大多数微生物信息。
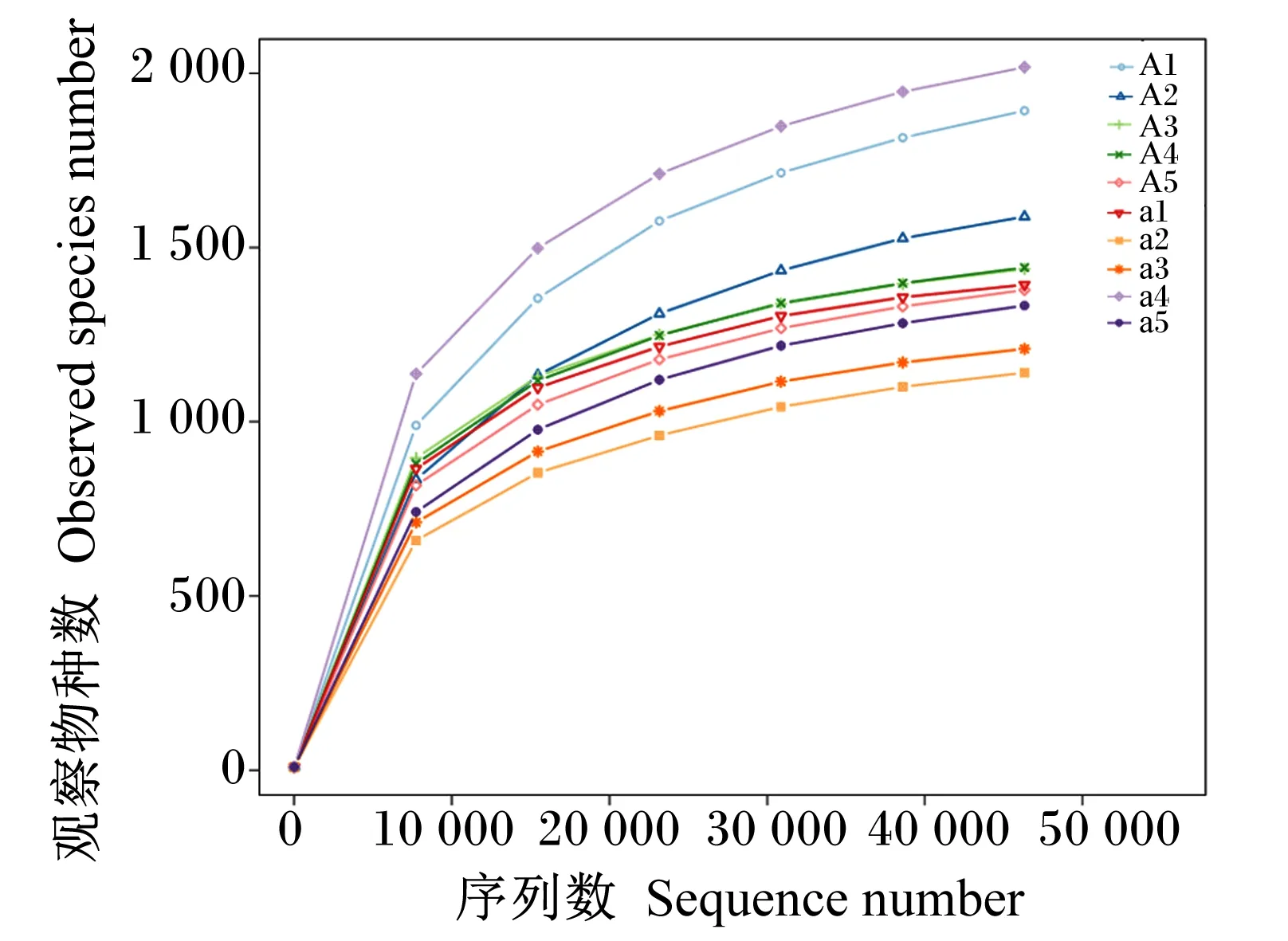
A组包括犊牛样本:A1、A2、A3、A4、A5;RAS组包括犊牛样本:a1、a2、a3、a4、a5。
本试验从10头犊牛瘤胃液中获得925 748条有效序列,在3%的距离上,10个样本共获得1 591个OTU,平均每个样本有502.90个OTU,所有样本共有的OTU数目为402个。由表6可知,样本的覆盖率达到99%以上,说明测序深度足够。其中,RA组的OTU数目显著高于RAS组(P<0.05),而2组的ACE指数和Chao1指数、香农指数和辛普森指数均无显著差异(P>0.05)。

表6 牦牛犊牛瘤胃微生物OTU数目和Alpha多样性指数分析
2.4.2 补饲开食料对牦牛犊牛瘤胃微生物相对丰度的影响
分析瘤胃液菌群在门水平的组成比例及变化,共检测到69个菌门。由表7可知,在门水平上,RA组和RAS组的优势菌群一致,但相对丰度不同。其中,RA组拟杆菌门相对丰度极显著高于RAS组(P<0.01);RAS组变形菌门相对丰度极显著高于RA组(P<0.01)。
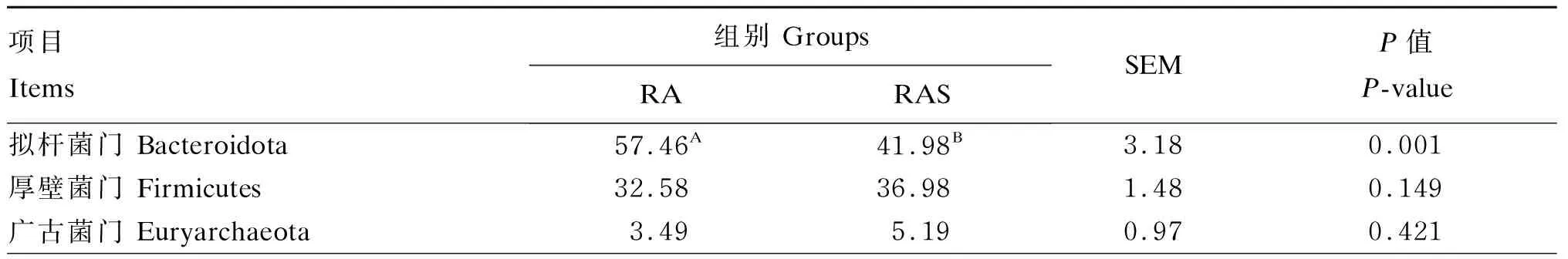
表7 补饲开食料对牦牛犊牛瘤胃微生物优势菌门相对丰度的影响
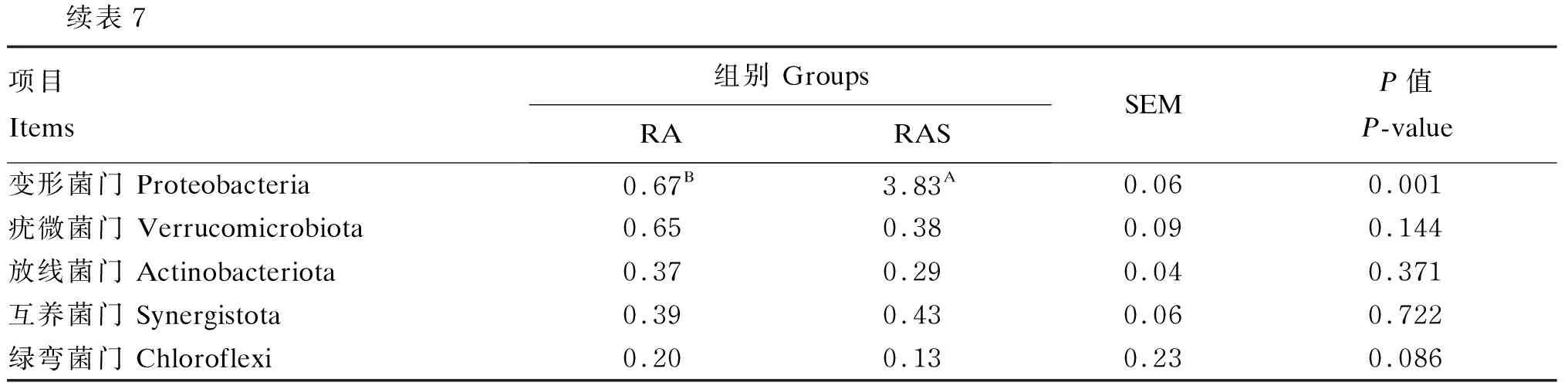
续表7项目Items组别 GroupsRARASSEMP值P-value变形菌门 Proteobacteria0.67B3.83A0.060.001疣微菌门 Verrucomicrobiota0.650.380.090.144放线菌门 Actinobacteriota0.370.290.040.371互养菌门 Synergistota0.390.430.060.722绿弯菌门 Chloroflexi0.200.130.230.086
分析RA组和RAS组瘤胃微生物在属水平的组成和变化,共计检测到519个菌属。根据表8可知,RAS组甲烷短杆菌属和瘤胃球菌属相对丰度显著高于RA组(P<0.05),RA组奎因氏菌属相对丰度极显著高于RAS组(P<0.01)。
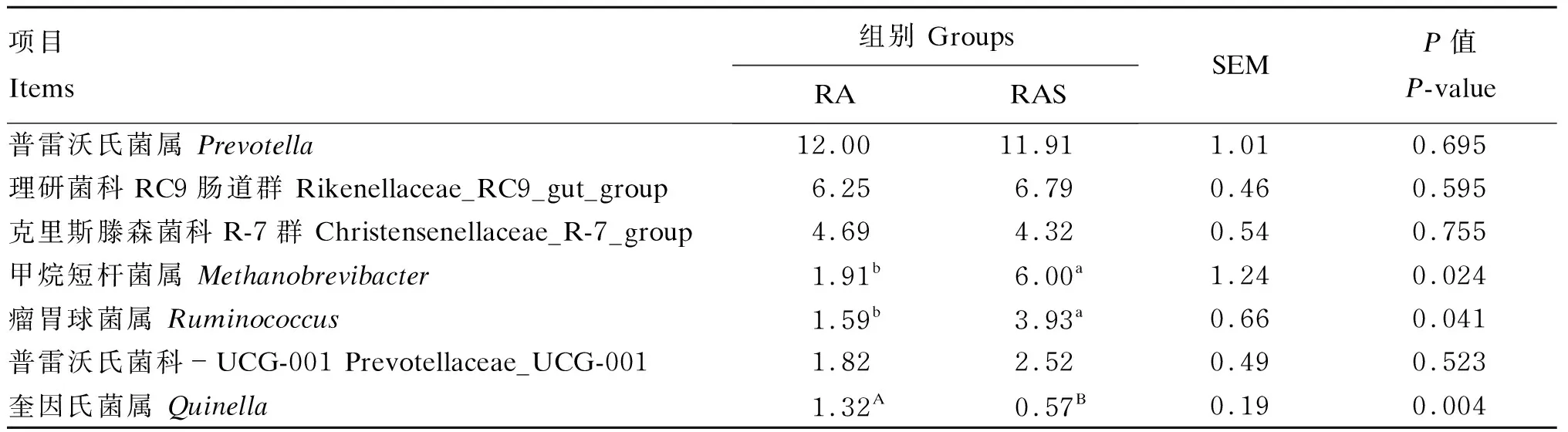
表8 补饲开食料对牦牛犊牛瘤胃微生物优势菌属相对丰度的影响
3 讨 论
3.1 补饲开食料对牦牛犊牛生长性能的影响
在高原地区,营养的匮乏和恶劣的环境严重影响了牦牛犊牛的成活率。随着技术的进步,科学的补饲开食料不仅能够提高母畜的繁殖率,还能改善天然牧草的载畜量,促进畜牧业健康持久地发展[14]。对放牧牦牛进行补饲开食料能够促进其生长性能,提高经济效益[15],但如何提高放牧牦牛犊牛的生长性能以及如何科学补饲的机制亟待完善,因此,本试验开展对哺乳期牦牛犊牛补饲开食料的深入探究,结果发现,补饲开食料后,犊牛增重达到45.7 kg,极显著提高了犊牛的体重,这与完玛措[16]和黄文植等[17]冷季对牦牛犊牛补饲提高增重的结果一致。断奶前后犊牛采食颗粒饲料可以提高犊牛的干物质消化率,提高生产性能[18]。有研究显示,代乳+补饲培育方式能显著提高牦牛犊牛的干物质采食量,有助于犊牛增重[19],本研究结果与之相同。在饲养管理和环境条件一致的情况下,RA组犊牛体重较低可能是由于采食营养单一的苜蓿干草,且苜蓿干草纤维水平较高,适口性差,进而影响了其生长发育。
3.2 补饲开食料对牦牛犊牛瘤胃发育和发酵参数的影响
犊牛出生时瘤胃发育迟缓,其生长发育主要依靠皱胃和肠道的消化吸收。随着日龄的增长和固体饲粮的采食,瘤胃内微生物发酵产生的VFA刺激瘤胃迅速发育,消化系统也逐步建立免疫代谢功能[20-22]。研究发现,采用代乳粉和开食料的培育方式能够缓解断奶应激并提高瘤胃发育水平[23]。本试验中也发现,采食开食料刺激了犊牛瘤胃的组织形态发育,RAS组瘤胃乳头长度显著增加,这与Xie等[24]对荷斯坦犊牛补饲开食料的研究结果相似。
在早期培育方式的影响下,苜蓿干草和开食料均能够改变反刍动物消化道的健康和免疫[25-26]。瘤胃作为反刍动物体内的发酵罐,其发酵产生的VFA直接刺激着瘤胃上皮的发育进程[27]。瘤胃pH是反映瘤胃是否健康发酵的综合指标,本试验的瘤胃液pH在7.23~7.47,在瘤胃健康发酵的范围内[28]。NH3-N浓度和MCP含量是反映反刍动物瘤胃的发酵状态,NH3-N浓度在瘤胃中处于动态平衡,为反刍动物合成MCP提供原料,是检测瘤胃微生物活性的指标[29]。此外,微生物对NH3-N的利用主要受饲粮中非纤维性碳水化合物的影响,随着饲粮中非纤维性碳水化合物含量的增加,瘤胃微生物会提高对NH3-N利用[30],本研究中RA组犊牛瘤胃内NH3-N浓度显著较低,这与Agle等[31]研究发现,高比例粗饲料饲粮会降低奶牛瘤胃中NH3-N浓度的结果相同,说明瘤胃微生物对NH3-N的利用会随着饲粮中结构性碳水化合物含量的增加而降低。RAS组MCP的含量显著高于RA组,MCP是瘤胃微生物氮的主要来源,说明了补饲开食料满足了微生物对饲粮降解的蛋白质需求[32]。
反刍动物利用瘤胃微生物将饲料中的纤维素降解并转化为VFA,为机体提供70%~80%的能量需求[33]。乙酸在动物体内经过一系列变化进入三羧酸循环,也可以合成脂肪或与丁酸相互转化产生酮体,促进动物对脂肪的囤积[34]。刘敏雄[35]报道,当粗饲料水平升高时,纤维素分解菌占优势,乙酸浓度上升。本试验中RA组犊牛仅采食苜蓿干草,中性洗涤纤维和酸性洗涤纤维水平较高,导致了瘤胃乙酸浓度显著升高,这与王文奇等[36]提高饲粮中酸性洗涤纤维水平,发现乙酸浓度升高的结果一致。目前关于牦牛犊牛的培育工作正在初期探索进程中,先前研究报道采用代乳粉饲喂后,150日龄犊牛瘤胃内乙酸浓度显著升高[37],本研究结果与之不同,可能是由于海拔、饲粮结构和饲养模式的差异所导致的。
3.3 补饲开食料对牦牛犊牛瘤胃微生物区系的影响
饲粮的构成影响着瘤胃微生物区系的建立,进而作用于瘤胃的形态和功能。Ben等[38]和Abecia等[39]发现,饲粮中添加单宁或甲烷抑制剂等均会改变瘤胃微生物组成,影响反刍动物的生长性能和健康发育。同时,瘤胃微生物的丰度又作用于宿主对饲粮的利用效率[40]。饲粮中高水平的非纤维性碳水化合物能降低犊牛瘤胃微生物的种类和丰富度,当饲粮中性洗涤纤维水平低于20%时,瘤胃中细菌的相对丰度有所下降[41]。本研究中,开食料中酸性洗涤纤维水平为4.10%,因此补饲开食料后犊牛瘤胃内OTU数目显著降低,这与杨硕等[42]在绒山羊上的研究结果相近。这表明尽管开食料为犊牛瘤胃微生物的定植提供充足的碳源和氮源[43],但一定程度上抑制了微生物群落的丰度。本试验中2组犊牛的优势菌门均为拟杆菌门和厚壁菌门,这与前人的研究结果[44-45]一致。Sander等[21]的研究表明,不同日龄犊牛瘤胃微生物菌群在门水平上有显著差异,本研究中犊牛采食开食料后拟杆菌门的相对丰度极显著下降,厚壁菌门的相对丰度没有显著性变化,说明开食料抑制了拟杆菌门的生长与增殖。变形菌门能够降解可溶性碳水化合物含量[46],犊牛所采食的开食料中粗蛋白质与粗脂肪水平较高,中性洗涤纤维和酸性洗涤纤维水平较低,且补饲开食料后犊牛瘤胃中变形菌门的相对丰度极显著升高,因此推测变形菌门的相对丰度随着饲粮中蛋白质水平的升高而增加,并且与饲粮中纤维水平呈负相关。
瘤胃微生物间相互作用,将纤维素等不易降解的物质转化为VFA,进一步作用于宿主的生长和维持[47]。营养水平的提高导致了微生物门水平细菌相对丰度的差异,进而影响了营养物质的利用,在属水平上,RAS组甲烷短杆菌属的相对丰度显著升高,甲烷杆菌属能够利用氢气还原甲醇,在瘤胃中,甲醇是原虫水解果胶和细菌酯酶活性的产物,这意味着补饲开食料后牦牛犊牛瘤胃发酵产生了更多的氢气,对碳水化合物的消耗增加,也为机体提供了更多的能量[48]。厚壁菌门中的瘤胃球菌属被Flint等[49]和Kabel等[50]认为在蛋白质、果胶等非纤维素植物多糖的降解等方面发挥着重要的作用,RAS组瘤胃球菌属的相对丰度显著升高进一步说明了开食料积极调控着瘤胃微生物的相对丰度。
4 结 论
本研究表明,哺乳期补饲开食料能够显著提高牦牛犊牛的干物质采食量和体重,改变瘤胃微生物群落的多样性和丰富度,正向调控了瘤胃形态功能发育,为青藏高原地区牦牛犊牛健康高质量培育提供了重要理论依据。
