禾谷镰孢FgCYP51B蛋白F511L突变对分生孢子产量及其对烯唑醇敏感性的影响
2022-06-07孙晓梅赵彦翔迟梦宇黄金光
孙晓梅 赵彦翔 迟梦宇 黄金光


摘要 Phe511是禾谷镰孢甾醇-14α-脱甲基酶FgCYP51B活性口袋中的一个重要氨基酸。本研究中,我们探究了FgCYP51B蛋白中该位点突变后对禾谷镰孢主要生物学表型的影响,并通过分子对接探讨了可能的原因。结果表明禾谷镰孢FgCYP51B-F511L突变体在菌落形态、生长速率等表型上与野生型菌株PH-1没有明显差异。但是F511L突变导致分生孢子的产量严重降低,对烯唑醇的敏感性增强。分子对接发现突变后亮氨酸的长侧链使得烯唑醇的甲基发生扭转,侧链朝向发生改变,更有利于与蛋白受体形成较强的疏水作用,这可能是导致FgCYP51B-F511L突变体对烯唑醇敏感性增强的原因。
关键词 禾谷镰孢;CYP51B;点突变;生物学表型;药剂敏感性
中图分类号: S431
文献标识码: A
DOI: 10.16688/j.zwbh.2021222
Abstract Phenylalanine 511 is an important amino acid residue in the active pocket of FgCYP51B,a sterol 14α-demethylase in Fusarium graminearum. In this study, we investigated the effect of the F511L mutation in FgCYP51B on its biological phenotypes. The results showed that the colony morphology and growth rate of the FgCYP51B-F511L mutant were consistent with those of the wild type strain PH-1. However, the F511L mutation led to significant reduction in conidia and increased sensitivity to diniconazole compared with the wild type strain. Molecular docking indicated that the F511L mutation made the methyl group of diniconazole twisted and changed the direction of the side chain of diniconazole, which facilitates strong hydrophobic interaction between diniconazole with the protein receptor. It may be the reason why FgCYP51B-F511L mutant is more sensitive to diniconazole than wild type strain.
Key words Fusarium graminearum;CYP51B;point mutation;biological phenotype;fungicide sensitivity
禾谷鐮孢Fusarium graminearum是全世界各小麦产区中小麦赤霉病(Fusarium head blight,FHB)最主要的致病菌[1]。由其引起的小麦赤霉病不仅会造成严重的产量损失,病原菌产生的真菌毒素还会污染谷物,导致谷物品质下降,并且会严重危害人畜健康[2-3]。2012年分子植物病理学期刊(Molecular Plant Pathology)评选的十大植物病原真菌中禾谷镰孢名列第4位[2]。小麦赤霉病是典型的气候型流行性病害。目前,在小麦扬花期使用杀菌剂喷雾防治是最有效的防治方法,常用的杀菌剂有苯并咪唑类杀菌剂(MBCs)、甾醇脱甲基抑制剂(DMIs)、氰烯菌酯(JS399-19)及其复配剂等。但是,由于药剂的不合理使用,目前已经出现了对MBCs及DMIs产生抗性的禾谷镰孢田间菌株[4-5]。室内药剂驯化试验等也表明禾谷镰孢对氰烯菌酯较易产生抗性突变[6-7]。因此加强对禾谷镰孢的田间监测以及研发新型杀菌剂对于有效防控小麦赤霉病具有重要意义。
DMIs的靶标蛋白是病原真菌的甾醇-14α-脱甲基酶(CYP51)。其作用机理主要是通过抑制该酶的活性阻断真菌细胞膜主要成分麦角甾醇的合成,同时造成大量有害中间产物的积累,破坏细胞膜的结构与功能。目前研究表明病原真菌主要通过CYP51中氨基酸点突变、CYP51基因的过量表达以及编码外排泵基因的过量表达等方式对DMIs药剂产生抗性,而氨基酸点突变是植物病原菌对DMIs产生抗性的主要机制[8-9]。导致抗药性产生的突变位点主要集中在CYP51蛋白N端和C端,这些位点通常参与构成药剂与蛋白互作口袋[10]。在禾谷镰孢中存在3个编码CYP51蛋白的基因,其中FgCYP51B编码功能性甾醇-14α-脱甲基酶。通过同源建模和分子对接发现,FgCYP51B与DMIs药剂分子的结合口袋主要由Val136、Tyr137、Ala308、Ser312、Ile374和Phe511等6个氨基酸残基构成[11]。课题组前期通过定点突变技术,将FgCYP51B第137位酪氨酸进行定点突变,并测定了野生型菌株和突变株对戊唑醇等甾醇脱甲基抑制剂的敏感性,发现第137位酪氨酸突变为组氨酸后对戊唑醇的敏感性降低,分生孢子产量降低,子囊孢子的发育受阻[12-13]。目前的研究表明N端第123位酪氨酸、第137位酪氨酸等在FgCYP51B蛋白抗药性及生物学功能方面承担重要角色[12,14],但是C端氨基酸在杀菌剂敏感性方面的研究相对较少。2014年有研究发现指梗青霉Penicillium digitatum PdCYP51B中与FgCYP51B的Phe511等价的Phe506发生F506I突变及G459S突变在指梗青霉对咪鲜胺产生中等抗性中发挥作用[15]。
为探究禾谷镰孢C端511位苯丙氨酸在FgCYP51B发挥功能中的作用,本研究构建了FgCYP51B 蛋白的F511L突变体,并对突变体的菌落形态、生长速率、分生孢子产量等生物学表型特征进行了分析,发现FgCYP51B第511位苯丙氨酸突变后严重影响禾谷镰孢孢子发育以及其对烯唑醇杀菌剂的敏感性。使用同源建模和分子对接分析了可能的原因,试验结果也为设计防治小麦赤霉病新型杀菌剂提供了结构基础。
1 材料与方法
1.1 材料
试验用菌株、载体:大肠杆菌Escherichia coli DH5α,禾谷镰孢野生型菌株PH-1、FgCYP51B敲除体(ΔFgCYP51B)、回补体(ComCYP51B)、互补载体pKN-FgCYP51B-Com由本实验室保存,基因回补载体pKN由中国农业大学杨俊教授惠赠。
马铃薯葡萄糖琼脂培養基(potato dextrose agar,PDA):马铃薯200 g切丁后煮沸20 min,过滤后滤液加葡萄糖20 g,去离子水定容至1 L,添加1.5%(m/V)琼脂粉。1%绿豆培养基(mung bean broth,MBB): 10 g绿豆于水中煮沸20 min后过滤,滤液定容至1 L。水琼脂(water agar,WA)培养基:向去离子水中加入2.0%(m/V)的琼脂粉。培养基均高温灭菌后保存备用。
试验药剂:98%烯唑醇原药由青岛中达农业科技有限公司提供。试验中用DMSO配制成有效成分浓度为1 000 μg/mL的母液备用。
1.2 CYP51B基因突变载体pKN-FgCYP51B-F511L的构建
以互补载体pKN-FgCYP51B-Com为模板,利用重叠延伸PCR的方法[12]制备突变片段,定点突变引物见表1。利用引物F511L-F和F511L-mutR扩增FgCYP51B-F511L突变片段上游序列,用引物F511L-mutF和F511L-R扩增FgCYP51B-F511L突变片段下游序列。通过引物F511L-F和F511L-R对F511L突变上、下游序列进行融合PCR。通过限制性内切酶HindⅢ和XhoⅠ对突变片段FgCYP51B-F511L和pKN载体进行双酶切,利用T4连接酶将突变片段和pKN载体进行连接。热激转化大肠杆菌DH5α后,将菌液PCR验证正确的阳性克隆进一步测序确认。提取质粒,-20℃ 保存备用。
1.3 原生质体转化及转化子的筛选、验证
使用PEG介导的原生质体转化法将pKN-FgCYP51B-F511L转化到禾谷镰孢FgCYP51B敲除体菌株(ΔFgCYP51B)中。具体的转化方法
及转化子的筛选、验证方法参照Qian等的方法[12],验证正确的转化子保存在30%的甘油中,于-80℃保存备用。
1.4 菌落形态、生长速率及分生孢子产量测定
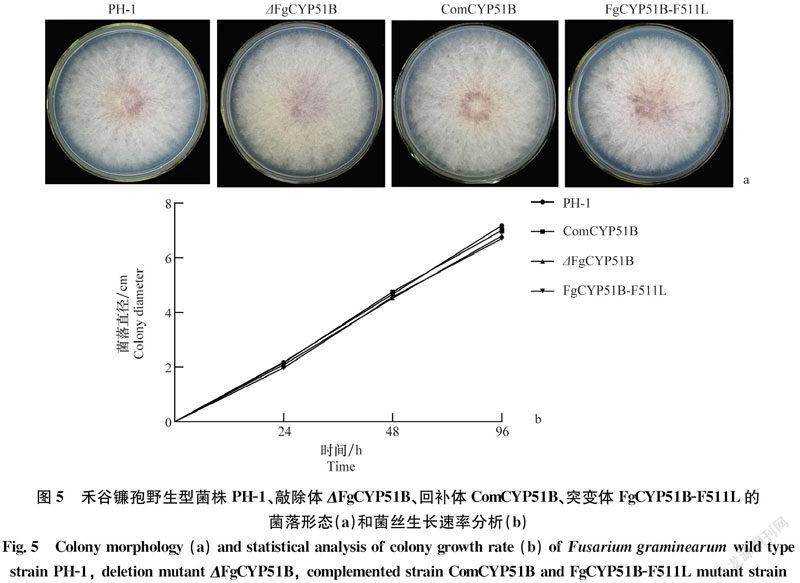
打取禾谷镰孢野生型菌株PH-1、FgCYP51B敲除体、回补体及FgCYP51B-F511L突变体菌株菌丝块,置于PDA培养基上,25℃黑暗下培养72 h。观察菌落形态,采用十字交叉法测量菌落大小。在1%绿豆培养基中于25℃、200 r/min条件下培养进行分生孢子的诱导。双层擦镜纸过滤收集分生孢子,25℃,4 000 r/min离心,1 mL无菌水悬浮分生孢子,血球计数板进行计数。试验重复3次,每次试验每个菌株3个重复。
1.5 F511L突变体对烯唑醇敏感性测定
采用菌丝生长速率法测定FgCYP51B-F511L突变体、野生型PH-1、FgCYP51B敲除体及回补体菌株对烯唑醇的敏感性变化[12]。试验中使用的烯唑醇药剂浓度为0、0.13、0.25、0.50、1.0、2.0 mg/L。利用以下公式计算菌丝生长抑制率:菌丝生长抑制率 =(对照菌落直径 - 处理菌落直径)/(对照菌落直径 - 菌饼直径)×100%。使用SPSS软件进行概率回归分析计算得到抑制中浓度EC50[16]。
1.6 统计分析
试验数据采用GraphPad Prism软件进行统计分析,进行单因素方差分析后,采用Duncan氏新复极差法进行差异显著性分析。
1.7 同源建模和分子对接
FgCYP51B三维结构的同源建模以及其与烯唑醇的分子对接试验在四川魔德科技有限公司进行。方法简述如下,通过BLASTP程序检索蛋白质数据库(Protein Data Bank),得到与FgCYP51B序列一致性为61%的4UYL晶体结构[17],以此结构为模板用SWISS-MODEL程序[18]对FgCYP51B同源建模,使用PROCHECK[19]和QMEAN程序[20]对蛋白模型进行合理性评价。使用AutoDock Tools 1.5.6软件处理获得的FgCYP51B蛋白和烯唑醇(diniconazole, DIN)配体结构,然后使用AutoDock 4.2.6软件包进行分子对接。首先设定血红素附近为配体的结合位点,FgCYP51B及突变体对接口袋中心点坐标设为(-80.593, 158.870, -8.968),对接盒子XYZ各方向的格点数设为40×40×40,格点间距为0.375 ,对接次数设为200,其余参数采用默认值。能量优化采用Amber14力场,进行两步优化:先进行5 000步的最陡下降法优化,再用3 000步的共轭梯度法对结构进行进一步优化,将最终的结果作为后续分析的模型。
2 结果与分析
2.1 pKN-FgCYP51B-F511L突变载体的构建
以互补载体pKN-FgCYP51B-Com为模板,通过PCR分别扩增得到FgCYP51B-F511L突变片段的5′端和3′端约3.2 kb、570 bp的片段(图1)。将突变片段的5′端和3′端片段进行融合PCR,获得大约4.0 kb的目标片段。然后将融合片段酶切后连接到pKN载体上,利用FgCYP51B基因的特异性引物F511L-CheckF、F511L-CheckR对突变载体进行菌液PCR验证(图2),测序结果显示,FgCYP51B基因编码序列的第1 533位核苷酸C突变为A,对应511位氨基酸由苯丙氨酸F突变为亮氨酸L。
2.2 禾谷镰孢FgCYP51B-F511L突变菌株验证pKN-FgCYP51B-F511L
转化到禾谷镰孢FgCYP51B敲除体菌株中后,经潮霉素和G418双抗筛选得到突变体转化子,单孢分离后提取转化子DNA。用载体特异性引物M13-20-F、M13-R对F511L转化子进行检测。F511L的2个转化子中均检测到约4 100 bp特异性条带(图3)。
2.3 FgCYP51B第511位氨基酸突变(F511L)对分生孢子产量的影响
利用1%绿豆培养基培养菌株并进行分生孢子产量的测定。通过GraphPad Prism软件对FgCYP51B-F511L突变体和野生型菌株PH-1、FgCYP51B基因敲除体ΔFgCYP51B以及FgCYP51B回补体ComCYP51B分生孢子产量进行统计分析。结果显示,PH-1与ComCYP51B的分生孢子产量无显著差异,测量平均值分别为2.3×106、2.2×106个/mL。
但是ΔFgCYP51B与FgCYP51B-F511L突变体的产孢量分别为0.8×106、1.5×106个/mL,与野生型相比产孢量显著下降(P<0.05)(图4)。这说明FgCYP51B基因与禾谷镰孢分生孢子产量有关,与Fan等报道一致[23]。而且CYP51B基因C端第511位苯丙氨酸在分生孢子产生过程中也起着重要的作用,但是FgCYP51B第511位氨基酸突变后对禾谷镰孢的营养生长没有影响(图5),这与Fan等报道FgCYP51B基因并不是禾谷镰孢营养生长的必需基因相一致[23]。
2.4 突变体对烯唑醇的敏感性
采用菌丝生长速率法测定禾谷镰孢野生型菌株PH-1、FgCYP51B基因敲除体、FgCYP51B基因回补体以及FgCYP51B-F511L突变菌株对烯唑醇的敏感性差异,利用SPSS软件计算各自的EC50(表2)。比较4个菌株对烯唑醇的敏感性差异,其中FgCYP51B基因敲除及回补后对烯唑醇的敏感性与野生型禾谷镰孢相比仅略有下降,而FgCYP51B-F511L突变菌株对烯唑醇的敏感性则比野生型禾谷镰孢明显升高。在同一药剂浓度下,F511L突变菌株的菌落直径明显小于野生型禾谷镰孢菌落,尤其在高浓度時菌落直径差异明显。由表2可知烯唑醇对F511L突变体的EC50比对野生型的EC50降低了约58%。这说明FgCYP51B蛋白第511位氨基酸在FgCYP51B与烯唑醇的互作过程中发挥着一定的作用。
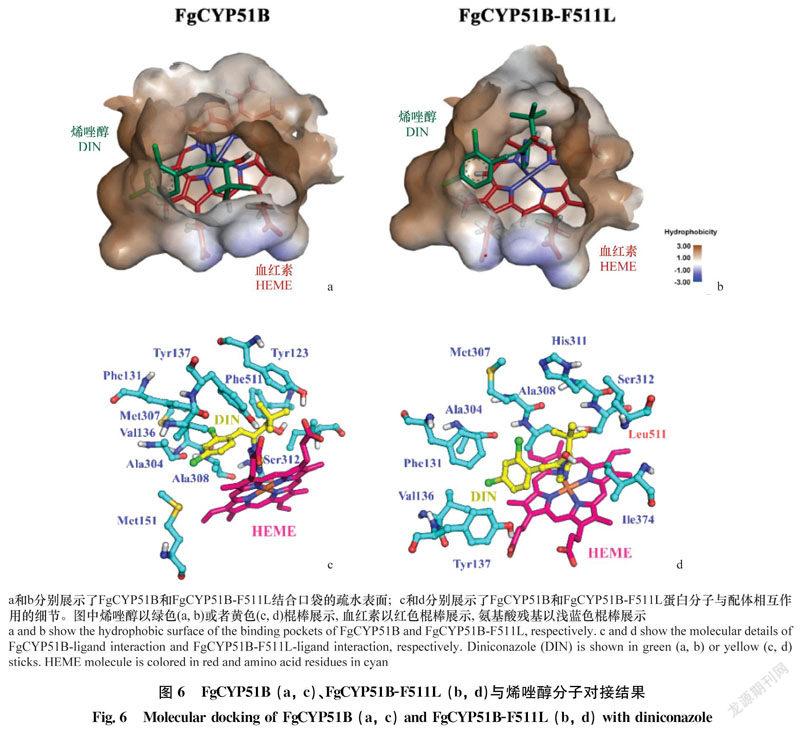
2.5 分子对接结果
将烯唑醇(DIN)分别对接到FgCYP51B、FgCYP51B-F511L的催化活性中心,得到的结合能分别为-7.44 kcal/mol和-7.65 kcal/mol。从能量角度看,FgCYP51B-F511L突变体与DIN之间的亲和力要比FgCYP51B高,表明突变的位点可能有利于DIN的结合,进一步导致烯唑醇对FgCYP51B-F511L突变体菌株的EC50值较野生型菌株要低。
从对接得到的结构看,DIN结合在FgCYP51B活性口袋内,参与二者结合的基本上为疏水性氨基酸残基,主要有Tyr123、Phe131、Val136、Tyr137、Ala304、Met307、Ala308和Phe511,这些氨基酸残基为受体结合DIN提供了一个极强的疏水性环境,有利于分子识别的顺利进行(图6)。DIN在空间位置上靠近血红素(HEME)的铁,DIN中三氮唑上的N原子均可与血红素中的Fe原子鳌合,可能会影响血红素参与的酶促反应过程。
将Phe511突变成Leu511后,DIN侧链结构的朝向发生了变化,与Met307、Ala308和His311形成较强的疏水作用,有利于增强DIN与酶的亲和力;同时由于Leu511的侧链较Phe511更长,通过烷基-烷基堆积作用诱导DIN的甲基发生扭转,进而与其形成较强的疏水作用(图6)。由此导致FgCYP51B-F511L对DIN具有更强的亲和力。
3 讨论
在CYP51蛋白中主要有6个底物识别区域(SRS1~SRS6),其中SRS1和SRS4是最保守的。在目前的研究中,CYP51蛋白位点的突变主要集中在N端SRS1结合区域,在该区域内重要氨基酸突变后能够引起蛋白与杀菌剂的结合能力发生改变或者使蛋白的结构及活性发生变化,从而引起抗性的产生[12,24-25]。如在绿糙棒菌Villosiclava virens、禾生球腔菌Mycosphaerella graminicola、禾谷镰孢中,第137位酪氨酸突变后菌株对甾醇脱甲基抑制剂产生了抗性[12,26-27];而白色念珠菌Candida albicans中Tyr132、Phe145突变在降低催化活性的同时也使得病原菌对杀菌剂产生了抗性[28]。前期课题组通过遗传学及生物信息学研究,发现了禾谷镰孢中甾醇14α-脱甲基酶FgCYP51B与底物甾醇脱甲基抑制剂结合过程中发挥重要作用的氨基酸位点,其中N端的123、136、137位氨基酸均位于SRS1底物结合区域,而511位氨基酸位于SRS6底物结合区域[11]。进一步研究发现禾谷镰孢第137位酪氨酸突变成组氨酸后对戊唑醇的敏感性降低[12]。此外,该位点的突变还会导致禾谷镰孢产分生孢子的能力下降,而且会影响有性世代子囊孢子的发育[13]。
本研究对FgCYP51B第511位氨基酸突变(F511L)后菌株的分生孢子产量、菌落形态、生长速率等生物学表型以及常用甾醇脱甲基抑制剂敏感性进行了分析。研究结果发现FgCYP51B的敲除导致禾谷镰孢分生孢子产生降低,这与之前的报道一致[23]。蛋白质中的重要氨基酸往往会直接或者间接影响蛋白质的生物学功能,本研究中FgCYP51B-F511L突变体表型与FgCYP51B基因敲除体表型基本一致,表明F511确实在FgCYP51B发挥功能过程中起重要作用。分子对接表明F511L突变可以直接改变与烯唑醇分子的相互作用,从而参与病原菌对烯唑醇敏感性的变化。该位点的苯丙氨酸残基在不同病原菌中是比较保守的,本研究中与禾谷镰孢野生型菌株相比,FgCYP51B-F511L突变体对烯唑醇的敏感性升高,而等价的PdCYP51B-F506I突变和G459S突变共同导致指梗青霉对咪鲜胺敏感性的降低[15],这表明该氨基酸残基在CYP51蛋白家族与甾醇脱甲基酶抑制剂中发挥重要的作用,其突变可能会导致病原菌对DMIs药剂敏感性的改变。通过对重要氨基酸位点突变后进行表型分析,我们阐明了FgCYP51B与甾醇脱甲基抑制剂互作过程中重要氨基酸F511的功能,为其他氨基酸的功能研究以及其他真菌中相应氨基酸表型的研究提供了理论依据。
參考文献
[1] GOSWAMI R S, KISTLER H C. Heading for disaster: Fusarium graminearum on cereal crops [J]. Molecular Plant Pathology, 2004, 5(6): 515-525.
[2] DEAN R, VAN KAN J A L, PRETORIUS Z A, et al. The top 10 fungal pathogens in molecular plant pathology [J]. Molecular Plant Pathology, 2012, 13(4): 414-430.
[3] KANG Z, BUCHENAUER H. Studies on the infection process of Fusarium culmorum in wheat spikes: degradation of host cell wall components and localization of trichothecene toxins in infected tissue [J]. European Journal of Plant Pathology, 2002, 108(7): 653-660.
[4] YIN Yanni, LIU Xin, LI Bin, et al. Characterization of sterol demethylation inhibitor-resistant isolates of Fusarium asiaticum and F.graminearum collected from wheat in China [J]. Phytopathology, 2009, 99(5): 487-497.
[5] CHEN Changjun, YU Junjie, BI Chaowei, et al. Mutations in a β-tubulin confer resistance of Gibberella zeae to benzimidazole fungicides [J]. Phytopathology, 2009, 99(12): 1403-1411.
[6] ZHENG Zhitian, HOU Yiping, CAI Yiqiang, et al. Whole-genome sequencing reveals that mutations in myosin-5 confer resistance to the fungicide phenamacril in Fusarium graminearum [J/OL]. Scientific Reports, 2015, 5(1): 8248. DOI:10.1038/srep08248.
[7] ZHANG Chengqi, CHEN Yun, YIN Yanni, et al. A small molecule species specifically inhibits Fusarium myosin I [J]. Environmental Microbiology, 2015, 17(8): 2735-2746.
[8] FAN Jieru, CHEN Fu, DIAO Yongzhao, et al. The Y123H substitution perturbs FvCYP51B function and confers prochloraz resistance in laboratory mutants of Fusarium verticillioides[J]. Plant Pathology, 2014, 63(4): 952-960.
[9] DUDAKOVA A, SPIESS B, TANGWATTANACHULEEPORN M, et al. Molecular tools for the detection and deduction of azole antifungal drug resistance phenotypes in Aspergillus species [J]. Clinical Microbiology Reviews, 2017, 30(4): 1065-1091.
[10]BECHER R, WIRSEL S G R. Fungal cytochrome P450 sterol 14α-demethylase (CYP51) and azole resistance in plant and human pathogens [J]. Applied Microbiology and Biotechnology, 2012, 95(4): 825-840.
[11]QIAN Hengwei, DUAN Meilin, SUN Xiaomei, et al. The binding mechanism between azoles and FgCYP51B, sterol 14α-demethylase of Fusarium graminearum: Interaction between azoles and FgCYP51B [J]. Pest Management Science, 2018, 74(1): 126-134.
[12]QIAN Hengwei, DU Juan, CHI Mengyu, et al. The Y137H mutation in the cytochrome P450 FgCYP51B protein confers reduced sensitivity to tebuconazole in Fusarium graminearum [J]. Pest Management Science, 2018, 74(6): 1472-1477.
[13]迟梦宇, 钱恒伟, 赵颖, 等. 禾谷镰孢FgCYP51B蛋白Y137H影响分生孢子及子囊孢子发育[J]. 植物病理学报, 2019, 49(2): 283-288.
[14]ZHAO Yanxiang, CHI Mengyu, SUN Huilin, et al. The FgCYP51B Y123H mutation confers reduced sensitivity to prochloraz and is important for conidiation and ascospore development in Fusarium graminearum [J]. Phytopathology, 2021, 111(8): 1420-1427.
[15]WANG Jinlong, YU Jinhui, LIU Jing, et al. Novel mutations in CYP51B from Penicillium digitatum involved in prochloraz resistance [J]. Journal of Microbiology, 2014, 52(9): 762-770.
[16]LI Jinli, LIU Xiangyang, XIE Jiatao, et al. A comparison of different estimation methods for fungicide EC50 and EC95 values [J]. Journal of Phytopathology, 2015, 163(4): 239-244.
[17]HARGROVE T Y, WAWRZAK Z, LAMB D C, et al. Structure-functional characterization of cytochrome P450 sterol 14α-demethylase (CYP51B) from Aspergillus fumigatus and molecular basis for the development of antifungal drugs [J]. Journal of Biological Chemistry, 2015, 290(39): 23916-23934.
[18]WATERHOUSE A, BERTONI M, BIENERT S, et al. SWISS-MODEL: Homology modelling of protein structures and complexes [J]. Nucleic Acids Research, 2018, 46(W1): W296-W303.
[19]LASKOWSKI R A, MACARTHUR M W, MOSS D S, et al. PROCHECK: a program to check the stereochemical quality of protein structures [J]. Journal of Applied Crystallography, 1993, 26(2): 283-291.
[20]BENKERT P, BIASINI M, SCHWEDE T. Toward the estimation of the absolute quality of individual protein structure models [J]. Bioinformatics, 2011, 27(3): 343-350.
[21]MORRIS G M, HUEY R, LINDSTROM W, et al. AutoDock4 and AutoDockTools4: Automated docking with selective receptor flexibility [J]. Journal of Computational Chemistry, 2009, 30(16): 2785-2791.
[22]MAIER J A, MARTINEZ C, KASAVAJHALA K, et al. ff14SB: Improving the accuracy of protein side chain and backbone parameters from ff99SB [J]. Journal of Chemical Theory and Computation, 2015, 11(8): 3696-3713.
[23]FAN Jieru, URBAN M, PARKER J E, et al. Characterization of the sterol 14α-demethylases of Fusarium graminearum identifies a novel genus-specific CYP51 function [J]. New Phytologist, 2013, 198(3): 821-835.
[24]LEROUX P, WALKER A S. Multiple mechanisms account for resistance to sterol 14α-demethylation inhibitors in field isolates of Mycosphaerella graminicola [J]. Pest Management Science, 2011, 67(1): 44-59.
[25]PEREIRA D A, MCDONALD B A, BRUNNER P C. Mutations in the CYP51 gene reduce DMI sensitivity in Parastagonospora nodorum populations in Europe and China [J]. Pest Management Science, 2017, 73(7): 1503-1510.
[26]WANG Fei, LIN Yang, YIN Weixiao, et al. The Y137H mutation of VvCYP51 gene confers the reduced sensitivity to tebuconazole in Villosiclava virens [J/OL]. Scientific Reports, 2015, 5(1): 17575. DOI:10.1038/srep17575.
[27]COOLS H J, MULLINS J G L, FRAAIJE B A, et al. Impact of recently emerged sterol 14α-demethylase (CYP51) variants of Mycosphaerella graminicola on azole fungicide sensitivity [J]. Applied and Environmental Microbiology, 2011, 77(11): 3830-3837.
[28]KUDO M, OHI M, AOYAMA Y, et al. Effects of Y132H and F145L substitutions on the activity, azole resistance and spectral properties of Candida albicans sterol 14-demethylase P450 (CYP51): A live example showing the selection of altered P450 through interaction with environmental compounds [J]. The Journal of Biochemistry, 2005, 137(5): 625-632.
(責任编辑:杨明丽)
