不同牦牛毛色转录组特征以及候选基因筛选
2022-06-06韩敏振王国文徐尚荣付长其
韩敏振,王国文,彭 巍,舒 适,黄 荣,徐尚荣,付长其,张 君*
(1.青海大学农牧学院,青海 西宁 810016; 2.青海大学畜牧兽医科学院,青海 西宁 810016)
哺乳动物的毛色表型是由黑色素细胞分泌的黑色素所控制的,黑色素分为真黑色素和褐黑色素,两者积聚到黑色素体中,最终它们的分布数量和比例造成了哺乳动物毛色的多样性[1]。尽管在黑色素形成过程中涉及的信号通路众多,但起主要作用的是a-MSH/MC1R信号通路及酪氨酸酶基因家族,Du等[2]报道a-MSH/MC1R信号通路可促进哺乳动物真黑色素的生成,而刺豚鼠信号蛋白基因(Agouti signaling protein,ASIP)通过抑制酪氨酸酶的表达,导致真黑色素合成受阻[3],从而诱导褐黑色素的生成。随着研究的深入,发现ASIP和酪氨酸酶相关蛋白酶1基因(Tyrosinase-related protein1,TYRP1)、黑素皮质激素受体1(Melanocortin 1 receptors,MC1R)、酪氨酸酶基因(Tyrosinase,TYR)等基因对黑色素的形成有重要的影响[4-6]。
牦牛(Bosgrunniens)主要分布于我国青藏高原(海拔3 000~5 500 m)地区[7]。经过长期的自然环境选择淘汰,牦牛已完全适应了高海拔特殊生态环境[8-10]。野牦牛全身为黑色或乌褐色[11],而家牦牛毛色比野牦牛毛色类型更加丰富,主要以黑色或乌褐色为主,纯白色占有一定的比例,还有部分呈棕色、金色、青色或杂色。Zhang等[12]发现牦牛棕色毛色与TYRP1不相关,而与MC1R的3个无义突变及前黑素小体蛋白(Premelanosome protein,PMEL)的1个缺失突变相关。Guangxin等[13]利用全基因组重测序筛选出可能决定天祝白牦牛的9个候选基因,KEGG分析结果显示,9个候选基因中有5个被归入12个信号通路,包括鞘脂代谢和ABS转运体及P13K-Akt信号通路等。对牦牛毛色遗传基础的解析有助于牦牛适应性进化解析以及家牦牛毛色的演变研究;同时也有助于牦牛品种的保护。本研究通过对黑色、白色以及棕色牦牛皮肤组织进行比较转录组分析,筛选与不同毛色相关的差异表达基因,为进一步挖掘控制不同毛色牦牛的主效基因及新基因提供基础数据。
1 材料与方法
1.1 试验材料
选取相同发育阶段的成年健康黑色(black)、白色(white)和棕色(brown)牦牛各3头,采集耳组织样品,用剪刀剪去耳组织的毛发,立即用RNase-free水冲洗后置于液氮中,置-80 ℃冰箱冷冻保存,用于总RNA提取。
1.2 试验方法
1.2.1 总RNA的提取及质量检测 按照Trizol RNA试剂盒(Promega,USA)说明书分别提取黑色、白色和棕色牦牛耳组织总RNA,使用Agilent 2100和无RNA酶的1%琼脂糖凝胶电泳对RNA的浓度及完整性进行检测,以确保测序所用样品的质量。
1.2.2 文库构建及质量检测 建库起始RNA为total RNA,通过Oligo(dT)磁珠富集带有poly A尾的mRNA,加入二价阳离子将得到的mRNA随机打断。反转合成cDNA并对其进行纯化,用AMPure XP beads筛选大小为370~420 bp的cDNA片段。然后进行PCR扩增并纯化PCR产物,PCR富集建库。文库构建所有的步骤完成后,先使用Qubit 2.0进行初步定量,将文库浓度稀释至标准浓度(1.5 ng/μL),接着用Agilent 2100对文库的insert size进行检测,当insert size符合预期后,为了确保所构建文库的质量,利用qRT-PCR法检测使文库的有效浓度高于2 nmol/L。
1.2.3 测序结果的质量控制
为了保证数据的质量,对经过Illumina Hi Seq高通量测序所得原始序列,除去质量较低的reads,获得高质量Clean reads之后开展后续分析,保证了最终所得数据的准确性及可靠性。
1.2.4 RNA-seq数据处理及分析
将获得的Clean reads使用HISAT2软件与参考基因组进行比对。然后进行基因表达水平的定量分析(feature Counts工具),计算出各个样本所有基因的表达量FPKM值,采用DESeq2软件(1.20.0)分析3组数据之间(黑色、白色、棕色)的差异表达基因。使用Benjamini & Hochberg法调整P值,将差异表达基因筛选条件确定为经过校正的P值为FDR(False Discovery Rate)小于0.01,且差异倍数FC(Fold Change)大于1。通过cluster Profiler(3.4.4)软件实现差异表达基因的富集分析。将IBM SPSS Statistics 19.0软件用于数据分析,用t-test分析检验候选基因在黑色、白色和棕色牦牛中的表达差异性;P<0.05为差异显著。
2 结果与分析
2.1 测序数据质量控制
本研究共产生了57.57Gb Clean Data,数据质量情况见表1。由表1可知,黑色、白色、棕色牦牛中的GC含量均高于48%,Q30均在93%以上,说明测序正确率较高,可用于后续分析。
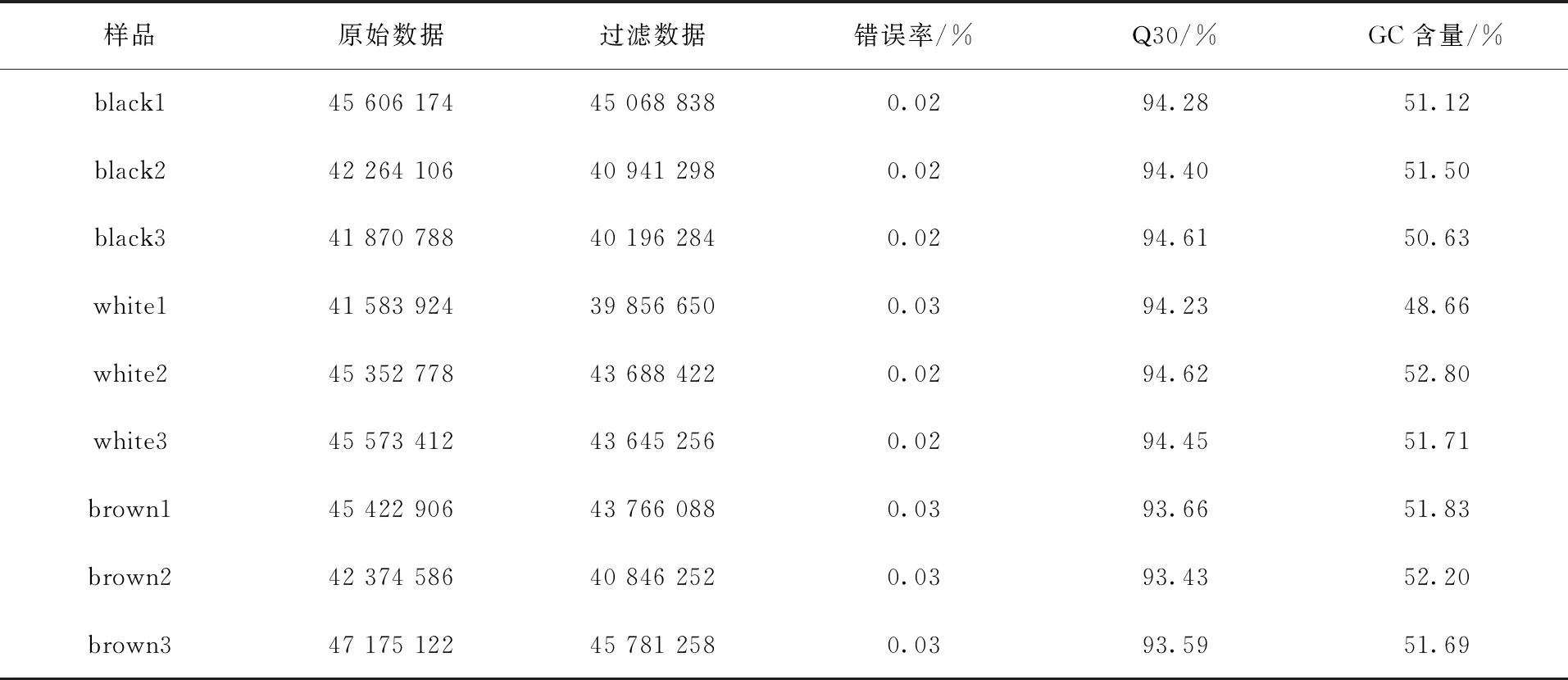
表1 数据质量情况一览表
2.2 转录组数据与参考基因组的比对
黑色、白色、棕色牦牛的reads与黄牛参考基因组的匹配率均在84%以上,表明测序数据良好,详细的比对结果见表2。

表2 Reads与参考基因组比对
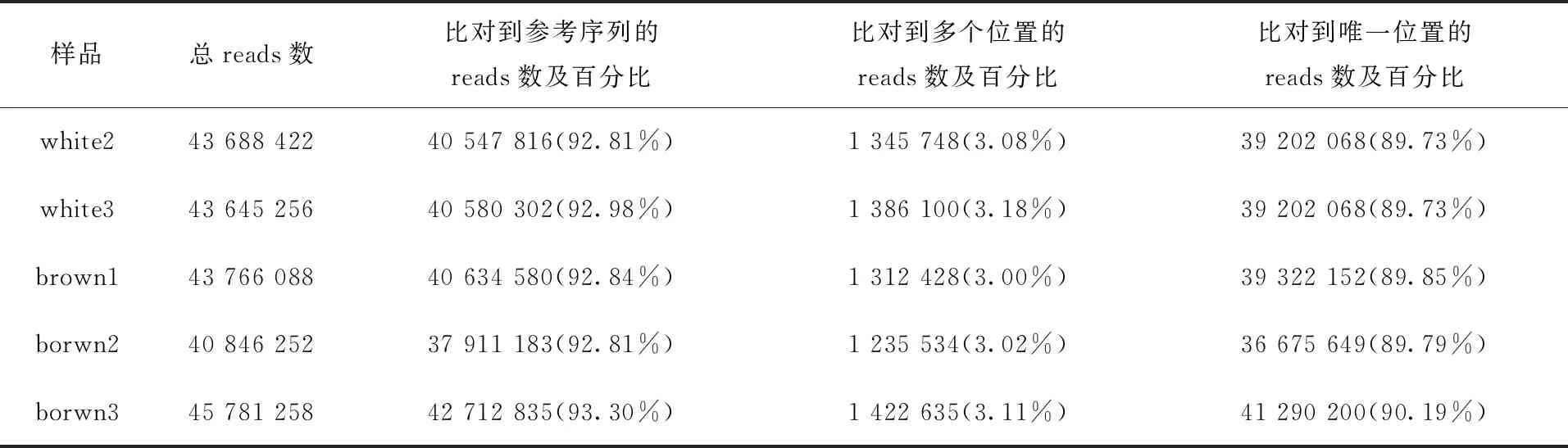
表2(续)
2.3 基因表达水平分析
为排除因为基因长度、测序深度等因素造成的干扰,一般通过FPKM值对不同样品组数据进行标准化处理,从而反映基因的表达水平。图1为不同样品基因表达量FPKM的箱线图和密度分布图。分析FPKM箱线图(图1a)得知,各组基因表达量的分布基本一致,未出现较大波动,提示样品处理正常。同时FPKM密度分布图(图1b)也显示,各组样本的密度分布曲线的趋势较为一致,能够正确反映不同表达量的基因的占比情况。
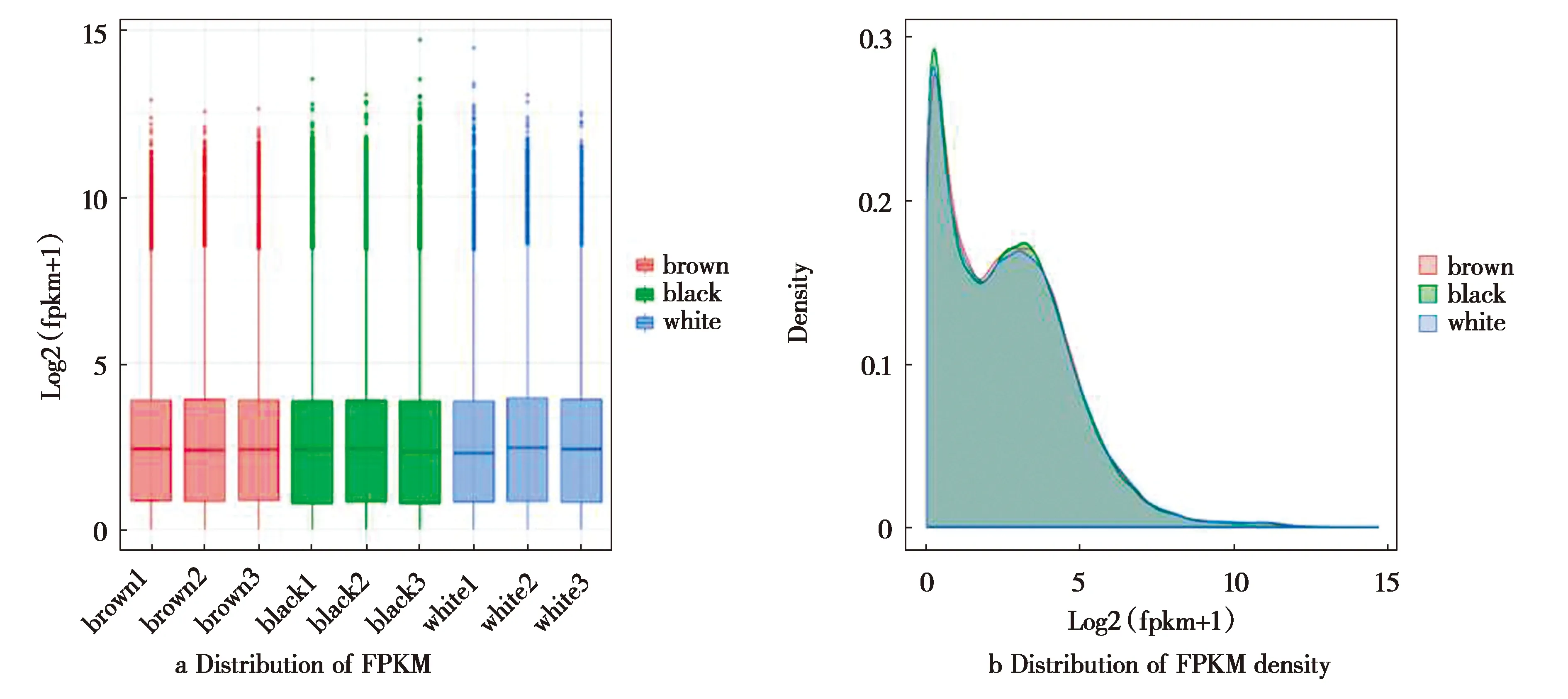
图1 不同样品基因表达水平比对图
2.4 差异表达基因分析及KEGG通路富集分析
3种毛色牦牛差异表达基因及KEGG通路富集情况见图2。由图2a可以看出,经过对白色牦牛和黑色牦牛基因差异性表达分析,共得到426个差异表达基因,其中上调基因259个,下调基因167个;经过对白色牦牛和棕色牦牛基因差异性表达分析,共得到246个差异表达基因,其中上调基因126个,下调基因120个;经过对黑色牦牛和棕色牦牛基因差异性表达分析,共得到4 230个差异表达基因,其中上调基因1 995个,下调基因2 235个。在3个对比中,黑色牦牛与棕色牦牛转录本的差异巨大,表明黑色牦牛与棕色牦牛毛色调控机制更加复杂。
图2b显示白色牦牛和棕色牦牛差异表达基因主要富集在酪氨酸代谢通路。图2c显示白色牦牛和黑色牦牛差异表达基因主要富集在药物代谢—细胞色素P450通路和酪氨酸代谢通路。图2d显示黑色牦牛和棕色牦牛差异表达基因主要富集在鞘脂代谢通路、不饱和脂肪酸的生物合成以及花生四烯酸代谢通路。酪氨酸代谢与黑色素的合成相关,白色牦牛与黑色牦牛及白色牦牛与棕色牦牛差异表达基因富集在酪氨酸代谢通路中,分别为TYRP1、TYR、ALDH3A1以及AOX4。
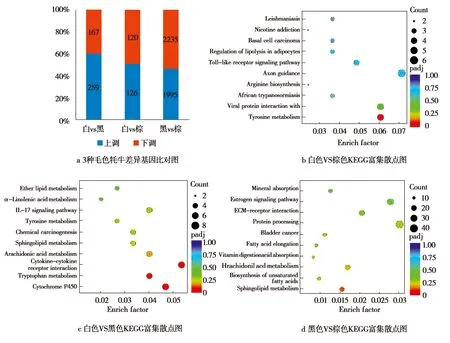
图2 3种毛色牦牛差异表达基因及KEGG通路富集散点图
2.5 牦牛毛色候选基因筛选
为了筛选与毛色相关的基因,根据已知的644个毛色基因,从白色牦牛与黑色牦牛对比的差异表达基因中筛选到19个与毛色相关的基因,分别为PMEL、TYRP1、MLANA、MC1R、TYR、SLC45A2、TRPM1、SLC24A5、OCA2、KCNJ13、GPR143、PCBD1、HSP90B1、PKNOX1、FIG4、IRF4、SOX10、LRSAM1、HSD3B1,其中FIG4、LRSAM1、HSD3B1基因在白色牦牛中呈显著高表达,其余基因均呈显著低表达;白色牦牛与棕色牦牛比对发现,16个与毛色相关的基因,分别为PMEL、TYRP1、MLANA、TYR、TRPM1、MC1R、SOX10、SLC24A5、OCA2、SLC45A2、SHH、KCNJ13、GPR143、PAX3、DIO2、MDN1,其中SHH、DIO2、MDN1在白色牦牛中呈显著高表达,其余基因均呈显著低表达;黑色牦牛与棕色牦牛比对发现,SLC7A11、COL17A1、KRT5、等138个基因与毛色相关。对3个比对组的共有基因进行分析的Venn图结果显示(图3),白色牦牛比黑色牦牛、白色牦牛比棕色牦牛两个比对组共有45个基因,其中与毛色相关的基因有12个,分别为PMEL、TYRP1、MLANA、MC1R、TYR、SLC45A2、TRPM1、SLC24A5、OCA2、KCNJ13、GPR143、SOX10;白色牦牛比黑色牦牛、黑色牦牛比棕色牦牛共有313个基因,其中与毛色相关的基因有8个,分别为PCBD1、HSP90B1、PKNOX1、FIG4、IRF4、SOX10、LRSAM1、HSD3B1;白色牦牛比棕色牦牛、黑色牦牛比棕色牦牛共有177个基因,其中与毛色相关的基因有4个,分别为SOX10、SHH、DIO2、MDN1;3个比对组共有9个基因,与毛色相关的基因为SOX10。
酪氨酸代谢通路在白色牦牛与棕色牦牛以及白色牦牛与黑色牦牛中均有富集,且该通路与黑色素形成相关。经过分析发现,TYRP1、TYR、ALDH3A1、AOX4及SOX10基因在3种毛色牦牛中表达量FPKM值如图4所示。TYRP1和TYR基因在棕色牦牛与黑色牦牛之间无显著差异,但在白色牦牛中显著低表达。而AOX4及ALDH3A1基因在白色牦牛中高表达,在黑色牦牛与棕色牦牛中低表达。SOX10调控黑色素细胞数量以及分布,其在黑色、棕色及白色牦牛中均有表达,在棕色牦牛中表达最高,在黑色牦牛中表达次之,在白色牦牛中表达最低,该基因的不同表达丰度对于牦牛毛色可能具有调控作用。
3 讨论与结论
本研究对相同发育阶段3种常见的纯色牦牛的皮肤组织在转录组水平进行研究,较全面地分析了不同毛色牦牛皮肤组织的基因表达差异。结果发现黑色牦牛和棕色牦牛之间的差异表达基因远多于黑色牦牛和白色牦牛及白色牦牛和棕色牦牛之间的差异表达基因。同时也发现,白色牦牛与黑色牦牛及白色牦牛与棕色牦牛差异表达基因在酪氨酸代谢通路中均有富集,分别为TYRP1、TYR、ALDH3A1及AOX4基因,这四种基因在3种毛色牦牛中表达量的差异可能是引起毛色不同的原因。
真黑色素的合成与TYR、TYRP1及DCT(TYRP2)的活性相关,而褐黑色素的合成受到TYR活性及半胱氨酸浓度的共同调控[14]。本研究结果中TYR和TYRP1基因在3种毛色牦牛中的表达量为白色牦牛<棕色牦牛<黑色牦牛,该结果印证了上述观点。Zhang等[12]研究表明棕色牦牛毛色与TYRP1调控不相关,是由PMEL(p.Leu18del)及MC1R(p.Gln34*,p.Met73Leu和p.Arg142Pro)基因隐性突变导致。本研究结果显示PMEL及MC1R基因在白色牦牛和棕色牦牛中均有表达,且在棕色牦牛中的表达量高于白色牦牛,与Zhang等[12]的研究结果一致,但牦牛棕色毛色是由单基因还是多基因调控需进一步探讨。有关猫科动物的研究认为[15],金色老虎毛色的形成是CORIN蛋白(p.H587Y)突变所致,然而该突变位点在牛中未检测到。对绵羊转录组的研究结果显示,浅棕色绵羊MLANA基因表达量显著高于白色绵羊[16],该基因在牦牛中也有同样的表达模式。SOX10基因是黑色素细胞的标记物,可以调控黑色素细胞的增殖[17-18]。在本研究中,SOX10基因在不同毛色牦牛中均有表达,在棕色牦牛中表达最高,在黑色牦牛中表达次之,在白色牦牛中表达最低。据此推测,棕色牦牛中SOX10基因的高表达促进了成黑色素细胞的增殖,同时TYR基因的高表达促进了褐黑色素的生成,导致了牦牛棕色毛色的形成。
白毛色在家畜中普遍存在,其形成分为色素合成受阻和成熟黑色素细胞缺失两类。Liang等[19]在白水牛中发现一个LINE-1转座子,位于ASIP基因上游并发挥作用,使白水牛ASIP基因表达量增加,进而导致白水牛皮肤和毛发中黑色素表达减少。本研究发现,ASIP基因在黑色、白色以及棕色牦牛间无显著差异。有研究表明白色牦牛的黑色素细胞发育完整,但在白色牦牛表皮基底层中基本检测不到黑色素[20],可能是由于苯丙氨酸羟化酶的缺失致使酪氨酸合成发生障碍,而出现白色表型[21]。具有黑色条纹的白色老虎由于SLC45A2蛋白(p.Ala477Val)隐性突变导致黑色素合成过程受阻,最终形成白色[22]。在雪虎中,同时检测到CORIN蛋白(p.H587Y)、SLC45A2蛋白(p.Ala477Val)双突变[15]。但在牛或其他物种中并未检测到此突变。黑色素的合成底物为酪氨酸,酪氨酸代谢通路中的AOX4及ALDH3A1基因在白色牦牛中高表达,而在黑色牦牛与棕色牦牛中低表达,表明这两个基因的高表达在白色牦牛毛色中发挥着重要作用。在本研究中也同时检测到白化基因MC1R、TYR在白色牦牛中表达量极低,但已有研究报道MC1R、TYR基因与白色毛色不相关[23]。有研究发现[24]TRPM1基因的功能是指导黑色素细胞向皮肤、毛囊迁移分化,并且TRPM1基因的表达减少与黑色素合成受阻有关,白色牦牛中TRPM1基因的表达降低可能干扰了黑色素体的迁移,由此推测酪氨酸代谢通路受阻是导致白色牦牛毛色形成的重要原因。
综上所述,本研究对3种毛色的牦牛皮肤进行了转录组测序,发现黑色、白色及棕色牦牛转录本差异巨大,在酪氨酸代谢通路上显著富集。同时筛选到牦牛中与毛色相关的差异表达基因,这有助于对牦牛毛色调控主效基因的筛选。
