高中化学主题式实验活动课的实践探索
2022-05-30王曼儿陈菲菲郭大俊
王曼儿 陈菲菲 郭大俊

摘要:本节实验活动课,以“模拟工业流程题中除铁的过程”为教学主题情景,依托数字化实验手段,利用问题导学,启发学生自主实验探究,解决高中化学测定铁离子、亚铁离子的沉淀范围的教学难点,将工业流程题中除铁的过程可视化,落实学生学科核心素养的培养。
关键词:主题式教学;自主实验探究;问题导学;化学核心素养
文章编号:1008-0546( 2022)12x-0017-05
中图分类号:G632.41
文献标识码:B
doi: 10.3969/j .issn.1008-0546.2022. 12x.004
《普通高中化学课程标准(2017年版)》(以下简称新课标)明确提出,必修课程内容依据主题组织,提高课程实施的整体性,倡导基于学科核心素养实施主题式教学。[1]主题式教学是围绕某主题,让学生借助各种探究活动以及与主题相关的各种资源,使学生的认知发生迁移,提高学生解决问题的能力以及科学探究精神的有效教学方式。[2]主题式教学的实施,是落实发展学生学科核心素养的教学目标的必要途径,有利培养学生的综合能力和终身学习习惯,有利改进教师的教学行为,促进教师的专业化发展。
通过调节pH进行工业废水中除铁元素的考察是高考热点之一。对于Fe2+、Fe3+与NaOH溶液反应的沉淀pH范围的判定,教材中利用Kp进行理论计算可得,该知识点本身不难,但大部分学生仍难以接受三价铁元素在溶液酸性仍为较强的条件下即与氢氧根结合沉淀完全的计算结果,对于工业废水中除铁的相关问题更仅限于纸上谈兵,缺乏客观实验事实依据。
数字化实验有着微型、便捷、绿色、直观等优势,广受中学化学教学研究者的青睐,特别在2011年各地高考出现相关命题后,已成为中学化学实验课堂的研究热点之一。
四重表征法是宏观一微观一符号一曲线四种维度的表征方式,能够给学生提供对化学实验进行分析的有序指引,促进学生对化学实验多层次、多维度的表征能力的发展。[3]
本节实验活动课是基于人民教育出版社(2017版)高中化学选择性必修1第三单元第四节“沉淀溶解平衡”一课中关于“沉淀溶解平衡的应用”的深度延伸,以“模拟工业流程题中除铁元素的过程”为教学主题情景,依托数字化实验手段,通过V(NaOH溶液)-pH滴定曲线可视化呈现,应用四重表征分析,利用问题情景导学,启发学生自主实验探究,解决高中化学测定铁离子、亚铁离子沉淀范围的教学难点,模拟工业流程除铁元素的生产实际,落实学生化学核心素养的培养。
一、教学流程整体设计展示
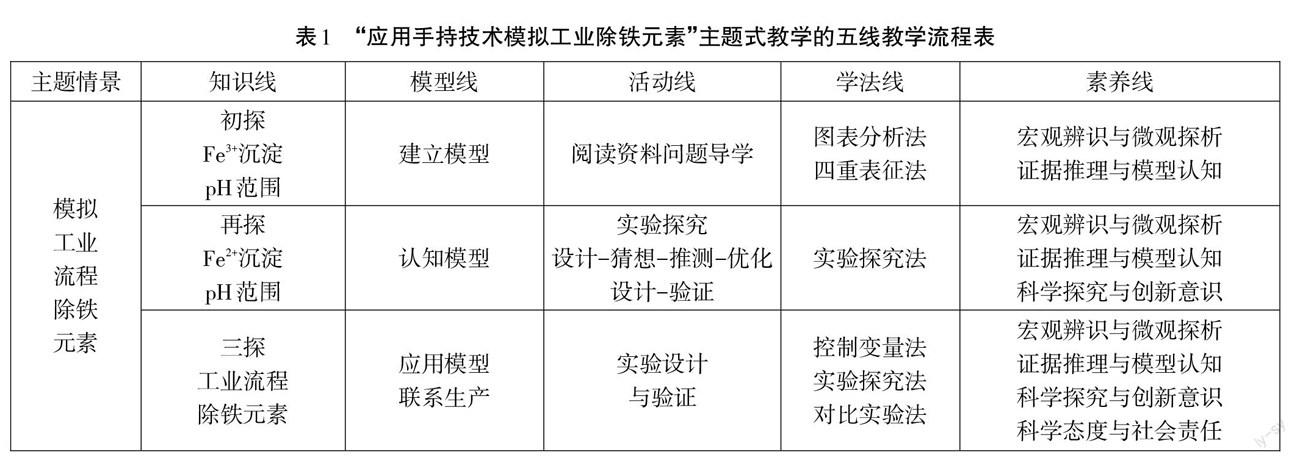
本课主要教学流程如表1所示。
教学重点:实验法测定Fe2+、Fe3+与NaOH溶液反应的沉淀pH范围
(“V(NaOH溶液)-pH曲线”与沉淀关系的模型建立与应用)
教学难点:模拟工业流程除铁元素的实验设计
二、教学片段展示与分析
1.实验法初探Fe3+与NaOH溶液反应的沉淀pH范围
[学生活动]课前阅读资料1,思考以下问题:
材料1:小王在做工业流程题时,在信息表格里看到Fe3+理论沉淀范围pH为2.2-3.2,他很是疑惑:在酸性比较强的环境下,Fe3+如何沉淀完全?他经过Ksp理论计算,确实可得该理论数据,但是没有客观事实依据,他总是不断质疑。于是,他的老师做了以下实验:测定Fe3+与NaOH溶液反应的沉淀pH范围。实验装置如图1所示。
向50 mL 0.02 mol/L FeCl,溶液(用盐酸调节pH为1.5- 1.7)逐滴加入0.1 mol/L NaOH溶液。具体操作为:取用0.1 mol/L NaOH溶液润洗50.00 mL滴定管,往滴定管中加入0.1 mol/L NaOH溶液。量取50.00 mLFeCl3溶液于250 mL燒杯中备用。调试传感器,设置数据采集频率为ls/次。如图1所示连接实验装置,开启磁力搅拌器,点击采集数据按钮,观察记录烧杯中溶液和沉淀的颜色变化。当体系pH稳定之后,开始滴加NaOH溶液。实验完成,得到如图2所示实验数据。
问题1:通读材料,联系图2曲线与表2中信息,完成表2中(1)、(2)、(3)空白处。
问题2:实验1测定的Fe3+沉淀范围是
。对比理论计算该实验Fe3+理论沉淀范围pH为2.2~3.2,[4]可证明该实验方法可用于判定Fe3+沉淀范围。
问题3:思考pH-V(NaOH)曲线中,拐点与平台的意义,建立从曲线获取沉淀范围的模型?
设计意图:通过问题1和问题2引导学生自主阅读文献材料和图表分析,pH为2.20-3.03时,宏观实验现象出现沉淀、pH变化趋于平缓、微观粒子在3.03之后不再有Fe3+,可得所发生的主要反应为(1)HCl+NaOH=NaCl+H2O、(2) FeCl3+3NaOH=Fe( OH)3↓+3NaCl、(3) HCl+NaOH=NaCl+H20;可得Fe3+沉淀范围是2.20-3.03,符合理论值,验证该实验方法的科学性。通过问题3引导学生观察曲线拐点和平台,分析可得溶液中与NaOH反应的离子有H+、Fe3+:在曲线上升期时,为酸碱中和阶段;在曲线为平缓段时,为Fe3+沉淀阶段。进而引导学生自主小结建立通过pH-V(NaOH)曲线获取沉淀范围的新知模型:平台两端拐点,即为Fe3+开始沉淀和沉淀完全的标志,平缓段即沉淀范围。
本教学环节设计于课前进行,让学生有充足的时间进行通读陌生材料,处理陌生图表信息。该信息材料有着“人口难,出口易”的特点,表面上看文献资料深奥难懂,进而在层层递进的简单问题串推动下,逐一攻破,逐步形成新知模型。该设计着眼于克服学生遇到新材料新信息的排斥心理,培养学生信息获取能力,通过四重表征学习法提升学生宏观辨识与微观探析、证据推理与模型认知的核心素养。
实验1通过“宏观一微观一符号一曲线”四重表征的形式,直观呈现Fe3+与NaOH反应历程,将“沉淀范围”这一理论知识进行可视化处理,用客观实验事实为学生释疑。
2.实验法二探Fe“与NaOH溶液反应的沉淀pH范围
问题4:参考材料1的实验方案,小组讨论设计课堂实验,测定Fe2+与NaOH溶液反应的沉淀pH范围,并猜想预测pH-V(NaOH)实验曲线特征。
学生1:仅更换0.02 mol/L FeCl3溶液(用盐酸调节pH为1.5-1.7)为0.02 mol/L FeSO4溶液(用硫酸调节pH约为2.4),其他操作保持不变。
学生2:预测pH-V(NaOH)实验曲线将仅出现一个pH数值在7.4-8.3(理论值)的平台,即为Fe2+与NaOH溶液反应的沉淀pH范围。
学生3:预测可能会有2个平台出现,分别是Fe2+、Fe“与NaOH溶液反应的沉淀pH范围。
学生4:哦,那是因为Fe2+容易被氧化为Fe3+。
学生5:那我们进行实验优化,开展两组实验对比,另一组添加维生素C防止Fe2+发生氧化反应。
选派一个四人小组按实验方案进行课堂实验展示,将实验现象与曲线表征在电教屏幕上进行全班直播。
问题5:请仔细观察、对比实验2、实验3的实验现象和曲线特征,小组讨论,完成表4、表5四重表征。
问题6:观察图3所示实验2的曲线,学生2和学生3哪个推测正确?对比实验2和实验3的四重表征,可得测得Fe2+的沉淀范围为____。
问题7:对于实验法测定Fe2+的沉淀范围的操作,有何注意事项?
设计意图:通过问题导学,引导学生设计实验一猜想实验一推测实验一优化实验一验证实验的自主实验探究历程,本实验利用pH-V(NaOH)曲线获取沉淀范围的新知模型,可得实验2曲线出现两个沉淀平台,分别为pH为7.73-8.49、2.00-2.71的平台,对比理论值,结合实验现象,可知分别是实验测得的Fe2+、Fe2+的沉淀范围;图4所示实验3加入维生素C仅出现一个pH为7.36-8.08的平台,对比Fe2+的沉淀理论值pH为7.4-8.3.[5]结合现象出现灰绿色沉淀,可知该平台为Fe2+的沉淀平台;对比实验2,加入维生素C后Fe3+沉淀平台几乎消失,说明维生素C有效防止Fe2+被氧化,因此测定Fe“的沉淀pH范围,需要添加还原剂进行防氧化。
通过小组讨论完成四重表征,培养学生宏观辨识与微观探析的素养;本实验利用pH-V(NaOH)曲线获取Fe2+的沉淀范围,巩固新知模型的认知,培养学生证据推理与模型认知的核心素养;在学生自主讨论、自主设计并优化实验等实验探究学习法的实践,培养学生科学探究与创新意识。
3.实验模拟工业流程除铁元素
问题8:以4人小组为单位,以材料1的实验试剂,完成工业废水中除铁元素的实验模拟并验证其有效性。( 25.00 mL 0.02 mol/L FeS04和25.00 mL 0.02 mol/LFeCl,的混合溶液模拟为工业废水)
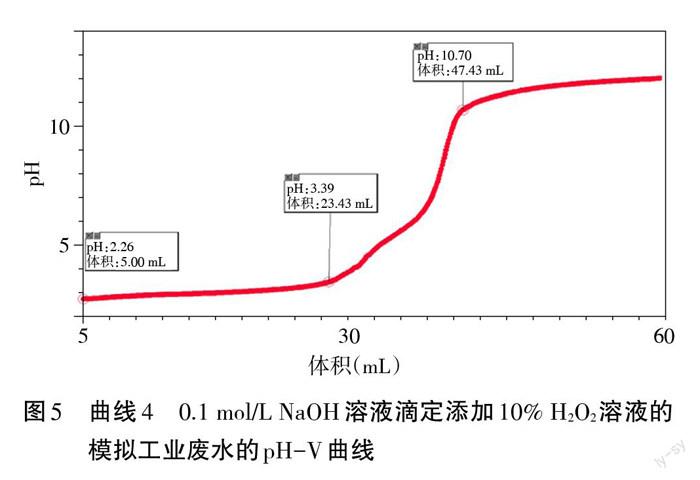
学生:开展实验4模拟工业废水除铁,应选择试剂:模拟工业废水溶液,添加10滴100-/0 H202溶液进行氧化,再逐滴加入0.1 mol/L NaOH溶液,得到的pH-V(NaOH溶液)曲线4。
为了实验科学严谨,再开展实验5作为空白参照组,不加10滴10% H202溶液。此时需要控制变量,实验5需要增加10滴去离子水,保持实验4和实验5的铁元素浓度一致。
学生按表6实验方案实验,并将实现现象和曲线展示在电教屏幕上。实验结束思考问题9和问题10。
问题9:已知棕黑色沉淀为Fe( OH)3沉淀和Fe (OH)2沉淀混合的颜色。实验4和实验5的曲线分别得到哪些平台?
问题10:对比实验1和实验4,对比实验4和实验5,分别可获取什么结论?
设计意图:通过问题引导,启发学生观察实验5出现两个pH平台,实验测得Fe3+的沉淀范围是pH为2.35-2.87,基本符合理论值;Fe2+的沉淀范围是pH为6.14-7.49,与理论值(7.4-8.3)较为符合。经添加H202处理后的实验4曲线,仅出现一个pH为2.26-3.39的沉淀平台,结合现象为红褐色沉淀,可得该平台为Fe3+的沉淀范围。
问题引导启发学生对比实验4、5,发现加入H2O2溶液Fe3+沉淀平台变长,Fe2+沉淀平台几乎消失,铁元素在实验5需pH达7.49才完全除去,在实验4 pH仅达3.39即可,说明添加H2O2处理后,铁元素在pH较低处可被完全除去,符合工业流程中的需求,帮助学生理解工业流程题中铁元素除杂过程。
问题引导启发学生对比实验1、4,发现实验4曲线与实验1曲线基本一致,说明实验4模拟工业流程除铁元素过程的实验比较成功,进一步加深理解除铁过程:混合溶液中Fe2+先被H2O2转化为Fe3+,再进行的Fe3+沉淀反应。
本实验再次利用四重表征,强化宏观辨识与微观探析的核心素养;启发学生应用pH-V(NaOH)曲线获取沉淀范围的新知模型,帮助分析实验历程,培养学生证据推理与模型认知的核心素养;利用对比法、控制变量法等实验方法,提升学生探究与创新意识;实验模拟联系生活生产,体会微型数字化技术的绿色观,培养学生科学态度与社会责任感。
三、教学反思与启示
反应历程可視化。本实验借助数字化技术,通过图表和数据直观、定量地呈现Fe2+、Fe3+与NaOH溶液反应时溶液pH的变化情况,将反应过程可视化,解决课本中理论计算沉淀范围,缺乏客观事实直观体验的教学难点。
探究实验新优化。本节课中三个实验的学习深度与自主探究程度具有递进性。实验1为完整实验方案的文字材料呈现,着力培养学生获取新信息和自主建立新知模型的能力;实验2以小组实验探究呈现,完整贯穿“实验猜想一实验预测一讨论一实验优化一实验验证”五个实验探究环节,着力培养实验探究能力;实验3以小组实验设计呈现,通过对比法、控制变量法等常见的实验手段,模拟工业流程除铁元素并验证其有效性。
主题内容问题化。本节课紧紧围绕“模拟工业流程除铁元素”为情景,分为三个子主题进行探索:测定Fe3+与NaOH溶液反应的pH沉淀范围;测定Fe2+与NaOH溶液反应的pH沉淀范围;模拟工业流程除铁元素(即测定Fe2+、Fe3+混合溶液与NaOH溶液反应的pH沉淀范围)。三个子主题的学习过程,均用环环相扣的问题串引导自主学习、自主实验,逐步深化。
陌生信息方法化。在pH-V(NaOH)曲线获取沉淀范围的新知模型学习上,先通过实验1进行信息获取新知的方式,总结拐点、平台的规律,建立模型;再通过实验2加深认知模型;最后通过实验3应用模型,验证生产中实际的问题——用H2O2溶液进行工业除铁的有效性。整个教学设计通过层层递进的问题串,帮助学生完整经历建立模型—认知模型一应用模型的知识构建过程,培养学生深度学习的能力,真正做到授之以鱼,不如授之以渔。pH-V(NaOH)曲线本身非高中阶段必学图表,相对于知识点本身而言,本节课更侧重于培养学生对于陌生信息、陌生图表的信息获取,帮助学生在考试中遇到陌生图表的分析问题能力的提升。
知识运演结构化。本节课选用四重表征进行实验分析,利用四重表征的有序思维和内在关联,引导学生对实验宏观现象、微观粒子与反应、图像表征等多角度的信息进行有序思考与内在对应关系的梳理,进而推进知识运演结构化。
参考文献
[1] 陈凯,陈悦.《普通高中化学课程标准(2017年版)》的文本挖掘[J].化学教学,2019(4):7-12.
[2] 肖平.基于主题教学的教学设计应用研究[D].上海:华东师范大学,2006.
[3]吴荣华,孙彦雁,李京津,等.基于手持技术及虚拟实验的四重表征模式构建及评估[J].中国现代教育装备,2021(22):7-9,17.
[4] 温美凤,钱扬义.应用手持技术测定氯化铁溶液与氢氧化钠溶液反应的pH曲线[J].化学教育(中英文),2017,38(17):50-56.
[5] 温美凤,钱扬义.硫酸亚铁及氯化铁与硫酸亚铁混合溶液与氢氧化钠溶液反应的沉淀pH曲线的测定及分析[J].化学教育(中英文),2018,39(03):69-75.
