基于数字化实验进行Fe3+ 催化H2 O2分解机理探究
2022-05-30陈林袁君亚
陈林 袁君亚

摘要:围绕Fe3+催化H2O:分解反应机理的探索,设计3个学习任务。首先,实验取证Fe3+/Fe2+与H2O2循环反应的宏观事实:其次,理论分析Fe“催化H2O2分解的微观机制;最后,通过降解生物染料龙胆紫的实验,感受芬顿技术在降解有机废水中的应用价值。通过问题解决,增进对催化机理的理解和跨学科知识的融合,提升科学探究能力,培养绿色化学观念。
关键词:催化机理:实验探究:芬顿反应;绿色化学;跨学科
文章编号:1008-0546(2022)12x-0012-05
中图分类号:G632.41
文献标识码:B
doi: 10.3969/j .issn.1008-0546.2022. 12x.003
2019年版新教材选择性必修1《化学反应原理》(人教版)探究栏目中,以铁离子催化过氧化氢分解作为研究对象分析影响化学反应速率的因素;…当过氧化氢溶液中滴人少许FeCl溶液后,除气泡显著加快以外,还发现体系颜色由黄色很快变成红棕色,最后又变成黄色。这一异常现象引人思考:催化剂与反应物之间到底发生什么变化,Fe3+催化H2O2分解的反应机理是什么?
一、催化机理文献综述
一般认为,Fe3+、Fe2+能加快H2O2分解反应是基于产生活泼性很强的游离基所致。其中Fe3+与H2O2反应产生强氧化性的羟基自由基(.OH)的过程被称为类一Fenton反应。[2,3]
1.类-Fenton反应
类-Fenton反应的机理分为3个阶段:首先,Fe3+发生水解;其次,Fe“及其水解产物与H2O2形成过渡络合物Fem(HO2)2+和Fem(OH) (HO2)+,过渡络合物再分解产生Fe2+和HO2.;最后,Fe2+与H2O2反应产生.OH,发生典型的Fenton反应阶段。
2.Fenton反应
1893年,化学家Fenton(中文译为芬顿)发现H2O2与Fe2+的混合溶液具有强氧化性,可以将当时很多已知的有机化合物氧化为无机态,氧化效果十分显著。[4]进入20世紀70年代,芬顿试剂被广泛应用于去除废水中难降解的有机污染物;近年来,芬顿技术还被应用于微量药物类污染物的深度处理以及病原微生物杀灭等研究。[5]研究表明,Fenton反应中存在大量复杂的中间反应,其中最被广泛接受的为Fe2++H2O2→Fe3++ OH+.OH,即Fe2+与H202反应生成羟基自由基(.OH),羟基自由基具有强氧化能力和高电负性,除经多步基元反应产生O2外,还可以将大多数有机污染物快速且无差别地氧化为二氧化碳和水。[5]
二、教学分析
1.课程目标分析
课程标准对选择性必修有关催化剂对化学反应速率影响机理的内容要求:结合具体实例使学生“知道化学反应是有历程的,认识基元反应、活化能对化学反应速率的影响”“知道催化剂可以改变反应历程,对调控化学反应速率具有重要意义”;并提出情境素材建议“催化剂研究与诺贝尔奖,温度改变和活化能改变对化学反应速率的影响数据”。[6]但教材中关于基元反应、活化能、催化机理与反应速率之间的关系除去理论描述外,缺乏具体例子或数据的支撑,造成学习如同囫囵吞枣,理解起来相当费力。
2.学生情况分析
初中时,学生知道了使用MnO2催化过氧化氢分解来制取O2,由于过度强调催化剂的组成、化学性质和质量在反应前后不发生变化,导致学生认为催化剂并没有参与反应。《化学反应原理》指出,催化剂能加快化学反应速率的机制,在于能改变反应历程,降低活化能,[1]但这种理论论述因缺乏例子的支撑,显得空洞乏力,并不能起到纠正学生原有错误概念的作用。当学生捕捉到过氧化氢溶液中滴入FeCl3溶液后、体系颜色发生异常变化时,笔者以为正是开展催化机理教学的切入口。
3.教学价值分析
以Fe3+催化H2O2分解的反应机理作为课题实施教学,一方面能深化学生对催化机理的认识、拓展科学视野;另一方面,中学实验中存在直接排放有机污染物的普遍现象,特别是以苯、硝基苯等为代表的芳香族化合物(含生物学常用染色剂苯酚品红、龙胆紫等),高毒、难降解,易造成水体严重污染,指导学生运用芬顿技术降解实验中产生的有机废液,彰显化学的实用价值。
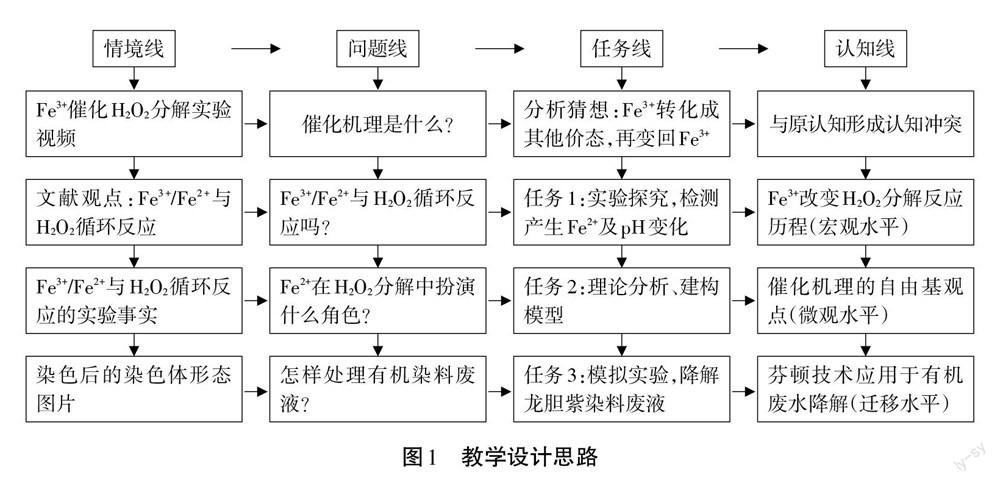
三、教学设计思路
Fe3+催化H2O2分解反应机理的复杂性和学生错误前概念并存,双重挑战使得教学设计困难重重。将文献中反应机理直接“科普”给学生,并不能有效纠正学生原有的错误认知。所以需要对收集到的文献资料、情景素材进行深度加工,一方面保留材料的基本观点与主要成果;另一方面,按照学科核心素养的要求和学生的认知情况及规律去组织课堂教学活动。关于催化机理的主要观点是Fe3+/Fe2+与H2O2循环反应[5]及产生活泼性很强的自由基,[2]据此设计3个学习任务开展实验与理论探究,见图1:
四、教学目标
1.通过实验探究,了解Fe3+ /Fe2+与H2O2循环反应从而催化H2O2分解的事实,丰富催化剂通过改变反应历程、降低活化能来加快反应速率的认识。
2.通过分析“Fe2+在催化H2O2分解反应中扮演的角色”,运用物质结构的理论知识,解释反应的微观机制,促进学科知识的结构化。
3.通过生物学染料龙胆紫的模拟降解实验,促进跨学科知识的融合;了解芬顿技术在降解工业有机废水中的广泛应用,培养绿色化学观念。
五、教学实录
[创设情境、提出问题]播放Fe3+催化H:O:分解的实验视频,分析现象。加入FeCl3溶液后溶液变黄,后颜色逐渐加深,最后变回黄色。提问:Fe3+催化H2O2分解的反应机理是什么?
[学生猜想] Fe3+与H2O2反应转化成其他价态,再变回Fe3+。
任务一:实验探究——收集Fe3+ /Fe2+與H2O2循环反应的事实证据
[文献资料]展示有关Fe3+催化H202分解的反应机制的主要观点如下:
2Fe3++H2O2→2Fe2++O2 ↑+2H+[7]
2Fe2++ H2O2+ 2H+→ 2Fe3++ 2H2O
[问题]这种观点可靠吗?
[师生讨论]检测指标:体系中是否生成Fe2+及pH变化。
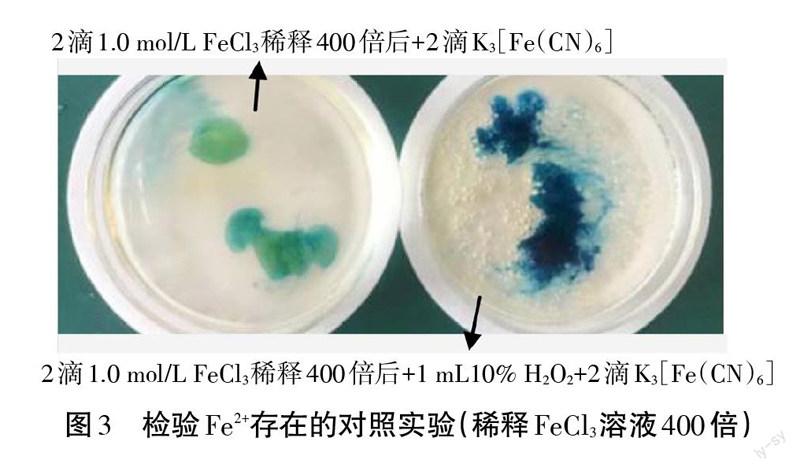
[资料卡]铁氰化钾,化学式K3[Fe(CN)6],红色晶体,水溶液呈黄色,遇亚铁盐则生成深蓝色沉淀(滕氏蓝)。
[学生设计方案1]在点滴板孔穴内滴人1-2滴H2O2溶液,然后滴人1滴FeCl,溶液,再滴人1滴K3[Fe(CN)6]溶液,观察是否有深蓝色沉淀;另一学生补充方案:需要用K3[Fe(CN)6]检验原FeCl3溶液中本身不携带Fe2+,作为对照,见图2(上)。
[学生实施实验,得出结论]FeCl,溶液、Fe3+/H2O2混合体系分别滴人K3[Fe(CN)6]均有深蓝色沉淀。
[教师]由于原FeCL溶液本身携带Fe2+,干扰实验的验证;老师将原溶液稀释400倍,再进行对照实验,实验现象见图3,根据蓝色显著加深证明Fe3+与H2O2反应生成了Fe2+。
[设计方案2]在三颈烧瓶中加入60 mL 15%H2O2,在磁力搅拌器搅拌下,滴人1滴管1 mol/L FeCl3溶液,用pH传感器测量体系pH变化。实验装置及数据结果见图4。
[学生观察演示实验视频、分析数据]解释pH传感器测得的pH-时间图像中各段pH变化的原因。
[学生1]前20 s溶液pH值保持2.47,表明原过氧化氢溶液呈弱酸性;20-23 s,pH直线下降是因为加入FeCl3溶液,因为Fe3+水解呈弱酸性,且配制FeCl,溶液时会加入少许盐酸抑制其水解。
[学生2]从23 s往后,pH先减小后缓慢增大,证明体系中先生成氢离子,后又被消耗了。
[结论]实验证明:Fe3+催化H2O2分解过程中,Fe3+/Fe2+与H207的循环反应,改变了反应历程。
设计意图:通过实验探究Fe3+/H2O2体系中Fe2+的存在和pH变化,获取Fe3+/Fe2+与H2O2的循环反应的事实证据,同时提高学生对照实验方案设计、数据分析、合作实验等科学探究能力。
任务二:证据推理——分析Fe3+催化H2O2分解的微观机制
[问题1]H2O2分解在常温常压下能自发进行吗?
[教师]研究反应进行的方向,分析过氧化氢分解反应的焓变和熵变。
[学生]△HO。故而△G
[问题2]常温常压下,H2O2分解为什么速率缓慢呢?
[教师]H202分解活化能约为220 kj/mol[2],较高。活化能的大小与反应物分子结构相关。
[学生]完成以下任务:(1)写出过氧化氢分子的电子式、结构式,分析空间构型;(2)分析键能数据O-H 464 kj/mol,0-0 146 kj/mol,思考过氧化氢发生氧化还原反应,可能优先断裂哪根键。
[教师]从键能来看,较容易断裂的是O-O键;而两侧的原子团对O-O键中共用电子对的作用一模一样,断键不容易;好比拔河,如果两队力量均衡,要分出胜负总是困难的。
[问题3] Fe2+在H2O2分解反应历程中扮演了什么角色?
[任务]写出Fe2+、Fe3+的外围电子排布式,根据洪特规则判断其性质。(Fe2+:3d6、Fe3+: 3d5半充满,Fe2+易失去1个电子,具有很强的还原性,转化为较稳定的Fe3+)
[教师]Fe“失去的一个电子怎样与H2O2作用呢?
[播放动画]通过电子式来模拟Fe2+失去的一个电子与H2O2作用的过程。
[结论]推理可知:Fe2++ H2O2→Fe3++ OH-+.OH
[问题4]从结构角度分析,羟基自由基(-OH)可能具有什么性质?
[学生]羟基自由基有一个未成对电子,极易得到一个电子,可能具有强氧化性。
[教师]研究表明,羟基自由基在溶液中氧化性极强,其氧化性仅次于氟。[7]羟基自由基在铁催化过氧化氢分解过程中发挥着重要作用。
[科技前沿1]中国科学院研究员谢银德等(2000)研究发现[8]:H202和Fe2+氧化还原中间步骤涉及自由基参加反应,其反应历程由多步基元反应构成,主要如下:
[教师]其中式①反应是基元反应链的引发,在反应历程中起到关键作用;.OH具有很高的活性,寿命短,存在时间仅10-6秒,难以被检测,但已被科学家们证实存在。
[科技前沿2]中国科学院研究员马会民等(2018)通过改造花菁分子合成出荧光探针,可以高效检测H202和Fe2+反应产生的羟基自由基。[9]原理见图5。
[问题5]Fe“最初是如何转化为Fe2+的呢?
[教师]一般认为,金属离子(Fe3+、Fe2+等)能加快H2O2分解反应是基于产生活泼性很强的游离基所致。其中Fe3+与H2O2反应产生强氧化性的羟基自由基(.OH)的过程被称为类- Fenton反应。反应由3个阶段构成,‘31见图6。
[模型建构] Fe3+催化H2O2分解的微观机制是非常复杂的,但是可以形成以下基本观点:1.Fe3+/Fe2+与H2O2循环反应;2.Fe2+与H2O2反应产生的强氧化性羟基自由基(-OH)起到了关键作用,见图7。
[教师] Fe2+与H2O2的反应称为Fenton反应,产生强氧化性羟基自由基(-OH),[8]被广泛应用于去除废水中难降解的有机污染物。
设计意图:通过设计5个子问题,层层深入地引導学生建立化学反应速率一活化能一反应物分子结构之间的关联,从微观结构角度理解催化剂与反应物分子之间的相互作用;结合最新的科技文献资料,建构模型,帮助学生形成Fe3+、Fe2+能加快H2O2分解是基于产生活泼性很强的游离基所致的观点。
任务三:迁移应用——使用芬顿技术降解有机废水的模拟实验
[情境问题]投影显微镜下观察到的染色体形态照片,分别使用龙胆紫、苯酚品红染料染色。实验中产生的染料废液你是怎么处理的?
[教师]阅读资料卡,思考:龙胆紫染料废液能否直接排放?为什么?若不能,什么试剂可以降解龙胆紫呢?
[学生讨论并汇报]因龙胆紫有毒、结构稳定、难以降解,所以不能直接排放;向龙胆紫中滴人H2O2溶液和Fe2+溶液,观察是否褪色。
[教师]很好,同时我们向龙胆紫溶液中滴入等量的过氧化氢溶液,进行比较。
[学生实施实验、汇报现象和结论]当龙胆紫中只滴入H2O2溶液时未褪色,滴人H2O2和FeS04溶液时很快褪色,见图2(下),证明芬顿试剂的氧化性要强于过氧化氢。
[文献]研究表明,羟基自由基具有强氧化性,酸性条件下,可以将常见的有机物无区别地氧化为二氧化碳和水。[5]
[演示实验方案]向圆底烧瓶内依次加入20 mL龙胆紫溶液和5 mL 10%H2O2溶液,塞上瓶塞;在不断搅拌下,用注射器逐滴加入少许0.4 mol/L FeSO4溶液,同时用CO2传感器检验产生气体的成分,图9。
[实验现象与结论]当滴人FeSO4溶液后,CO2传感器测得CO2浓度逐渐增大,证明羟基自由基可将龙胆紫氧化生成二氧化碳。
[科学·技术·应用]简述芬顿反应的科学发现、机理研究和芬顿技术应用的百年历程。
[教师寄语]芬顿技术在环境化学中有着广泛的应用,今天我们学习了如何处理实验中产生的有机废水,保护我们身边的水资源是我们共同的责任,期待从你我做起。
设计意图:通过芬顿反应降解生物学染料龙胆紫的模拟实验,感受羟基自由基的强氧化性,体验芬顿技术在有机废水降解中的应用价值,促进知识的跨学科融合,培养综合素养和绿色观念。
六、教学反思
通过查阅文献,笔者发现Fe3+催化H2O2分解的反应机理较为复杂,怎样才能将蕴含催化机理的众多真实情境素材转化为一节扎扎实实的“化学课”呢?
1.去粗取精——聚焦真实情境素材的核心主题
笔者采取主题式学习模式,围绕Fe3+催化H2O2分解反应机理的探索,从学生的认知情况和学科素养要求出发,认真剖析真实情境素材(文献、实验、图表、图片等),梳理文献有关催化机理的基本观点,发现其包涵2个要点:一是Fe3+/Fe2+与H2O2循环反应;二是产生的活泼性很强的自由基加快了H2O2分解,因而探究过程的设计围绕这2个要点而展开。
2.由表及里——基于学科思维关联学习大任务
与催化机理的2个要点相对应,学生认知存在2种水平:认识Fe2+为中间产物的宏观水平及自由基观点的微观水平,据此设置3个学习任务:实验探究收集Fe3+/Fe2+与H2O2循环反应的宏观事实;理论分析Fe3+、Fe2+与H2O2作用形成羟基自由基的微观过程;最后使用芬顿试剂模拟降解生物学染色剂的实验,间接验证自由基的存在。通过对反应机理由表及里的深入剖析,不仅促进了学科知识的内部关联;而且促进了知识的跨学科融合,认识科学发展、技术进步与环境保护之间的密切联系。
3.问题驱动——细化真实问题为有序的问题链
本节课围绕“Fe3+催化H2O2分解的反应机理是什么”和“怎样处理生物学染料废液”2个真实问题,依托化学物质结构理论、化学反应原理的知识,设计层层深入的问题链,引发基于学科思维的深度思考,提升学生对催化机理的认识水平,促进学生高阶思维和综合实践能力的发展。
参考文献
[1]人民教育出版社,课程教材研究所,化学课程教材研究开发中心.普通高中教科书(化学选择性必修1)[M].北京:人民教育出版社,2019:24-27.
[2] 于客峻.Fe3+催化H:0:分解的实验探究[J]化学教学,2014(10):53-55.
[3]王春.借助手持技术探究外界条件对三价铁离子催化过氧化氢分解的影响[J].化学教育(中英文),2022,43(9):86-89.
[4]赵启文,刘岩.芬顿(Fenton)试剂的历史与应用[J].化学世界,2005(5):319-320.
[5] 陈撰,嵇家辉,冉茂希,邢明阳,无机助催化(类)芬顿反应降解有机污染物的研究进展[J].环境科学研究,2021,34(12):2787-2797.
[6] 中华人民共和国教育部.普通高中化学课程标准(2017年版)[M].北京:人民教育出版社,2017:90-92.
[7] 陈凯,赵钧若,陈昌云.芬顿反应的原理和微型实验[J].中学化学教学参考,2010,(10):40-41.
[8]谢银德,陈锋,何建军,赵进才.Photo-Fenton反应研究进展[J].感光科学与光化学,2000,18 (4):357-365.
[9] 雨回.Angew:荧光探针检测铁自氧化产生的羟基自由基[EB/OL],2018(09):07.
