晶状体发育过程中细胞器降解及其机制的研究现状
2022-05-27马婧宇综述李金燕陈奕嘉欧阳帅罗莉霞审校
马婧宇 综述 李金燕,陈奕嘉,欧阳帅,罗莉霞 审校
(中山大学中山眼科中心,眼科学国家重点实验室,广东省眼科视觉科学重点实验室,广州 510060)
白内障是世界首位的致盲眼病[1],其最基本的病理变化为高分子量(high-molecular weight,HMW)蛋白聚集或晶状体微结构破坏,可由异常的晶状体发育分化过程导致,而参与这些过程的基因突变引致严重蛋白损害会导致先天性白内障的发生,基因突变或环境因素引致较温和的蛋白损害则与年龄相关性白内障有关[2]。晶状体细胞器降解过程是贯穿晶状体整个生命周期的重要生理过程,该过程的异常可导致晶状体微结构破坏,与先天性及年龄相关性白内障的发生均密切相关。探索晶状体细胞器降解的机制,以期为白内障的干预提供理论基础。
脊椎动物成熟的晶状体无血管,由单层的晶状体上皮细胞、伸长的晶状体纤维细胞及包绕在其周围的晶状体囊构成[3],屈光和调节是晶状体的生理功能[4],透明性是其生理功能的基础。在物理学上,生物组织维持透明需要最大程度减少光的散射,而光散射主要取决于光程长度及细胞器[5]。晶状体的组织特性可最大程度减少光散射,其中最重要的即为晶状体纤维细胞在在终末分化过程中发生的细胞器降解,使位于中央的纤维细胞形成无细胞器区(organelle-free zone,OFZ);而单层的晶状体上皮细胞由于光程太短,其对光的散射可忽略不计。因此,正常的晶状体细胞器降解过程是保证其透明性的一个关键步骤,异常的细胞器降解可使其微结构破坏,光散射增加,导致白内障发生。
1 晶状体的发生及纤维细胞的分化
脊椎动物晶状体胚胎发育起源于前神经板表面外胚层[6]。晶状体的发生是由于表面外胚层接受到了来自视泡和眼周间质信号的刺激[7]。形态学上,当间脑前部两侧膨出形成视泡后,其与表面外胚层接触,诱导表面外胚层形成晶状体基板;而后,晶状体基板逐渐向内凹陷形成晶状体小凹;随着凹陷的加深,晶状体小凹脱离表面外胚层,形成近球形中空的晶状体泡[8]。
晶状体泡由单层上皮细胞构成,位于后部的上皮细胞向前延伸为初级晶状体纤维并逐渐填满空腔[8]。在初级纤维细胞延伸的过程中,其细胞器发生降解[6]。晶状体泡的前部细胞始终保持上皮样,其子细胞迁移到晶状体的赤道区,延伸并分化为次级晶状体纤维。整个生命过程中,新的纤维细胞不断地包裹到晶状体表面,形成外周同心层的皮质[9],在一定的信号刺激下次级纤维细胞的细胞器也不断发生降解。由此可见,细胞器降解分别发生于晶状体初级和次级纤维细胞的分化过程中。有研究[10]发现:初级纤维细胞中细胞器的降解同时发生在一簇细胞,而次级纤维细胞中细胞器降解是一个接一个细胞发生的,这提示初级纤维细胞和次级纤维细胞的降解过程存在不同。
晶状体纤维分化包括细胞骨架重排、细胞伸长、晶状体蛋白的积累、晶状体细胞外基质的产生以及细胞器的降解[11],在细胞器降解之后,处于OFZ的纤维细胞实质上相当于包裹晶状体蛋白的囊袋。
2 晶状体细胞器降解的过程
晶状体细胞器降解是指在纤维细胞分化成熟中,细胞核、线粒体、内质网及高尔基体等膜性细胞器降解形成OFZ的过程(图1)。
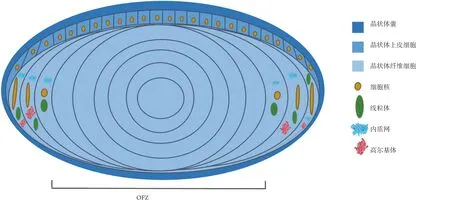
图1 示意图:晶状体细胞器降解及OFZ的形成Figure 1 Organelle degradation and formation of OFZ in lens
2.1 细胞器降解发生的时间及部位
晶状体初级纤维细胞的细胞器降解发生在胚胎期,在不同物种中发生时间略有差异。在鸡晶状体胚胎期第8天,纤维细胞中的线粒体从最内层开始解体,同时细胞核也开始变小;在第12天,晶状体中央细胞的线粒体和细胞核已经消失[12]。而在小鼠中,晶状体细胞器降解开始发生在胚胎期的16.5~18.5 d之间[10]。在人晶状体中,初级纤维的细胞器降解发生于胎儿早期;在其他哺乳动物中,该过程大多发生在妊娠晚期[10]。晶状体次级纤维的细胞器降解也始于胚胎期,并贯穿于整个生命周期。
晶状体初级纤维和次级纤维中细胞器降解发生在不同部位。OFZ最初只是由初级纤维细胞构成,随着发育的进展,逐渐扩大到越来越多的次级纤维细胞[3]。新的次级纤维细胞不断包裹在晶状体外层,在到达晶状体皮质相当于虹膜缘的位置时,其细胞器开始发生降解[12]。最终位于视轴上的纤维细胞都经历了细胞器降解过程,形成了晶状体的OFZ。不同的细胞器发生降解的部位也有所不同,高尔基体在晶状体纤维分化早期解体,线粒体、内质网及细胞核都是在OFZ边缘发生降解[13]。
2.2 细胞器降解的触发因素
次级晶状体纤维细胞到达皮质区的一定深度触发细胞器降解,但具体因素仍不明确。有研究[14]表明:晶状体内的低氧环境可能是细胞器降解的一个触发因素。由于成熟晶状体缺乏血液供应,处于低氧环境,房水中的氧气被动扩散,从而导致晶状体内形成从表面到核心逐渐下降的氧气浓度梯度。此外,Brennan等[15]在鸡晶状体外植体中发现低氧可使HIF1a(hypoxia-induciblefactor 1a)表达上调,进而通过影响BNIP3L(BCL2 interacting protein 3-like)的转录来调控晶状体纤维细胞非核细胞器降解。在低氧环境下,除了HIF1a表达上调,未折叠蛋白反应(unfolded protein response,UPR)也会被激活,Yang等[16-17]在年龄相关性、高度近视并发核性白内障及先天性白内障患者的晶状体中发现UPR的激活,但UPR是否参与细胞器降解还有待进一步研究。除了低氧环境的影响,有学者认为晶状体中离子的梯度分布可能与细胞器降解有关,已有研究[18]证明水通道蛋白AQP0-/-(Aquaporin 0)小鼠,由于影响晶状体中钙离子及其他反射介质的梯度分布,破坏了晶状体内稳态导致白内障发生。除了氧气和Ca2+外,成熟晶状体中可扩散性的营养物质及代谢产物在晶状体内也是呈梯度分布的,如pH、乳酸等[19]。但这些物质的不均匀分布是否参与了晶状体细胞器降解也有待进一步探索。
2.3 细胞器降解过程中细胞器的形态学变化
晶状体细胞器的降解过程中,首先发生形状改变的是细胞核,由“卵状”变成“球形”[20],在这个过程中DNA逐渐在核的边缘固缩,在核膜上出现小孔,核固缩伴随着核蛋白,包括组蛋白和非组蛋白,转移到细胞质,而丝状细胞质组分,如CP49进入核内[21],随着染色质的不断浓缩,核逐渐减小,之后解体为多个凋亡样颗粒[20]。相比于细胞核降解,线粒体降解要迅速很多,在OFZ边缘的纤维细胞中,线粒体变得肿胀、片段化并失去其功能[12]。上述形态学变化在不同物种中是类似的。但染色质变化存在种属差异[5],比如在鸡晶状体核降解过程中有染色质边缘化,而在鼠中该现象不明显[21]。最近,Costello等[22]用高分辨率共聚焦光学显微镜和透射电镜(TEM)对第12~15天的鸡胚晶状体进行观察,发现在发生细胞器降解的细胞中存在一种特殊的结构,称为核外切体(excisosome),由邻近纤维细胞产生,参与细胞核的降解。
2.4 细胞核降解过程中胞内转录活性的变化
晶状体纤维细胞中的转录活性随核降解过程的进行而发生变化。纤维细胞去核开始后,调控细胞器降解的相关基因发生转录;随着降解过程的进行,细胞核高度固缩,转录活性降低,但仍可观察到纤维细胞内特定基因的表达[20];最终在核膜重塑和核解体之间的某个时间点,转录停止[5]。在核降解过程中转录活性逐渐降低,而成熟晶状体纤维细胞中富含晶状体蛋白,因此纤维细胞内一定存在某种机制,使晶状体蛋白即使在转录活性逐渐降低的情况下,也能维持较高的表达。最近,Shao等[23]在斑马鱼中揭示了RNA结合蛋白Rbm24可以通过调节晶状体蛋白mRNA的poly(A)尾的长度使其在胞质中维持一定的稳定性,进而调控晶状体蛋白的翻译效率。晶状体纤维细胞核降解后虽失去转录活性,但细胞中还残存有RNA。至于这些残存的RNA是否还能翻译,Faulkner-Jones等[24]研究发现在鸡晶状体纤维细胞核降解后,现存的RNA在纤维细胞的细胞质中迅速衰变,核糖体RNA消失的半衰期估计为2.5 d;编码管家基因如GAPDH的mRNA的半衰期为3~4 d;而晶状体蛋白的mRNA在核降解数周后还可以检测到,并能维持一段时间的翻译活性,当翻译所需的元件都被降解后,晶状体蛋白的产生也随即停止。这提示在细胞核降解后,其RNA及蛋白合成都在一段时间后停止,因此纤维细胞在核降解之前就完成了绝大部分晶状体蛋白的合成。
3 晶状体细胞器降解的机制
晶状体纤维细胞分化及细胞器降解的过程复杂,涉及多个并行和冗余的路径,并形成相互作用的网络。目前关于晶状体细胞器降解机制主要有以下几种学说:细胞自噬、细胞凋亡和泛素-蛋白酶体途径(ubiquitin-proteasome pathway,UPP)等。
3.1 细胞自噬
细胞自噬是广泛存在于各种细胞内的溶酶体降解系统,通过清除细胞内错误折叠的蛋白质以及衰老的细胞器,以维持胞内稳态[25]。除了非选择性自噬,大多数生物体还存在选择性自噬,即通过自噬的方式选择性降解某类大分子或细胞器,其异常与多种疾病发生有关。线粒体自噬即为一种选择性自噬,是细胞内线粒体质量控制的核心机制[26]。自噬的发生由自噬溶酶体介导,在自噬启动后,隔离膜(isolation membrane)包住一部分细胞质形成双膜结合的自噬体[27],自噬体随后与溶酶体融合成为自噬溶酶体,在这个结构中,细胞质来源的内容物被溶酶体水解酶降解。自噬相关蛋白5(autophagy-related 5,ATG5)是参与自噬溶酶体形成所必需的蛋白[28]。
为研究自噬在细胞器降解过程中的作用机制,Matsui等[29]发现敲除小鼠Atg5后,不会影响其胚胎期晶状体细胞器降解的正常发生。但Atg5-/-小鼠在出生后不久则死亡[30],无法研究成体晶状体中自噬的作用机制。随后,Morishita等[31]特异性敲除小鼠晶状体Atg5基因后,发现成体和胚胎期小鼠的晶状体细胞器降解均不受影响。虽然ATG5是参与自噬发生的关键蛋白,但也有报道[32]称“替代性自噬”(alternative autophagy)不依赖于ATG5,可由依托泊苷或星孢素诱导产生。这类自噬需要FIP200、Ulk1、Beclin 1和Pik3c3等因子的参与,为了研究替代性性自噬在晶状体细胞器降解中的可能作用,Morishita等[31]也对小鼠晶状体的Pik3c3基因进行了特异性敲除,结果发现:其晶状体细胞器在胚胎期也正常降解。以上结果均表明自噬对晶状体细胞器降解没有直接作用。然而,持续观察晶状体特异性Atg5敲除的小鼠,发现在21个月时所有的小鼠都出现了严重的双侧皮质或全白内障,伴随多泛素化蛋白、氧化蛋白p62和不溶性晶状体蛋白的累积[31],提示自噬对整个晶状体细胞内稳态的维持起关键作用。
以上结果虽表明细胞自噬不影响晶状体细胞器的降解,但也有研究提示线粒体和细胞核可能是通过自噬的方式发生降解的。Joseph等[33]通过电镜及双标记共聚焦成像观察到在人和鸡胚胎晶状体上皮细胞、未成熟的纤维细胞中及早期分化的纤维细胞都有包含线粒体的自噬泡存在;在鸡原代晶状体上皮细胞中通过血清饥饿处理诱导了线粒体自噬的发生,提示自噬至少是晶状体细胞降解线粒体的一种方式。DNase IIβ (DNase II-like acid DNase,DLAD)在晶状体细胞器降解过程中通过类似于自噬的途径发挥作用,DNase IIβ是一种在晶状体中显著表达的DNA酶[34],也被证明是一种溶酶体酶[35]。研究表明DNase IIβ在晶状体去核中起关键作用。Nishimoto等[34]构建了DLAD-/-小鼠,发现由于中央纤维细胞中未消化的DNA异常保留而导致核性白内障。Cui等[36]发现在斑马鱼中热休克转录因子4(heat shock transcription factor 4,HSF4)通过直接与DNase IIβ启动子结合,促进DNase IIβ的表达;而HSF4突变可使DNase IIβ活性降低,从而使晶状体不完全去核[37]。此外,在小鼠晶状体纤维细胞中观察到DNase IIβ与溶酶体相关膜蛋白-1(lysosome-associated membrane protein,LAMP-1)共定位,在OFZ区边缘细胞中观察到了含DNase IIβ的溶酶体[38]。因此,DNase IIβ对核DNA的作用很可能类似于自噬溶酶体的形成,即通过含有DNase IIβ的溶酶体与核膜融合而发挥降解作用[5]。
同时,也有研究[39]发现FYCO1(FYVE and coiled-coil domain containing 1)基因突变可导致先天性白内障的发生,而FYCO1是一种自噬相关蛋白(autophagy adaptor protein),可与微管相关蛋白1轻链3B (MAP1LC3B)、磷酸磷脂酰肌醇-3-磷酸(PI3P)及RAB7相互作用介导自噬体的定向运动[40],Pankiv等[41]报道,FYCO1突变可导致残余自噬体在核周积累。因此推测FYCO1基因突变后自噬体累积,从而使蛋白聚集体形成或细胞器无法正常降解,进而导致先天性白内障的发生。
总之,目前可以明确自噬参与晶状体细胞稳态的维持,但是自噬是否参与了晶状体细胞器降解过程还需进一步研究。
3.2 细胞凋亡
细胞凋亡是一种程序性细胞死亡过程,在各种生物过程中起关键作用[42],其过程伴随DNA片段化、染色质浓缩、核膜裂解及线粒体肿胀等形态学变化[43]。这与晶状体细胞器降解过程的形态学变化有相似之处,且纤维细胞表达了细胞凋亡所需的大部分调节因子[44-45],提示细胞凋亡参与了细胞器降解。
p53是参与细胞凋亡的重要调节因子,介导细胞凋亡的发生[46]。Deng等[47]发现在bFGF诱导的晶状体细胞体外分化过程中,p53或Bak的敲低导致晶状体细胞分化受到显著抑制,证实了p53-Bak凋亡信号通路在晶状体发育分化中起重要作用。Reichel等[48]发现p53敲除后的小鼠发生白内障。Gao等[45]建立了斑马鱼HSF4突变体,在HSF4敲除后p53的活性下调,同时,p53下游的Fas和Bax基因表达也下调,从而导致细胞凋亡通路活性降低,引起晶状体细胞器的不完全降解;进一步在HSF4突变体中通过显微注射p53、Fas和Bax mRNA,发现可以部分挽救细胞器降解缺陷,证明了p53及其介导的细胞凋亡促进了晶状体细胞器降解。
Bcl-2家族也是细胞凋亡的调节因子,其既具有抗凋亡活性(Bcl-2、Bcl-xl、Bcl-w及Mcl-1等),也具有促凋亡活性(Bax、Bak、Bcl-xs及Bad等),处于Caspase蛋白酶家族上游[49]。为了研究晶状体细胞器降解中是否有Bcl-2家族的参与,Sanders等[44]在鸡胚胎晶状体过表达Bcl-2,发现其导致晶状体纤维细胞排列紊乱、去核障碍及白内障形成;在小鼠中过表达Bcl-2后,也发现了类似的对细胞器降解的抑制作用[50]。也有研究[44]发现在鸡晶状体次级纤维细胞去核的过程中Bcl-2表达降低,Bax表达增加。Brennan等[51]在小鼠中发现,Bcl-2家族蛋白BNIP3L在晶状体纤维细胞线粒体、内质网、高尔基体的降解中发挥重要作用。
Caspase蛋白酶家族是细胞凋亡的效应因子,细胞凋亡不论是由外部或内部信号触发,凋亡通路最终都集中于Caspase蛋白酶家族。在受到相应的信号刺激后,Caspases从无活性的前体被剪切为有活性的成熟体,Caspase-2、-8和-9通常处于效应分子Caspase-3、-6和-7的上游[52]。研究表明,Caspase蛋白酶家族在晶状体中有表达,Wride等[53]利用鸡胚胎晶状体,发现Caspase-1、-2、-4、-6和-9抑制剂均能显著降低晶状体中TUNEL标记的程度,提示这些Caspase均在鸡胚晶状体纤维细胞去核过程中发挥作用。
上述研究表明细胞凋亡相关因子参与了晶状体细胞器降解,但与细胞凋亡不同的是,细胞器降解的纤维细胞并未表现出细胞骨架破裂、凋亡小体形成等结果。针对这一问题,有人提出晶状体细胞中可能存在抗凋亡系统,可以减弱细胞凋亡的效应。Christopher等[54]及Kamradt等[55]分别在人晶状体上皮细胞及成肌细胞中发现αB-晶状体蛋白具有抗凋亡功能。Wang等[56]利用大鼠晶状体外植体及小鼠晶状体上皮细胞证明了过表达αB-晶状体蛋白可抵抗由氧化应激诱导的细胞凋亡。因此有研究[57]提出:晶状体纤维细胞因富含αB-晶状体蛋白,减弱了细胞凋亡级联反应,从而仅表现为细胞器降解。
总之,细胞凋亡的组分参与了晶状体细胞器降解,但晶状体中可能也存一些类似于αB-晶状体蛋白的抗凋亡因子,使晶状体细胞器降解与细胞凋亡的机制有所不同[58]。
3.3 泛素-蛋白酶体途径(UPP)
UPP是细胞中主要的蛋白质降解系统,泛素化修饰后的蛋白质被蛋白酶体特异性识别和降解,在细胞发育、免疫反应和程序性细胞死亡中发挥重要作用[59]。
晶状体中存在UPP的全部组分[60],泛素激活酶、泛素结合酶、19S和20S蛋白酶体亚基等UPP核心组分存在于整个晶状体纤维中[61]。Shang等[62]发现泛素依赖通路在晶状体细胞分化过程中上调。Guo等[60]在晶状体上皮细胞外植体中发现晶状体细胞增殖和分化需要泛素-蛋白酶体途径参与。已有研究[63]证明在晶状体纤维细胞分化晚期UPP的核心成分重新分布进入细胞核,这提示UPP可能在细胞核降解中发挥一定作用。随后,Zandy等[64]在发育中的鸡晶状体通过玻璃体注射乳胞素以抑制UPP途径,发现其阻止了晶状体纤维细胞中一种线粒体内膜蛋白(琥珀酸泛醌氧化还原酶)的降解,这是第一个表明UPP参与晶状体细胞器降解过程的证据。Caceres等[65]发现K6W-泛素可以与底物有效地结合,但底物不能通过UPP降解,这相当于抑制了泛素的功能,通过在小鼠晶状体细胞中表达K6W-泛素后,发现晶状体特异性蛋白的表达下调、上皮细胞向纤维的分化减慢及纤维细胞去核障碍。这些结果均表明UPP途径参与了晶状体细胞器降解过程。
3.4 其他
晶状体细胞器降解过程还有炎症因子、生物电信号、RNA结合蛋白(RNA-binding protein)等其他因素的参与,Wride等[66]发现鸡的晶状体纤维细胞表达TNFα及TNF受体,提出炎症因子在诱发细胞器降解过程中可能起重要作用;Cao等[67]研究了哺乳动物晶状体赤道部Na+/K+泵电流产生的生物电信号,发现超极化膜电位差(Vmem)的去极化可以激活晶状体纤维细胞去核;RNA结合蛋白主要介导转录后调控,Siddam等[68]发现RNA结合蛋白Celf1可以通过调控p27和DNase IIβ的翻译,进而影响晶状体细胞器降解,其他RNA结合蛋白,如Tdrd7、Rbm及Caprin2等也参与晶状体的发育过程,但是否参与细胞器降解还需进一步研究。
此外,其他多种信号通路和分子也参与细胞器降解的发生,Subhasre等[69]发现在鸡胚胎晶状体体外培养和分化系统中,化学抑制MAPK/JNK和mTORC1可导致细胞器降解提前发生;Rowan及Lyu等[35,70]发现细胞周期调控因子p27的异常累积也可导致去核障碍;He等[71]发现Hippo通路的下游效应分子Yap在晶状体上皮细胞中特异性表达,而在小鼠中条件性敲除Yap可使上皮细胞减少及纤维细胞去核障碍。另外,最近的研究[72]揭示了PLAAT家族磷脂酶是参与晶状体细胞器降解的关键分子,在细胞器降解过程中移位至细胞器膜介导膜的裂解。
尽管目前对参与晶状体细胞器降解过程的基因表达调控和参与的信号通路已有一定的认识,但对于另一种调控基因表达的重要方式—表观遗传学在晶状体细胞器降解中的作用还知之甚少。表观遗传学是指在不改变基因组DNA序列的情况下,对基因组结构进行修饰,进而调控基因表达。DNA甲基化是表观遗传调控基因表达的关键方式,DNA甲基转移酶(DNMT1,DNMT3A和DNMT3B)催化哺乳动物DNA甲基化[73]。Tittle等[74]利用Uhrf1和Dnmt1斑马鱼突变体发现Uhrf1和Dnmt1在晶状体上皮中表达,在缺失Uhrf1和Dnmt1后晶状体上皮细胞基因表达发生变化,增殖减少,伴随次级晶状体纤维的解体,这首次证明了Uhrf1和Dnmt1在晶状体发育中发挥重要作用。随后,Hoang等[75]利用Le-Cre小鼠和Dnmt1 Floxed小鼠进行晶状体条件性敲除Dnmt1,发现Dnmt1缺失导致晶状体DNA整体呈低甲基化状态,晶状体上皮细胞大量凋亡,但晶状体纤维细胞的分化基本没有受到影响。Liu等[76]也揭示了表观遗传修饰在先天性白内障中的作用,研究团队对散发性双眼或单眼先天性白内障患者和无白内障患者的外周血进行了全基因组重亚硫酸盐测序(whole genome bisulfite sequencing),用于全基因组DNA甲基化检测,结果提示先天性白内障患者的DNA甲基化状态与对照组有显著不同,同时揭示了5个甲基化状态显著不同的核心基因(ACTN4、ACTG1、TUBA1A、TUBA1C及TUBB4B),这些核心基因编码的蛋白质主要参与了细胞骨架和细胞间连接的构建。这些研究揭示了表观遗传修饰在晶状体发育中的重要作用,但细胞器降解作为晶状体发育分化的关键生物学过程是否受到表观遗传机制的调控还需进一步研究和探索。
4 结语
目前手术仍是治疗白内障最有效的方式。药物研发受到许多因素的阻碍,虽已有一些针对氧化应激的抗氧化药物,但由于给药方式等因素的影响,其疗效不甚理想[77]。刘奕志教授团队在2015年揭示了羊毛甾醇逆转蛋白聚集体的作用,在体内外都验证了羊毛甾醇可使白内障严重程度下降和晶状体透明度提高[78],这给白内障的药物治疗带来了曙光。而随着对细胞器降解等重要生理过程机制的深入研究,探索发动和参与这些生理过程的核心基因和分子,有望通过设计针对这些分子的药物甚至通过基因工程的手段干预这些过程而进行白内障的治疗。白内障治疗另一个关键的问题即为婴幼儿白内障的治疗,由于小于2岁的婴幼儿眼球处于发育阶段,不宜植入人工晶状体,尚缺乏较理想的治疗方式。在干细胞与再生医学领域,刘奕志教授团队在2016年发现并利用晶状体上皮干细胞实现了人晶状体原位再生,已成功用于临床治疗婴幼儿白内障[79]。但体内再生的晶状体存在透明度不足的问题,因此,探索晶状体细胞器降解的机制也有望为解决该问题提供线索。
由于晶状体发育分化过程调控的复杂性,要实现上述目标还有很多尚待解决的问题,如什么因素诱发了晶状体细胞器降解,晶状体中梯度分布的物质有何特点;参与细胞器降解过程的众多通路中的核心通路是哪条;细胞凋亡、自噬等途径发挥什么样的作用,不同途径是否有协同作用;不同细胞器的降解机制是否相同;细胞器降解后纤维细胞内的状态是怎么样的,其新陈代谢如何进行;丰富的晶状体蛋白的转录和翻译是否有特殊的调控机制;如何通过这些核心分子或关键通路干预细胞器降解障碍等。
以上问题的解决也有赖于更好的研究模型。在基础研究领域,除了动物及细胞模型,已有研究者在体外建立了类晶状体诱导体系,这为进一步研究晶状体发育分化提供了平台。Yang等[80]在2010年用hESC(human embryonic stem cell)通过顺序添加Noggin、FGF和BMP4、BMP7及FGF和Wnt3a的三阶段诱导方法在体外成功诱导出透明的类晶状体,表达晶状体特异性蛋白,并通过电子显微镜观察到了细胞器降解过程开始发生,但类晶状体体积很小且功能不确定。在此诱导体系基础上,Fu等[81]利用尿液细胞来源的iPSC(induced pluripotent stem cell),用“煎蛋法”诱导产生了体积更大的且有放大功能的类晶状体。Murphy等[82]从分化的多能干细胞中纯化出晶状体上皮细胞团块,从而更高效的产生可以聚焦光线的类晶状体,该类晶状体在形态、细胞排列、mRNA表达和蛋白表达等方面与人晶状体细胞和晶状体更具相似性。因此,利用这些成熟的体外诱导体系可进行细胞器降解等晶状体发育分化过程调控机制的探索,而这些发育分化过程的深入研究也有望促进晶状体体外诱导体系进一步成熟,为晶状体发育分化的研究及白内障的治疗开辟新的思路。
此外,需要强调的是晶状体的透明性是综合因素作用的结果。细胞器降解是保证晶状体透明性的重要生理过程,但不是唯一因素。晶状体纤维细胞中的高浓度、有序堆积的晶状体蛋白,也是其透明性的来源。晶状体内运行着一个内部微循环系统通过维持晶状体内的离子流和代谢稳态保持晶状体的透明度[83]。AQP0是晶状体中最丰富的膜蛋白,占质膜蛋白的50%~60%,也对维持晶状体透明度和稳态发挥重要作用[84]。晶状体纤维细胞之间紧密结合,存在大量的黏附蛋白,使细胞边缘的散射最小,这也是晶状体透明性的来源[85]。总而言之,晶状体透明不是由单一因素造成的,使晶状体透明的关键是脉管系统的缺乏、晶状体有序细胞结构、胞内细胞器的降解以及纤维细胞的膜和细胞质折射率匹配等综合因素的结果[3]。因此,对于晶状体透明性的研究应全面考虑,综合分析。
开放获取声明
本文适用于知识共享许可协议(Creative Commons),允许第三方用户按照署名(BY)-非商业性使用(NC)-禁止演绎(ND)(CC BY-NC-ND)的方式共享,即允许第三方对本刊发表的文章进行复制、发行、展览、表演、放映、广播或通过信息网络向公众传播,但在这些过程中必须保留作者署名、仅限于非商业性目的、不得进行演绎创作。详情请访问:https://creativecommons.org/licenses/by-ncnd/4.0/。