一氧化氮对苹果果实愈伤苯丙烷代谢的影响及生理机制分析
2022-05-24柴秀伟李宝军朱亚同DovPrusky
柴秀伟,孔 蕊,李宝军,朱亚同,毕 阳*,Dov Prusky
(1 甘肃农业大学 食品科学与工程学院,兰州 730070;2 Department of Postharvest Science of Fresh Produce, Agricultural Research Organization, Rishon LeZion 7505101, Israel)
苹果是最重要的温带水果,但其在采收及采后处理期间极易遭受机械损伤[1]。表面形成的伤口不仅会加剧水分蒸腾,而且会为病原物的侵染提供通道,加剧腐烂的发生[2]。苹果果实具备愈伤的能力[3],但自然愈伤所需时间较长,因此,需要采取措施加速果实愈伤。作为植物体内的信号分子,一氧化氮(nitric oxide,NO)在介导植物生长发育、成熟衰老和防御反应等诸多生物学过程中发挥着重要作用[4]。有报道表明,采用NO供体SNP浸泡甘薯块根,可以有效促进伤口处的木质化,增加伤口处木质化细胞层厚度,促进甘薯愈伤[5]。SNP处理还可通过加速伤口处聚酚软木酯及木质素的沉积来降低马铃薯块茎愈伤期间的失重率和病情指数[6]。果实发育期多次喷洒SNP还可促进采后厚皮甜瓜伤口处聚酚软木酯及木质素的沉积,有效降低愈伤期间损伤果实的病情指数[7]。进一步研究表明,NO处理可提高厚皮甜瓜和马铃薯伤口处的苯丙氨酸解氨酶活性,增加总酚、类黄酮和木质素的含量;NO还可使厚皮甜瓜和马铃薯伤口处的H2O2含量和过氧化物酶活性显著提高[6-7]。此外,NO处理激活了损伤甘薯块根的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX),提高块根抗坏血酸(ASA)的含量及抗氧化能力[5]。虽然已有SNP促进甘薯、马铃薯及甜瓜等一年生地下根茎和果实采后愈伤的报道,但SNP是否影响苹果果实采后愈伤尚鲜见报道。因此,本研究以“红星”苹果为试材,采用SNP浸泡处理人工模拟损伤的果实,评价处理对愈伤期间果实失重率和病情指数的影响,分析伤口处苯丙烷代谢关键酶活性和产物含量,以及H2O2含量和过氧化物酶活性,为苹果果实采后快速愈伤提供方法及理论依据。
1 材料和方法
1.1 材 料
供试‘红星’苹果(MalusdomesticaBorkh. cv. Starkrimson)于2019年10月采自甘肃省景泰县条山农场,选择大小均匀、未受机械和病虫害影响的果实,并将单个果实套网后装箱,于次日运至本实验室,常温(20~25 ℃;相对湿度 80%~85%)下贮藏待用。SNP(纯度98.5%)购自Sigma公司。供试病原菌扩展青霉PenicilliumexpansumLink.(T01)由中国科学院植物研究所提供,于PDA培养基上保存待用。
1.2 方 法
1.2.1 苹果果实人工损伤、SNP处理及愈伤果实人工损伤参照Zhang等[3]的方法并适当修改。苹果清洗后用1%次氯酸钠浸泡2 min,蒸馏水冲洗,待自然晾干后,用灭菌刀片在果实赤道周围切出3个人工伤口(15 mm×1 mm)。30 min后将损伤的果实分别用蒸馏水(对照)和0.5 mmol/L SNP溶液(前期预实验筛选)浸泡5 min。处理果实在常温[(20±5) ℃,相对湿度(80%~85%)]黑暗条件下愈伤。
1.2.2 失重率及病情指数的测定失重率的测定采用重量法,在果实愈伤的第0、0.5、1、3、5、7天分别称取果实的重量,每个处理重复3次,每处理用果实6个。病情指数的测定参照Zhang等[3]的方法。在果实愈伤的第0、0.5、1、3、5、7天,分别将20 μL浓度为1×106spores/mL的P.expansum孢子悬浮液均匀涂于果实伤口处,晾干后常温[(20±5) ℃,相对湿度(80%~85%)]黑暗培养5 d后统计发病级别。每个处理用果实9个,重复3次。

式中,发病级别标准:果面全部发病为4级,四分之三发病为3级,一半发病为2级,四分之一发病为1级,不发病为0级。
1.2.3 生化指标取样测定参照Zhang等[3]的方法并作适当修改。分别于愈伤的第0、0.5、1、3、5和7天时用不锈钢刀切取果实伤口下2~3 mm厚的组织,液氮速冻后,用研磨机(A11 basic S025型,IKA艾卡(广州)仪器设备有限公司,中国)磨成粉后装入离心管,于-80 ℃的超低温冰箱(DW-86L828型,北京盛科信德科技有限公司,中国)中保存待用。每个苹果取样3个伤口,每个伤口取样0.2 g,共用150个苹果。
1.2.4 酶活性的测定苯丙氨酸解氨酶(phenylalnine ammonia-lyase,PAL)活性的测定参照Koukol等[8]的比色法,以每小时290 nm处吸光值变化0.01为1个酶活力单位(U),PAL活性以U/g表示。肉桂酸氢化酶(cinnamate-4-hydroxylase,C4H)活性的测定参照Lamb等[9]的比色法,以每分钟340 nm处吸光度值变化0.01为1个酶活力单位(U),C4H活性以U·g-1表示。肉桂醇脱氢酶(cinnamyl alcohol dehydrogenase,CAD)活性的测定参照Goffner等[10]的比色法,以每分钟400 nm处吸光值变化0.01为1个酶活力单位(U),CAD活性以U·g-1表示。过氧化物酶(peroxidase,POD)活性的测定参照Venisse等[11]的比色法,以每分钟470 nm处吸光值变化增加1为一个酶活性单位(U),POD活性以ΔOD470·min-1·g-1表示。
1.2.5 酚酸及木质素单体含量的测定酚酸及木质素单体含量的测定参照Ayaz等[12]的方法。(1)样品制备:取1.0 g冷冻粉末,加入3 mL 70%的甲醇在40 kHz常温超声提取30 min,在8 000×g下离心20 min,收集上清液并用浓缩仪浓缩后,用复溶液(甲醇∶水∶冰醋酸=70∶30∶1)溶至1 mL,过0.22 μm微孔滤膜,将滤液转移至2 mL自动进样瓶中。采用Waters Symmetry®C18柱(4.6×250 mm,5 μm)进行四元梯度超快速液相色谱仪(ACQUITY Arc,Waters,USA)分析。(2)HPLC条件:以100%甲醇(A)和1%乙酸(B)为流动相,进样量5 μL,流速0.8 mL/min,柱温35 ℃,检测波长325 nm。在相同条件下分别用肉桂酸、咖啡酸、阿魏酸、芥子酸、p-香豆醇、芥子醇和松柏醇标准品建立标准曲线,并计算样品含量,4种酚酸及3种木质素单体含量以μg·g-1表示。
1.2.6 总酚、类黄酮和木质素含量的测定总酚和类黄酮含量的测定参照Scalbert等[13]的比色法并作适当修改。总酚于760 nm处测定吸光度(OD)值,并以没食子酸(GAE)为标准物质制定标准曲线来评估总酚含量,单位以mg·(100 g)-1表示。类黄酮于510 nm处测定OD值,并以儿茶素(CE)为标准物质建立标准曲线评估类黄酮含量,单位以mg·(100 g)-1表示。木质素含量的测定参照Hamerschmidt等[14]的比色法,于280 nm处测定OD值,单位以OD280·g-1表示。
1.2.7 H2O2含量的测定H2O2含量的测定参考Prochazkova等[15]的比色法,于410 nm处测定OD值,单位以μmol·g-1表示。
1.3 数据统计
上述各项指标的测定至少重复3次,用Excel 2010计算平均值和标准误,用SPSS 19.0进行Duncan’s差异显著性分析(P<0.05)。
2 结果与分析
2.1 SNP处理对愈伤期间损伤果实失重率和病情指数的影响
失重率和病情指数是用来评价果实愈伤效果的常用指标。图1显示,在愈伤期间,SNP处理组和对照组苹果果实的失重率均逐渐提高,但不同时间点存在明显差异。其中,SNP处理组果实的失重率在第0和0.5天无显著差异,在第1~7天迅速上升,且不同时间点之间均存在显著差异(P<0.05);对照组果实失重率的变化趋势与SNP处理组果实基本一致;SNP处理组果实的失重率在愈伤期间显著低于对照,如处理第5天时显著低于对照40.2%(图1,Ⅰ)。同时,在果实愈伤期间,SNP处理组和对照组果实的病情指数逐渐下降,但不同时间点之间存在差异。其中,SNP处理组果实的病情指数在第0~0.5天无显著差异,在第1~5天迅速下降,且各时间点间均差异显著(P<0.05);对照组果实的病情指数除第0.5~1天外,其余时间点之间均差异显著(P<0.05);SNP处理组果实的病情指数在第0和0.5天与对照组果实无显著性差异,对照组病情指数在第5天低于50%,而处理组病情指数在第3天时已低于50%,且处理组果实的病情指数在第1~7天显著低于对照,第3天时显著低于对照31.4%(图1,Ⅱ)。以上结果表明,SNP处理有效促进了苹果果实的愈伤。
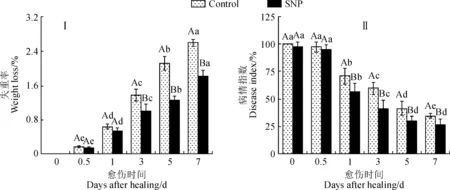
不同大写和小写字母分别代表处理间和处理内在0.05水平存在显著性差异(P<0.05)。下同图1 SNP处理对愈伤期间损伤果实失重率(A)和损伤接种果实病情指数(B)的影响Different capital and normal letters indicate significant differences between and within treatments at 0.05 level, respectively (P<0.05). The same as belowFig.1 Effect of SNP treatment on weight loss (A) of wounded fruit and disease index (B) of inoculated fruit during healing
2.2 SNP处理对愈伤期间果实伤口处PAL、C4H和CAD活性的影响
PAL、C4H和CAD的活性与酚类物质的合成水平呈正相关。在苹果果实愈伤期间,SNP处理组和对照组果实伤口处的PAL、C4H和CAD活性均呈单峰型变化,三者的峰值依次出现在第1天、第5天和第3天,且各酶活性在不同时间点之间均存在差异(图2,Ⅰ-Ⅲ)。其中,SNP处理组果实的PAL活性在第0~1天迅速上升,之后迅速显著降低(P<0.05);对照组果实的PAL活性在第0~1天无显著差异,之后迅速显著降低;处理组果实伤口处的PAL活性在愈伤期间均显著高于相应对照,其峰值时的活性显著高出对照26.1%(图2,Ⅰ)。同时,处理组果实的C4H活性在第0~3天迅速上升,在第5~7天迅速显著降低(P<0.05);对照组果实的C4H活性在第0~0.5天迅速上升,之后缓慢增加,在第3~5天再迅速上升后又迅速降低(P<0.05);处理组果实伤口处的C4H活性在愈伤期间显著高于相应对照(图2,Ⅱ)。另外,SNP处理组果实的CAD活性在第0~0.5天迅速上升,之后缓慢增加后下降,在第5~7天迅速显著降低(P<0.05);对照组果实的CAD活性在第0~5天无显著差异,之后迅速显著降低(P<0.05);SNP处理组果实伤口处的CAD活性在愈伤期间均显著高于相应对照(图2,Ⅲ)。上述结果表明SNP处理激活了苹果果实伤口处的PAL、C4H和CAD活性。
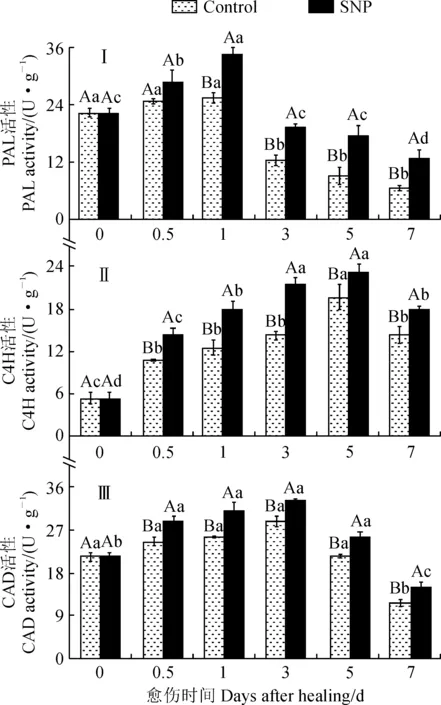
图2 SNP处理对愈伤期间果实伤口处PAL、C4H和CAD活性的影响Fig.2 Effect of SNP treatment on PAL, C4H and CAD activities at wounded sites of fruit during healing
2.3 SNP处理对愈伤期间果实伤口处4种酚酸及总酚和类黄酮含量的影响
酚酸不仅参与愈伤封闭层的形成,而且具有抗菌和抗氧化活性。SNP处理组和对照组果实伤口处的肉桂酸、咖啡酸和芥子酸含量在愈伤期间均呈单峰型变化,峰值依次出现在第3天、第1天和第1天,且不同时间点的含量存在差异;处理组果实的肉桂酸、咖啡酸和芥子酸含量水平在愈伤期间始终显著高于同期对照(图3,Ⅰ、Ⅱ、Ⅳ)。其中,处理组果实的肉桂酸含量在第0~0.5天迅速显著上升后缓慢增加,在第1~3天又迅速显著增加,之后迅速显著降低(P<0.05);对照组果实的肉桂酸含量在第0~0.5天无显著差异,之后迅速显著上升,在第3~5天又迅速显著下降(图3,Ⅰ)。SNP处理组果实的咖啡酸含量先迅速上升后迅速显著下降(P<0.05);对照组果实的咖啡酸含量在第0~0.5天迅速上升后基本稳定,1 d后迅速显著下降(P<0.05)(图3,Ⅱ)。SNP处理组果实的芥子酸含量在第0~1天迅速显著上升,之后迅速显著降低(P<0.05);对照组果实芥子酸含量的变化趋势与处理果实基本一致(图3,Ⅳ)。
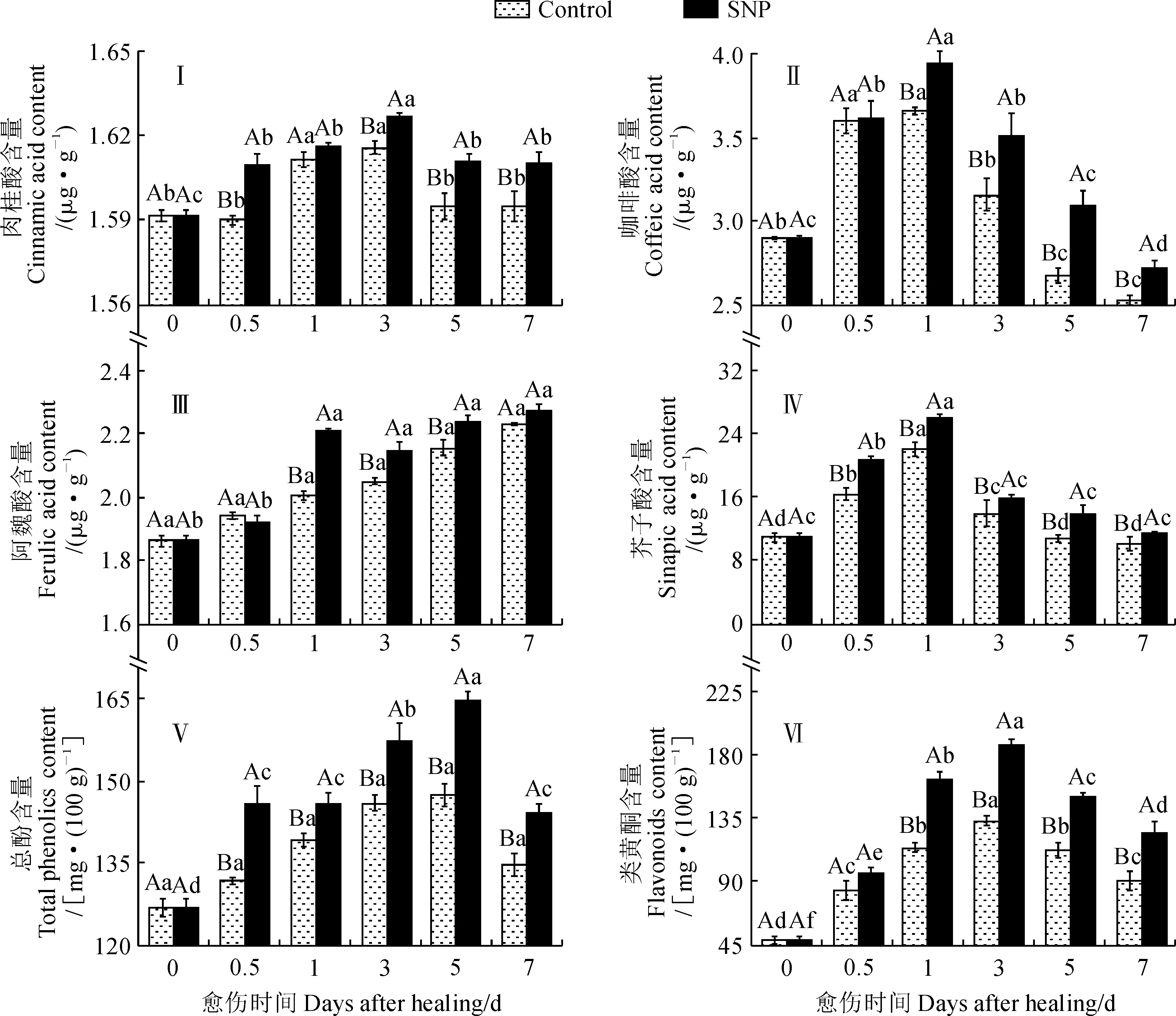
图3 SNP处理对愈伤期间果实伤口处肉桂酸、咖啡酸、阿魏酸、芥子酸、总酚和类黄酮含量的影响Fig.3 Effect of SNP treatment on the contents of cinnamic acid, coffeic acid, ferulic acid, sinapic acid,total phenolic and flavonoids at wound sites of fruit during healing
同时,SNP处理组果实伤口处的阿魏酸含量在愈伤期间先上升后趋于平稳,相应的对照组果实的含量则逐渐上升;处理组果实的阿魏酸含量在第0~0.5天无显著差异,之后迅速显著增加(P<0.05);对照组果实伤口处的阿魏酸含量在愈伤期间持续增加,但不同时间点无显著性差异;除了第0.5天和第7天外,处理组果实阿魏酸的含量在愈伤期间均显著高于同期对照(图3,Ⅲ)。
另外,在愈伤期间,SNP处理组和对照组果实伤口处的总酚和类黄酮含量均先上升后降低,峰值分别出现在第5天和第3天,且不同时间点的含量存在差异(图3,Ⅴ、Ⅵ)。其中,SNP处理组果实的总酚含量先迅速显著上升,在第0.5~1天基本稳定,在第1~5天又迅速显著上升,之后迅速显著下降(P<0.05);对照组果实的总酚含量在愈伤期间虽有变化但不同时间点无显著差异;处理果实的总酚含量在愈伤期间始终显著高于同期对照(图3,Ⅴ)。SNP处理组和对照组果实的类黄酮含量均呈先迅速显著上升后迅速显著下降的变化趋势;处理组果实的类黄酮含量在愈伤期间大多显著高于同期对照,在峰值时显著高出对照28.5%(图3,Ⅵ)。可见,SNP处理有效促进了苹果果实伤口处4种酚酸及总酚和类黄酮的合成。
2.4 SNP处理对愈伤期间果实伤口处3种木质素单体及木质素水平的影响
木质素由p-香豆醇、松柏醇和芥子醇3种单体构成。SNP处理组和对照组苹果果实的p-香豆醇含量在愈伤期间呈单峰型变化,峰值出现在第5天,且不同时间点的含量存在差异(图4,Ⅰ)。其中,SNP处理组果实的p-香豆醇含量在第0~0.5天无显著差异,在第0.5~1天和第3~5天都迅速显著上升,之后迅速显著下降(P<0.05);对照组果实的p-香豆醇含量在第0~1天迅速显著增加,之后基本稳定,第5天后迅速显著下降(P<0.05);处理组果实的p-香豆醇含量在愈伤的中后期显著高于同期对照(图4,Ⅰ)。同时,SNP处理组和对照组果实伤口处的松柏醇和芥子醇含量均随愈伤时间的延长逐渐上升,且在不同时间点之间存在差异;处理组果实伤口处的松柏醇和芥子醇含量在愈伤的中后期均显著高于同期对照,在第5天时分别显著高出相应对照19.8%和26.9%(图4,Ⅱ、Ⅲ)。其中,SNP处理组和对照组果实的松柏醇含量在第0~1天均无显著性变化,之后均迅速显著上升(图4,Ⅱ);SNP处理果实的芥子醇含量在第0~0.5天无显著变化,之后迅速显著上升(P<0.05),而对照组果实的芥子醇含量在第3~7天迅速显著上升(图4,Ⅲ)。另外,SNP处理组和对照组果实伤口处的木质素含量在愈伤期间均逐渐上升,且不同时间点的含量存在差异(图4,Ⅳ)。其中,处理组果实的木质素含量在第0~3天迅速显著上升,之后基本稳定,在第5~7天又迅速显著上升(P<0.05);对照组果实的木质素含量在第0~0.5天和第1~3天均迅速显著上升(P<0.05);处理组果实的木质素含量在愈伤的中后期均显著高于同期对照(P<0.05),在第7天时显著高出对照38.2%。以上结果表明,SNP处理明显提高了苹果伤口处p-香豆醇、松柏醇、芥子醇和木质素含量。
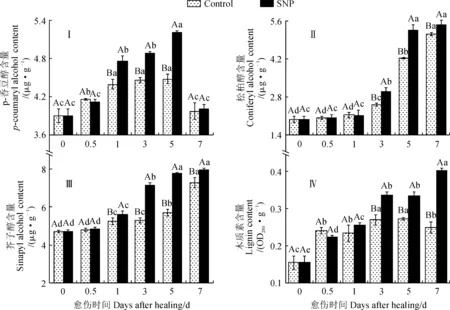
图4 SNP处理对愈伤期间果实伤口处p-香豆醇、松柏醇、芥子醇和木质素含量的影响Fig.4 Effects of SNP treatment on contents of p-coumaroyl alcohol, coniferyl alcohol, sinapyl alcohol and lignin at wound sites of fruit during healing
2.5 SNP处理对愈伤期间果实伤口处的H2O2含量及POD活性的影响
H2O2含量和POD活性在一定程度上反映了果实伤口处木质素单体的聚合水平。在苹果果实愈伤期间,SNP处理组和对照组果实的H2O2含量均呈双峰型变化,峰值分别出现在第0.5天和第3天;处理组果实的H2O2含量在不同时间点均存在显著性差异,对照组果实的H2O2含量除第5~7天外的时间点也均存在显著性差异(P<0.05);处理组果实伤口处的H2O2含量在愈伤期间始终显著高于同期对照组,第3天时显著高出对照45.1%(图5,Ⅰ)。同时,SNP处理组和对照组果实伤口处的POD活性在愈伤期间均呈单峰型变化,峰值出现在第1天,且不同时间点的活性存在差异;处理组果实伤口处的POD活性在第0~1天先迅速显著上升,之后迅速显著下降(P<0.05);对照组果实的POD活性的变化趋势与处理组果实基本一致;除第0.5天外,处理组果实的POD活性在愈伤期间显著高于同期对照(P<0.05),在第1天时显著高出对照34.4%(图5,Ⅱ)。因此,SNP处理有效提高了苹果果实伤口处H2O2含量及POD活性。
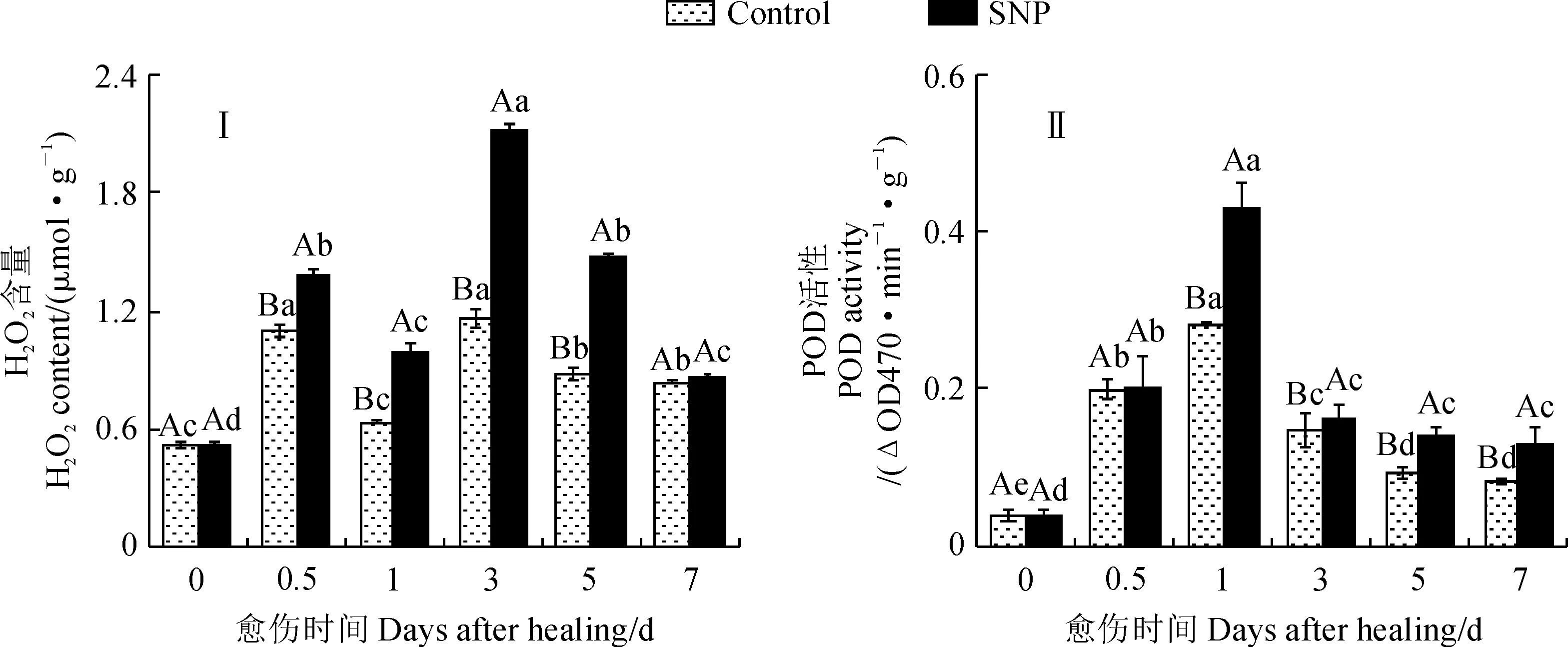
图5 SNP处理对愈伤期间果实伤口处H2O2含量和POD活性的影响Fig.5 Effects of SNP treatment on H2O2 content and POD activity at wound sites of fruit during healing
3 讨 论
亚硝基铁氰化钠(SNP)作为外源NO供体进入植物体后在半胱氨酸、谷胱甘肽或其他2SH类化合物、细胞色素P2450/NADPH系统的催化下会逐步分解,释放出NO[16]。外源NO会促进内源NO的产生,而内源NO作为信号分子参与了植物对生物和非生物胁迫的应答[17]。
苯丙烷代谢既可提供愈伤封闭层形成所需的底物,又可合成具有抗菌和抗氧化活性的酚类和黄酮类物质[18]。PAL作为苯丙烷代谢的关键酶和限速酶,催化L-苯丙氨酸脱氨基生成反式肉桂酸[19-20]。反式肉桂酸在C4H的作用下羟基化生成p-香豆酸,p-香豆酸在香豆酸-3-羟基化酶作用下经过羟基化和酯化生成咖啡酸,咖啡酸经儿茶酚氧位甲基转移酶生成阿魏酸,阿魏酸首先羟化生成5-羟基阿魏酸,接着在5-羟基阿魏酸-O-甲基转移酶作用下催化生成芥子酸[21]。本研究观察到,SNP处理提高了苹果果实伤口处的PAL和C4H活性,促进了4种酚酸以及总酚和类黄酮的合成。该结果与SNP处理及NO气体熏蒸处理提高苹果及甜瓜果实的PAL与C4H活性,促进总酚、类黄酮合成的结果类似[22-23]。据报道,NO作为信号分子可以激活PAL,促进甜瓜果实中总酚、类黄酮的合成[23-24];NO还可促进桃果实中茉莉酸(JA)和水杨酸(SA)以及马铃薯块茎中H2O2的合成,而JA、SA和H2O2可作为信号分子激活苯丙烷代谢[25-28]。JA可上调盐芥中芥子油苷生物合成转录因子MYB28和MYB51的表达,从而启动盐芥对损伤及非生物胁迫的响应[22];SA可诱导瞿麦DsMYB的表达,增强瞿麦对盐胁迫的抗性[22]。此外,SNP处理还可诱导苹果果实的莽草酸途径,促进L-苯丙氨酸的合成,从而为苯丙烷代谢提供所需底物[22]。据此,我们认为NO可能通过诱导JA、SA等信号分子合成,激活莽草酸途径来促进苯丙烷代谢,从而提高酚酸和类黄酮的合成水平。
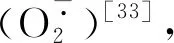
SNP处理有效降低了愈伤期间苹果果实的失重率和病情指数,该结果与SNP降低马铃薯块茎愈伤期间失重率和病情指数的结果一致[6]。由于NO促进了聚酚软木酯及木质素在伤口处的沉积,通过形成物理屏障进而抑制了水分经由伤口蒸腾,有效抵御了病原物的侵染和扩展[6]。NO还可以促进烟草和番茄SA和JA的合成,而SA和JA可调控植物气孔关闭,从而减少水分经由气孔蒸腾[38,16]。另外,NO还可抑制番木瓜的呼吸速率,通过降低呼吸强度来减少呼吸底物的消耗,进而减轻失重[39]。因此,我们认为SNP处理减少苹果愈伤期间失重率的原因除了促进伤口处物理屏障的形成外,还与诱导气孔关闭,减少呼吸底物消耗有关。此外,苯丙烷代谢形成的酚类和类黄酮物质还能直接抑制病原菌的生长发育[40,22],NO还可促进病程相关蛋白PR1的积累,从而破坏病原菌的结构[41]。因此,我们认为SNP处理减少苹果愈伤期间病情指数的原因除了促进伤口处物理屏障的形成外,还与提高总酚和类黄酮含量,增加病程相关蛋白有关。
4 结 论
SNP处理激活了苹果果实伤口处PAL、C4H和CAD的活性,促进了肉桂酸、咖啡酸、阿魏酸、芥子酸、总酚和类黄酮以及p-香豆醇、松柏醇、芥子醇及木质素的合成;SNP处理还提高了果实伤口处的H2O2含量和POD活性。上述苯丙烷代谢产物在H2O2和POD共同作用下氧化聚合形成木质素在伤口表面沉积,木质素作为物理屏障有效降低了果实愈伤期间的失重率和病情指数,促进了苹果愈伤。
