基于网络药理学探讨止嗽散治疗喉源性咳嗽的作用机制
2022-05-22王旗旗韩秀丽王玉明
王旗旗 韩秀丽 王玉明












摘要 目的:利用网络药理学探讨止嗽散治疗喉源性咳嗽的作用机制。方法:运用中药系统药理学数据库与分析平台(TCMSP)对止嗽散的主要成分及作用靶点进行筛选和挖掘;利用Cytoscape 3.7.2软件,构建中药成分-靶点网络图;以GeneCards平台挖掘喉源性咳嗽的相关靶点;运用STRING数据库構建止嗽散治疗喉源性咳嗽的蛋白质-蛋白质相互作用(PPI)网络图;进行拓扑分析并筛选出止嗽散治疗喉源性咳嗽的核心靶点;利用David数据库对药物、疾病交集靶点进行富集分析。结果:止嗽散药物-成分-靶点-疾病网络图包含152个有效成分,相对应靶点155个;喉源性咳嗽相关靶点 176个。其中β-谷甾醇、槲皮素、木犀草素、豆甾醇、山柰酚等可能是止嗽散治疗喉源性咳嗽的关键成分,涉及TP53、VEGFA、IL6、MAPK、JUN、TNF、EGF等14个核心靶点。基因本体(GO)生物过程分析涉及一氧化氮生物合成过程的正调控、细胞外间隙、基因表达的正调控、细胞外区、脂多糖介导的信号通路等。京都基因和基因组百科全书(KEGG)通路富集分析提示这些靶点参与TNF信号通路、NOD样受体信号通路、FoxO信号通路、Toll样受体信号通路、HIF-1信号通路等。结论:本研究揭示止嗽散治疗喉源性咳嗽多成分、多靶点、多通路的网络调节机制,从整体上阐述止嗽散治疗喉源性咳嗽的有效作用机制,为下一步实验研究提供分子层面思考。
关键词 止嗽散;喉源性咳嗽;网络药理学;成分;靶点;通路;富集分析;作用机制
The Mechanism of Zhisou Powder in the Treatment of Laryngeal Cough According to Network Pharmacology
WANG Qiqi1,HAN Xiuli2,WANG Yuming2
( Shandong University of Traditional Chinese Medicine,Ji′nan 250011,China; 2 Affiliated Hospital of Shandong University of Traditional Chinese Medicine,Ji′nan 250011,China)
Abstract Objective:To explore the mechanism of Zhisou Powder in the treatment of laryngeal cough by network pharmacology.Methods:Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform(TCMSP) was used to screen and mine the main components and targets of Zhisou Powder.The network diagram of traditional Chinese medicine components and targets was constructed via Cytoscape 3.7.2 software.The related targets of laryngogeal cough were mined via GeneCards platform.The Protein-protein Interaction(PPI) network diagram of Zhisou Powder in the treatment of laryngogeal cough was constructed via STRING database.Topology analysis was carried out and the therapeutic effect of Zhisou Powder was screened.David database was used to enrich and analyze the intersection targets of drugs and diseases.Results:The drug component target disease network diagram of Zhisou Powder contained 152 active components,155 corresponding targets,and 176 related targets of laryngeal cough.Among them,β-sitosterol,quercetin,luteolin,stigmasterol and kaempferol may be the key components of Zhisou Powder in the treatment of laryngeal cough,involving 14 core targets such as TP53,VEGFA,IL6,MAPK,Jun,TNF and EGF.The biological process of Gene Ontology(GO) analysis involves the positive regulation of nitric oxide biosynthesis,extracellular space,gene expression,extracellular domain and lipopolysaccharide mediated signaling pathway.Kyoto Encyclopedia of Genes and Genomes(KEGG) pathway enrichment analysis suggested that these targets were involved in TNF signaling pathway,nod like receptor signaling pathway,FoxO signaling pathway,Toll-like receptor signaling pathway,HIF- signaling pathway and so on.Conclusion:This study reveals the network regulation mechanism of Zhisou Powder in the treatment of laryngeal cough with multi-component,multi-target and multi-channel,and expounds the effective mechanism of Zhisou Powder in the treatment of laryngeal cough as a whole,so as to provide molecular thinking for the next experimental research.
Keywords Zhisou Powder; Laryngogenic cough; Network pharmacology; Component; Target; Pathway; Enrichment analysis; Mechanism of action
中图分类号:R285文献标识码:Adoi:10.3969/j.issn.1673-7202.2022.05.014
喉源性咳嗽是耳鼻喉科的常见病与多发病,多因咽喉部病变引起,临床表现为阵发性的干咳,咽痒即咳,无痰而咳,自觉咽喉不适或有异物感等症状[1]。中医学认为,本病为脏腑失调,外邪侵袭所致。喉为气道,与肺相通,为肺系所属,故主要病位在肺[2]。此病在各年龄段均有发病,病程长、易复发,缠绵难愈,严重影响了患者正常的生活和工作[3]。现代医学多用止咳、抗组胺、抗生素等药物治疗,疗效欠佳[4]。
止嗽散记载于《医学心悟》,具有宣利肺气,疏风止咳的功效,是中医临床治疗喉源性咳嗽的常用方剂,该方由桔梗、荆芥、紫菀、百部、白前、甘草、陈皮7味中药组成。紫菀、百部,为止咳要药,对于新久咳嗽皆宜,共用为君。白前长于降气化痰,桔梗善于宣肺止咳,荆芥疏风解表,陈皮行气化痰,甘草可利咽止咳,并調和诸药。诸药配伍肺气得宣,咳嗽得治。在现代药理学研究中,百部的有效成分具有镇咳、祛痰、杀虫、抗菌等作用[5];紫菀的有效成分具有镇咳、祛痰、平喘等作用[6];桔梗的有效成分具有镇痛、抗炎、抗氧化等作用[7];陈皮具有抗氧化、清除自由基、祛痰止咳及促进消化等作用[8];白前的有效成分具有抗炎、镇痛、抗氧化、调节免疫等作用[9];荆芥有效成分具有抗菌、抗病毒、抗氧化、调节免疫等作用[10];甘草有效成分具有抗炎、调节免疫、抗氧化、抗溃疡等作用[11]。由此可见,止嗽散中药物配伍对于治疗喉源性咳嗽具有确切的依据。然而由于中药复方多成分、多靶点之间相互作用的特点,使得中药对于疾病的治疗作用机制复杂。我们利用网络药理学多层次的网络构建,从整体角度分析止嗽散中药物有效成分的作用机制,这和中医药的相互配伍与治疗原则具有极大的相似性[12]。本研究选择喉源性咳嗽中药治疗中常用的方剂止嗽散中的7味药物进行网络药理学研究,明确止嗽散中的有效成分及靶点的相互作用,进一步分析止嗽散治疗喉源性咳嗽的作用机制,拓展诊疗新思路。
资料与方法
1. 止嗽散活性成分的获取与筛选
止嗽散的中药组成:百部、紫菀、白前、桔梗、荆芥、陈皮、甘草。在中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP,http://lsp.nwu.edu.cn/tcm-spsearch.php)中分别录入止嗽散中百部、紫菀等7味中药进行检索,按口服生物利用度(Oral Bioavailability,OB)≥30%,类药性(Drug Likeness,DL)≥0.18条件筛选出有效成分,并得到止嗽散的潜在作用靶点。利用Uniprot数据库,将所得的潜在靶点进行基因标准化处理。
1.2 喉源性咳嗽疾病靶点的获取与预测
在数据库GeneCards(https://www.genecards.org/)中,以“laryngeal cough”为关键词进行检索,得到喉源性咳嗽的相关靶点信息。
1.3 药物-疾病共同靶点的筛选
于Venny 2.1平台上分别录入1.1中预测得到的止嗽散中的药物靶点与1.2中预测得到的喉源性咳嗽疾病的靶点,对比二者并取交集,绘制韦恩图,得到药物与疾病的共同靶点数量。
1.4 构建“药物-成分-疾病-靶点”相互作用网络图
将1.4所得交集靶点的数据导入Cytoscape 3.7.2软件,构建“药物-成分-疾病-靶点相互作用网络图”,并且利用“Tool”中“Network Analyzer”功能进行数据分析,得到的节点代表止嗽散中7种药物及其有效成分、疾病、靶点;边代表药物、有效成分、靶点、疾病之间的相互作用关系。记录相关特征数据进行后续分析。
1.5 药物-疾病靶点蛋白质-蛋白质相互作用网络的构建与核心靶点的筛选
在STRING数据库(https://www.string-db.org/)中上传1.3中得到的止嗽散与喉源性咳嗽的交集靶点,将物种设置为“Homo sapiens”,进行蛋白质-蛋白质相互作用(Protein-protein Interaction,PPI)网络的构建。构建完成后将得到的分析文件下载并导入Cytoscape 3.7.2软件中,根据1.5倍节点度(degree≥35)值进行筛选,得到止嗽散治疗喉源性咳嗽的核心作用靶点。
1.6 核心靶点基因本体富集分析和京都基因和基因组百科全书富集分析
将1.5中得到的核心靶点导入到David(https://david.ncifcrf.gov/)数据库Step1中,Step2中选择“OFFICIAL-GENE-SYMBOL”,Step3中选择“gene list”,种属选为“Homo sapiens”,在“gene ontology”下的“GOTERM-BP-DIRECT”和“pathways”下的“KEGG-PATHWAY”进行京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路分析以及基因本体(Gene Ontology,GO)生物过程的富集分析。以P≤0.05,FDR≤0.05为筛选标准,并进行数据的可视化处理。将符合条件的前10条GO生物过程与10条KEGG通路筛选,并用表格的形式展示。通过通路富集的分析结果对止嗽散治疗喉源性咳嗽的作用机制进行预测。
2 结果
2. 止嗽散有效成分的靶点筛选及预测
运用TCMSP数据库,搜索各中药并筛选后得到有效成分171个,其中百部32个、紫菀19个、陈皮5个、白前4个、桔梗7个、甘草93个、荆芥11个。去除各中药之间重复值之后得到止嗽散有效成分152个,对应靶点155个。有效成分包括槲皮素(Quercetin)、β-谷甾醇(Beta-sitosterol)、木犀草素(Luteolin)、山柰酚(Kaempferol)、豆甾醇(Stigmasterol)等。见表1。
2.2 喉源性咳嗽相关靶点PPI网络构建
通过GeneCards数据库筛选的与喉源性咳嗽相关的靶点有 176个。
2.3 药物-疾病共同靶点的获得
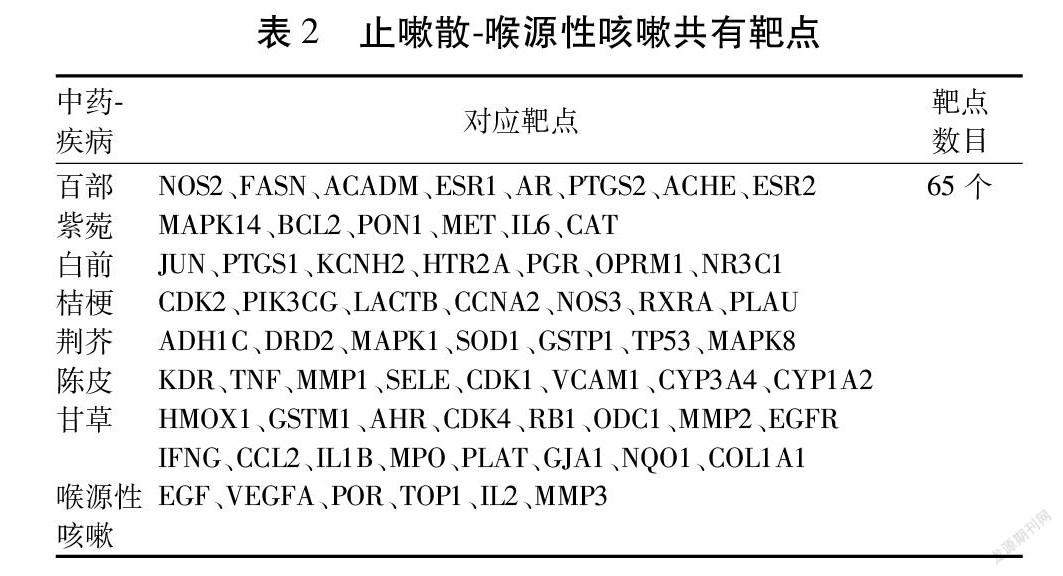
将所得的止嗽散和喉源性咳嗽相关靶点输入Venny 2.1平台,并绘制韦恩图,最终获得65个共同靶点。见图1,表2。
2.4 药物-成分-靶点-疾病网络模型
将上述药物、活性成分、共同靶点、药物数据导入Cytoscape 3.7.2软件中。并对与靶点无交集的成分予以去除,绘制出“药物-成分-靶点-疾病”相互作用的网络图。图中米白色代表止嗽散中7种药物:百部、紫菀、桔梗、甘草、白前、荆芥、陈皮,棕色代表止嗽散中的152种活性成分(19种活性成分靶点与疾病靶点无交集,予以刪除),紫色代表155个共同靶点,红色代表疾病名称。Dgree值越大说明相应的有效成分在治疗喉源性咳嗽中发挥的作用越明显,其中槲皮素、β谷甾醇、木犀草素、山柰酚、豆甾醇Degree值相对较大,分别为264、208、126、112、90,说明这些有效成分在喉源性咳嗽的治疗中起到关键性的作用。见图2。
2.5 药物-疾病共同靶点PPI网络
在STRING数据库中录入上述65个共同靶点,将物种(Organizm)设置为人类(Homosapiens)分析得到PPI网络。见图3。图中节点数65,边数731,平均节点度22.5。
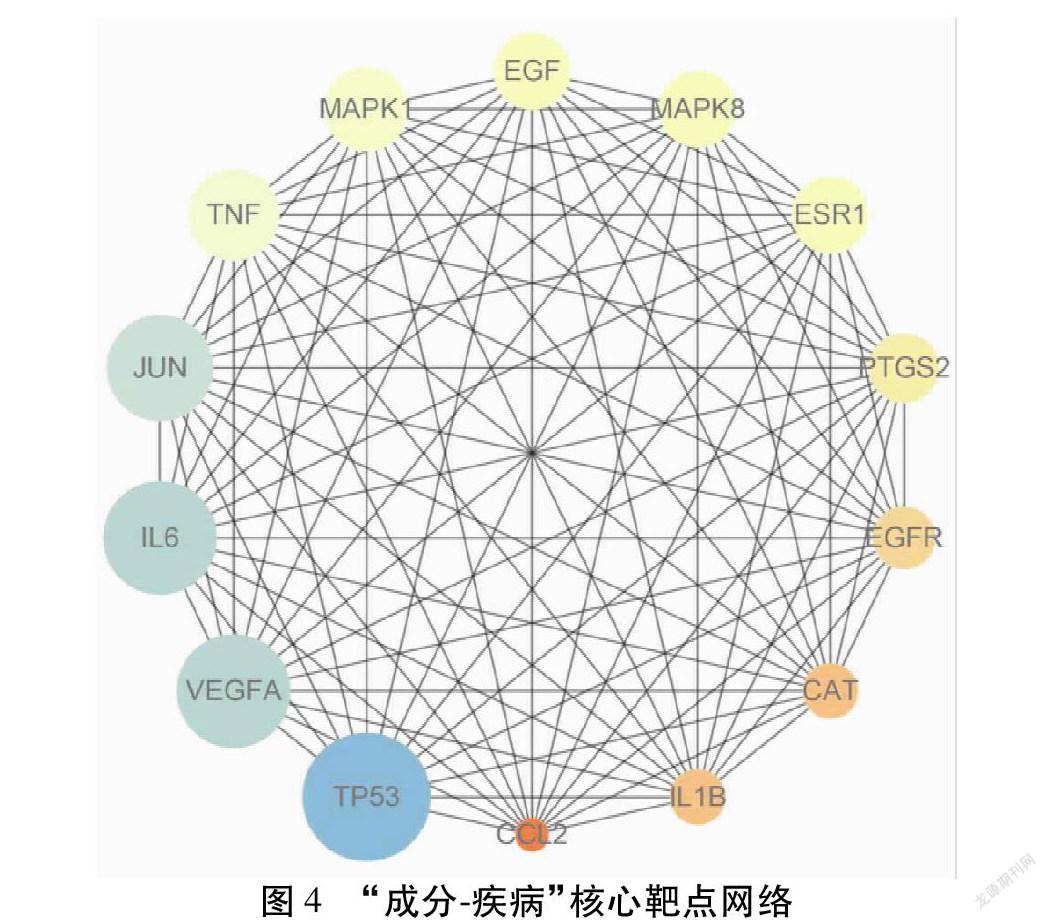
节点代表靶蛋白,每条边代表PPI关系。将得到的数据导入Cytoscape 3.7.2软件中,以1.5倍的平均节点度为筛选标准,得到“成分-疾病”核心靶点图。其中TP53(肿瘤抑制基因)、VEGFA(血管内皮生长因子A)、IL-6(白细胞介素6)、JUN(转录因子)、TNF(肿瘤坏死因子)节点度值分别为48、46、46、45、43,预测这些靶点蛋白在喉源性咳嗽的治疗中起着关键性的作用。见图4。
2.5 GO生物过程结果
将2.4项得到的核心靶点录入David数据库并进行GO生物过程分析,得到分子功能、生物过程和细胞组分条目186个,以P≤0.05,FDR≤0.05为标准,筛选出符合条件且与研究相关的前10个GO条目。见表3。主要包括一氧化氮生物合成过程的正调控、平滑肌细胞增殖的正调控、基因表达的正调控、MAPK级联、MAP激酶活性的正调控、细胞外区、血管生成等生物过程。见图5。
2.6 KEGG通路富集分析
将2.4项得到的核心靶点录入David数据库,得到KEGG通路75条,以P≤0.05,FDR≤0.05为标准,筛选出符合条件且与研究相关的10条关键信号通路。见表4。其中包括肿瘤坏死因子信号通路、NOD样受体信号通路、MAPK信号通路、Toll样受体信号通路、FoxO信号通路、ErbB信号通路、HIF-1信号通路等信号通路,其中,与喉源性咳嗽相关的通路可能为TNF信号通路、Toll样受体信号通路、FoxO信号通路、NOD样受体信号通路、MAPK信号通路、ErbB信号通路、HIF-1信号通路等。见图6。
3 讨论
本研究运用网络药理学,构建了治疗的“药物-成分-靶点-疾病”网络图,筛选之后获得152个有效成分,作用于14个核心靶点,10条关键代谢通路,生物过程主要涉及一氧化氮生物合成过程的正调控、细胞外间隙、基因表达的正调控等,信号通路主要涉及TNF信号通路、Toll样受体信号通路、FoxO信号通路、NOD样受体信号通路、MAPK信号通路、ErbB信号通路、HIF-1信号通路等,进一步探究了止嗽散治疗喉源性咳嗽复杂的作用机制。
通过以上分析得出,止嗽散中主要的有效成分包括槲皮素、β-谷甾醇、木犀草素、山柰酚、豆甾醇等。槲皮素和木犀草素对于变态反应性疾病意义重大。槲皮素是一种天然存在的多酚黄酮类化合物,具有丰富的抗氧化功能,具有抑制组胺产生和促炎症介质的抗过敏作用。槲皮素能调节Th1/Th2的稳定性,减少B细胞释放抗原特异性IgE抗体。槲皮素具有抗炎和免疫调节作用,适合多种疾病的治疗[13]。槲皮素通过与磷脂酰肌醇-3-磷酸激酶(PI3K)、丝裂原活化蛋白激酶(MAPK)、细胞外信号调节激酶(ERK)、MAP-ERK激酶(MEK)1等相互作用发挥生理作用,对肥大细胞FceRI交联及其他激活受体具有负效应。木犀草素是一种黄酮类化合物,可抑制肿瘤坏死因子(TNF)诱导的角质形成细胞产生白细胞介素(IL)-6、IL-8和血管内皮生长因子(VEGF),是治疗炎症性皮肤病的候选药物[14],对于治疗过敏性和炎症性疾病有非常好的效果,是一种很有前途的肥大细胞抑制剂[15]。山柰酚及其糖基衍生物已被证明具有心脏保护、神经保护、抗炎、抗糖尿病、抗氧化、抗菌、抗肿瘤等作用[16]。研究认为山柰酚可促进促炎症介质(白细胞介素-6、8、趋化因子、单核细胞趋化蛋白-1)的表达,阻断MAPK,阻断MAPK、JAK/STAT、p53等的表达和核因子κB的释放。降低缺氧诱导因子1(HIF-1)的表达水平。通过诱导细胞凋亡,剂量依赖性有效抑制细胞迁移、ERK、表皮生长因子受体(EGFR)等相关通路,增加FOXP3表达水平,提高调节性T细胞的抑制活性[17]。β-谷甾醇被证明是一种强大的免疫调节剂。据报道,肥大细胞的靶点是特异性Th淋巴细胞,能增加Th1活性,提高T淋巴细胞和NK细胞活性[18]。万星等[19]研究表明β-谷甾醇可干预TNF-α/核因子κB炎症通路。此外,其抗氧化、血管生成效应、解热活性、抗炎等药理学作用值得进一步研究。豆甾醇具有抗肿瘤、抗炎、抗氧化等药理学作用[20]。冯思敏等[21]实验认为植物甾醇可以通过抑制核因子κB相关通路从而抑制炎症介质的表达,经豆甾醇处理的小鼠模型中IL-1β、IL-6、MCP-1和环氧合酶COX-2的mRNA表达显著降低,有比β-谷甾醇更好的抗炎作用,更能改善小鼠模型的病理学评分。以上进一步说明了这些化合物在止嗽散治疗喉源性咳嗽中发挥了主要作用。
从药物-疾病PPI网络分析发现,止嗽散治疗喉源性咳嗽的核心蛋白主要有TP53、VEGFA、IL-6、JUN、TNF、MAPK、EGF、MAPK8、ESR1等。TP53的作用途径是多方面的,虽然该蛋白在抑制肿瘤中具有明显的作用,但该蛋白还调节代谢、氧化还原状态和生殖等功能,对于炎症以及免疫反应也具有重要意义[22]。武明云等[23]认为长期的气道炎症可促使气道平滑肌细胞(ASMCs)增肥增厚,使气道结构改变,干预MAPK介导的信号通路,对于减轻气道炎症,逆转气道重塑,调节Th1/Th2平衡起着重要的作用。方向明等[24]研究表明c-Jun氨基端激酶的激活以及磷酸化,可使炎症转录启动并增强,EGF与其受体EGFR结合调节上皮细胞的迁移、增殖、分化及成活,影响气道上皮组织修复,缓解气道重塑过程。bFGF与气道重塑的程度相关,VEGF为一种重要的上皮细胞生长因子,通过内皮细胞释放bFGF以促使平滑肌细胞增殖。VEGF还可促进血管内皮细胞增殖、提高血管通透性,促进血管的生成,可增加气管壁的厚度,而血管的重塑是气道重塑的先决条件[25]。IL-6是一种典型的细胞因子,对炎症、免疫反应和造血有多向性。通过刺激抗体产生和诱导幼稚的CD4+分化,在获得性免疫应答中发挥重要作用。IL-6激活血管内皮细胞产生IL-6、IL-8、单核细胞趋化蛋白-1(MCP-1)、细胞间黏附分子(ICAM)-1和C5a受体,诱导血管内皮细胞钙黏合素(C5a)解体。IL-6还能促进多个非免疫细胞的分化和增殖。IL-6还可诱导血管内皮生长因子(VEGF)过度生成,促进血管生成,增加血管通透性。由于其活动多向性,IL-6的持续或过度分泌失调导致各种疾病的发生发展。所以与慢性炎症、炎症性损伤、血管壁重塑以及免疫类疾病密切相关[26]。唐贤豪等[27]研究认为IL-6对于慢性炎症及炎症性损伤和修复造成气道和血管壁重塑的改变具有重要影响。肿瘤坏死因子(TNF)是一种促炎和抗炎的细胞因子,介导多种炎症反应,可诱导中性粒细胞的趋化作用和局部浸润,启动炎症反应,刺激血中炎症介质分泌,气道炎症反应加重,诱发高气道反应,慢性咳嗽患者的痰液中发现这些炎症介质水平升高[28-30]。
GO生物过程分析主要涉及一氧化氮生物合成过程的正调控、细胞外间隙、基因表达的正调控、细胞外区、脂多糖介导的信号通路、血管生成、缺氧反应等生物过程。通过KEGG通路富集分析发现,止嗽散治疗喉源性咳嗽的靶点主要富集在TNF信号通路、Toll样受体信号通路、NOD样受体信号通路、FoxO信号通路、ErbB信号、MAPK信号通路、HIF-1信号通路等。研究显示TNF-α/核因子κB信号通路的异常激活与气道的炎症以及黏液高分泌有着密切的关系[31-32]。姜春燕等[33]研究认为下调大鼠肺组织FoxO信号通路Raf1、FOXO1蛋白的磷酸化水平,纠正T细胞相关因子之间的免疫失衡,可以减轻气道慢性炎症。pAKT/AKT、FoxO1通路可由Toll样受体4(TLR-4)介导并激活,经过一系列的反应产生TNF-α、IL-6等炎症介质。AKT信号通路在TLR-4的作用下发生磷酸化。同时,在炎症或缺氧等条件下,AKT磷酸化后会进一步激活FoxO1[34]。研究显示,ErbB调节通路的改变与肺部过敏性炎症反应有着密切的关系[35]。在中性粒细胞显性哮喘中,HIF-1α调节Th17细胞的分化和IL-17的表达[36],而MAPK通路参与了气道重塑[37]。NOD信号通路的活化与气道炎症反应关系密切,在哮喘患者血清、诱导痰及支气管肺泡灌洗液中IL-1β水平较正常明显升高[38-40]。
综上所述,本研究利用网络药理学的方法对止嗽散治疗喉源性咳嗽的作用机制进行了分析,通过分析发现,止嗽散通过多成分、多靶点、多通路参与治疗喉源性咳嗽,为止嗽散治疗喉源性咳嗽的作用机制提供了基础和理论依据。此外,由于本研究未结合实验来验证所得到的活性成分、靶点及通路,为进一步探讨止嗽散治疗喉源性咳嗽的复杂作用机制,将进行更深入的实验研究。
参考文献
[1]李煜,张毅,徐核,等.基于网络药理学的芩暴红止咳口服液抗炎、止咳、祛痰、平喘的作用机制研究[J].中国中药杂志,2021,46(22):5902-5911.
[2]王平生,艾博海.喉源性咳嗽中医治法研究进展[J].山东中医杂志,2019,38(11):1082-1085,1090.
[3]刘威威,苏玉峰,王欢,等.布地奈德福莫特罗对咳嗽变异性哮喘患者气道阻力及咳嗽敏感性的影响[J].中国医药,2021,16(4):525-529.
[4]文继红,沈宇明,邱江红,等.麻杏咳宁汤加减方治疗喉源性咳嗽的临床观察[J].云南中医学院学报,2019,42(5):37-40.
[5]邹璐,唐凌,韩涵,等.百部治疗呼吸系统疾病的基础研究进展[J].上海医药,2021,42(1):10-13.
[6]范玲,王鑫,朱晓静,等.紫菀化学成分及药理作用研究進展[J].吉林中医药,2019,39(2):269-273.
[7]邓亚羚,叶先文,刘敏敏,等.药食同源桔梗和百合配伍治疗肺炎的作用机制研究[J].中国中药杂志,2021,46(10):2403-2412.
[8]杨放晴,何丽英,杨丹,等.不同陈化时间广陈皮中黄酮类成分的UPLC-Q-Orbitrap HRMS分析[J].中国实验方剂学杂志,2021,27(12):125-132.
[9]刘洋,王四旺,唐志书.白前的现代研究与开发应用前景[J].西北药学杂志,2015,30(6):768-770.
[10]刘英男,牛凤菊,辛义周,等.荆芥的化学成分、药理作用及临床应用研究进展[J].中国药房,2020,31(11):1397-1402.
[11]李冀,李想,曹明明,等.甘草药理作用及药对配伍比例研究进展[J].上海中医药杂志,2019,53(7):83-87.
[12]世界中医药学会联合会.网络药理学评价方法指南[J].世界中医药,2021,16(4):527-532.
[13]Jafarinia M,Sadat Hosseini M,Kasiri N,et al.Quercetin with the potential effect on allergic diseases[J].Allergy Asthma Clin Immunol,2020,16:36.
[14]Shaik Y,Caraffa A,Ronconi G,et al.Impact of polyphenols on mast cells with special emphasis on the effect of quercetin and luteolin[J].Cent Eur J Immunol,2018,43(4):476-481.
[15]Che DN,Shin JY,Kang HJ,et al.Luteolin suppresses IL-3 production in IL-33-stimulated mast cells through MAPK and NF-κB signaling pathways[J].Int Immunopharmacol,2020,83:106403.
[16]Kashyap D,Sharma A,Tuli HS,et al.Kaempferol-A dietary anticancer molecule with multiple mechanisms of action:Recent trends and advancements[J].J Funct Foods,2017,30:203-219.
[17]Imran M,Salehi B,Sharifi-Rad J,et al.Kaempferol:A Key Emphasis to Its Anticancer Potential[J].Molecules,2019,24(12):2277.
[18]Bin Sayeed MS,Karim S,Sharmin T,et al.Critical Analysis on Characterization,Systemic Effect,and Therapeutic Potential of Beta-Sitosterol:A Plant-Derived Orphan Phytosterol[J].Medicines(Basel),2016,3(4):29.
[19]万星,李相国,李修贤,等.Beta-谷甾醇通过抑制TNF-α-NF-κB和TβR1-Smad2/3信号通路抗小鼠肝纤维化损伤[J].中国药理学通报,2020,36(1):75-80.
[20]汪帅,孙宇,李春梅,等.豆甾醇的研究进展概述[J].中国药业,2019,28(23):96-98.
[21]冯思敏,宁可,邵平,等.β-谷甾醇和豆甾醇对小鼠急性结肠炎的治疗作用研究[J].中国粮油学报,2018,33(12):80-86,94.
[22]Jiang Z,Liu Z,Li M,et al.Immunogenomics Analysis Reveals that TP53 Mutations Inhibit Tumor Immunity in Gastric Cancer[J].Transl Oncol,2018,11(5):1171-1187.
[23]武明云,虞坚尔,薛征,等.基于MAPK信号通路的中药治疗支气管哮喘的实验研究进展[J].上海中医药大学学报,2019,33(2):86-91.
[24]方向明,严郑元,刘静,等.平喘宁调节哮喘大鼠肺组织EGF、C-JUN干预气道重塑研究[J].辽宁中医药大学学报,2019,21(4):12-15.
[25]马莹,刘建秋,王雪慧.平喘颗粒对哮喘大鼠VEGF、bFGF表达及气道重塑的影响[J].辽宁中医杂志,2020,47(2):191-193,223.
[26]Tanaka T,Narazaki M,Kishimoto T.Interleukin(IL-6) Immunotherapy[J].Cold Spring Harb Perspect Biol,2018,10(8):28456.
[27]唐贤豪,张徐非,张进兴,等.加味喉科六味汤对上气道咳嗽综合征大鼠血清IL-6、IL-8、TNF-α的影响[J].中国中医药科技,2019,26(5):666-669.
[28]Mehta AK,Gracias DT,Croft M.TNF activity and T cells[J].Cytokine,2018,101:14-18.
[29]李英会,张瑾,杨环玮,等.加味取渊汤治疗痰热郁肺型上气道咳嗽综合征疗效及对患儿免疫功能和血清IL-6、TNF-α水平的影响[J].陕西中医,2020,41(3):308-311.
[30]Tamasauskiene L,Sitkauskiene B.Immune system in the pathogenesis of chronic cough[J].Immunol Lett,2020,218:40-43.
[31]Inam A,Shahzad M,Shabbir A,et al.Carica papaya ameliorates allergic asthma via down regulation of IL-4,IL-5,eotaxin,TNF-α,NF-κB,and iNOS levels[J].Phytomedicine,2017,32:1-7.
[32]姚楠,韦凌霞,王志旺,等.当归对阴虚哮喘小鼠气道黏液高分泌及TNF-α/NF-κB信号通路的影响[J].中国应用生理学杂志,2020,36(2):97-100,142.
[33]姜春燕,宋红,孔丽娅,等.基于FOXO信号通路探讨益肾喘宁汤对肾气虚哮喘的作用机制[J].浙江中医杂志,2020,55(4):235-237.
[34]潘旭东,陈思文,沈旦,等.戈米辛A通过调控TLR-4、Akt/FoxO1信号通路降低LPS诱导的大鼠急性肺损伤[J].中国医院药学杂志,2019,39(12):1248-1252.
[35]昝琼,胡荣,罗先钦.小儿肺咳颗粒对脂多糖致大鼠慢性支气管炎的防治作用及机制研究[J].中国中药杂志,2021,46(8):2112-2118.
[36]Xu L,Sun WJ,Jia AJ,et al.MBD2 regulates differentiation and function of Th17 cells in neutrophils-dominant asthma via HIF-1α[J].J Inflamm(Lond),2018,15:15.
[37]Sun Y,Shi Z,Liu B,et al.YKL-40 mediates airway remodeling in asthma via activating FAK and MAPK signaling pathway[J].Cell Cycle,2020,19(11):1378-1390.
[38]段亞辉,秦雪梅,李震宇.中药干预哮喘的作用机制及调控信号通路研究进展[J].中草药,2019,50(15):3700-3706.
[39]廖成松,韩阳阳,陈志婧.黑种草保健茶水浸液对OVA诱导小鼠过敏性哮喘的作用[J].中成药,2021,43(9):2514-2519.
[40]张鑫,王孟清,罗银河,等.五虎汤对RSV诱导的哮喘小鼠模型树突细胞自噬和炎性因子IL-17A和IL-17F水平的影响[J].中草药,2021,52(3):718-726.
(2020-10-05收稿 本文编辑:杨觉雄)
